Determinar los efectos de la atorvastatina sobre las concentraciones de proteína C reactiva (PCR) en mujeres con síndrome de ovarios poliquísticos (SOPQ) con sobrepeso.
MétodoSe seleccionaron 45 mujeres con diagnóstico de SOPQ. Se analizaron las concentraciones séricas de PCR, colesterol, triglicéridos, colesterol unido a lipoproteínas de alta densidad (HDL) y colesterol unido a lipoproteínas de baja densidad (LDL) antes y después de 6 meses de tratamiento con 20mg/día de atorvastatina.
ResultadosLa edad promedio de las mujeres fue de 23,2±2,8 años. El valor promedio del índice de masa corporal fue de 29,4±4,8kg/m2 y de la relación cintura cadera fue de 0,87±0,07. Al comparar las concentraciones de lípidos plasmáticos se observó una disminución de 19,1% en las concentraciones de colesterol, 11% en las concentraciones de triglicéridos y 8,5% en las concentraciones de LDL (p<0,05). Las concentraciones de PCR iniciales fueron de 24,2±6,9mg/dl. Posterior al tratamiento con atorvastatina, las concentraciones promedios de PCR fueron de 17,4±5,8mg/dl. Esta diferencia fue considerada estadísticamente significativa y superior al 39% (p<0,05). No se reportaron efectos adversos severos.
ConclusiónLa atorvastatina produce disminución de las concentraciones de PCR en mujeres con SOPQ y sobrepeso.
To determine the effects of atorvastatin on C-reactive protein (CRP) concentrations in overweight women with polycystic ovary syndrome (PCOS).
MethodsForty-five women with a diagnosis of PCOS were included. Serum concentrations of CRP, cholesterol, triglycerides, high-density lipoprotein cholesterol (HDL-c) and low-density lipoprotein cholesterol (LDL-c) were recorded before and after 6 months of atorvastatin therapy (20mg/d).
ResultsThe mean age of the women was 23.2±2.8 years. The mean body mass index was 29.4±4.8Kg/m2 and the mean waist/hip ratio was 0.87±0.07. When lipid concentrations were compared, there were reductions of 19.1% in cholesterol concentrations, 11% in triglyceride concentrations and 8.5% in LDL-C concentrations (p<0.05). The initial CRP value was 24.2±6.9mg/dl. After atorvastatin therapy, the CRP value was 17.4±5.8mg/dl. This difference was statistically significant and over 39% (p<0.05). There were no severe side effects.
ConclusionAtorvastatin lowers CRP concentrations in overweight women with PCOS.
El síndrome de ovarios poliquísticos (SOPQ) es una condición clínica caracterizada por alteración de la secreción de gonadotropinas, anovulación crónica, hiperandrogenismo y una variedad de efectos metabólicos como obesidad y resistencia a la insulina1. La asociación entre el SOPQ, insulinorresistencia e hiperandrogenemia ha sido bien documentada en la literatura médica. La resistencia a la insulina y el aumento resultante de la insulina plasmática han sido reportados como los responsables de la alta concentración de andrógenos observada en las mujeres con ovarios poliquísticos2,3. Todos estos cambios endocrinos llevan a la paciente a desarrollar un estado de inflamación crónica de bajo grado3.
La proteína C reactiva (PCR) es un reactante de fase aguda, que fue descubierta hace más de 70 años4. Es producida en los hepatocitos y está normalmente presente solo con valores trazas en el suero. Una vez liberada, se une a las estructuras o membranas alteradas o necróticas y sus efectos biológicos incluyen potenciar la fagocitosis, estimular la motilidad leucocitaria y los efectos de opsonización, sugiriendo un papel específico en la regeneración y reparación tisular5. Se ha discutido mucho sobre el rol de la PCR en la fisiopatología de la aterosclerosis, por ser un marcador de la inflamación subyacente al proceso aterosclerótico.
Estudios recientes indican que niveles altos de PCR asociados a otros factores de riesgo de enfermedad cardiovascular, pueden predecir el riesgo de su desarrollo en los siguientes 15-25 años, independientemente de los valores de colesterol, por lo que su utilización como prueba pronostica de dicha entidad, ofrece grandes ventajas, entre ellas mayor costo-efectividad que el perfil lipídico4. La mayoría de los resultados de los estudios demuestran relación directa entre el nivel de PCR ultrasensible y el riesgo de incidencia de enfermedad coronaria. Algunos estudios más recientes sugieren una relación de altos niveles de PCR ultrasensible con incidencia de enfermedad cerebrovascular, muerte súbita y enfermedad arterial periférica6.
Los inhibidores de la reductasa de la 3 hidroxi3-metilglutarilcoenzima A, o estatinas, han demostrado disminuir la morbimortalidad por enfermedades cardiovasculares7–9. También tienen otros efectos no lipídicos, que sugieren sus beneficios en pacientes hipertensos con concentraciones lipídicas normales al igual que efectos antiinflamatorios en pacientes con artritis reumatoide10. Otros efectos de efectos beneficiosos de las estatinas incluyen modificaciones de las concentraciones de PCR, mejoría de la disfunción endotelial, aumento de la biodisponibilidad de óxido nítrico, propiedades antioxidantes, inhibición de la respuesta inflamatoria y estabilización de la placa aterosclerótica11.
Hipotéticamente, la reducción de la inflamación con el tratamiento con estatinas debería ser beneficiosa en las mujeres con SOPQ donde se ha demostrado que la PCR está elevada12. Por lo que el objetivo de la investigación fue determinar los efectos de la atorvastatina sobre las concentraciones de PCR en mujeres con SOPQ y sobrepeso.
Material y métodoEntre abril 2008 y enero 2012, se incluyeron en el estudio 45 mujeres vistas consecutivamente en la consulta de Medicina Interna, Endocrinología y Ginecología del Hospital Central «Dr. Urquinaona» con diagnóstico de SOPQ. El comité de ética del hospital aprobó el estudio y se obtuvo consentimiento por escrito de todas las mujeres.
El diagnóstico de SOPQ se confirmó por los siguientes criterios: evidencia de oligo-anovulación (menos de 6 periodos menstruales en el año previo), signos clínicos o bioquímicos de hiperandrogenismo (hirsutismo, acné y/o concentraciones de testosterona plasmática por encima del límite superior normal y ovarios normales o aumentados de tamaño (>10ml) con la presencia de microquistes subcapsulares (en número de 12 o más) de 2-9 milímetros de diámetro en la evaluación ecográfica13.
Se excluyeron las mujeres con enfermedad tiroidea o suprarrenal, presencia de hiperprolactinemia, aquellas mujeres que no aceptaron a participar en el estudio o que no asistieron a las consultas de seguimiento del tratamiento o que consumieron algún tratamiento que alterara las concentraciones de alguno de los parámetros estudiados (por ejemplo, anticonceptivos orales).
La evaluación morfológica-ecográfica ovárica se realizó con un ecógrafo Doppler color Logiq Pro 3 Marca General Electrics usando un transductor abdominal convexo de 3,5MHz y un transductor vaginal de 5MHz. Se midió la circunferencia de la cintura y la cadera en la región más estrecha del abdomen y en la parte más ancha de la región glútea, respectivamente. Las muestras de sangre venosa se tomaron después de un ayuno de 12 horas; se extrajo una muestra de la vena antecubital en la primera semana posterior a la menstruación espontánea o inducida, antes del inicio del tratamiento y a los 6 meses después. Todas las muestras se manejaron de forma similar y se almacenaron a −8°C en las siguientes 72 horas.
Las mujeres recibieron atorvastatina a una dosis de 20mg/día por 6 meses. Se seleccionó esta dosis como tratamiento inicial para reducir las concentraciones séricas de colesterol y LDL. Se solicitó a las mujeres que no realizaran modificaciones en su dieta y actividad física y que las realizaran en forma similar a antes del inicio del estudio.
Las concentraciones de FSH, LH, androstenodiona y testosterona libre se midieron por radioinmunoensayo y quimioluminiscencia usando kits comerciales. Los coeficientes de variación intra e interensayo fueron de 4 y 7% para FSH, 6 y 7% para LH, 6 y 10% para androstenodiona y 4 y 7% para testosterona libre, respectivamente. La globulina fijadora de hormonas sexuales (GFHS) se cuantificó por radioinmunoensayo usando anticuerpos policlonales anti-GFHS. El colesterol total y los triglicéridos se midieron usando métodos enzimáticos automáticos en un analizador Roche/Hitachi74. Las concentraciones de colesterol unido a lipoproteínas de alta densidad (HDL) se determinaron después de precipitación selectiva usando manganeso heparina y posterior determinación enzimática de colesterol. El colesterol unido a lipoproteínas de baja densidad (LDL) se calcularon usando la fórmula de Friedwald (LDL=colesterol-HDL-[triglicéridos/5]). Las concentraciones plasmáticas de PCR ultrasensible se midieron por radioensayo de quimioluminiscencia con coeficientes de variación intra e interensayo de 8,7 y 7%, respectivamente. La sensibilidad de detección fue de 0,01mg/dl.
La evaluación de los efectos adversos se realizó en forma bimensual con la evaluación clínica (cefalea, astenia, dolor abdominal, dispepsia, náuseas, flatulencia, estreñimiento, diarrea, mialgias) o de laboratorio (concentraciones de transaminasas). Si las mujeres en algún momento presentaban efectos adversos severos o alteraciones del funcionalismo hepático fueron retiradas inmediatamente de la investigación.
Los datos se analizaron usando el análisis de varianza usando la prueba t de Student para muestras relacionadas comparando los resultados de laboratorio antes y después del tratamiento. Un valor de p<0,05 se consideró estadísticamente significativo.
ResultadosSe seleccionaron un total de 45 mujeres que cumplieron los criterios de inclusión. La edad promedio de las mujeres fue de 23,2±2,8 años. El valor promedio del índice de masa corporal (IMC) fue de 29,4±4,8kg/m2 y de la relación cintura cadera fue de 0,87±0,07.
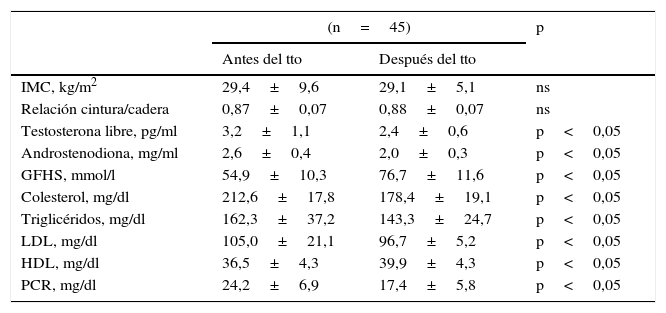
En la tabla 1 se muestran los valores promedio de IMC, andrógenos, lípidos, lipoproteínas en las mujeres estudiadas antes y después del tratamiento con atorvastatina. No se encontraron modificaciones en los valores promedios de IMC y en la relación cintura cadera antes y después del tratamiento (p<0,05). Sí se encontraron disminuciones significativas en las concentraciones de testosterona libre y androstenodiona luego del tratamiento por 6 meses (p<0,05). También se observó un aumento significativo en las concentraciones de GFHS al comparar las concentraciones luego de 6 meses de tratamiento comparado con las concentraciones iniciales (p<0,05).
Efectos del tratamiento con atorvastatina en las pacientes con síndrome de ovarios poliquísticos
| (n=45) | p | ||
|---|---|---|---|
| Antes del tto | Después del tto | ||
| IMC, kg/m2 | 29,4±9,6 | 29,1±5,1 | ns |
| Relación cintura/cadera | 0,87±0,07 | 0,88±0,07 | ns |
| Testosterona libre, pg/ml | 3,2±1,1 | 2,4±0,6 | p<0,05 |
| Androstenodiona, mg/ml | 2,6±0,4 | 2,0±0,3 | p<0,05 |
| GFHS, mmol/l | 54,9±10,3 | 76,7±11,6 | p<0,05 |
| Colesterol, mg/dl | 212,6±17,8 | 178,4±19,1 | p<0,05 |
| Triglicéridos, mg/dl | 162,3±37,2 | 143,3±24,7 | p<0,05 |
| LDL, mg/dl | 105,0±21,1 | 96,7±5,2 | p<0,05 |
| HDL, mg/dl | 36,5±4,3 | 39,9±4,3 | p<0,05 |
| PCR, mg/dl | 24,2±6,9 | 17,4±5,8 | p<0,05 |
GFHS: globulina fijadora de hormonas sexuales; HDL: colesterol unido a lipoproteínas de alta densidad; IMC: índice de masa corporal; LDL: colesterol unido a lipoproteínas de baja densidad; PCR: proteína C reactiva.
Al comparar las concentraciones de lípidos plasmáticos (tabla 1) al momento del inicio del estudio las mujeres presentaron valores de colesterol de 212,6±17,8mg/dl y luego del tratamiento se observaron valores promedio de 178,4±19,1mg/dl, siendo la disminución de 19,1% (p<0,05). Con respecto a las concentraciones de triglicéridos se observó una disminución estadísticamente significativa de 11% (p<0,05). En forma similar, las mujeres seleccionadas presentaron reducciones significativas de 8,5% en las concentraciones de LDL (p<0,05). Por otra parte, se encontró un aumento significativo de 8,5% en las concentraciones de HDL (p<0,05).
Con respecto a las concentraciones de PCR, las concentraciones iniciales fueron de 24,2±6,9mg/dl. Posterior al tratamiento las concentraciones promedios fueron de 17,4±5,8mg/dl. Esta diferencia fue considerara estadísticamente significativa y superior al 39% (p<0,05).
No se reportaron efectos adversos severos que ameritaran la retirada de alguna de las participantes de la investigación.
DiscusiónLos resultados de la investigación demuestran que el tratamiento con atorvastatina por 6 meses produce disminución significativa de las concentraciones de PCR en mujeres con SOPQ y sobrepeso. También se demostró la modificación en las concentraciones de lípidos y lipoproteínas a un perfil menos aterogénico.
El SOPQ está caracterizado por anovulación crónica, hiperinsulinemia, hiperandrogenismo e infertilidad; y es uno de los desórdenes endocrinos más frecuente en las mujeres en edad reproductiva. Comparte muchas características con el síndrome metabólico, incluyendo obesidad abdominal, resistencia a la insulina, hipertensión, dislipidemia y aterosclerosis2. El incremento de la adiposidad es un hallazgo común en las mujeres con SOPQ. Aunque los mecanismos moleculares de esta asociación aún no están claros, existen evidencias de que el incremento de la grasa corporal tiene un impacto negativo en varios hallazgos clínicos de estas mujeres3,14. La hipótesis que en estas mujeres la grasa corporal tiene un papel principal en la inflamación crónica de bajo grado, la cual se asocia con el riesgo potencial de aterosclerosis.
La disminución en las concentraciones de PCR y colesterol en las mujeres con SOPQ ha demostrado tener efectos benéficos. En estudios de laboratorio y animales se ha demostrado que la PCR se asocia con un incremento de la depuración de triglicéridos pospandriales, esterificación de los ácidos grasos en el tejido adiposo y disminución de la lipólisis mediada por la lipasa sensitiva a hormonas4. Sin embargo, en estudios en humanos, el incremento en las concentraciones de la PCR se asocia con obesidad, diabetes y enfermedades cardiovasculares15,16. Más aún, el incremento de las concentraciones es un mecanismo que indica el desarrollo de resistencia a la insulina. Aunque las mujeres con SOPQ son relativamente sensibles a la insulina, el incremento de las concentraciones de PCR ultrasensible sugiere una alteración del estado metabólico que puede contribuir al incremento del riesgo cardiovascular.
En la presente investigación se observó una reducción del 39% en las concentraciones de PCR luego del tratamiento con atorvastatina durante 6 meses. Esta reducción es mayor al 25% reportado por Sathyapalan et al.17. La atorvastatina también produce disminuciones significativas de la PCR con la tendencia a reducir la resistencia a la insulina en mujeres con alteración de la tolerancia glucosada18. Una reducción en la resistencia a la insulina puede ser fundamental para las mejoras reportadas para la hiperandrogenemia en investigaciones previas17,19 y en las concentraciones de PCR reportadas en la presente investigación.
Otro hallazgo importante, y esperado, es la demostración de la mejoría del perfil lipídico observado luego del tratamiento con atorvastatina. Este efecto es de particular valor en las mujeres con SOPQ, una condición caracterizada por concentraciones plasmáticas elevadas de colesterol, LDL, VLDL y triglicéridos con reducción significativa de las concentraciones de HDL20,21. Más aún las mujeres con SOPQ tienen una mayor prevalencia de aterosclerosis subclínica14. El uso de estatinas en estas mujeres es probable que ofrezca una protección significativa de la morbilidad cardiovascular a largo plazo.
La disminución del LDL colesterol es el objetivo primario del tratamiento en pacientes con síndrome metabólico, y a su vez de las mujeres con SOPQ. La disminución observada en la presente investigación (8,5%) es menor a la considerada ideal para el tratamiento de la hiperlipidemia en pacientes con síndrome metabólico22. Sin embargo, las concentraciones de LDL podrían no reflejar en forma adecuada el riesgo asociado con la dislipidemia aterogénica en este grupo de mujeres. Ciertos expertos han recomendado considerar el colesterol no-HDL. En esta investigación la atorvastatina disminuyó estas concentraciones a valores similares de investigaciones previas en sujetos con síndrome metabólico22,23.
Entre los agentes conocidos que afectan la hiperandrogenemia en las mujeres con SOPQ, la reducción observada en investigaciones previas demuestra que la reducción observada en las concentraciones de testosterona es mayor en las mujeres tratadas con atorvastatina (33%) comparado con otros sensibilizadores de la insulina como la metformina que produce una disminución de 14% en las concentraciones luego de 3 meses de uso17,19 y que las tiazolidonas que provocan una disminución entre el 6-15% de las concentraciones de testosterona24,25.
Las concentraciones de PCR son influenciados por las concentraciones de andrógenos. Las estatinas inhiben la proliferación de las células intersticiales de la teca y la esteroidogénesis in vitro26,27. Los ovarios de las mujeres con SOPQ están generalmente aumentados de tamaño con hiperplasia prominente de las células intersticiales de la teca y producción excesiva de andrógenos por estas células28. Los efectos de las estatinas sobre la esteroidogénesis están posiblemente más relacionados con la inhibición de la síntesis de colesterol por la vía del mevalonato, con una reducción posterior de la disponibilidad de progesterona y testosterona. La disminución de la isoprenilación puede llevar a reducción de la actividad de pequeñas GTPasas resultando, por lo tanto, en alteración en los mecanismos de proliferación y función de los tejidos ováricos. En particular, las estatinas pueden reducir la actividad de la MAPK1 y disminuir la producción citoplasmática de especies reactivas de oxígeno al atenuar la actividad de la oxidasa fosfato del dinucleotido nicotinamida adenina26,27.
Se concluye que luego del uso de atorvastatina por 6 meses se observó disminución de las concentraciones de PCR, al igual que en las concentraciones de colesterol, triglicéridos y LDL, en mujeres con SOPQ y sobrepeso.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.