Los fallos repetidos en fecundación in vitro constituyen un reto en los tratamientos de fertilidad, sobre todo en ciclos con embriones de buena calidad, donde el endometrio parece ser la causa del fracaso reproductivo. Las pruebas diagnósticas dirigidas para la evaluación del endometrio óptimo, antes de una nueva transferencia, siguen siendo un reto para los tratamientos de reproducción asistida. El test de receptividad endometrial Endometrial Receptivity Map (ER®map) (Pronacera Therapeutics SL, Sevilla, España) nos aporta nueva información endometrial para personalizar la transferencia embrionaria siguiente, pudiendo mejorar así los resultados reproductivos de las pacientes con fallos previos de implantación.
ObjetivoEl objetivo principal es conocer si existen diferencias en la tasa de embarazo evolutivo (OPR) y tasa de embarazo clínico (PR) tras transferencias embrionarias fallidas previas con embriones de buena calidad, entre el grupo de estudio (E) con biopsia endometrial para estudio de receptividad endometrial previa a una nueva transferencia, y el grupo de control (C) con nueva transferencia estándar sin estudio anterior de receptividad endometrial.
Material y métodosEstudio observacional, analítico, longitudinal, retrospectivo de casos y controles históricos, realizado en la Unidad de Reproducción Asistida (URA) del Hospital Quirónsalud Barcelona, incluyendo a 104 pacientes con una o más transferencias embrionarias previas fallidas de embriones de buena calidad entre los años 2017 a 2019. A las pacientes con dos o más transferencias fallidas previas se les realizó una histeroscopia diagnóstica, junto a una analítica con la determinación de anticoagulante lúpico, anticuerpos antiB2 glicoproteina IgG/IgM, anticuerpos anticardiolipina IgG/IgM, y trombofilia hereditaria como parte del estudio de fallos de implantación del centro. El grupo E, con 55 pacientes, fue informado por escrito sobre la posibilidad de ampliar el estudio endometrial con una biopsia de endometrio para el análisis de la receptividad endometrial y aceptaron, realizando dicho estudio endometrial mediante el test ER®map (Pronacera Therapeutics SL, Sevilla, España) previo a programar una nueva transferencia personalizada (TEp) en función del resultado del test. En el grupo C incluimos a 49 pacientes (controles históricos) que habíamos visitado previamente en nuestra Unidad, que cumplían los mismos criterios de inclusión y exclusión, y a las que no se les informó sobre la posibilidad de realizar dicho estudio mediante biopsia endometrial previa a nueva transferencia embrionaria al no disponer en ese momento de ella, programándose una nueva transferencia (sTE), según el protocolo estándar del centro.
ResultadosLos resultados de la prueba de receptividad endometrial en el grupo E fueron 63,6% receptivos y 36,3% no receptivos. El grupo E presentó una tasa de PR mayor al grupo C (PR 70,9 vs. 42,8% p < 0,05), y una tasa de OPR en el grupo E mayor (OPR 60% vs. 38,7% p< 0,05). Si analizamos los datos en función del número de transferencias fallidas previas la PR y OPR en el grupo E fue superior al grupo C (PR 72,2 vs. 33,3% no significativo [NS]) (OPR 55,5 vs. 33,3% NS) tras una transferencia fallida previa; también obtuvimos mejores resultados en el grupo E respecto al grupo C (PR 84,2 vs. 56% NS), (OPR 73,6 vs. 48% NS) después de dos transferencias fallidas previas; los resultados después de tres o más transferencias fallidas previas fueron mejores en el grupo E (PR 55,5 vs. 27,7% NS), (OPR 50 vs. 27,7% NS). Si analizamos solo los resultados con transferencias de embriones euploides y/o de donación de ovocitos la PR y OPR fueron mayores en el grupo E vs. el grupo C (PR 71 vs. 47% NS), y (OPR 60,5 vs. 41,1% NS), respectivamente.
ConclusionesLa transferencia embrionaria personalizada mediante el estudio de receptividad endometrial previo a una nueva transferencia podría mejorar los resultados reproductivos en pacientes con fallos previos de implantación, respecto al grupo C en el que no hemos realizado dicho estudio endometrial.
Repeated failures in in vitro fertilization are a challenge in fertility treatments, especially in cycles with good quality embryos, where the endometrium appears to be the cause of reproductive failure. Targeted diagnostic tests for evaluation of the optimal endometrium before a new transfer remains a challenge for assisted reproduction treatments. The Endometrial Receptivity Map (ER®map Pronacera Therapeutics SL, Seville, Spain) test provides new endometrial information to customize the next embryo transfer to improve reproductive outcomes for patients with previous implantation failure.
ObjectiveThe main objective is to determine whether there are differences in the ongoing pregnancy rate by embryo transfer (OPR), after previous failed embryo transfers with good quality embryos, between the study group (E) with endometrial biopsy for endometrial receptivity study prior to a new transfer, and the control group (C) with new standard transfer without previous endometrial receptivity study.
Material and methodsObservational, analytical, longitudinal, retrospective study of cases and historical controls, conducted in the Assisted Reproduction Unit (ARU) of the Hospital Quirónsalud Barcelona, including 104 patients with one or more previous failed embryo transfers with good quality embryos between the periods 2017-2019. Patients with more than one previous failed transfer underwent a diagnostic hysteroscopy, and an analysis was requested with the determination of: lupus anticoagulant, anti-B2-glycoprotein IgG/IgM antibodies, anti-cardiolipin IgG/IgM antibodies, and hereditary thrombophilia as part of the study of implantation failures in the centre. The study group (E), with 55 patients, underwent an endometrial biopsy for the analysis of endometrial receptivity by means of the ER®map (Pronacera Therapeutics SL, Seville, Spain) test prior to scheduling a new personalized transfer (pTE) based on the test result; the control group (C), with 49 patients (historical controls), did not undergo endometrial biopsy for the study of endometrial receptivity after one or more failed embryo transfers with good quality embryos, and a new embryo transfer was scheduled according to the centre's standard protocol (sTE).
ResultsThe results of the endometrial receptivity test in the study group were 63.6% receptive and 36.3% non-receptive. The study group had a higher clinical pregnancy rate (PR) than the control group (PR 70.9 vs. 42.8% p< .05), and there was a higher ongoing pregnancy rate (OPR) in the study group (OPR 60 vs. 38.7% p< .05). If we analyse the data according to the number of previous failed transfers, the PR and OPR in the study group was higher than in the control group (PR 72.2 vs, 33.3% NS) (NS: non significance), (OPR 55.5 vs. 33.3% NS) after a previous failed transfer; we also obtained better results in the study group with respect to the control group (PR 84. 2 vs. 56% p< .05), (OPR 73.6 vs. 48% NS) after two previous failed transfers; the results after three or more previous failed transfers were better in the study group (PR 55.5 vs. 27.7% NS), (OPR 50 vs. 27.7% NS). If we eliminate the embryonic factor by analysing only the results with euploid embryo transfers and/or oocyte donation, the PR and OPR were higher in the study group vs the control group (PR 71 vs. 47% NS), and (OPR 60.53 vs. 41.17% NS) respectively.
ConclusionsThe study of endometrial receptivity prior to a new transfer improves reproductive results in patients with previous implantation failure, with respect to the control group in which we did not carry out an endometrial study.
La implantación es el proceso en el cual un embrión sano y viable se fija en el endometrio para continuar su desarrollo, gracias a un diálogo molecular constante entre ambos. El endometrio es un órgano dinámico y activo con cambios histológicos y moleculares en cada ciclo menstrual para permitir la implantación de un embrión, adquiriendo un estado de receptividad endometrial. Durante la mayor parte del ciclo menstrual de la mujer, el estado del endometrio no es receptivo para la implantación de un embrión. Solo se vuelve receptivo durante un corto período de tiempo entre el día 19 al 21 del ciclo menstrual, lo que llamamos ventana de implantación (WOI)1 que ocurre siete días después del pico de hormona luteinizante (LH) endógena (LH + 7 endógena), o bien, tras cinco días completos de exposición exógena de progesterona P + 5 (120 horas) en un ciclo sustitutivo después de la toma de estrógenos y posteriormente progesterona.
La WOI puede alterarse por la estimulación ovárica2, por la presencia de una patología uterina/tubárica3, por factores ambientales o de forma intrínseca en una misma persona. Definir cuando una paciente abre su WOI puede ser la clave para tratar los fallos de implantación en fecundación in vitro (FIV), ya que la transferencia de embriones fuera de la WOI personalizada podría justificar la no implantación de un embrión de buena calidad.
Tradicionalmente, la valoración del endometrio receptivo se ha realizado mediante técnicas de imagen como la histeroscopia4, ecografía, eco-Doppler, histología, e inmuno-histoquímica. Con la era de las técnicas genómicas, la transcriptómica endometrial nos ha permitido estudiar con mayor exactitud el estadio de receptividad endometrial5,6, identificando el patrón génico que codifica los cambios histológicos y moleculares correspondiente a la WOI, es decir, definir el patrón génico del endometrio receptivo. Con el estudio del endometrio receptivo podemos mejorar los resultados en las técnicas de reproducción asistida, sobre todo dirigido a pacientes con fallos repetidos de implantación (RIF), concepto definido por la no consecución de embarazo en mujeres de menos de 40 años tras haber transferido al menos cuatro embriones de buena calidad, repartidos en al menos tres transferencias7. La definición ha sido actualizada por la Sociedad Española de Fertilidad (SEF) y adaptada a las nuevas tecnologías en las que se trabaja actualmente en los centros de reproducción asistida (transferencias en blastocisto, transferencias embrionarias únicas y análisis de aneuploídias en pacientes a partir de los 38 años), publicando unas recomendaciones donde define los RIF como la no consecución de embarazo en mujeres de < 38 años tras haber transferido al menos tres blastocistos de buena calidad, o posteriormente la transferencia de tres blastoscistos euploides en mujeres de 38 años o más, definiendo al blastocisto como un embrión de cinco o seis días después de la fecundación.
El 70 a 80% del éxito de una implantación depende de la calidad embrionaria, por lo que, para el estudio de los RIF (en que la propia definición excluye a embriones de mala calidad) nos debemos centrar en el estudio endometrial8. La histeroscopia diagnóstica con alto nivel de evidencia4 y el ensayo de trombofilia adquirida y hereditaria4,9 forman parte del estudio inicial en el contexto de pacientes con RIF. Junto con estas pruebas deben considerarse otro tipo de estudios relacionados con la implantación como el de la microbiota10, el grosor endometrial previo a la transferencia11, niveles elevados de progesterona sérica durante la estimulación ovárica en fresco12, así como los niveles óptimos en fase lútea en ciclos sustitutivos el día de la transferencia embrionaria13, relacionados todos ellos con la implantación.
El fallo de implantación se puede entender también como un error en el momento de sincronizar el endometrio con el embrión a transferir. En una cuarta parte de las pacientes con RIF, la WOI se encuentra desplazada14. Bajo este criterio, para el estudio de los RIF, el transcriptómico endometrial, con sus diferentes enfoques genéticos, podría formar parte del estudio endometrial, junto con el resto de las pruebas. Centrándonos con los test moleculares que datan el endometrio en el momento de mayor receptividad endometrial (día 20 del ciclo) mediante la transcriptómica, como el test Endometrial Receptivity Map (ERmap® Pronacera Therapeutics SL, Sevilla, España) y el Endometrial Receptivity Array (ERA® Igenomix SL,Valencia, España), las pacientes con resultados de receptividad endometrial desplazados, la transferencia embrionaria en estadio de blastocisto se planifica sincronizándola con la WOI específica de cada paciente, incluyendo el concepto de transferencia embrionaria personalizada (TEp). Con resultados del test receptivo, tras cinco días completos de progesterona (120 horas), también podemos realizar la transferencia de un embrión en estadio de células a día + 3, suplementando a la paciente con tres días completos de progesterona (72 horas).
Hasta el momento, existen en la literatura datos contradictorios a favor15,16 que publican resultados muy prometedores tras la transferencia personalizada (TEp) en pacientes con fallos de implantación previos, que se contradicen con publicaciones17-19 en las que no encuentran diferencias estadísticamente significativas respecto a poder demostrar que después de modificar la WOI, según los resultados genéticos y moleculares del estudio endometrial, mejoren las tasas de embarazo en pacientes con fallos previos de implantación.
Nuestro trabajo se centra en aportar más información sobre el papel del estudio transcriptómico endometrial y los resultados reproductivos, en pacientes sometidas a FIV/inyección intracitoplasmática de espermatozoides (ICSI) con fallos previos de implantación. El objetivo principal de nuestro trabajo es identificar la contribución del factor endometrial en fallos de implantación al comprobar si mejoran las tasas embarazo clínico (PR) y tasa de embarazo evolutivo (OPR), por TEp mediante el test ER®map (Pronacera Therapeutics SL, Sevilla, España), respecto la transferencia estándar (TEs) sin la información de la WOI de la paciente antes de una nueva transferencia embrionaria.
Material y métodosLa hipótesis del trabajo expone que las pacientes presentan diferentes patrones de receptividad endometrial que pueden explicar los fallos de implantación en ciclos de FIV. Se trata de un estudio observacional, longitudinal, de casos y controles históricos, retrospectivo, realizado en un solo centro, incluyendo 104 pacientes de entre 18 a 45 años, visitadas en la Unidad de Reproducción Asistida del Hospital Quirónsalud Barcelona, entre diciembre del 2017 y abril del 2019, que realizaron un ciclo de FIV/ICSI en nuestro centro con fines reproductivos, con cariotipos de la pareja normales, sin factor masculino grave, ni enfermedades crónicas conocidas, ni exposición a fármacos y/o tóxicos, sin patología urogenital, ni enfermedades infecciosas, ni inflamatorias, con una o más transferencias previas sin éxito de embriones de buena calidad, categoría A y/o B según criterios de la Asociación para el Estudio de la Biología de la Reproducción (ASEBIR). Controlamos los sesgos de selección al comparar los grupos de pacientes lo más homogéneos posibles y los sesgos de información identificando como paciente estudio (E) a quien le realizamos la prueba diagnóstica y al paciente control (C) como a quien no se le efectuó la prueba endometrial. No hay conflicto de intereses por ninguna parte.
Con dos o más transferencias previas fallidas se les realizó una histeroscopia, con cultivo endometrial siendo normal en un 60,3% de los casos, y en el resto 39,7% se diagnosticó: pólipos, miomas, sinequias, malformaciones uterinas y endometritis, de forma similar a lo reportado en la literatura20. En todos los casos en los que se encontró patología uterina, esta fue corregida antes de una nueva transferencia. Junto a la histeroscopia, se les practicó una analítica de sangre para descartar trombofilia adquirida y/o hereditaria como parte del estudio de fallos de implantación, encontrando presencia de algún tipo de trombofilia en el 39% de los casos (mayor prevalencia de la mutación FV Leiden, mutación MTHFR, anticuerpos antifosfolípidos) resultados similares a los descrito por Qublan et al.21 A las pacientes diagnosticadas de trombofilia hereditaria se les trató con heparina de bajo peso molecular desde el inicio del tratamiento hormonal y a las mujeres con presencia de anticuerpos antifosfolípidos, en al menos dos determinaciones, fueron tratadas con ácido acetilsalicílico junto con heparina de bajo peso molecular, protocolo consensuado con el servicio de hematología de nuestro hospital.
A todas las pacientes del centro URA Hospital Quirónsalud Barcelona con al menos una transferencia embrionaria previa fallida con embrión de buena calidad (A/B según categoría ASEBIR), visitadas entre diciembre del 2017 y abril del 2019, se les informó verbalmente y por escrito de la posibilidad de realizar una biopsia endometrial para el estudio de la WOI previo a una nueva transferencia de embriones, tanto en ovocitos propios como en ciclos de donación de ovocitos. Después de leer el documento informativo y aceptar libremente hacerse la prueba de receptividad endometrial ERMap® fueron incluidas un total de 55 participantes en el grupo E. Una vez conseguidas las pacientes E comparamos sus resultados con un total de 49 controles históricos de nuestra misma Unidad que habíamos visitado durante un año previo al inicio del estudio bajo los mismos criterios de selección, sin que hubiésemos podido informarlas de poder realizar el test, tras una o más transferencias embrionarias fallidas, al no disponer del mismo.
El protocolo de estimulación ovárica previa para generar embriones, tanto en pacientes como en donantes de nuestro centro, consiste en un protocolo corto con antagonistas, con gonadotropinas urinarias y/o recombinantes, desde el tercer día de un ciclo espontaneo o tras cinco días de haber dejado el anticonceptivo oral que previamente tomaba la paciente, con descarga de la ovulación al detectar por ecografía tres o más folículos ováricos de ≥ 18 mm, mediante 250 mcg de coriogonadotropina alfa recombinante (Ovitrelle® 250 mcg, Merck Serono SA, Madrid, España) subcutánea a las 36 horas previas a la punción ovárica. A las pacientes que les efectúa transferencia en fresco realizarán suplemento de fase lútea desde la noche de la punción ovárica con 400 mg de progesterona natural micronizada vaginal cada 12 horas (Utrogestan® SEID LAB SA, Barcelona, España) (Progeffik® EFFIK SA, Madrid, España) hasta el día de la prueba de embarazo. En los casos con riesgo de síndrome de hiperestimulación ovárica (estradiol el día de la descarga >3.000 pg/mL y/o más de 15 folículos en crecimiento de >14 mm) se realizó la descarga ovulatoria con 0,2 mg subcutáneo de un análogo de la hormona liberadora de gonadotropina (GnRH) (Decapeptyl® 0,1 mg IPSEN PHARMA SA, Barcelona, España) con la consiguiente congelación de los embriones.
El protocolo de preparación endometrial que realizaron todas nuestras pacientes (grupo E y grupo C) para efectuar una transferencia embrionaria de aquellos procedentes de ovocitos propios congelados, como de embriones en fresco o congelados de un ciclo de donación de ovocitos, consistió en administrar valerato de estradiol 2 mg (Estradiol-Meriestra® SANDOZ Farmacéutica SA, Barcelona, España) (Progyluton® LAB SCHERING PLOUGH SA, Madrid, España) (Progynova® BAYER HISPANIA SL, Barcelona, España) cada ocho horas vía oral, iniciando la impregnación estrogénica desde el primer día del ciclo menstrual, tanto en ciclo espontaneo como previa supresión ovárica con un análogo de la GnRH (Decapeptyl® 3,75 mg IPSEN PHARMA SA, Barcelona, España) intramuscular entre los días 18 y 21 del ciclo previo. Se realizó una ecografía endometrial a los siete a 10 días de haber iniciado la pauta con estrógenos para comprobar grosor endometrial de ≥ 7 mm, y morfología endometrial triple línea/ proliferativo. Posteriormente, se suplementó durante cinco días completos PG + 5 (120 horas) con 400 mg de progesterona natural micronizada vaginal (Progeffik® EFFIK SA, Madrid, España) (Utrogestan® SEID LAB SA, Barcelona, España) cada 12 horas si transferimos un embrión en estadio de blastocisto, hasta el día de la prueba de embarazo.
En un ciclo previo, al grupo E (n = 55 pacientes) se le realizó una biopsia endometrial tras cinco días completos de progesterona sobre un endometrio previamente impregnado de estrógenos, para personalizar la transferencia embrionaria (TEp) en el ciclo posterior en función de los resultados del test de receptividad endometrial (Ermap® Pronacera Therapeutics SL, Sevilla, España). El día de la biopsia endometrial, comprobamos los datos de la paciente, así como los días de progesterona que llevaba y realizamos la biopsia endometrial, utilizando el Kit ER®map (Pronacera Therapeutics SL, Sevilla, España) con una cánula de Cornier Pipelle, recogiendo material endometrial del fondo uterino hasta el número 5 de la cánula, mediante un proceso de biopsia endometrial. Este material lo introducimos inmediatamente en un tubo comercial para análisis de la toma, debidamente etiquetado con el nombre de la paciente, fecha de nacimiento, y fecha de la prueba. Agitamos suavemente el contenido del tubo correctamente cerrado invirtiéndolo ocho a 10 veces después de la recogida de la muestra. El contenido del tubo del mapa ER®map (Pronacera Therapeutics SL, Sevilla, España) se almacenó en el refrigerador a 4°C por un mínimo de cuatro horas hasta que la muestra se envía a temperatura ambiente en el receptáculo apropiado por el kit. Se adjunta al tubo de muestra un formulario de solicitud con el nombre de la paciente y del médico que realiza la prueba, el número de historia clínica de la paciente y fecha y hora de inicio de administración de progesterona, junto con el consentimiento informado del estudio por la paciente y el personal médico. La muestra se envía a una temperatura no superior a 35°C para su correcto procesamiento.
El resultado de la prueba ER®map (Pronacera Therapeutics SL, Sevilla, España) puede ser receptivo o no receptivo. Si el resultado es receptivo se programa una nueva transferencia embrionaria con el mismo patrón de tratamiento hormonal sustitutivo que hemos realizado previo a la biopsia. Si el resultado del test no es receptivo, pudiendo ser pre-receptivo o post-receptivo, informamos a la paciente que el perfil de expresión génica de su endometrio nos indica que no se encuentra en la WOI y se sugiere tomar una segunda biopsia confirmatoria con las recomendaciones específicas en cada caso que nos guiará en la programación de la siguiente transferencia embrionaria. Compararemos los resultados con base en dos variables principales: PR y OPR.
El cálculo de PR por transferencia embrionaria se define como el número de pacientes con la fracción beta de la hormona coriónica humana (Beta-hCG) positiva (>15 mUI/mL) a los 10 días de la transferencia embrionaria con comprobación ecográfica de presencia de saco gestacional, dividido por el total de mujeres en las que hubo transferencia embrionaria en cada uno de los grupos. Evaluaremos la OPR, dividiendo las pacientes con saco gestacional comprobado por ecografía con latido cardiaco embrionario positivo, por el total de pacientes que se han sometido a una transferencia embrionaria en cada uno de los grupos, excluyendo las pérdidas gestacionales precoces, embarazos bioquímicos y gestaciones ectópicas.
Las variables secundarias recogidas en los dos grupos fueron: datos demográficos de las pacientes como edad (años), valores de hormona folículo estimulante (FSH mUI/mL) determinada el tercer día del ciclo, hormona antimülleriana (AMH ng/mL), recuento de folículos antrales (RFA), ciclo con ovocitos propios o donación de ovocitos, ciclos con diagnóstico genético preimplantacional (PGT-A), grosor endometrial (mm) el día previo al inicio de la suplementación con progesterona y el resultado de la prueba de receptividad endometrial (receptivo, post-receptivo, pre-receptivo).
Recogimos los datos de las pacientes en una tabla de Excel. El estudio fue aprobado por el comité de ética del Hospital Quirón-Teknon de Barcelona. Para el cálculo del tamaño de la muestra se estableció una frecuencia de exposición entre los controles del 40%, un OR = 4, un nivel de seguridad del 95% y un poder estadístico del 80%. El cálculo de la muestra fue de 55 pacientes en el grupo E y 49 en el grupo C. La muestra del estudio fue suficiente para encontrar diferencias entre los grupos de >20%, con un intervalo de confianza del 95%. Las variables cualitativas se expresarán en forma de frecuencias absolutas y relativas. Las variables cuantitativas se presentarán en forma de media. Para la comparación de las variables principales y secundarias, PR y OPR, tras personalizar la transferencia entre los grupos, se empleará la prueba X2 para la comparación de porcentajes en muestras independientes. La comparación de las variables secundarias continuas se realizará mediante la prueba t de Student o U de Mann-Whitney, según sea más conveniente. La comparación de las variables respuesta secundarias cualitativas se efectuará mediante la prueba X2o la F de Fisher, según sea más conveniente. Se considerarán como estadísticamente significativos valores p < 0,05.
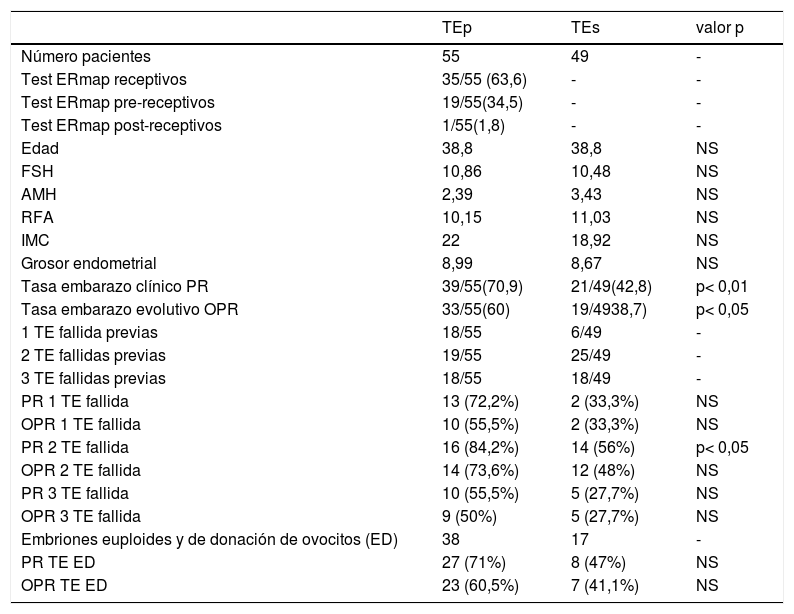
ResultadosNo encontramos diferencias entre los grupos E y C estadísticamente significativas con las variables secundarias: edad, FSH, AMH, RFA, índice de masa corporal (IMC), grosor endometrial el día previo al inicio de la progesterona (tabla 1).
Variables secundarias del estudio
| TEp | TEs | valor p | |
|---|---|---|---|
| Número pacientes | 55 | 49 | - |
| Test ERmap receptivos | 35/55 (63,6) | - | - |
| Test ERmap pre-receptivos | 19/55(34,5) | - | - |
| Test ERmap post-receptivos | 1/55(1,8) | - | - |
| Edad | 38,8 | 38,8 | NS |
| FSH | 10,86 | 10,48 | NS |
| AMH | 2,39 | 3,43 | NS |
| RFA | 10,15 | 11,03 | NS |
| IMC | 22 | 18,92 | NS |
| Grosor endometrial | 8,99 | 8,67 | NS |
| Tasa embarazo clínico PR | 39/55(70,9) | 21/49(42,8) | p< 0,01 |
| Tasa embarazo evolutivo OPR | 33/55(60) | 19/4938,7) | p< 0,05 |
| 1 TE fallida previas | 18/55 | 6/49 | - |
| 2 TE fallidas previas | 19/55 | 25/49 | - |
| 3 TE fallidas previas | 18/55 | 18/49 | - |
| PR 1 TE fallida | 13 (72,2%) | 2 (33,3%) | NS |
| OPR 1 TE fallida | 10 (55,5%) | 2 (33,3%) | NS |
| PR 2 TE fallida | 16 (84,2%) | 14 (56%) | p< 0,05 |
| OPR 2 TE fallida | 14 (73,6%) | 12 (48%) | NS |
| PR 3 TE fallida | 10 (55,5%) | 5 (27,7%) | NS |
| OPR 3 TE fallida | 9 (50%) | 5 (27,7%) | NS |
| Embriones euploides y de donación de ovocitos (ED) | 38 | 17 | - |
| PR TE ED | 27 (71%) | 8 (47%) | NS |
| OPR TE ED | 23 (60,5%) | 7 (41,1%) | NS |
AMH: hormona antimülleriana ng/mL (media %); ED: analizando resultados incluyendo únicamente embriones euploides y/o procedentes de donación de ovocitos; Edad (media %); FSH: hormona folículo estimulante mUI/mL (media %); IMC: índice de masa corporal kg/m2 (media %); mm: grosor endometrtial (media %); OPR: tasa embarazo evolutivo (%); PR: tasa embarazo clínico (%); RFA: recuento de folículos antrales (media %); TE: transferencia embrionaria; TEp: transferencia embrionaria personalizada; TEs: transferencia embrionaria estándar.
p < 0,05 estadísticamente significativo, p >0,05 (NS) no estadísticamente significativo.
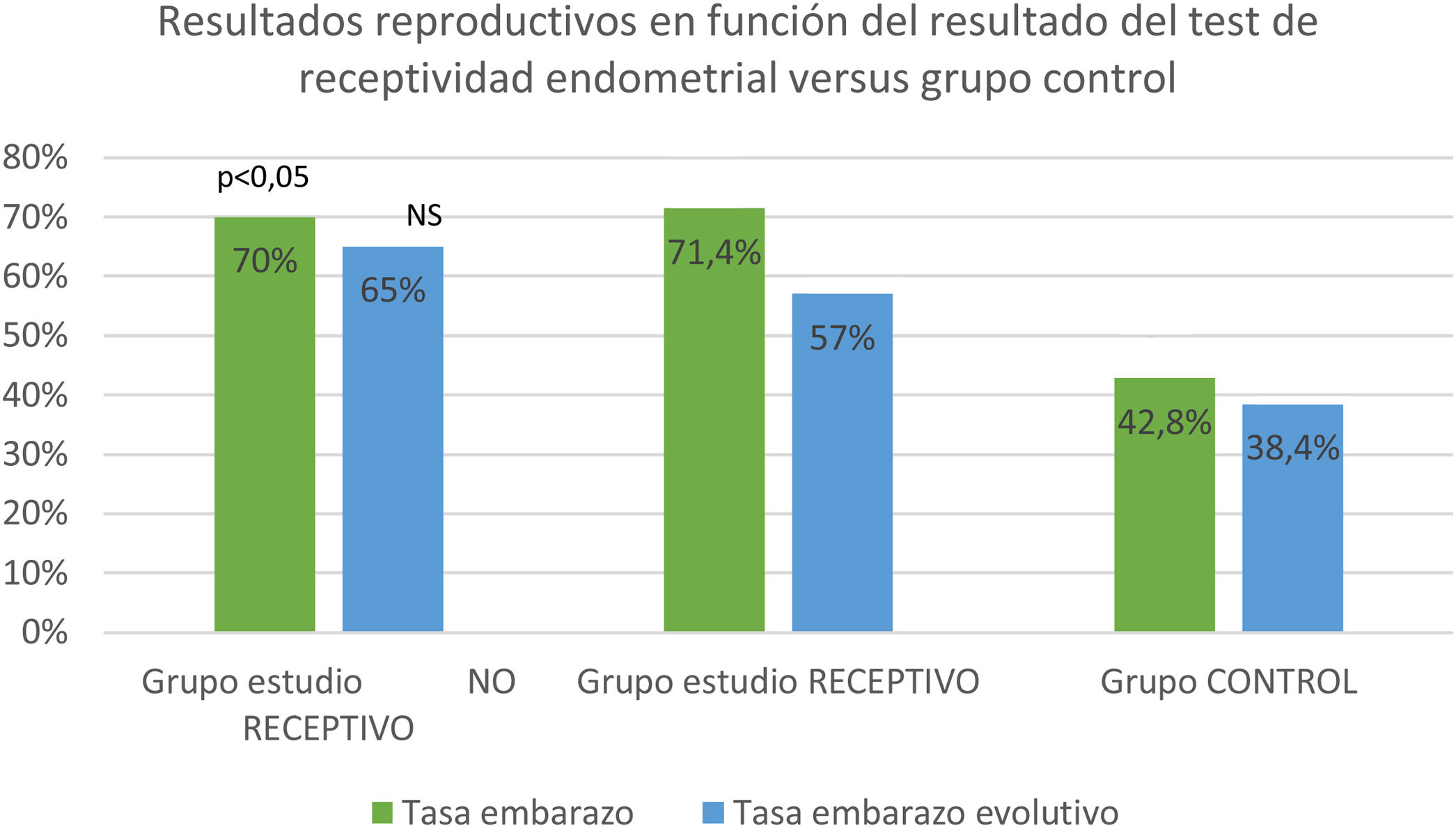
La PR y la OPR en el grupo E (70,9 y 60,0%) fueron significativamente superiores al grupo C (42,8 y 38,7%) (p< 0,01;p< 0,05) (tabla 1). Al comparar los resultados reproductivos en función del resultado del test de receptividad endometrial del grupo E con resultado no receptivo, receptivo, respecto al grupo C, observamos una PR (70, 71,4 y 42,8%) (p< 0,05) y una OPR (65, 57 y 38,4%) no estadísticamente significativo (NS) (fig. 1).
Resultados reproductivos en función del test de receptividad endometrial ER®map comparando resultados del grupo estudio NO receptivo 20/55 (36,4%), grupo estudio Receptivo 35/55 (63,6%), con el grupo control. Diferencias en tasa embarazo clínico (PR) estadísticamente significativas (p < 0,05), diferencias en tasa embarazo evolutivo (OPR) no estadísticamente significativas (NS).
En función del número de transferencias fallidas previas encontramos que de las 55 pacientes del grupo E, 18 presentan una transferencia fallida, 19 dos y 18 tres o más. No encontramos una relación correlativa con el número de transferencias fallidas previas y mejora de los resultados reproductivos, es más, a partir de tres transferencias fallidas previas baja la PR y OPR en todos los grupos. Únicamente encontramos diferencias estadísticamente significativas en PR posterior a dos transferencias embrionarias fallidas con PR 84,2% en el grupo E vs. PR 56% grupo C (tabla 1).
Al analizar los resultados, incluyendo únicamente embriones euploides y/o procedentes de donación de óvulos, no se observaron diferencias entre el grupo E y el grupo C ni en la PR (71 vs. 47%, respectivamente) ni en la OPR (60,5 vs. 41,1%) (tabla 1).
DiscusiónA día de hoy, sabemos que centrar todos nuestros esfuerzos en conseguir el mejor embrión a transferir no es suficiente para mejorar las tasas de embarazo en ciclos de FIV, debemos tener en cuenta el resto de factores necesarios para una exitosa implantación como concluyen las guías de las sociedades científicas de Ginecología y Obstetricia 2017 (SEGO) y el grupo de trabajo de fallos de implantación de la SEF 2019.
La implantación embrionaria con éxito depende básicamente de la calidad del embrión a transferir, Taranisi et al.22 ya apuntaban que en pacientes con fallos repetidos de implantación (RIF) presentaban un porcentaje mayor de embriones aneuploides. Por este motivo, durante mucho tiempo, hemos centrado toda nuestra atención en seleccionar el mejor embrión para transferir. Pagidas et al.23concluye que tener embriones euploides para transferir mejora los resultados reproductivos y una Revisión Cochrane realizada por Blake et al.24 en 2007 defiende que la transferencia única en blastocisto mejora la sincronía embrión y endometrio. La transferencia diferida vs. transferencia en fresco parecía mejorar los resultados según publicaba Roque et al.25 en 2013 aunque revisiones posteriores como la de Wong26 en 2017 no encontró diferencias significativas. La eclosión asistida (AH) parecía mejorar la implantación según los metaanálisis de: Seif et al.27, Martins et al.28 y Das et al.29, reportando mejores tasas de nacidos vivos; aunque Practice Committee de la ASMR30 en 2014 no encontró diferencias estadísticamente significativas como para recomendar dicha técnica en casos de fallos de implantación.
Para el análisis de la correcta función endometrial disponemos de distintas pruebas diagnósticas que estudian el momento en que el endometrio se encuentra receptivo para una mayor implantación embrionaria. Actualmente, existen cuatro tests para el diagnóstico endometrial con enfoques distintos: pruebas moleculares que buscan la sincronía endometrio/embrión y pruebas histológicas que identifican marcadores histológicos relacionados con la implantación. Dentro de las pruebas moleculares encontramos comercializados el test Endometrial receptivity analysis ERA® (Igenomix SL Valencia España), y el test endometrial Receptivity Map ER®map (Pronacera Therapeutics SL, Sevilla España). Test ERA® (Igenomix SL Valencia España) descrito por Díaz et al.31 y validado por Garrido32, que diagnostica errores en la datación endometrial, buscando una sincronía mediante técnicas de secuenciación masiva Next-Gen Sequencing (NGS) RNA-Seq secuenciando 238 genes relacionados con la receptividad endometrial. Enciso et al.33 presentan un nuevo panel de genes relacionados con la proliferación endometrial y la respuesta inmunitaria materna, asociada a la implantación, llamado Endometrial Receptivity Map ER®map (Pronacera Therapeutics SL, Sevilla España), que analiza y secuencia 48 genes, que han sido demostrados ser potenciales predictores transcriptómicos de receptividad endometrial, utilizando la Revers Transcription polymerese chain reaction (RT-qPCR) como técnica de secuenciación genómica. Entre los test histológicos encontramos el Endometrial Function Test EFT® (EFT Innovation & commercialization consulting SL, Santiago de Compostela España) que estudia el desarrollo endometrial mediante inmunohistoquímica, con la expresión en el endometrio de ciclina E (marcador de proliferación celular) y P27 (marcador de detención de proliferación celular) alterado en un 40% de las pacientes con fallos de implantación34,35. El test ReceptivaDx® BCL6 test (Cicero Dx, Inc, EE. UU.) identifica factores inflamatorios como el BCL6 que interfieren con la implantación, asociados a la endometriosis, descritos por Almquist36 que nos identifican los endometrios menos receptivos para la transferencia desde el punto de vista inmunohistoquímico.
Actualmente, encontramos publicaciones contradictorias respecto a los resultados reproductivos tras el estudio de la receptividad endometrial, aunque cada vez aparecen más artículos que respaldan estos test endometriales con mejoría en tasas de embarazo, implantación y nacidos vivos acumulados frente a las transferencias en las que no hemos realizado el estudio de receptividad endometrial37, indicando la utilidad potencial de la TEp, incluso antes de la primera transferencia embrionaria.
En nuestra muestra se evalúan los resultados reproductivos tras el análisis de receptividad endometrial, mediante test ERmap® (Pronacera Therapeutics SL, Sevilla España), en parejas con un fallo o más de implantación en ciclos de FIV. La proporción de resultados no receptivos fue del 34,54%, datos similares si extrapolamos nuestros datos con lo publicado en la literatura, utilizando el test ERA® (Igenomix SL Valencia España)38, por tanto, una de cada tres pacientes a quienes se les realizó el estudio de receptividad endometrial presentaba un error en la sincronización endometrio/embrión. La PR del grupo con TEp fue del 60%, vs. el 41,17% del grupo de TEs, valores concordantes a los publicados por Hromadová39, Hashimoto15 y Tan16 utilizando en todos ellos el test ERA®.
En el grupo de TEp obtuvimos resultados reproductivos similares tanto en las pacientes con la WOI desplazada como en los que no lo estaban, debido que al corregir la WOI igualamos sus resultados a las pacientes con WOI receptivo. Teniendo en cuenta que deberíamos de encontrar una proporción de mujeres con WOI desplazada en el grupo de TEs que no hemos corregido, esto explicaría la diferencia de resultados entre ambos grupos. Hay autores que atribuyen los mejores resultados en el grupo de TEp por otros factores, como la lesión endometrial que produce la biopsia «scratching» producida por la biopsia endometrial al realizar el test. Esto podría condicionar los mejores resultados en las TEp respecto las TEs, tal y como describe la revisión Cochrane Natri 2015. Otros autores40,41, no encuentran mejores resultados reproductivos tras la realización del scratching, no obstante, Liu40 termina afirmando que si no se encuentra otra vía de actuación podría ser una opción en casos de RIF.
Concluimos que, tras los resultados obtenidos en nuestra muestra, nos parece razonable y ventajoso ofrecer la realización de un estudio de receptividad endometrial en pacientes con fallos previos de implantación, y completar así el estudio del factor endometrial junto con el resto de pruebas de las que ya disponemos. Su naturaleza invasiva y su elevado coste pueden considerarse limitaciones, pero dicho estudio debe valorarse en el contexto de una pareja en la que hemos invertido todos nuestros esfuerzos en conseguir el mejor embrión para transferir, sobre todo en parejas que tienen un bajo número de embriones disponibles, y a pesar de haber descartado ya todos los factores uterinos y ambientales relacionados con una menor tasa de implantación, siguen sin conseguir un embarazo evolutivo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.