Establecer la eficacia diagnóstica de la determinación de creatinina en flujo vaginal para el diagnóstico de la rotura prematura de membranas.
MétodosSe realizó una investigación de tipo prospectivo en una muestra de 270 embarazadas que asistieron al Hospital Central Dr. Urquinaona. Los grupos consistieron en pacientes con rotura prematura de membranas (grupo A: n = 135) y embarazadas con membranas íntegras (grupo B: n = 135), consideradas como controles. Se evaluaron las características generales, valores de creatinina en flujo vaginal y efectividad diagnóstica.
ResultadosLa edad gestacional al momento de la determinación de las concentraciones de creatinina en flujo vaginal fue de 32,9 ± 1,6 semanas para el grupo A y 33,1 ± 1,9 semanas para el grupo B (p = ns). No se encontraron diferencias estadísticamente significativas en la edad materna ni en la frecuencia de paridad entre ambos grupos de tratamiento (p = ns). Las pacientes del grupo A presentaron concentraciones significativamente más altas de creatinina en flujo vaginal (1,09 ± 0,35mg/dl) comparadas con las embarazadas del grupo B (0,36 ± 0,17mg/dl, p < 0,05). Un valor de corte de 0,45mg/dl presentó un valor por debajo de la curva de 0,87 con una sensibilidad del 78,3%, especificidad del 78,7%, valor predictivo positivo del 80,6% y valor predictivo negativo del 76,4%.
ConclusiónLa determinación de las concentraciones de creatinina en el flujo vaginal es una técnica diagnóstica útil para la rotura prematura de membranas.
To establish the diagnostic efficacy of determining creatinine concentrations in vaginal fluid for the diagnosis of premature rupture of membranes.
MethodsA prospective study was performed in a sample of 270 pregnant women attending the Dr. Urquinaona Central Hospital. Group A consisted of patients with premature rupture of membranes (n = 135) and group B of pregnant women with intact membranes (n = 135), considered as controls. We evaluated general characteristics, creatinine values in vaginal fluid, and diagnostic efficacy.
ResultsGestational age at creatinine determination in vaginal fluid was 32.9 ± 1.6 weeks in group A and 33.1 ± 1.9 weeks in group B (p = ns). There were no significant differences in maternal age or the frequency of parity between the 2 groups (p = ns). Creatinine concentrations in vaginal fluid were significantly higher in group A (1.09 ± 0.35mg/dl) than in group B (0.36 ± 0.17mg/dl; P<.05). A cut-off point of 0.45mg/dl showed an under the curve value of 0.87, with a sensitivity of 78.3%, a specificity of 78.7%, a positive predictive value of 80.6%, and a negative predictive value of 76.4%.
ConclusionsDetermination of creatinine concentrations in vaginal fluid is a useful diagnostic tool for premature rupture of membranes.
La rotura prematura de membranas (RPM) es definida como la salida de líquido amniótico (LA) que comienza por lo menos una hora antes de la aparición del trabajo de parto a cualquier edad gestacional1. La forma de presentación más común es la presencia de LA en la vagina, seguida por la pérdida persistente e incontrolada, pero algunas pacientes reportan pérdida de pequeñas cantidades en forma intermitente o solo la sensación de húmedad de la vulva2.
En la actualidad se acepta que aproximadamente el 10% de todos los embarazos están complicados con la RPM y el 25% de ellas ocurren en embarazos pretérmino, los cuales son responsables del 30% de los nacimientos prematuros2. Puede llevar a serias complicaciones para la madre, el feto y el neonato (por ejemplo, infecciones, sea la causa o el resultado de la rotura). También, existe un alto riesgo de parto pretérmino, prolapso del cordón, nacimiento por cesárea y desprendimiento prematuro de placenta1,2.
La incapacidad de identificar a las pacientes con RPM puede producir dificultades para la implementación de medidas obstétricas. El diagnóstico de falsos positivos puede llevar a intervenciones inadecuadas como hospitalización o inducción del parto. Por lo tanto, es necesario establecer un diagnóstico definitivo sin retrasos en los casos inciertos. Sin embargo, los métodos y pruebas diagnósticas tradicionales tienen limitaciones y no pueden ser aplicadas a todas las pacientes con 100% de precisión3,4.
La ausencia de una prueba no invasiva «ideal» para el diagnóstico de la RPM ha llevado a la búsqueda de procedimientos diagnósticos alternativos. En este contexto, existen estudios relacionados con la detección de algunos marcadores bioquímicos en el fluido vaginal, los cuales tienen altas concentraciones en el LA pero bajas en los líquidos vaginales. Esto incluye la gonadotropina coriónica humana, prolactina, fibronectina fetal, alfafetoproteína, diamino-oxidasa y proteína I de unión del factor de crecimiento similar a la insulina5,6. La creatinina está presente en el LA al igual que en la sangre y la orina tanto de la madre como del feto. Sin embargo, estudios previos7–10 han reportado diferentes valores de precisión diagnóstica. En la literatura existen pocos datos sobre la utilidad de la creatinina en el diagnóstico de RPM.
El objetivo de la investigación fue establecer la eficacia diagnóstica de la determinación de creatinina en flujo vaginal para el diagnóstico de la RPM.
Materiales y métodosEsta investigación fue de tipo prospectivo en el Hospital Central Dr. Urquinaona entre enero del 2010 y diciembre del 2012. La muestra fue probabilística intencional de pacientes en las que se recolectó la secreción vaginal después de obtener la aprobación del Comité de Ética del hospital y el consentimiento por escrito de las mujeres con embarazos de 20 a 36 semanas. La edad gestacional fue establecida por la fecha de última regla y confirmada por la evaluación ecográfica antes de las 14 semanas. Todas las mujeres seleccionadas presentaban embarazos simples.
Se excluyó a las embarazadas con menos de 20 semanas de embarazo, restricción del crecimiento intrauterino del feto, polihidramnios, alteraciones de la frecuencia cardiaca fetal, anomalías fetales o embarazo postérmino, enfermedades crónicas (diabetes, hipertensión arterial crónica o gestacional), diagnóstico de parto pretérmino, presencia de infección intrauterina (por ejemplo, corioamnionitis) o materna activa, neoplasias, enfermedades inmunológicas, obesidad o que se negasen a participar en la investigación. Así mismo, fueron excluidas las embarazadas con sangrado y flujo vaginal patológico y aquellas que se negaron a participar en el estudio.
Las pacientes fueron divididas en 2 grupos: grupo A o de estudio, pacientes con RPM confirmada por acúmulo de LA, prueba de helecho y papel de nitrazina positiva y grupo B o controles, pacientes sin RPM que fueron seleccionadas por tener la misma edad gestacional, evaluadas en el Servicio de Obstetricia y que asistieron a la consulta prenatal, sin enfermedad ni complicaciones. Una vez seleccionadas las pacientes para el estudio, se llenó una ficha de recolección de datos que incluyó: identificación de la paciente, antecedentes personales y ginecoobstétricos, control prenatal, edad de gestación (por fecha de última regla o ecografía del primer trimestre) y concentraciones de creatinina en flujo vaginal. Todos los procedimientos y las evaluaciones ecográficas fueron realizados por un único investigador para eliminar las diferencias interobservador.
Para la obtención de la muestra de flujo vaginal, después de confirmar la ausencia de sangre en la vagina, esta fue limpiada con una gasa estéril y se colocó un espéculo estéril en vagina. Se procedió a irrigar el fondo de saco vaginal posterior con 3ml de solución fisiológica estéril usando una jeringa de 10ml; inmediatamente, con la misma jeringa, se aspiró todo el líquido, el cual se depositó en un tubo de ensayo estéril tapado. La muestra fue centrifugada de inmediato a 1.750g por 5 min y fue almacenada a –20° C hasta que se determinó la concentración de creatinina en forma cuantitativa. Los resultados obtenidos se expresaron en mg/dl. Todas las muestras de LA fueron estudiadas en un mismo laboratorio usando la misma técnica.
Los valores obtenidos se presentaron como promedio ± desviación estándar. Se utilizó la prueba de la U de Mann-Whitney para comparar las variables continuas. Los coeficientes de correlación entre las concentraciones de creatinina vaginal y los valores de cuenta blanca y creatinina sérica se evaluaron usando la prueba de Spearman. La precisión de la creatinina vaginal para el diagnóstico de preeclampsia se presenta en función de la sensibilidad, la especificidad, el valor predictivo positivo, el valor predictivo negativo y la precisión. Se utilizó el análisis operador-receptor para determinar el mejor valor de corte. Se consideró p < 0,05 como estadísticamente significativa.
ResultadosSe seleccionó a un total de 270 embarazadas de las cuales en el grupo A se colocó a las pacientes con RPM o casos (grupo A: n = 135) y las embarazadas que fueron seleccionadas como controles (grupo B: n = 135). Las características de ambos grupos se muestran en la tabla 1. La edad gestacional al momento de la determinación de las concentraciones de creatinina en flujo vaginal fue de 32,9 ± 1,6 semanas para el grupo A y 33,1 ± 1,9 semanas para el grupo B (p = ns). No se encontraron diferencias estadísticamente significativas en la edad materna ni en la frecuencia de paridad entre ambos grupos de tratamiento (p = ns).
En la tabla 2 se muestran los parámetros de laboratorio en ambos grupos. No se encontraron diferencias estadísticamente significativas en los valores de cuenta blanca ni en las concentraciones de creatinina sérica materna (p = ns). Las pacientes del grupo A presentaron concentraciones significativamente más altas de creatinina en flujo vaginal (1,09 ± 0,35mg/dl) comparadas con las embarazadas del grupo B (0,36 ± 0,17mg/dl; p < 0,05). No se encontraron correlaciones entre las concentraciones de creatinina sérica materna y creatinina en el flujo vaginal en ambos grupos (r = 0,050; p = ns), ni en las pacientes en el grupo A (r = –0,103; p = ns).
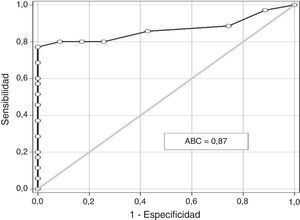
En la figura 1 se muestra la curva operador receptor para la precisión diagnóstica de la creatinina en el flujo vaginal para el diagnóstico de RPM. Un valor de corte de 0,45mg/dl presentó un valor por debajo de la curva de 0,87 con una sensibilidad del 78,3% (intervalo de confianza [IC] del 95%; 61,8-90,8%), especificidad del 78,7% (IC del 95%; 61,3-91,0%), valor predictivo positivo del 80,6% (IC del 95%; 63,9-91,8%) y valor predictivo negativo del 76,4% (IC del 95%; 58,8-89,2%).
DiscusiónLa RPM es un problema obstétrico que complica aproximadamente el 10% de todos los embarazos. Puede llevar a serias consecuencias a la madre y al feto. Por lo tanto, el correcto y rápido diagnóstico tiene gran importancia. La RPM no es un diagnóstico que pueda ser realizado de forma causal y nunca debe ser completamente excluido en cualquier paciente con oligohidramnios o sensación permanente de pérdida de LA2.
Las manifestaciones clínicas de la paciente son útiles pero no confiables. La visualización de LA en la vagina durante la especuloscopia es diagnóstica con un 100% de precisión, pero la ausencia de visualización no excluye el diagnóstico3. En casos de rotura prolongada u oligohidramnios, el LA no se observa en la vagina en todos los casos. Por lo tanto, la tasa de falsos positivos de este método es alta.
El patrón de cristalización del LA como prueba diagnóstica de la RPM tiene una tasa de falsos positivos superior al 30%, debido a que la cristalización del moco cervical puede interferir con el patrón del LA4.
La determinación ecográfica del índice de LA es útil pero no confiable, debido a que el oligohidramnios de cualquier origen no puede ser diferenciado fácilmente de la disminución del volumen secundario a la RPM. También, en casos de roturas pequeñas o fuga de LA, el volumen puede ser normal. Por lo tanto, la tasa de falsos positivos y falsos negativos puede ser alta1.
Las técnicas de coloración citológicas para la identificación del lanugo fetal, glóbulos de grasa y células escamosas son pruebas diagnósticas que ya casi no se usan debido a que toman tiempo, son técnicamente difíciles, requieren de elementos como colorantes y microscopios que no se encuentran en todos los centros clínicos y la tasa de falsos negativos es alta11. En forma similar, la inyección de agentes colorantes para el diagnóstico de RPM no es un método de elección, debido a que toma tiempo y algunos agentes pueden tener efectos adversos sobre el feto12.
La ausencia de una prueba ideal no invasiva para el diagnóstico de la RPM ha llevado a la búsqueda de métodos alternativos. En este contexto, se han multiplicado los estudios relacionados con la detección de marcadores bioquímicos en el flujo vaginal pero con baja concentración en la vagina, como por ejemplo fibronectina fetal, alfafetoproteína, interleucina 6, proteína I de unión del factor de crecimiento similar a la insulina, prolactina, gonadotropina coriónica y creatinina13. Desafortunadamente, la fibronectina fetal estaba presente en las secreciones vaginales en cerca del 50% de las mujeres con parto pretérmino y membranas intactas6. Por otra parte, se encontró que la proteína I de unión del factor de crecimiento similar a la insulina en las secreciones vaginales tenía baja sensibilidad y valor predictivo negativo en la detección de la RPM5. Todos los otros marcadores tienen ventajas y desventajas5,6.
Una prueba de laboratorio ideal debe ser aceptable para la paciente y el médico. La velocidad en la obtención de los resultados de la prueba también es de gran importancia. Existen múltiples publicaciones relacionadas con las concentraciones de prolactina, gonadotropina coriónica y alfafetoproteína en el flujo vaginal en casos de RPM. A pesar de las mejoras en los valores diagnósticos, estos no son utilizados en forma rutinaria debido a que ambos métodos de detección (ELISA y radioinmunoensayo) descritos en estos estudios, generalmente, son procesos que lleva bastante tiempo realizar14.
En la literatura existen pocos estudios relacionados con la detección de creatinina en el flujo vaginal en pacientes con RPM. El análisis de la creatinina en el LA permite una evaluación de la maduración y la función renal. Se ha reportado que las embarazadas en el primer trimestre tienen concentraciones promedios de creatinina en LA y suero similares15. Las concentraciones de creatinina en el LA se incrementan gradualmente entre las 20 y las 32 semanas y más rápidamente después de ese punto, cuando alcanza concentraciones de 2 a 4 veces más altas que en el suero materno14. Las concentraciones de creatinina en el LA que mejor representan la madurez fetal son de 1,5 a 2,0mg/dl. Una concentración de creatinina de 1,75mg/dl o más se correlaciona significativamente con una edad gestacional de 37 semanas o más16. Por lo que se puede proponer que la determinación de la concentración de creatinina no solo sea usada en el diagnóstico de RPM sino también como una prueba de madurez fetal en casos de parto pretérmino.
La determinación de creatinina en el flujo vaginal ha sido utilizada en estudios clínicos para diagnosticar la RPM7–10. Li et al.7 demostraron que la determinación de creatinina era más económica y fácil de medir que la gonadotropina coriónica y la alfafetoproteína y parecía ser más precisa que la gonadotropina coriónica. Gurbuz et al.8 reportaron que la sensibilidad, especificidad, valor predictivo positivo y negativo eran del 100% para la detección de la RPM con un valor de corte de 0,12mg/dl. Kafaliet al.9 encontraron que la determinación de creatinina tiene una sensibilidad, especificidad, valor predictivo positivo y valor predictivo negativo del 100% en la detección de RPM con un valor de corte de 0,6mg/dl. Zanjani et al.10 reportaron que un punto de corte óptimo de 0,5mg/dl tiene una sensibilidad, especificidad, valor predictivo positivo y negativo superior al 96% y propusieron que las mediciones de creatinina vaginal era un método más rápido y económico y que tenía unas más altas sensibilidad y especificidad para establecer un diagnóstico preciso. En la presente investigación, se determinó que un valor de corte para la creatinina en flujo vaginal es 0,45mg/dl. La precisión diagnóstica de este punto de corte es similar al de estudios previos8–10.
Este método de diagnóstico de RPM con la determinación de creatinina vaginal ofrece varias ventajas. El procedimiento se puede realizar fácilmente en cualquier ambiente apropiado sin instrumentos especializados cuando se tienen elementos para la determinación de creatinina sérica. Esto da una tasa de detección confiable y un costo razonable. Por lo tanto, esta prueba puede reducir los tratamientos innecesarios cuando existan diagnósticos equivocados basados en otros métodos17.
Se concluye que la determinación de las concentraciones de creatinina en el flujo vaginal es una técnica diagnóstica útil para la RPM.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.