La identificación de posibles alteraciones cromosómicas fetales es sin duda uno de los principales retos a los que ha de enfrentarse cualquier obstetra involucrado en el diagnóstico prenatal de anomalías congénitas.
ObjetivosEvaluar el rendimiento diagnóstico del procedimiento en nuestro servicio, así como sus complicaciones asociadas.
Pacientes y métodosEn el presente artículo realizamos un análisis retrospectivo de las amniocentesis realizadas en nuestro centro durante un periodo de 6 años, prestando atención a la rentabilidad diagnóstica del procedimiento, las complicaciones asociadas más frecuentes y las indicaciones que llevaron a la realización de la técnica, revisando finalmente las estrategias de cribado poblacional actualmente aplicadas.
ResultadosEl riesgo de cromosomopatía asociado a la edad materna fue el motivo principal por el cual la técnica fue realizada. El 2,16% de amniocentesis condujeron al diagnóstico de una cromosomopatía, con una tasa de complicaciones asociadas a la técnica del 1,02%.
ConclusionesAunque nuestros resultados son similares a los comunicados en otras series, debemos reconsiderar las estrategias de cribado que hasta ahora se han venido aplicando, particularmente para las gestantes de mayor edad.
Identification of fetal congenital chromosomal abnormalities is undoubtedly one of the main challenges faced by obstetricians involved in the prenatal diagnosis of congenital anomalies.
ObjectiveTo evaluate the diagnostic yield of genetic amniocentesis in our hospital and its associated complications.
Patients And MethodsWe performed a retrospective analysis of all genetic amniocenteses performed in our hospital in the last 6 years, focusing on diagnostic yield, the most common associated complications, and the indications for this procedure. We also reviewed the various population-based screening programs currently applied.
ResultsThe main indication for amniocentesis was maternal age-associated risk. A total of 2.161% of procedures led to diagnosis of chromosomal abnormalities, with a complications rate of 1.028%.
ConclusionAlthough our results are similar to those reported in other published series, current screening strategies should be revised, mainly in older pregnant women.
La identificación de posibles alteraciones cromosómicas fetales es sin duda una de las principales tareas a las cuales ha de enfrentarse cualquier obstetra involucrado en el diagnóstico prenatal de anomalías congénitas.
Aunque las anomalías cromosómicas ocurren hasta en el 5% de las concepciones, la mayoría de ellas no suelen alcanzar relevancia clínica (al suponer el nacimiento de individuos afectados) dada la alta tasa de letalidad que conlleva la disrupción morfogenética secundaria al desequilibrio genómico. De carácter hereditario (un pequeño porcentaje) o como expresión de un fenómeno de novo, las anomalías cromosómicas se pueden asociar a alteraciones en el desarrollo embrio-fetal que en ocasiones conducen a nacidos vivos con retraso mental importante y/o defectos físicos y funcionales, que suponen una importante causa de morbimortalidad y cuya asistencia lleva asociado un importante gasto social y sanitario.
Dentro de las cromosomopatias fetales, la trisomía 21 o síndrome de Down (SD) adquiere una especial relevancia al ser la aneuploidía más frecuente en recién nacidos, la de mayor supervivencia posnatal y la causa más común de retraso mental1.
Material y métodosEn el presente artículo realizamos un análisis retrospectivo de las amniocentesis realizadas en nuestro centro durante un periodo de 6 años, prestando atención a la rentabilidad diagnóstica del procedimiento, las complicaciones asociadas más frecuentes y las indicaciones que llevaron a la realización de la técnica, revisando finalmente las más frecuentes estrategias de cribado poblacional actualmente aplicadas.
ResultadosEn el periodo comprendido entre el 1 de enero de 2003 y el 31 de diciembre de 2008 se atendieron en nuestro centro un total de 1.338 propuestas de amniocentesis, 218 de las cuales (el 16,292% del total) provenían de otros hospitales.
Del total de propuestas se produjeron 269 renuncias voluntarias (20,104%), llevándose a cabo finalmente 1.069 procedimientos, correspondientes a 1.065 pacientes (4 gestaciones gemelares se sometieron a la técnica). Solamente en un caso (0,093%) fue imposible llevar a cabo la técnica invasiva, debido al severo oligoamnios concurrente. En 2 punciones (0,187%) no se obtuvieron células para el cultivo y en otras dos gestantes la muestra se contaminó, siendo imposible su estudio.
Como complicaciones asociadas al procedimiento se produjeron 4 casos de pérdida mantenida de líquido amniótico (0,374%), 7 hemorragias vaginales (0,654%), 2 de ellas en pacientes del grupo anterior y 7 abortos (0,654%). De los 4 casos referidos de pérdida mantenida de líquido amniótico, 3 evolucionaron sin complicación, finalizando el cuarto en un aborto tardío a las 22 semanas (incluido dentro del total de 7 abortos). Todo ello da como resultado una tasa de complicaciones asociadas a la técnica del 1,028%.
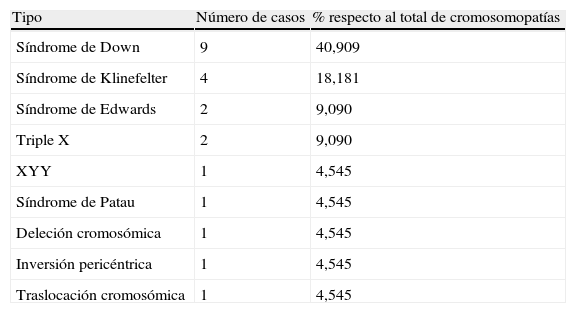
Del análisis citogenético de las 1.064 muestras válidas para estudio se derivó el diagnóstico de 23 cromosomopatías, correspondientes a la distribución que muestra la tabla 1.
Cromosomopatías diagnosticadas mediante amniocentesis en nuestro centro. Periodo 2003–2006
| Tipo | Número de casos | % respecto al total de cromosomopatías |
| Síndrome de Down | 9 | 40,909 |
| Síndrome de Klinefelter | 4 | 18,181 |
| Síndrome de Edwards | 2 | 9,090 |
| Triple X | 2 | 9,090 |
| XYY | 1 | 4,545 |
| Síndrome de Patau | 1 | 4,545 |
| Deleción cromosómica | 1 | 4,545 |
| Inversión pericéntrica | 1 | 4,545 |
| Traslocación cromosómica | 1 | 4,545 |
Así pues, el 2,161% de amniocentesis condujeron al diagnóstico de una cromosomopatía (1 de cada 46,26 amniocentesis), no produciéndose ningún falso negativo en el diagnóstico citogenético.
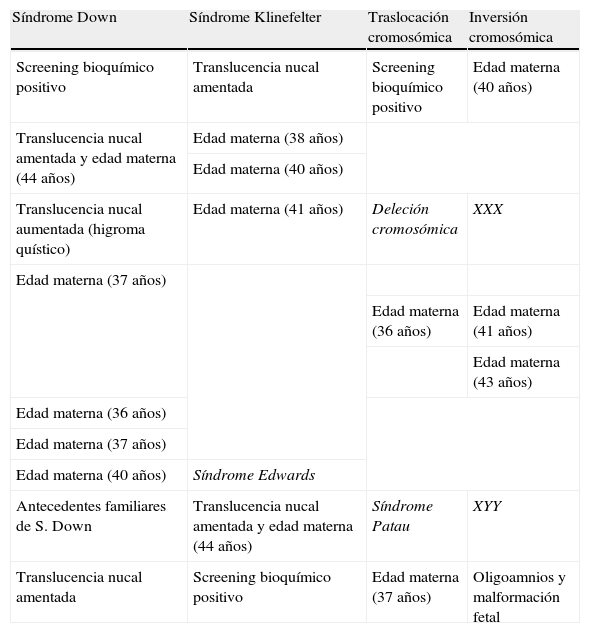
Las factores de riesgo por los cuales se indicó un estudio invasivo en los 22 casos de cromosomopatía fueron los correspondientes a la tabla 2.
| Síndrome Down | Síndrome Klinefelter | Traslocación cromosómica | Inversión cromosómica |
| Screening bioquímico positivo | Translucencia nucal amentada | Screening bioquímico positivo | Edad materna (40 años) |
| Translucencia nucal amentada y edad materna (44 años) | Edad materna (38 años) | ||
| Edad materna (40 años) | |||
| Translucencia nucal aumentada (higroma quístico) | Edad materna (41 años) | Deleción cromosómica | XXX |
| Edad materna (37 años) | |||
| Edad materna (36 años) | Edad materna (41 años) | ||
| Edad materna (43 años) | |||
| Edad materna (36 años) | |||
| Edad materna (37 años) | |||
| Edad materna (40 años) | Síndrome Edwards | ||
| Antecedentes familiares de S. Down | Translucencia nucal amentada y edad materna (44 años) | Síndrome Patau | XYY |
| Translucencia nucal amentada | Screening bioquímico positivo | Edad materna (37 años) | Oligoamnios y malformación fetal |
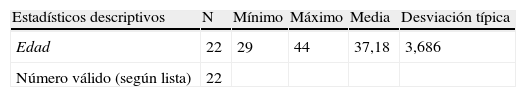
De los 22 casos de cromosomopatía fetal, en 14 de ellos (63,63%) la edad materna superaba los 35 años. Los estadísticos descriptivos de esta variable vienen definidos en la tabla siguiente (tabla 3).
El cribado bioquímico del segundo trimestre fue positivo en 3 de las 22 gestantes (13,636%), mientras que la translucencia nucal fue superior al percentil 95 en 5 casos (22,727%), encontrándose antecedentes familiares de cromosomopatía únicamente en una de las embarazadas (4,545%). Finalmente, en 2 de las 22 pacientes (9,090%) se encontraron varios marcadores de riesgo presentes.
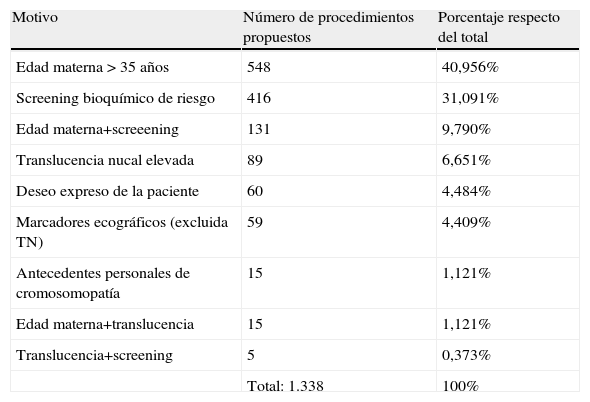
Respecto de las principales indicaciones por las cuales se propuso la técnica invasiva, se resumen en la tabla 4.
| Motivo | Número de procedimientos propuestos | Porcentaje respecto del total |
| Edad materna > 35 años | 548 | 40,956% |
| Screening bioquímico de riesgo | 416 | 31,091% |
| Edad materna+screeening | 131 | 9,790% |
| Translucencia nucal elevada | 89 | 6,651% |
| Deseo expreso de la paciente | 60 | 4,484% |
| Marcadores ecográficos (excluida TN) | 59 | 4,409% |
| Antecedentes personales de cromosomopatía | 15 | 1,121% |
| Edad materna+translucencia | 15 | 1,121% |
| Translucencia+screening | 5 | 0,373% |
| Total: 1.338 | 100% |
La ausencia de métodos de prevención primaria para las cromosomopatías fetales obliga a canalizar buena parte del esfuerzo del obstetra hacia el perfeccionamiento tanto de los procedimientos de cribado poblacional como de los métodos invasivos de diagnóstico prenatal.
Atendiendo a la necesidad imperativa de estudio citogenético del material fetal para obtener un diagnóstico definitivo, al riesgo materno-fetal asociado de estas técnicas invasivas y a la relativa baja prevalencia poblacional de estos trastornos, resulta imprescindible la selección cuidadosa de pacientes con riesgo de presentar un hijo afecto, para lo que se realiza el cribado o screening de detección de anomalías cromosómicas. Por tanto, debe ser entendido como un conjunto de procedimientos para la selección de gestantes con riesgo de hijo afecto y nunca deben ser confundidos con pruebas diagnósticas. Tal peculiaridad lleva implícita una tasa de falsos positivos y negativos así como una sensibilidad y especificidad intrínsecas y diferentes en cada estrategia, que necesariamente han de ser asumidas. Actualmente se contempla la aplicación de diversos marcadores bioquímicos, epidemiológicos y ecográficos con tal fin1.
Los marcadores ecográficos han aportado una mejora en la sensibilidad de los programas de cribado, reduciendo la tasa de falsos positivos2. En ocasiones la anomalía cromosómica lleva asociada una malformación estructural que permite un diagnóstico ecográfico de presunción previo a la técnica invasiva. La frecuencia de cromosomopatías ante malformación estructural aislada es del 2%, y asciende al 29% cuando las malformaciones son múltiples2. Se han definido diversos marcadores ecográficos de aneuploidía, principalmente para la trisomía 21, clasificados a su vez en mayores y menores. Entre los mayores encontramos:
- •
Pliegue nucal del segundo trimestre3 (sensibilidad del 40% e índice de falsos positivos menor del 1%).
- •
Translucencia nucal en el primer trimestre.
- •
Malformaciones cardiacas mayores.
- •
Atresia duodenal.
- •
Onfalocele e hidrocefalia (presentes en un tercio de los fetos afectos por SD en el segundo trimestre)
- •
Quistes en los plexos coroideos.
- •
Focos ecogénicos intracardiacos.
- •
Intestino ecogénico.
- •
Pielectasia renal.
- •
Acortamientos humeral y femoral.
- •
Amplitud del ángulo ilíaco.
- •
Hipoplasia de la falange media del quinto dedo.
Cuando estos marcadores se observan sin malformación fetal estructural asociada, la sensibilidad de cada uno de ellos es baja (1–16%) y la mayoría de fetos con estos marcadores tienen resultados cromosómicos normales. El empleo, por tanto, de los marcadores ecográficos como base para ofertar amniocentesis resultará en más pérdidas fetales que casos de SD detectados y conducirá a un descenso en la detección prenatal de fetos con SD1,4. Benacerraf propuso un índice de riesgo basado en criterios ecográficos según el cual se considera indicación para amniocentesis la presencia de al menos un marcador mayor o 2 menores. En las gestantes de mayor edad sería suficiente con la existencia de un criterio menor. Según el propio autor en gestantes de bajo riesgo es posible identificar hasta un 73% de los SD y el 80% de trrisomías 18, con una tasa de falsos positivos del 4%1,5. Tales resultados no han podido ser comprobados en nuestra serie, aunque esta es reducida. Capítulo aparte merece la aplicación de otros criterios ecográficos como son la frecuencia cardiaca embrionaria, la resistencia en la arteria umbilical o las alteraciones en el flujo del ductus, todas ellas con valor contrastado en la detección de riesgo de aneuploidía1, pero poco establecidos como método de cribado en la población general, dada su mayor complejidad técnica y sus mayores requerimientos materiales y temporales.
La utilización de marcadores séricos para el cribado de aneuploidía fetal data de principios de los años 70. La adquisición progresiva de nuevos marcadores y su combinación ha permitido la puesta en marcha de test bioquímicos capaces de alcanzar una efectividad suficiente como para establecer con relativa precisión el riesgo de trastorno cromosómico fetal, en base al cual se pueden tomar decisiones clínicas relevantes como la oferta de procedimientos invasivos basada en un criterio de riesgo. Existen diversas modalidades de screeening bioquímico cuya comparación en términos de resultados6 no siempre resulta fácil. En nuestro centro se realiza mediante determinación de HCG y AFP en el segundo trimestre. Su ventaja sobre el triple screening reside en una reducción marginal en la tasa de falsos positivos. Nosotros empleamos como punto de corte 1:190, para el cual se estima que el índice de deteción ronda el 58%, con un valor predictivo positivo de 1:46. Respecto del porcentaje de gestantes que presentan un riesgo superior al punto de corte, se calcula que es del 3,8%, previo ajuste exacto de la semana de gestación mediante datación ecográfica. El screening del primer trimestre obtiene índices de detección algo mayores (65%), con unas tasas de falsos positivos próximas al 5%1.
Las mejores estrategias de cribado actualmente disponibles son aquellas que combinan marcadores bioquímicos y ecográficos1,7. El cribado combinado en el segundo trimestre permite la detección del 78% de fetos afectos de trisomía 21 con un 14% de falsos positivos. El del primer trimestre obtiene índices de detección del 76–89% con un 3–5% de falsos positivos.
El cribado prenatal de cromosomopatías en el segundo trimestre del embarazo mediante combinación de edad materna y marcadores bioquímicos a las 15–18 semanas está bien establecido y su validez se encuentra avalada por múltiples publicaciones y grupos investigadores1. Posee una sensibilidad del 60–70% para la detección del SD, con una tasa de falsos positivos del 5%. Permite además detectar el 72% de defectos del canal neural8 y el 50–60% de trisomías 18 con unas tasas de falsos positivos de 6,6 y 5,2–6% respectivamente.
Existe evidencia de que la medición ecográfica del grosor de la translucencia nucal, sola o combinada con la edad materna, o la asociación de las dos anteriores con marcadores bioquímicos presenta una eficacia superior a la obtenida con el cribado prenatal del segundo trimestre9. Para una tasa de falsos positivos del 5% las tasas de detección alcanzan el 86,4% con la combinación de edad, TN y bioquímica y el 72,7% solo aplicando edad y TN. Aun así no existe gran uniformidad entre los datos publicados por los diversos autores, particularmente cuando esta estrategia se aplica a poblaciones de bajo riesgo. Indudablemente este cribado combinado del primer trimestre precisa de unos mayores requerimientos técnicos, humanos y logísticos. Por otra parte, la puesta en marcha de este programa supondría implícitamente la activación paralela de todos los mecanismos necesarios para ofertar a las parejas una biopsia de vellosidades coriales, pues poco justificable sería realizar un cribado precoz si la prueba diagnóstica definitiva subsiguiente se demorase varias semanas. Por otra parte, y no por ello menos relevante, la aplicación de un screening exclusivo del primer trimestre supondría la pérdida de cribado para la detección de defectos del tubo neural.
Tenemos poca información acerca de lo que las pacientes perciben del diagnóstico prenatal, así como de sus expectativas. Hay alguna evidencia de que las embarazadas desean un test tan precoz como sea posible, incluso si hay otro ligeramente mejor, aunque más tardío10. Por otra parte, cualquier test de screening lleva implícito un porcentaje tanto de falsos positivos, responsables de una ansiedad indebida, como de falsos negativos que podrían causar incertidumbre. El propio procedimiento es además fuente de estrés, llevando a renunciar al menos a una de cada 5 gestantes a las cuales se oferta11, circunstancia que hemos podido comprobar en nuestra serie.
Una vez realizada la técnica, no hay evidencia de que dar los resultados del cariotipo en una fecha prefijada o variable altere la ansiedad materna durante la fecha de espera12. En cambio, informar de los resultados de un test parcial pero rápido reduce la ansiedad materna durante la espera, comparado con informar únicamente de los resultados del cariotipo completo. Se debería seguir investigando acerca de las causas, características y consecuencias de la ansiedad asociada al cribado prenatal.
En relación a los criterios epidemiológicos de cribado antes referidos (edad y antecedentes reproductivos personales y familiares), han mostrado una eficacia escasa1. La edad materna es un mal marcador de riesgo cuando su aplicación no va acompañada de otro parámetro de cribado, pues presenta un alto número de falsos negativos (no permite definir mujeres de riesgo con una edad inferior al punto de corte establecido). Las mujeres de 35 o más años de edad han sido consideradas tradicionalmente de riesgo elevado para presentar hijos con aneuploidía fetal. Dicho límite fue establecido en base al aumento de prevalencia observado en las trisomías edad maternodependientes, cuando se calculaban para grupos de gestantes clasificadas en intervalos de edad que comprendían 5 años. Análisis posteriores han demostrado que este aumento es gradual, año a año, y por tanto debieramos desterrar el concepto de 35 años como edad límite a partir de la cual se produce un brusco aumento en la prevalencia de anomalía cromosómica fetal1. Existe evidencia de que la realización de técnica invasiva directamente a partir de los 38 años de edad y la aplicación de screening bioquímico a aquellas embarazadas bajo este umbral disminuye el porcentaje de falsos positivos por edad en el tramo que va de los 35–38 años13. Tres cuartas partes de las embarazadas en este rango de edad podrían omitir la realización de una técnica invasiva al resultar el cribado bioquímico-ecográfico de riesgo «normal». Como hemos podido observar en nuestra serie, la edad materna superior a 35 años es la principal causa por la cual se ofertó amniocentesis (548 de las 1.338 propuestas), pero solo un 2,161% del total de procedimientos condujeron al diagnóstico de cromosomopatía, y de ellas la edad superior a 35 años se encontraba presente en 14 de los 22 casos (63,636%). Tales resultados confirman la escasa rentabilidad de la edad materna como factor de cribado exclusivo.
Por otra parte, conviene no olvidar que el punto de corte a partir del cual consideramos una gestante como «de riesgo» es arbitrario. Dicha circunstancia resulta de gran transcendencia cuando se pretenden comparar los resultados obtenidos entre diversos centros14. Existe consenso en establecer un punto de corte tal que la tasa de falsos positivos obtenida para la trisomía 21 sea de alrededror del 5%, mientras que para la trisomía 18 sea del 1%.
Las diferentes opciones de cribado disponibles deberán ser contempladas en función de su valor intrínseco así como de otros factores externos no menos relevantes como por ejemplo la distribución de edad materna en la población a la cual se va a aplicar el procedimiento, la precocidad del sistema sanitario en la captación de las gestantes para control obstétrico y los recursos técnicos y humanos disponibles. El proceso asistencial concertado durante el periodo de tiempo que comprende la presente revisión incluía la realización de una ecografía para la medición de la translucencia nucal a las 12 semanas de gestación, con posterior screening bioquímico a cargo de atención primaria (determinación de AFP y HCG) a las 15 semanas, para el cual se fijó un punto de corte de 1:270 en el momento de cribaje. La edad superior a 35 años era contemplada como «indicación» de amniocentesis si la paciente rechazaba cribado y optaba por una técnica invasiva, del mismo modo que se contemplaba el expreso deseo de la paciente para someterse a la misma, independientemente de su edad y del resultado del screening. Sobre este particular conviene resaltar que solo el 11% de las propuestas de amniocentesis fueron realizadas en base a un screening bioquímico o ecográfico de riesgo elevado en gestantes con edad superior a los 35 años y que de los 14 casos de cromosomopatía diagnosticados en embarazadas sobre los 35 años, solo 2 se derivaron de una amniocentesis ofertada ante screening de riesgo, siendo el resto resultado de amniocentesis solicitadas por las propias embarazadas, tras rechazar cribado.
Algunos programas de cribado contemplan riesgo epidemiológico de aneuploidía fetal en edades maternas superiores a 38 o incluso 40 años1,15. En nuestros resultados podemos apreciar como en el grupo de 22 madres con feto cromosómicamente anómalo diagnosticado prenatalmente, 14 superaban los 35 años de dad. De ellas 9 tenían al menos 38 años y 8 se encontraban en la cuarta década de su vida.
De modo óptimo el riesgo de pérdida fetal atribuible a la aniocentesis es del 0,5–1%1,11. El riesgo de aborto asociado a la amniocentesis se calcula en 0,25–0,50%8, ligeramente mayor en nuestra serie. La pérdida gestacional dentro de los 14 días posteriores al procedimiento es del 0,6%, aumentando al 0,9% para pérdida gestacional antes de las 24 semanas y 1,9% para pérdida gestacional total16. En gestaciones gemelares el riesgo de pérdida fetal se estima en 1 o 2 pérdidas fetales por cada 64 amniocentesis6. Aun así varios son los autores que invocan la ausencia de adecuados controles como un sesgo que hace que se tienda a infraestimar verdadero riesgo añadido que suponen los procedimientos prenatales invasivos16.
La realización de amniocentesis para el estudio citogenético fetal comenzó hace más de 50 años. La fiabilidad del análisis cromosómico del cultivo de amniocitos procedentes de una punción uterina transabdominal ha hecho de este procedimiento la principal opción diagnóstica prenatal de cromosomopatía aún hoy día, cuando la biopsia corial comienza a ser contemplada como una opción ampliamente disponible y clínicamente caracterizada por su mayor precocidad1. Existen 2 modalidades técnicas de amniocentesis, una precoz que se realiza entre las 10 y las 14 semanas de gestación y otra «tardía» que se realiza en el segundo trimestre, generalmente a partir de la 15.a semana. En nuestro caso todas las amniocentesis corresponden a esta última modalidad.
La edad a la cual las mujeres occidentales deciden tener hijos mantiene una tendencia claramente creciente y progresiva, lo que conlleva varias implicaciones importantes para el resultado final del embarazo, una de las más obvias es el incremento en la incidencia de síndromes de Down, Edwards, Patau, Klinefelter y triple X1,2. Sin embargo conviene tener presente que otras anomalías relativamente comunes como el síndrome de Turner o la 47,XYY no guardan relación con la edad materna. En cualquier caso un 45% de fetos con SD se perderán espontáneamente entre las 10 semanas y el término17 y aunque el riesgo de nacimiento de un SD aumenta con la edad, no lo hace tanto como cabría esperar (se estima en 34 por 1.000 nacimientos en mujeres de 45 o más años de edad). Probablemente tal circunstancia se deba a la mayor propensión al aborto de estas gestantes, en relación con las embarazadas de menor edad17. Por dicho motivo, y por el riesgo inherente a las técnicas invasivas de diagnóstico prenatal, diversos autores se han mostrado restrictivos respecto al uso de la amniocentesis y la biopsia corial en gestantes de mayor edad15,18,19. En tal dirección apunta el último consenso canadiense para screening de aneuploidías fetales, el cual establece que los test diagnósticos prenatales invasivos deberían limitarse a mujeres que se someten a screening y obtienen un nivel de riesgo superior al punto de corte establecido para los test de screeening no invasivos y a mujeres que tengan 40 años en el momento del parto y que después de un adecuado consejo decidan directamente someterse a biopsia corial o amniocentesis. Estas guías están dirigidas a reducir el número de amniocentesis hechas con la indicación exclusiva de edad materna. Esto provocará en un beneficio en términos de pérdida de gestaciones normales debido a complicaciones asociadas a procedimientos invasivos.
Una importante desventaja de la amniocentesis es que sus resultados habitualmente están disponibles después de las 18 semanas de gestación11. La amniocentesis en el segundo trimestre es más segura que la toma de muestras de vellosidades coriónicas transcervical o la amniocentesis temprana y los beneficios del diagnóstico temprano deben contraponerse con los riesgos más altos. Si se requiere un diagnóstico más temprano, la toma de muestras de biopsia corial transabdominal es preferible a la amniocentesis temprana o a la biopsia transcervical. En las circunstancias en las cuales la biopsia corial transcervical puede ser técnicamente difícil, las opciones preferidas son la biopsia corial transcervical en el primer trimestre o la amniocentesis en el segundo trimestre11.
ConclusiónLa tendencia actual de creciente proporción de gestantes sobre los 35 años de edad hace que debamos replantear las estrategias de cribado que hasta ahora se han venido aplicando para las gestantes de mayor edad. La realización de amniocentesis por el solo criterio de edad materna no resulta un método diagnóstico rentable.
Cualquier programa de cribado debiera considerar dentro de sus cualidades las pérdidas fetales asociadas a procedimientos invasivos innecesarios.
Los padres que consideran el diagnóstico prenatal deberían ser informados en detalle acerca de los riesgos y los beneficios de los procedimientos alternativos y los beneficios de estos antes de elegir.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.