Determinar si existe alguna asociación entre el perfil de microbiota intestinal y la carga aterosclerótica global medida mediante cuantificación de calcio coronario (CCC) en sujetos sin antecedentes de enfermedad cardiovascular (ECV).
MétodosSe incluyeron 20 pacientes mayores de edad, sin antecedentes de ECV a los que se les hizo la CCC mediante tomografía computarizada multicorte. Además, se les recogió una muestra de heces para caracterizar la composición de la microbiota intestinal mediante la secuenciación del gen 16S RNAr con técnicas de secuenciación masiva y una muestra de sangre para la cuantificación de citoquinas proinflamatorias, mediante ELISA específicos, y del metabolito bacteriano N-óxido de trimetilamina (TMAO) por cromatografía de gases/líquidos acoplada a espectrometría de masas en tándem.
ResultadosLa media de edad fue de 63,5 años y un 60% eran mujeres. La mitad de los pacientes (n=10) presentaron una CCC>100 y se caracterizaron por una mayor abundancia de bacterias del filo Proteobacteria, pertenecientes principalmente a las familias Enterobacteriaceae y Pasteurellaceae, que los pacientes con CCC≤100. La mayoría de los géneros bacterianos identificados, Enterobacter, Escherichia/Shigella, Klebsiella, Citrobacter y Salmonella, se asociaron positivamente con los niveles plasmáticos de TNF-α o IL-1β y con la producción de TMAO.
ConclusiónLos resultados de este estudio piloto muestran un perfil de microbiota intestinal asociado a la presencia de CCC>100 en pacientes sin ECV previa, caracterizado por un aumento en la proporción de géneros bacterianos productores de TMAO. Puesto que la composición de la microbiota intestinal es altamente modulable por diversos factores, es posible que, en un futuro, podamos prevenir, e incluso intervenir, la enfermedad cardiovascular mediante estrategias nutricionales.
To investigate the relationship between gut microbiota composition and the presence of coronary atherosclerosis assessed by coronary artery calcium (CAC) quantification in individuals without previous cardiovascular disease (CVD).
MethodsWe included 20 patients over 18 years of age with no history of CVD who underwent multiple detector-computed tomography. From each patient, a stool sample was obtained to characterize gut microbiota composition by sequencing bacterial 16S ribosomal RNA gene. In addition, circulating levels of TNF-α and IL-1β, as well as trimethylamine N-oxide (TMAO) were determined in plasma samples by automated ELISA and capillary gas chromatography-mass spectrometry, respectively.
ResultsThe mean age of patients was 63.5 years and 60% were women. Half of patients had CAC >100 (Agatston score), and were characterized by a higher abundance of the phylum Proteobacteria, mainly of bacteria belonging to the families Enterobacteriaceae and than patients with a CAC ≤ 100. Moreover, bacterial genera identified as biomarkers, such as Enterobacter, Escherichia/Shigella y Klebsiella, were positively associated with inflammation levels and with TMAO production.
ConclusionOur data shows a gut microbiota profile associated with the presence of coronary calcium in patients without previous CVD. Although there are no strategies to decrease the amount of coronary calcium, gut microbiota is highly malleable by several factors. The possibility of preventing and even intervening CVD progression through strategies targeted gut microbiota is a very attractive idea that deserves further studies.
El cribado de la enfermedad aterosclerótica subclínica representa un desafío para la salud, ya que más de la mitad de los eventos coronarios iniciales, incluida la muerte súbita, se dan en pacientes que no han experimentado síntomas previamente1. Por ello, en los últimos años existe un gran interés por el desarrollo de nuevas estrategias encaminadas a identificar a aquellas personas que tienen un mayor riesgo cardiovascular. En este sentido, la cuantificación del calcio coronario a partir de imágenes obtenidas con tomografía axial computarizada (TAC) ha ido posicionándose como la herramienta más precisa para la selección de los pacientes con aterosclerosis coronaria2,3 ya que es una técnica no invasiva, con la que se obtienen resultados rápidos, y no es necesaria la interrupción de la medicación del paciente.
La lesión básica de la arteriosclerosis es la placa, que se caracteriza por ser una acumulación de lípidos, tejido fibroso, calcio y células inflamatorias en la pared vascular4. La calcificación coronaria comienza en los primeros estadios de la vida, pero progresa con mayor rapidez en sujetos mayores que tienen lesiones ateroscleróticas más avanzadas, produciéndose exclusivamente en arterias ya dañadas y no en arterias normales5. Aunque la ausencia de calcio coronario no excluye la presencia de placas no calcificadas6,7, la existencia de arterias coronarias calcificadas incrementa la probabilidad de enfermedad isquémica en más de diez veces en personas asintomáticas; una probabilidad sustancialmente mayor que la que se asocia a los factores de riesgo convencionales7. De hecho, las guías clínicas tanto estadounidenses como europeas consideran la puntuación del calcio score como una herramienta muy útil a la hora de evaluar y estratificar el riesgo cardiovascular en personas asintomáticas, pudiendo servir como guía para gestionar las futuras terapias preventivas8,9.
Nuestro organismo está habitado por millones de microorganismos, principalmente bacterias, que componen la microbiota humana10. Se localizan principalmente en el intestino y, de alguna manera, a lo largo de la evolución, se ha establecido una relación simbiótica entre el ser humano y su microbiota. En los últimos años, numerosas enfermedades crónicas, incluidas las enfermedades cardiovasculares (ECV), se han asociado con cambios en la composición de la microbiota intestinal (disbiosis). Así, diversos estudios han demostrado una asociación, no solo entre disbiosis intestinal y aterosclerosis, hipertensión, insuficiencia cardíaca, enfermedad renal crónica, u obesidad/diabetes mellitus tipo 2, sino también con sus complicaciones clínicas11. Un estudio realizado por Liu et al. demostró que los cambios ocurridos en la composición de la microbiota intestinal eran capaces de distinguir con precisión los pacientes con enfermedad arterial coronaria estable de aquellos con síndrome coronario agudo12. En un modelo experimental de isquemia/reperfusión se ha demostrado que una alteración de la microbiota intestinal inducida por un antibiótico o un probiótico resulta en infartos más pequeños y mejor recuperación de la función mecánica postisquémica en comparación con los animales sin tratamiento13. Resultados recientes de nuestro grupo en un modelo experimental de insuficiencia cardiaca (IC), demostraron que los cambios en la composición de la microbiota intestinal fueron anteriores a la manifestación de alteraciones cardíacas y que se asociaron con la evolución de los cambios estructurales y funcionales del corazón14. Además, la microbiota intestinal funciona como un sistema endocrino del hospedador, pudiendo contribuir al desarrollo de la ECV a través de la liberación de metabolitos que inciden en la inflamación, dislipemia, control del tono vascular o la fibrosis11. En conjunto, estos resultados sugieren que la disbiosis intestinal podría ser un importante factor de riesgo para el desarrollo de la arteriosclerosis.
Por lo tanto, el objetivo de este trabajo ha sido realizar un estudio piloto para investigar la relación entre la composición de la microbiota intestinal y el riesgo cardiovascular en individuos sin enfermedad cardiovascular previa en función de la calcificación de sus arterias coronarias.
Material y métodosPoblación de estudioSe incluyeron pacientes mayores de edad, sin antecedentes de enfermedad cardiovascular (IC, enfermedad arterial coronaria e ictus) a los que se indicó la realización de una TAC multidetector con el objetivo de cuantificar el calcio coronario en el Hospital Universitario Río Hortega de Valladolid por existencia de un cuadro clínico de dolor torácico sin claro perfil isquémico, sin pruebas funcionales definitivas y con baja probabilidad pre-test? de enfermedad coronaria. Se excluyeron los pacientes con deterioro de la función renal o hepática, cáncer, enfermedades inflamatorias, enfermedad arterial aterotrombótica clínica o subclínica diagnosticada previamente, o tratamiento con antibióticos o probióticos en los dos meses anteriores a su inclusión. A todos los participantes se les recogieron datos antropométricos, bioquímicos y factores de riesgo cardiovascular. La evaluación del riesgo cardiovascular se llevó a cabo mediante la puntuación por la escala de Framingham calibrada para la población española (REGICOR), que evalúa el riesgo de padecer enfermedad coronaria (infarto de miocardio o muerte) en los siguientes 10 años. Los pacientes se clasificaron con riesgo coronario bajo (0-9%), moderado (10-19%) y alto (≥ 20%)15.
Este trabajo se ha realizado cumpliendo los principios fundamentales establecidos en la Declaración de Helsinki, en el Convenio del Consejo de Europa relativo a los derechos humanos y la biomedicina y en la Declaración Universal de la Unesco sobre el genoma humano y los derechos humanos. Todos los sujetos dieron su consentimiento informado y el proyecto fue aprobado por el Comité Ético del Hospital Clínico San Carlos (C.I. 16/237-E).
Cuantificación del calcio coronarioA todos los pacientes se les realizó una cuantificación del calcio coronario (CCC) mediante TAC multidetector (128 detectores, Siemens Somaton Drive, Siemens Healthcare GmbH, Erlangen, Alemania). El protocolo de estudio incluyó la adquisición prospectiva basado en electrocardiograma (ECG) (ECG-gating) en un latido y sin administración previa de contraste de todo el volumen cardíaco, con posterior reconstrucción de las imágenes obtenidas (grosor de corte de 3,0mm). El análisis posproceso de las imágenes se realizó con un software específico (SYNGO VIA, Siemens Healthcare GmbH), siendo interpretado por dos observadores independientes. Se calculó el score de calcio de Agatston para cada lesión, basado en el área y la densidad de las lesiones calcificadas según método descrito16 y se sumó el total para determinar su valor para cada paciente.
Recogida de muestras fecales y extracción de ADN microbianoDe cada individuo se obtuvo una muestra de heces que se recogió en un tubo con un estabilizante del ADN (OMNIgene-GUT, DNAgenotek, Ottawa, Canadá) y que se almacenó a -80°C hasta su posterior procesado. El ADN microbiano de las muestras se extrajo usando el mini kit QIAamp Fast DNA Stool (Quiagen, Hilden, Alemania) siguiendo el protocolo del fabricante. La integridad del ADN se evaluó con un BioAnalyzer 2100 (Agilent, Palo Alto, CA, EE. UU.), y su concentración se determinó con un fluorómetro Qubit 3.0 utilizando el ensayo dsDNA HS (Thermo Fisher Scientific, Carlsbad, Ca, EE. UU.).
Secuenciación del gen del ARN ribosomal 16SPara cada muestra de heces, se amplificó el gen del ARN ribosomal 16S mediante PCR usando el kit Ion 16S Metagenomics (Thermo Fisher Scientific) que amplifica 7 regiones hipervariables (V2, V3, V4, V6-7, V8 y V9) de dicho gen. Las librerías se prepararon a partir de 5 ng de ADN por muestra, convirtiendo a romos los extremos de los amplicones mediante el kit Ion Plus Fragment Library (Thermo Fisher Scientific) y uniendo identificadores moleculares de ADN con el kit Ion Express Barcode Adapters (Thermo Fisher Scientific). A continuación, las librerías se diluyeron a 22 pM, se sometieron a amplificación clonal por PCR en emulsión con el Ion OneTouch™ 2 System (Thermo Fisher Scientific), y se secuenciaron en un equipo Ion S5™ System utilizando un Ion 520™ Chip (Thermo Fisher Scientific).
Análisis bioinformáticoLas secuencias obtenidas fueron preprocesadas de manera automática por el software Torrent Suite™ (v5.10.0; Thermo Fisher Scientific). Se eliminaron las regiones de los primers, y las secuencias fueron recortadas a 150 pares de bases usando Python. Los archivos FASTQ se analizaron usando el software QIIME 2 (v2020.2) para derreplicar las lecturas y eliminar las secuencias con una única aparición (singletons). Las secuencias finales se agruparon en unidades taxonómicas operativas (OTU) con un 99% de similitud usando la base de datos SILVA (v138). La asignación taxonómica de las OTU identificadas se realizó utilizando QIIME 2 y la taxonomía de SILVA. La riqueza de especies bacterianas (diversidad alfa) se midió a partir de un perfil de OTU rarificado a una profundidad de secuenciación de 115.435 lecturas. La abundancia relativa de los taxones se calculó como porcentaje basado en el número total de lecturas por muestra. Para estudiar la diversidad beta, se calculó el índice de Bray-Curtis. Se aplicó el análisis de coordenadas principales (PCoA) a la matriz de disimilitud resultante y se utilizaron gráficos de PCoA bidimensionales para la visualización de la estructura composicional entre grupos y muestras. El paquete de software PICURSt2 (v2.2.0-b) se usó para predecir el contenido funcional de las comunidades microbianas como perfil de ortólogos de la Enciclopedia de Genes y Genomas de Kyoto (KEGG). El tamaño del efecto del análisis discriminante lineal (LEfSe) se utilizó para identificar los taxones y las vías funcionales diferencialmente abundantes entre los grupos utilizando los scripts compartidos por el autor (github.com/SegataLab/lefse). Para este análisis se eliminaron los taxones con una abundancia relativa <0,01% y se seleccionaron los resultados con una puntuación logarítmica de LDA (LDA score) ≥2.0 y P <0,05. El protocolo de análisis ha sido publicado previamente más en detalle por nuestro grupo14.
Obtención del plasma y cuantificación de citoquinas proinflamatoriasDe cada paciente se obtuvo una muestra de sangre periférica por venopunción en tubos de vacío con EDTA como anticoagulante. El plasma se obtuvo centrifugando la sangre a 1.500rpm durante 10 min. Las muestras fueron entonces divididas en alícuotas y almacenadas a -80°C.
Los niveles circulantes de TNF-α e IL-1β se determinaron en el plasma mediante ELISA automatizados (Protein Simple Plex Assay, Biotechne, MN, EE. UU.) siguiendo las instrucciones del fabricante. La sensibilidad del ensayo para el TNF-α fue 0,278 pg/ml. Los coeficientes de variación intra- e interensayo fueron 5,0% y 0,771%, respectivamente. La sensibilidad del ensayo para la IL-1β fue 0,064 pg/ml. Los coeficientes de variación intra- e interensayo fueron 4,9% y 0,342%, respectivamente.
Cuantificación del metabolito bacteriano TMAOLa detección de N-óxido de trimetilamina (TMAO) se realizó en muestras de plasma mediante cromatografía de líquidos acoplada a espectrometría de masas (LC-MS) utilizando como sistema de ionización un electrospray (ESI) y como analizador un cuadrupolo simple (Qp). Las muestras de plasma se desproteinizaron utilizando metanol como reactivo precipitante y se centrifugaron a 12.500rpm durante 2 min a temperatura ambiente. A continuación, se realizó la separación cromatográfica inyectando 10μL del sobrenadante en un sistema LC-MS 2020 (Shimazdu Europa GmbH, Duisburg, Alemania) provisto de una columna de fase reversa C18 (150mm x 4,6mm x 5μm) de Supelco (Merck Life Science SLU, Madrid, España) a 35°C. La elución se llevó a cabo en gradiente con una solución acuosa de ácido fórmico 1N/metanol durante 14 min a un flujo de 0,2mL/min. La detección del TMAO se hizo con un cuadrupolo simple utilizando nitrógeno como gas de nebulización (flujo 1,5 L/min) y gas se secado (flujo 10 L/min) producido por un generador (Peak Scientific Spain SL, Madrid, España). Para llevar a cabo la cuantificación se utilizó la relación de alturas entre el TMAO y el estándar interno, monitorizando los iones moleculares (TMAO: m/Z=76 y D9-TMAO: m/Z=85) en modo Selected Ion Monitoring. Para evaluar los parámetros de linealidad, exactitud y recuperación se prepararon 6 concentraciones de TMAO (Sigma-Aldrich Química S.A., Madrid, España) por duplicado de 1, 5, 10, 25, 50 y 100μmoles/l. La linealidad del método se analizó mediante regresión lineal.
Análisis estadísticoLas variables recogidas en el estudio, así como la diversidad alfa y la abundancia de los diferentes taxones se expresaron como media±error estándar de la media o mediana (rango intercuartílico). La prueba de Shapiro-Wilk se usó para contrastar la normalidad de cada variable. Aquellas que tenían una distribución normal se compararon estadísticamente utilizando la prueba t de Student y las que siguieron una distribución no normal se compararon utilizando la prueba no paramétrica U de Mann-Whitney. Las variables cualitativas se analizaron con la prueba exacta de Fisher. Las diferencias entre grupos respecto a la estructura de las comunidades bacterianas (diversidad beta) se analizó con un análisis de permutaciones y múltiple ANOVA (PERMANOVA) con 999 permutaciones. La asociación entre las abundancias relativas de los géneros y los niveles plasmáticos de TNF-α e IL-β se analizó mediante correlaciones de Spearman. El análisis estadístico se llevó a cabo utilizando el paquete SciPy de Python. Para todos los análisis, las diferencias se consideraron estadísticamente significativas si P <0,05.
ResultadosCaracterísticas clínicas de los pacientesEn este estudio piloto hemos incluido un total de 20 sujetos a los que se les realizó una TAC multidetector por indicación de su médico para descartar la presencia de cardiopatía isquémica. La media de edad fue de 63,5 años y un 60% eran mujeres. Según la ecuación de REGICOR, 15 pacientes tenían un riesgo bajo de sufrir un episodio cardiovascular y dos, un riesgo moderado, con un riesgo medio de 5,0%. De tres pacientes no se pudo calcular su riesgo cardiovascular por tener más de 74 años. Sin embargo, 10 pacientes presentaron una CCC>100, con alta probabilidad de enfermedad coronaria y riesgo cardiovascular alto, frente a otros 10 pacientes que presentaron una CCC≤100, con probabilidad mínima o leve de estenosis coronaria y riesgo cardiovascular de bajo a moderado. Los pacientes con CCC>100 eran significativamente mayores, con una ligera tendencia a mayor presencia de hipertensos y dislipémicos que los pacientes con CCC ≤100, aunque no hubo diferencias significativas en el riesgo cardiovascular evaluado según la ecuación de REGICOR entre ambos grupos (4,5 [3,8-8,8] vs. 4,0 [3,0-6,5], P=NS). Las características antropométricas, clínicas y bioquímicas de los sujetos incluidos, en función de su CCC, están reflejadas en la tabla 1.
Características clínicas y bioquímicas de todos los pacientes en función de la cuantificación de calcio coronario (CCC)
| Todos(n=20) | Pacientes con CCC ≤100(n=10) | Pacientes con CCC>100(n=10) | |
|---|---|---|---|
| Edad, años | 64±2 | 56±3 | 71±2* |
| Mujeres, n (%) | 12 (60) | 7 (70) | 5 (50) |
| IMC, kg/m2 | 27,1±1,0 | 27,3±1,6 | 27,0±1,2 |
| Perímetro cintura, cm | 97±2 | 93±2 | 100±3 |
| Fumadores, n (%) | 5 (25) | 3 (30) | 2 (20) |
| Hipertensión, n (%) | 14 (70) | 5 (50) | 9 (90) |
| DMT2, n (%) | 2 (10) | 1 (10) | 1 (10) |
| Dislipemia, n (%) | 15 (75) | 6 (60) | 9 (90) |
| Triglicéridos, mg/dL | 118 (82-154) | 95 (69-146) | 131 (95-184) |
| Colesterol total, mg/dL | 207±10 | 212±13 | 203±16 |
| c-LDL, mg/dL | 125±10 | 133±14 | 117±14 |
| c-HDL, mg/dL | 59±4 | 58±3 | 59±7 |
| REGICOR | 4,0 (3,0-7,8) | 4,0 (3,0-6,5) | 4,5 (3,8-8,8) |
| Score de calcio | 90 (0-352) | 0 (0-13) | 323 (144-788)* |
Los valores están expresados como la media±EEM o mediana (rango intercuartílico) para las variables continuas o n (%) para las variables categóricas.
c-HDL: colesterol-HDL; c-LDL: colesterol-LDL; DMT2: diabetes mellitus tipo 2; IMC: índice de masa corporal.
La secuenciación de las muestras identificó un total de 4.457.899 lecturas que se clasificaron en 21.092 OTUs. La media de lecturas en las muestras de los pacientes con CCC ≤100 fue de 225.515 y de 220.275 en los pacientes con CCC>100.
Para analizar la composición de la microbiota intestinal, en primer lugar calculamos la diversidad alfa de las muestras, un parámetro que tiene en cuenta la biodiversidad intrínseca de cada muestra. No encontramos diferencias estadísticamente significativas ni en la riqueza bacteriana (expresada mediante curvas de rarefacción) (figura suplementaria 1A del anexo disponible online) ni en el índice de Shannon (un parámetro que tiene en cuenta tanto la riqueza como la distribución de las OTU) (figura suplementaria 1B) en las muestras de los pacientes con CCC ≤100 con respecto a las de los pacientes con CCC>100. El análisis de la diversidad beta de las muestras de microbiota intestinal demostró que las muestras tendían a agruparse en dos grupos en función con su cuantificación de calcio, aunque no alcanzó significación estadística (figura suplementaria 1C).
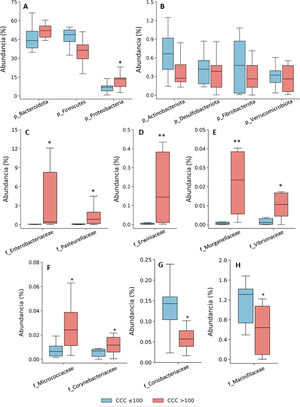
La asignación taxonómica de las OTU dio lugar a la identificación de 18 filos, 27 clases, 52 órdenes, 115 familias y 408 géneros teniendo en cuenta todos los pacientes incluidos en el estudio. La composición bacteriana de los pacientes con CCC ≤100 fue similar a la que presentaron los pacientes con CCC>100, aunque se observaron diferencias en la distribución de los taxones. En ambos grupos, los filos más abundantes fueron Firmicutes, Bacteroidota (antes Bacteroidetes) y Proteobacteria, correspondiendo a más del 97% de las bacterias identificadas, aunque las abundancias fueron diferentes entre los grupos; en los pacientes con CCC>100, la presencia de bacterias de los filos Bacteroidota y Proteobacteria fue mayor, y la de Firmicutes menor, que en los pacientes sin calcio coronario (fig. 1). Por otra parte, en ambos grupos, alrededor del 3% de las bacterias pertenecían a filos minoritarios, aunque no se identificaron diferencias significativas entre los grupos (fig. 1).
Composición taxonómica de la microbiota intestinal a nivel de filo (A y B) y abundancia relativa de bacterias pertenecientes a las familias del filo Proteobacteria (C-H). Los resultados se muestran en diagramas de caja con la mediana, el rango intercuartílico y los valores máximos y mínimos.
f: familia; p: filo.
*P<0,05 vs. pacientes con CCC ≤100.
**P<0,01 vs. pacientes con CCC ≤100.
Puesto que existía una diferencia de edad significativa entre ambos grupos de pacientes, analizamos la abundancia de proteobacterias en función de la edad de los pacientes (mayores o menores de 74 años). En el grupo de pacientes menores de 74 años, aquellos con CCC>100 seguían mostrando una mayor abundancia de proteobacterias que los pacientes con CCC ≤100 (figura suplementaria 2). En el grupo de pacientes mayores de 73 años, todos los pacientes presentaron un CCC>100, aunque no se observaron diferencias significativas en la cantidad de proteobacterias con respecto a los pacientes menores de 74 años (figura suplementaria 2).
Consecuentemente con el aumento de proteobacterias, se observó una mayor abundancia de bacterias de la clase Gammaproteobacteria (Filo Proteobacteria) (CCC ≤100: 3,8% [2,8-7,0]; CCC>100: 13,5% [7,4-14,4], P <0,05). A nivel de familias, las bacterias de las familias Enterobacteriaceae, Pasteurellaceae,Erwiniaceae, Vibrionaceae y Morganellaceae (Clase Gammaproteobacteria), Micrococcaceae y Corynebacteriaceae (Clase Actinobacteriota -antes Actinobacteria) eran significativamente más abundantes en los pacientes con CCC>100 que en los que tenían un CCC ≤100 (fig. 1C-F). Por el contrario, las familias Coriobacteriaceae (Clase Actinobacteriota) y Marinifilaceae (Clase Bacteroidota) estaban significativamente disminuidas en los pacientes con CCC>100 (fig. 1G-H).
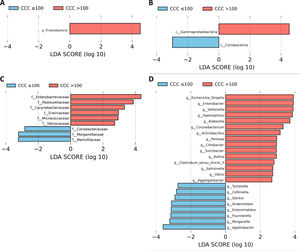
A continuación, realizamos un análisis LEfSe de todos los niveles taxonómicos, una herramienta bioinformática que nos permite inferir si algún taxón podría actuar como biomarcador de los pacientes con riesgo cardiovascular alto según su CCC. El filo Proteobacteria, su clase Gammaproteobacteria y las familias de esta clase Enterobacteriaceae, Pasteurellaceae, Erwiniaceae y Vibrionaceae se identificaron como biomarcadores taxonómicos (LDA score ≥ 2,0 y P <0,05) entre los pacientes con y sin calcio coronario (fig. 2A-C). A nivel de género, la identificación de biomarcadores taxonómicos demostró quince géneros significativamente aumentados en los pacientes con CCC>100 (LDA score ≥ 2,0 y P <0,05), de los cuales diez pertenecían al filo Proteobacteria: Escherichia/Shigella, Enterobacter, Klebsiella, Citrobacter, Salmonella (familia Enterobacteriaceae), Haemophilus, Actinobacillus, Aggregatibacter (familia Pasteurellaceae), Pantoea (familia Erwiniaceae) y Vibrio (familia Vibrionaceae) (fig. 2D).
Análisis LEfSe mostrando los filos (A), clases (B), familias (C) y géneros (D) identificados como biomarcadores en pacientes con CCC>100 respecto a pacientes con CCC ≤100. La longitud de las barras horizontales representa el LDA score. P <0,05; LDA score ≥2.0. c: clase; f: familia; g: género; p: filo.
Los pacientes con CCC>100 presentaron mayores niveles plasmáticos de TNF-α que los pacientes con CCC ≤100 (6,3±0,53 vs. 4,5±0,19 pg/ml, P<0,05). Todos los géneros pertenecientes a la familia Enterobacteriaceae que se identificaron como biomarcadores de los pacientes con CCC>100 se correlacionaron positivamente con los niveles de TNF-α (tabla 2). Aunque no encontramos diferencias significativas entre los niveles plasmáticos de IL-1β entre ambos grupos de pacientes (0,074±0,034 vs. 0,066±0,023 pg/ml, P=NS), la abundancia de dos géneros bacterianos (Escherichia/Shigella y Salmonella) también se asoció con mayor concentración de IL-1β (tabla 2).
Correlación entre los niveles circulantes de TNF-α e IL-1β, y las bacterias de la familia Enterobacteriaceae
| TNF-α | IL-1β | |||
|---|---|---|---|---|
| ρ | P | ρ | P | |
| Escherichia/Shigella | 0,480 | 0,032 | 0,470 | 0,037 |
| Enterobacter | 0,490 | 0,028 | 0,352 | 0,128 |
| Klebsiella | 0,495 | 0,027 | 0,391 | 0,088 |
| Citrobacter | 0,528 | 0,017 | 0,383 | 0,096 |
| Salmonella | 0,546 | 0,013 | 0,586 | 0,007 |
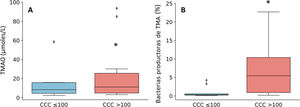
Puesto que los pacientes con CCC>100 se caracterizaron por un aumento de géneros bacterianos productores de TMA como Enterobacter, Escherichia/Shigella y Klebsiella, a continuación, cuantificamos la producción de TMAO, un metabolito bacteriano originado a partir de TMA que se considera un factor de riesgo cardiovascular11. Como se observa en la figura 3, los niveles plasmáticos de TMAO estaban elevados en sujetos con CCC>100 y se correlacionaron positivamente con la cantidad de calcio (R=0,54; P=0,017).
Niveles plasmáticos de TMAO (A) y abundancia relativa de géneros bacterianos productores de TMA (B) en función de la presencia de calcio coronario. Los resultados se muestran en diagramas de caja con la mediana, el rango intercuartílico y los valores máximos y mínimos. *P<0,05 vs. pacientes con CCC ≤100.
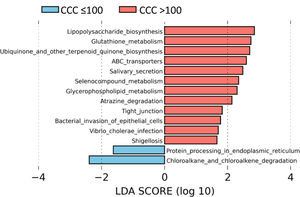
Para identificar el perfil funcional de la microbiota intestinal de los pacientes con y sin calcio coronario, realizamos un análisis LEfSe para comparar las rutas metabólicas KEGG de los pacientes con CCC>100 con respecto a los que presentaban CCC ≤100. En los pacientes con CCC>100, identificamos 12 rutas incrementadas con respecto a los pacientes sin calcio, principalmente relacionadas con la síntesis de lipopolisacárido (LPS), mecanismos antioxidantes como el metabolismo del glutatión, síntesis de ubiquinona, o asociadas a infecciones bacterianas o invasión del epitelio por microorganismos (fig. 4).
DiscusiónEn este trabajo hemos identificado un perfil de microbiota intestinal asociado a la presencia de calcio coronario en pacientes sin enfermedad cardiovascular previa. Los pacientes con una puntuación de calcio>100 se caracterizaron por una mayor abundancia de proteobacterias, principalmente de bacterias pertenecientes a las familias Enterobacteriaceae y Pasteurellaceae que los pacientes con una puntuación de calcio ≤100. La mayoría de los géneros bacterianos identificados se asociaron positivamente con los niveles de inflamación de los pacientes y con la producción del metabolito bacteriano TMAO.
Desde hace años, la presencia de calcio coronario se considera un marcador directo de la existencia de aterosclerosis y numerosos estudios han demostrado su utilidad para la estratificación del riesgo cardiovascular, incluso en individuos clasificados como de bajo riesgo con funciones de riesgo2,3. En este trabajo, la mitad de nuestros pacientes sin enfermedad cardiovascular previa presentaron calcio coronario, un resultado muy similar al descrito por otros autores en población española17. Sin embargo, aunque la TAC coronaria es una técnica no invasiva, tiene una disponibilidad limitada y existe cierta exposición a la radiación, por lo que existe un gran interés por identificar biomarcadores más asequibles. En este sentido, el análisis metagenómico de las muestras de heces de los pacientes nos ha permitido identificar un perfil de microbiota intestinal, caracterizado por un predominio de bacterias del filo Proteobacteria y, más concretamente, de la familia Enterobacteriaceae, en los individuos con presencia de calcio coronario. Hasta donde sabemos, este es el primer trabajo que analiza la composición de la microbiota intestinal en función de la existencia de calcio coronario en pacientes sin ECV conocida. Sin embargo, nuestros resultados coinciden con estudios previos que han investigado la composición de la microbiota intestinal en pacientes con aterosclerosis sintomática. En diferentes poblaciones de pacientes con ECV aterosclerótica (angina estable, angina inestable o infarto agudo de miocardio), se ha reportado un aumento significativo de la familia Enterobacteriaceae, principalmente de los géneros Escherichia-Shigella, Klebsiella y Enterobacter11. Además, se ha reportado que el aumento de proteobacterias como Klebsiella, Streptococcus, Haemophilus y Granulicatella, así como la producción de metabolitos bacterianos, se correlaciona positivamente con la severidad de la ECV12. Otro género bacteriano identificado, Citrobacter, se ha asociado con un mayor grosor íntima-media carotídeo en una población con alta susceptibilidad al desarrollo de enfermedad cardiovascular18. Además, aunque no en gran cantidad, algunos estudios han identificado la presencia de enterobacterias en placas ateromatosas, principalmente Klebsiella, Pantoea, Citrobacter o Enterobacter, que también se encuentran en la microbiota oral y del intestino19,20.
Es bien sabido que la inflamación desempeña un papel fundamental tanto en el inicio como en el desarrollo y complicaciones de la arterosclerosis4. De hecho, existe una estrecha relación entre marcadores de inflamación como TNF-α, IL-1β, IL-6 o la proteína C reactiva (PCR) y el riesgo de sufrir futuros eventos cardiovasculares, incluso en sujetos aparentemente sanos4. Estudios previos sugieren que la información que proporcionarían los marcadores inflamatorios en la predicción del riesgo de cardiopatía coronaria sería complementaria a la proporcionada por la CCC21. En los últimos años, el origen de este estado de inflamación se ha relacionado con la microbiota intestinal. Uno de los componentes principales de la pared de las bacterias gramnegativas es el LPS, el cual puede desatar una intensa respuesta inflamatoria cuando alcanza la circulación11. Existe una gran evidencia de la conexión entre la inflamación de bajo grado mediada por LPS y el desarrollo de trastornos metabólicos e inflamatorios22,23. La familia Enterobacteriaceae son bacterias gramnegativas. Se ha demostrado que la inoculación de bacterias del género Enterobacter (familia Enterobacteriaceae) aisladas de pacientes obesos a ratones libres de gérmenes induce un aumento significativo del peso de los animales, así como de diversos marcadores inflamatorios24. El aumento de enterobacterias es un fenómeno comúnmente observado en la disbiosis intestinal asociada a numerosas patologías que implican inflamación intestinal, para el cual se han propuesto diferentes mecanismos25,26. Por un lado, mientras que en condiciones normales las células epiteliales del colon agotan el oxígeno del lumen y generan un ambiente anaerobio, cuando existe inflamación intestinal, los colonocitos modifican su metabolismo hacia una glucólisis anaerobia, que, al consumir menos oxígeno, aumenta su disponibilidad y favorece el crecimiento de microorganismos anaerobios facultativos como las enterobacterias25. Otro factor importante que podría estar relacionado es la flexibilidad respiratoria de las enterobacterias, las cuales pueden utilizar el nitrato que se genera en estados de inflamación como aceptor alternativo de electrones25. Se ha descrito que la falta de butirato induce, por un lado, el cambio en el metabolismo de los colonocitos hacia una glucólisis anaerobia, y por otro, una mayor expresión del gen codificante para la óxido nítrico sintasa (NOS) que se traduce en una mayor producción de nitratos27, lo que sugiere un mecanismo por el cual la ausencia de una microbiota intestinal saludable, productora de butirato, podría conducir a un sobrecrecimiento de bacterias de la familia Enterobacteriaceae.
En nuestro trabajo hemos observado una asociación entre la abundancia de géneros bacterianos de la familia Enterobacteriaceae, como Enterobacter, Escherichia/Shigella y Klebsiella, y los niveles plasmáticos de TMAO en los pacientes con CCC>100. La familia Enterobacteriaceae son los principales productores de trimetilamina (TMA)28, el metabolito precursor del TMAO, asociado al desarrollo de aterosclerosis y enfermedad coronaria11. Diversos estudios han demostrado que el TMAO promueve la adherencia de los monocitos al endotelio y activa las vías de la proteína quinasa C y el factor nuclear κB (NF-κB), lo que induce disfunción endotelial y acelera el proceso aterosclerótico11,29. Además, los niveles elevados de TMAO aumentan la capacidad de respuesta de las plaquetas, promoviendo la trombosis29,30. Un estudio con más de 4.000 participantes demostró que la concentración de TMAO en plasma podía predecir el riesgo a 3 años de un incidente trombótico (infarto cardiaco, accidente cerebrovascular)30.
Las vías metabólicas predichas asociadas con la microbiota intestinal identificaron un incremento significativo en las vías de biosíntesis de LPS en pacientes con CCC>100, consistente con la abundancia de bacterias pertenecientes a la familia Enterobacteriaceae. Además, los pacientes con CCC>100 mostraron un aumento de los genes involucrados en el metabolismo del glutatión, el cual protege contra el estrés oxidativo, especialmente en el corazón. En este sentido, las alteraciones en la homeostasis del metabolismo del glutatión cardíaco se han asociado con anomalías en la función y estructura cardíaca31. También observamos un aumento significativo en la vía relacionada con la biosíntesis de ubiquinona, que se ha asociado con un menor grado de inflamación y estrés oxidativo en pacientes con cardiopatía isquémica32. Es posible que el aumento del metabolismo del glutatión y ubiquinona en pacientes con CCC>100 sea un mecanismo de compensación. Además, observamos un aumento de las vías relacionadas con la infección de las bacterias de la familia Enterobacteriaceae en las células epiteliales, como la Shigelosis o la infección por Vibrio cholerae.
Los pacientes con mayor cantidad de calcio coronario eran significativamente mayores que los que tenían menos calcio en sus arterias. La microbiota intestinal es un ecosistema dinámico que está influenciado por numerosos factores, siendo bien conocido que la composición de la microbiota varía en función de la edad33. A nivel de filo, Firmicutes predomina en los adultos, y se reduce en los ancianos, mientras que existe cierta discrepancia sobre el aumento o la disminución del filo Bacteroidota con la edad. Por el contrario, existe consenso sobre el aumento de los niveles de las bacterias del filo Proteobacteria, especialmente de la familia Enterobacteriaceae, en personas mayores, habiéndose relacionado con un incremento de marcadores inflamatorios como IL-6 o IL-834. Aunque la edad umbral para definir a un individuo como anciano se considera 70 años, se ha demostrado que la microbiota intestinal sana se ve afectada por factores fisiológicos y conductuales relacionados con el envejecimiento a partir de los 74 años35,36. En este sentido, nuestro estudio revela que la composición de la microbiota intestinal de los pacientes con CCC menores de 74 años era similar a la de los pacientes con CCC mayores de 74 años. Aunque no disponemos de los perfiles de la microbiota intestinal de sujetos mayores sin calcio coronario en nuestro estudio, nuestros datos sugieren que la edad no es el principal factor responsable de la composición de la microbiota intestinal. Este es uno de los resultados más interesantes de nuestro trabajo ya que estaría relacionado con el concepto de edad vascular37, sugiriendo que la edad del aparato cardiovascular estaría más relacionada con la composición de la microbiota intestinal que con la edad cronológica.
La principal limitación de nuestro trabajo es que se trata de un estudio piloto, con un tamaño de población de estudio relativamente pequeño, y con un diseño transversal, por lo que no nos puede proporcionar evidencia de efectos causales directos. Sin embargo, utilizando modelos experimentales de ratón se ha demostrado que la susceptibilidad a la aterosclerosis puede transmitirse mediante el trasplante de microbiota intestinal38. Además, nuestro grupo ha demostrado que el aumento de géneros pertenecientes a la familia Enterobacteriaceae (Escherichia/Shigella, Klebsiella, Enterobacter) que se produce en ratas alimentadas con una dieta rica en grasa, se puede revertir con la administración de un antioxidante mitocondrial, a la vez que se mejoran diversos parámetros relacionados con la fibrosis cardíaca39.
En conclusión, nuestro trabajo muestra un perfil de microbiota intestinal asociado a la presencia de calcio coronario en pacientes sin ECV previa, que será interesante validar en estudios con un tamaño muestral más grande. Aunque no existen estrategias para disminuir la cantidad de calcio coronario, la microbiota intestinal es altamente modulable por diversos factores, principalmente la dieta. La posibilidad de prevenir, e incluso intervenir, la ECV mediante estrategias nutricionales (probióticos, prebióticos, agentes antimicrobianos no absorbibles, etc.) es una idea muy atractiva pero que requiere aún ser demostrada.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este trabajo ha sido parcialmente financiado con una Beca Fundación Española de Arteriosclerosis (FEA)/Sociedad Española de Arteriosclerosis (SEA) 2016 para Investigación Básica, concedida durante el XXIX Congreso Nacional SEA celebrado en Granada del 18 al 20 de mayo de 2016. Javier Modrego es personal del Centro de Investigación Biomédica en Red de Enfermedades Cardiovasculares (CIBERCV).