La arteriosclerosis se considera una enfermedad inflamatoria crónica influenciada por múltiples factores de riesgo. Diferentes estudios prospectivos han mostrado que los niveles plasmáticos de moléculas inflamatorias se relacionan con la presencia de arteriosclerosis y el desarrollo de enfermedad cardiovascular.
ObjetivoEvaluar si los valores plasmáticos de interleucina18 (IL-18) están modulados por single nucleotide polymorphisms (SNP) del gen de IL-18 y su posible asociación con los niveles de insulina y otros factores de riesgo cardiovascular.
Materiales y métodosSe estudiaron 746 individuos, seleccionados de forma oportunística entre los pacientes que acudieron a diversas consultas del área metropolitana de Valencia durante 2años. Se determinaron mediante metodología estándar parámetros del metabolismo lipídico e hidrocarbonado. La IL-18 se determinó mediante ELISA.
ResultadosLos sujetos con resistencia a la insulina (RI) presentaron niveles de IL-18 significativamente superiores que los individuos sin RI. Los niveles de IL-18 se correlacionaron de forma significativa con los niveles de insulina y con otros factores de riesgo cardiovascular. El genotipo CC del SNP rs1834481 se asoció de forma significativa con menores niveles plasmáticos de IL-18. Por el contrario, el genotipo GG del SNP rs7559479 se asoció con niveles significativamente superiores de IL-18.
ConclusionesLos niveles de IL-18 se relacionan con la presencia de RI y otros factores de riesgo cardiovascular, estando modulados dichos niveles genéticamente.
Atherosclerosis is an inflammatory chronic disease influenced by multiple factors. Different prospective studies have shown that plasmatic levels of inflammatory markers were related to atherosclerosis and cardiovascular disease.
ObjectiveTo evaluate whether plasmatic levels of interleukin 18 (IL-18) are modulated by SNPs (single nucleotide polymorphisms) of the IL 18 gene and its possible association with insulin levels and other cardiovascular risk factors.
Methods746 individuals were studied for a period of two years by opportunistic selection in the metropolitan area of Valencia. Parameters of lipid and glucose metabolism were analyzed by standard methodology. IL-18 was measured by ELISA.
ResultsIndividuals with insulin resistance showed significant higher levels of IL-18. IL 18 was significantly correlated with insulin levels and other cardiovascular risk factors. The CC genotype of the rs1834481 SNP was significantly associated with lower levels of IL-18. However, the GG genotype of the rs7559479 was associated with significant higher levels of IL-18.
ConclusionIL-18 is associated with insulin resistance and other cardiovascular risk factors, being those levels genetically regulated.
La arteriosclerosis se considera una enfermedad inflamatoria crónica influenciada por múltiples factores de riesgo1. Diferentes estudios prospectivos han mostrado que los niveles plasmáticos de moléculas inflamatorias se relacionan con la presencia de arteriosclerosis y el desarrollo de enfermedad cardiovascular2-4. También se ha demostrado una estrecha asociación entre los procesos inflamatorios y el desarrollo de resistencia a la insulina (RI). Hotamisligil et al.5 mostraron por primera vez que la citoquina proinflamatoria factor de necrosis tumoral alfa (TNF-α) era capaz de inducir RI. Posteriormente, diferentes estudios han evidenciado una buena correlación entre los niveles plasmáticos de insulina y marcadores inflamatorios, así como aumento de los niveles de moléculas inflamatorias en individuos con RI y diabetes6. Además, estudios prospectivos han mostrado que un incremento de los niveles plasmáticos de marcadores inflamatorios y reactantes de fase aguda se asocian con el desarrollo de diabetes tipo2, RI y síndrome metabólico7,8.
En los últimos años se ha sugerido que la presencia de distintos factores, como los ambientales, o la predisposición genética podrían influir en el desarrollo de arteriosclerosis. De hecho, la regulación de la inflamación por factores genéticos podría explicar la extraordinaria variabilidad existente en la respuesta inflamatoria. Además, se ha asociado el desarrollo de RI a algunos single nucleotide polymorphisms (SNP) presentes en genes relacionados con moléculas inflamatorias9,10. Sin embargo, el conocimiento sobre el papel que desempeña la expresión de distintos genes relacionados con la inflamación en el desarrollo de RI y en el desarrollo de arteriosclerosis es reducido. Nuestro objetivo fue evaluar si los valores plasmáticos de interleucina18 (IL-18) se relacionan con los niveles plasmáticos de insulina, así como con otros factores de riesgo cardiovascular, y si dichos niveles están modulados por SNP del gen de IL-18.
Sujetos y métodosSujetosLos sujetos participantes en el presente estudio procedían del estudio VALencian CArdiovascular Risk (VALCAR). El estudio VALCAR es un estudio transversal que fue diseñado para evaluar los factores de riesgo cardiovascular clásicos y emergentes presentes en población urbana, así como su asociación con el desarrollo de arteriosclerosis determinado mediante la realización de ecografía carotídea. Se incluyeron durante 2años, de forma consecutiva, por el método oportunístico, 746 individuos de edades comprendidas entre 18 y 78años procedentes de diferentes centros de nuestro departamento de salud en el área metropolitana de Valencia. Para el presente estudio se excluyó a los sujetos con proteínaC reactiva de alta sensibilidad (PCRas)>10mg/l y a los que presentaron en las 2semanas previas algún episodio de tipo infeccioso o inflamatorio. El estudio recibió la aprobación del Comité Ético de nuestro hospital y los sujetos dieron su consentimiento por escrito para participar en él.
Parámetros clínicosSe realizó una anamnesis detallada recogiendo el hábito tabáquico (número de cigarrillos/día), consumo de alcohol (gramos de alcohol/día), fármacos de consumo habitual u ocasional que coincidiesen con el periodo de estudio, y episodios cardiovasculares presentados hasta la fecha de inclusión en el estudio. Se realizó la determinación de la presión arterial tras 10min de reposo en decúbito supino, utilizando el valor medio de 3 determinaciones separadas 5min.
Parámetros antropométricosLos parámetros recogidos fueron: peso en kilogramos (kg), talla en metros (m), índice de masa corporal (IMC) en kg/m2 y perímetro de la cintura (medido en el punto medio entre la espina ilíaca anterosuperior y el margen costal inferior, con el sujeto en bipedestación y los brazos en posición anatómica; la medida se obtuvo con una cinta métrica graduada en centímetros).
Parámetros bioquímicosTras 12h de ayuno nocturno se procedió a la extracción de una muestra de sangre para la determinación de las concentraciones plasmáticas de los parámetros estudiados. La metodología fue la previamente descrita11. El colesterol total (CT) y los triglicéridos (TG) se determinaron por métodos enzimáticos. El colesterol HDL (cHDL) tras precipitación con ácido fosfotúngstico cloruro de magnesio. El colesterol LDL (cLDL) fue calculado por la fórmula de Friedewald. La determinación de glucosa se realizó por método enzimático. La presencia de RI se definió como un valor de insulina plasmática >14μU/ml12.
Los niveles de IL-18 en plasma se analizaron mediante la técnica ELISA con «Human IL-18 ELISA Kit» (Medical & BiologicalLaboratoriesCo. Ltd.) y fueron cuantificados posteriormente por medición de absorbancia con el aparato GloMax®-Multi+ DetectionSystem (Promega).
Ecografía carotídeaLa exploración ecográfica se realizó mediante un equipo Siemens Sonoline G40. Se utilizó un transductor lineal de alta resolución de 8MHz de frecuencia. La prueba se realizó con los pacientes en posición de decúbito supino con la cabeza girada 45° hacia el lado contrario del lado explorado. Se examinaron 3 segmentos predeterminados de las arterias de ambos lados: carótida común (1cm proximal al bulbo carotídeo), bulbo carotídeo (1-2cm) y carótida interna (1cm distal a la bifurcación)13. Se realizaron 6 medidas a intervalos regulares de forma bilateral en 3 proyecciones diferentes (ACCD: 90, 120 y 150°; ACCI: 210, 240 y 270°). Para el análisis estadístico se utilizaron todas las mediciones. El grosor íntima media (GIM), definido como la distancia existente entre la interfaz luz carotídea-íntima y la interfaz media-adventicia de la pared distal, se determinó en sección longitudinal en la región previa a la bifurcación de la arteria carótida común (1cm).
Todas las exploraciones fueron realizadas por un único investigador entrenado en la realización de ecografías carotídeas y siguiendo siempre el mismo protocolo estandarizado previamente descrito. El coeficiente de variabilidad se estudió en 20 sujetos, y fue del 5,2% para el GIM medio de ambas carótidas comunes.
Selección de SNP y genotipadoLas muestras de sangre venosa fueron recogidas en tubos con EDTA para obtener ADN genómico. Este fue aislado a partir de células sanguíneas utilizando el sistema Chemagic (Chemagen, Baesweiler, Alemania). El ADN fue cuantificado y diluido hasta una concentración final de 100ng/μl.
Los SNP de IL-18 para el genotipado fueron seleccionados en base a una conjunción de diferentes parámetros: heterocigosidad (>10% para el alelo de menor frecuencia) en población caucásica, posición y espaciado a lo largo del gen y posible efecto funcional (http://www.ensembl.org/index.html). Cuatro de ellos fueron seleccionados finalmente: rs1834481, rs549908, rs2270297 y rs7559479. Los SNP fueron genotipados usando un ensayo de SNPlex (Applied Biosystems, Foster City, CA, EE.UU.) siguiendo las recomendaciones del fabricante.
Métodos estadísticosLas variables cuantitativas han sido expresadas como media±desviación estándar y las cualitativas como porcentajes o número total. Para la comparación de las variables cuantitativas entre grupos se ha utilizado el test t de Student, y la prueba de ANOVA (2 o más variables respectivamente) para las variables de distribución normal. Para las variables de distribución no normal se utilizaron el test de Mann-Whitney y el test de Kruskal-Wallis (2 o más variables, respectivamente). Para corregir factores de confusión en algunos estudios de comparación se ha utilizado el análisis por ANCOVA. Para la comparación de las variables cualitativas entre grupos se ha utilizado el test de Chicuadrado, o el test de Fisher cuando el número era inferior a 5. Las correlaciones bivariadas entre variables se estudiaron con la prueba de Pearson para variables con distribución normal y prueba de Spearman para variables sin distribución normal. Se consideró que las diferencias eran estadísticamente significativas si el valor de p era inferior a 0,05. Se utilizó el paquete estadístico SPSS para Windows versión 15.0 (SPSS, Chicago, IL, EE.UU.).
Las frecuencias de los alelos y los genotipos fueron calculadas para cada SNP utilizando SPSS y SNPstats (http://bioinfo.iconcologia.net/index.php)14. El equilibrio de Hardy-Weinberg (HWE) fue calculado mediante el test de Chicuadrado con un grado de libertad utilizando el software SNPstat. Los desequilibrios de ligamiento fueron calculados usando la estadística de R2. La asociación entre los polimorfismos y los niveles de IL-18 fue analizada usando un modelo de herencia codominante mediante spss y SNPstat. Para la comparación de las variables cuantitativas entre genotipos se ha utilizado la prueba de ANOVA. La edad y el sexo, como 2 potenciales factores de confusión, se utilizaron como covariables. Se consideró que las diferencias eran estadísticamente significativas si el valor de p era inferior a 0,05.
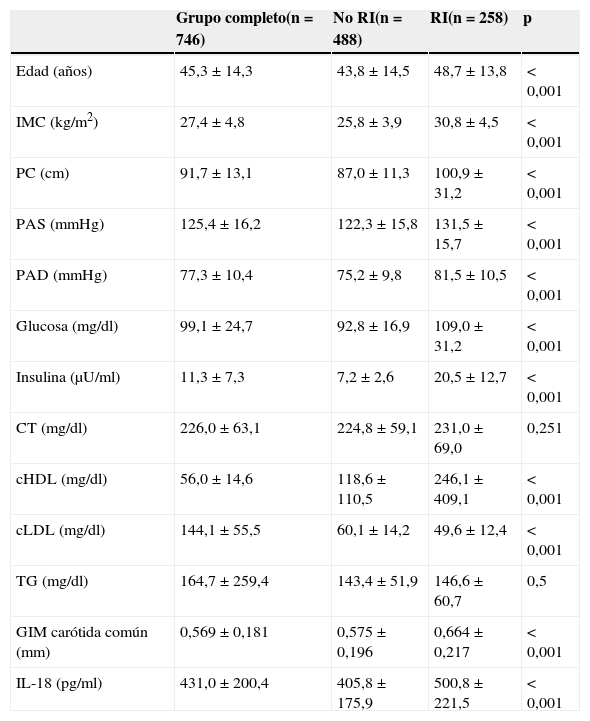
ResultadosIL-18 no siguió distribución normal, por lo que se emplearon para su análisis métodos no paramétricoas. En la tabla 1 se describen las características generales de la población estudiada. Se ha incluido a 746 individuos (48,52% hombres y 51,48% mujeres). Además, se muestran las características de los participantes en el estudio en función de la presencia o ausencia de RI. Encontramos diferencias significativas, lógicamente, en todos los parámetros relacionados con la presencia de RI. Los sujetos con niveles más elevados de IL-18 presentaron valores incrementados de GIM carotídeo. Además, los sujetos con RI presentaron niveles más elevados de IL-18 (405,8±175,9 vs 488,3±221,5pg/ml, p<0,001).
Características clínicas y bioquímicas de la población estudiada y estudio en función de la presencia o ausencia de resistencia a la insulina
| Grupo completo(n=746) | No RI(n=488) | RI(n=258) | p | |
|---|---|---|---|---|
| Edad (años) | 45,3±14,3 | 43,8±14,5 | 48,7±13,8 | < 0,001 |
| IMC (kg/m2) | 27,4±4,8 | 25,8±3,9 | 30,8±4,5 | < 0,001 |
| PC (cm) | 91,7±13,1 | 87,0±11,3 | 100,9±31,2 | < 0,001 |
| PAS (mmHg) | 125,4±16,2 | 122,3±15,8 | 131,5±15,7 | < 0,001 |
| PAD (mmHg) | 77,3±10,4 | 75,2±9,8 | 81,5±10,5 | < 0,001 |
| Glucosa (mg/dl) | 99,1±24,7 | 92,8±16,9 | 109,0±31,2 | < 0,001 |
| Insulina (μU/ml) | 11,3±7,3 | 7,2±2,6 | 20,5±12,7 | < 0,001 |
| CT (mg/dl) | 226,0±63,1 | 224,8±59,1 | 231,0±69,0 | 0,251 |
| cHDL (mg/dl) | 56,0±14,6 | 118,6±110,5 | 246,1±409,1 | < 0,001 |
| cLDL (mg/dl) | 144,1±55,5 | 60,1±14,2 | 49,6±12,4 | < 0,001 |
| TG (mg/dl) | 164,7±259,4 | 143,4±51,9 | 146,6±60,7 | 0,5 |
| GIM carótida común (mm) | 0,569±0,181 | 0,575±0,196 | 0,664±0,217 | < 0,001 |
| IL-18 (pg/ml) | 431,0±200,4 | 405,8±175,9 | 500,8±221,5 | < 0,001 |
cHDL: colesterol HDL; cLDL: colesterol LDL; CT: colesterol total; GIM: grosor íntima-media; IL-18: interleucina 18; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PC: perímetro de cintura; RI: resistencia a la insulina; TG: triglicéridos.
Los datos se presentan como media±desviación estándar. p valor entre grupos con y sin resistencia a la insulina.
Se consideró la presencia de resistencia a la insulina si el nivel de insulina plasmática era >14μU/ml.
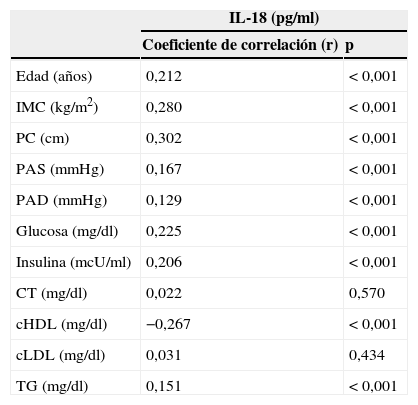
Al analizar la correlación de Pearson entre los niveles plasmáticos de IL-18 y los parámetros estudiados observamos asociación significativa con los niveles de insulina, así como con otros factores de riesgo cardiovascular, como todos los incluidos en la definición de síndrome metabólico (tabla 2).
Correlación de Pearson entre los niveles plasmáticos de IL-18 y los parámetros analizados para el grupo completo
| IL-18 (pg/ml) | ||
|---|---|---|
| Coeficiente de correlación (r) | p | |
| Edad (años) | 0,212 | < 0,001 |
| IMC (kg/m2) | 0,280 | < 0,001 |
| PC (cm) | 0,302 | < 0,001 |
| PAS (mmHg) | 0,167 | < 0,001 |
| PAD (mmHg) | 0,129 | < 0,001 |
| Glucosa (mg/dl) | 0,225 | < 0,001 |
| Insulina (mcU/ml) | 0,206 | < 0,001 |
| CT (mg/dl) | 0,022 | 0,570 |
| cHDL (mg/dl) | −0,267 | < 0,001 |
| cLDL (mg/dl) | 0,031 | 0,434 |
| TG (mg/dl) | 0,151 | < 0,001 |
CHDL: colesterol HDL; CLDL: colesterol LDL; CT: colesterol total; IL-18: interleucina 18; IMC: índice de masa corporal; PAD: presión arterial diastólica; PAS: presión arterial sistólica; PC: perímetro de cintura; TG: triglicéridos.
Los datos se presentan como media±desviación estándar.
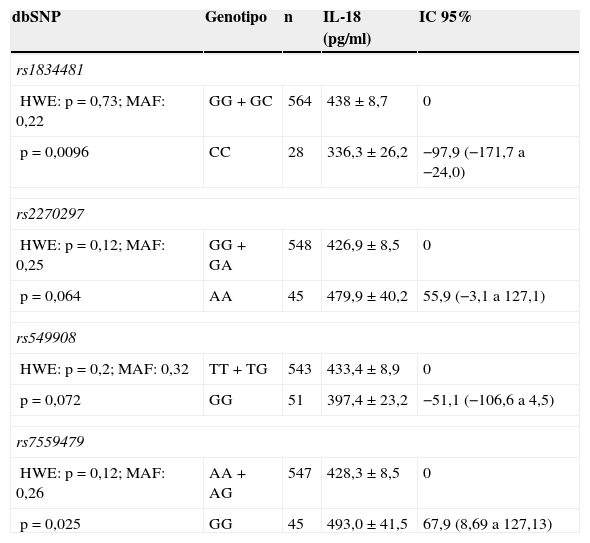
Por último, en la tabla 3 se recoge la influencia de diferentes SNP sobre los niveles plasmáticos de IL-18. El HWE se mantuvo para todos los polimorfismos analizados. Los portadores en homocigosis del alelo menor de rs1834481 presentaron niveles plasmáticos significativamente inferiores de IL-18, mientras que los portadores en homocigosis del alelo menor de rs7559479 presentaron niveles plasmáticos significativamente superiores de IL-18.
Asociación entre los niveles plasmáticos de IL-18 y los SNP del gen de IL-18 ajustado por edad y género
| dbSNP | Genotipo | n | IL-18 (pg/ml) | IC 95% |
|---|---|---|---|---|
| rs1834481 | ||||
| HWE: p=0,73; MAF: 0,22 | GG+GC | 564 | 438±8,7 | 0 |
| p=0,0096 | CC | 28 | 336,3±26,2 | −97,9 (−171,7 a −24,0) |
| rs2270297 | ||||
| HWE: p=0,12; MAF: 0,25 | GG+GA | 548 | 426,9±8,5 | 0 |
| p=0,064 | AA | 45 | 479,9±40,2 | 55,9 (−3,1 a 127,1) |
| rs549908 | ||||
| HWE: p=0,2; MAF: 0,32 | TT+TG | 543 | 433,4±8,9 | 0 |
| p=0,072 | GG | 51 | 397,4±23,2 | −51,1 (−106,6 a 4,5) |
| rs7559479 | ||||
| HWE: p=0,12; MAF: 0,26 | AA+AG | 547 | 428,3±8,5 | 0 |
| p=0,025 | GG | 45 | 493,0±41,5 | 67,9 (8,69 a 127,13) |
HWE: Hardy-Weinberg equilibrium; IL-18: interleucina 18; MAF: minor allele frequency; SNP: single-nucleotide polymorphism.
Los datos se presentan como media±desviación estándar.
En este estudio poblacional se ha observado que los niveles circulantes de IL-18 se asocian de forma significativa con la presencia de RI. Además, dichos niveles estaban modulados genéticamente por variaciones en el gen de IL-18.
La presencia de RI y síndrome metabólico son factores de riesgo cardiovascular independientes15. Diferentes moléculas inflamatorias han sido asociadas con el desarrollo de enfermedad cardiovascular (ECV). En este sentido, IL-18 tiene interés dado que es una citoquina proinflamatoria que desempeña un importante papel en la cascada inflamatoria16. En una población mediterránea los sujetos con RI presentan niveles significativamente superiores de IL-18 comparados con sujetos sin alteraciones en el metabolismo de los hidratos de carbono. Los resultados encontrados son consistentes con los aportados previamente por otros autores, que han demostrado que IL-18 está estrechamente relacionada con la presencia de RI y síndrome metabólico17,18. Así mismo, en modelos animales se ha demostrado que la sobreexpresión de IL-18 empeoraba la situación de RI19, además de predecir el desarrollo de diabetes tipo220. En la misma línea, estudios previos sugieren que los cambios en los niveles plasmáticos de IL-18 se relacionan con la presencia de RI, y no con los cambios en la situación de obesidad per se, dado que los niveles de IL-18 no se vieron afectados por la pérdida de peso21. En este sentido, IL-18 se ha implicado en el desarrollo de RI. El incremento de ácidos grasos libres presente en los estados de hiperinsulinemia induce la liberación de citoquinas proinflamatorias, entre las que se incluye IL-18, y estas citoquinas, a su vez, producen una alteración de la sensibilidad a la insulina22.
Estudios previos demostraron que IL-18 era un predictor independiente de enfermedad cardiovascular en sujetos con síndrome metabólico23. En el presente estudio, los sujetos con niveles más elevados de IL-18 presentan valores incrementados de GIM carotídeo (tabla 1). En esta línea, se ha sugerido que IL-18 tiene un papel proaterogénico24,25. Modelos animales deficientes en IL-18 mostraron una reducción del desarrollo de arteriosclerosis26. Además, en humanos, los niveles circulantes de IL-18 se han asociado con el riesgo de enfermedad coronaria de forma independiente27-29. De hecho, la expresión de IL-18 y de su receptor está incrementada en arterias arterioscleróticas, comparadas con segmentos arteriales normales30,31.
Como hemos comentado previamente, los niveles de IL-18 se asocian con el desarrollo de enfermedad cardiovascular. Sin embargo, los niveles circulantes son muy variables de unos individuos a otros. Diferentes polimorfismos en el gen de IL-18 se han asociado con los niveles circulantes de esta citoquina32-34. En nuestra población el genotipo CC del SNP rs1834481 se asocia con menores niveles plasmáticos de IL-18. Por el contrario, el genotipo GG del SNP rs7559479 se asocia con niveles más elevados (tabla 3). Estudios previos han asociado la presencia del alelo menor del SNP rs1834481 con menores niveles de IL-1835. Sin embargo, no existen estudios previos relacionando variaciones en el SNP rs7559479 con las concentraciones de IL-18.
En conclusión, este estudio llevado a cabo en población mediterránea apoya la hipótesis de que los valores plasmáticos de IL-18 se relacionan con la presencia de RI y otros factores de riesgo cardiovascular, como son los componentes del síndrome metabólico. Además, existen variaciones genéticas que explicarían la variabilidad existente en los niveles plasmáticos de las moléculas inflamatorias, como es IL-18. Sin embargo, este estudio presenta una serie de limitaciones. Se trata de un estudio transversal, y por tanto, no podemos establecer relaciones de causalidad. Por otro lado, aunque se ha analizado en un número considerable de individuos, no se han replicado los resultados obtenidos en otra población. No obstante, nuestros resultados apoyan la influencia de las moléculas inflamatorias como factor de riesgo cardiovascular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
FinanciaciónCIBERDEM es una iniciativa del Instituto de Salud CarlosIII de Madrid. Este trabajo se ha realizado gracias a una ayuda concedida por la Conselleria de Educación-Generalitat Valenciana a Sergio Martínez-Hervás (GVPRE/2008/221).
Este trabajo ha sido posible gracias a una ayuda recibida de la Sociedad Española de Arteriosclerosis. Beca FEA-SEA 2010 Investigación clínico epidemiológica.
AutoríaTodos los autores cumplen los requisitos exigidos por la revista para ser coautores en el artículo.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.