La apolipoproteína (apo) A-II es la segunda proteína cuantitativamente más importante de las HDL; sin embargo su función es poco conocida. Los estudios realizados en humanos y ratones modificados genéticamente han demostrado un efecto de la apoA-II sobre el metabolismo de los triglicéridos. El objetivo principal de este estudio es analizar la relación entre la apoA-II y la composición apolipoproteica de las HDL así como la capacidad de estas lipoproteínas de modular la actividad de la enzima lipoproteína lipasa (LPL) y, por tanto, la concentración de triglicéridos.
MétodosSe recogieron muestras de sangre en 32 voluntarios sanos tras 11h de ayuno. Se recogieron los datos antropométricos y se determinaron los parámetros lipídicos y apolipoproteicos. Las HDL aisladas por ultracentrifugación fueron incubadas con una emulsión radioactiva de triglicéridos y LPL bovina. En 14 de los voluntarios, se obtuvo una muestra adicional de sangre, 3h después de un desayuno.
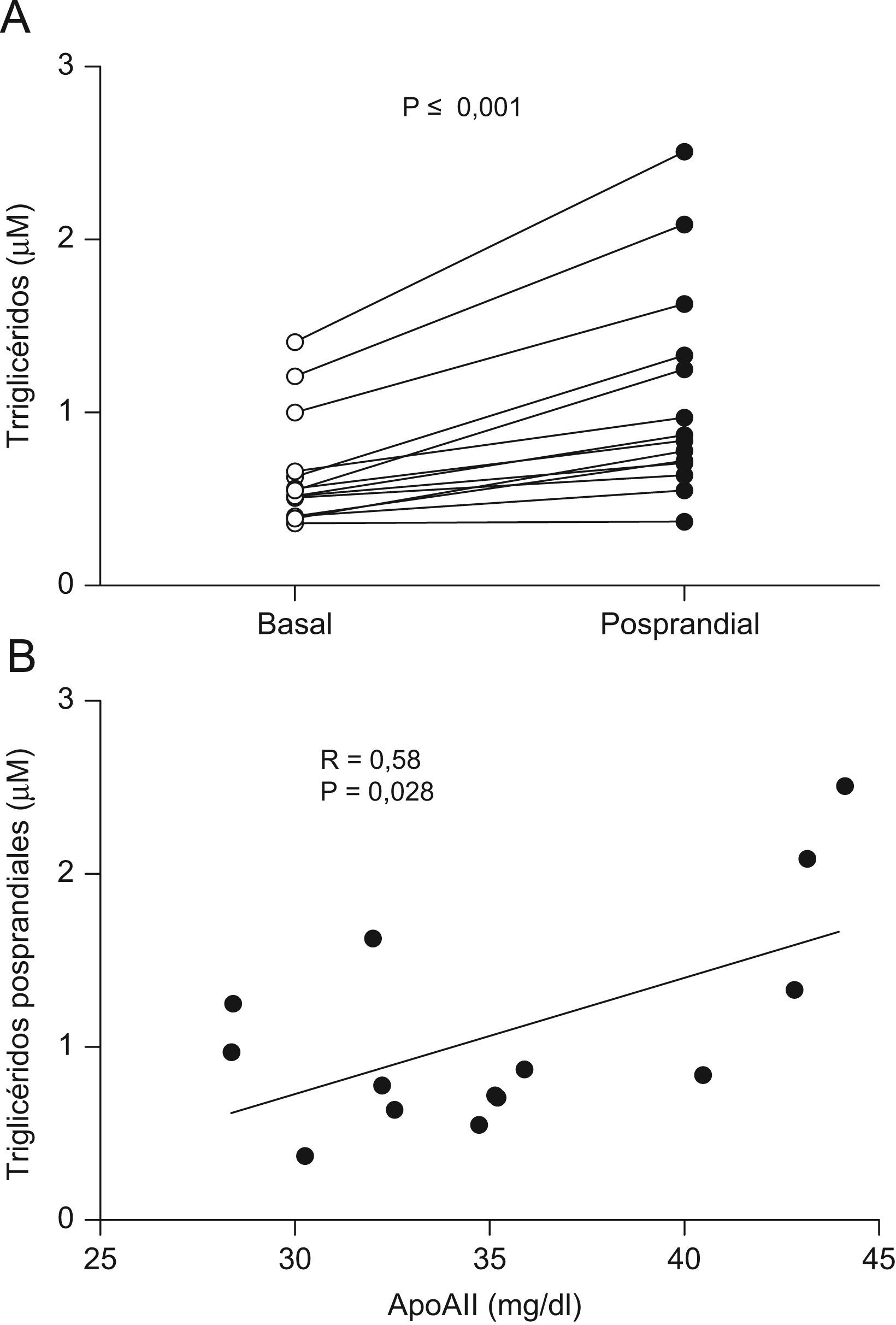
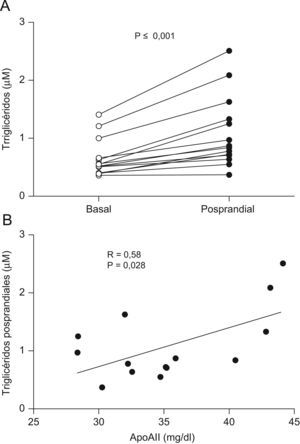
ResultadosLa concentración de apoA-II correlacionó de forma positiva con la concentración de triglicéridos (R=0,55, p<0,05) y de forma inversa con el cociente apoC-II+apoE/apoC-III en HDL (R=−0,43, p<0,05). La apoA-II también correlacionó inversamente con la capacidad de las HDL de modular la actividad LPL (R=−0,35, p<0,05). Por ultimo, la concentración de apoA-II correlacionó positivamente con los triglicéridos postprandiales (R=0,58, p<0,05).
ConclusiónEstos resultados sugieren que la apoA-II en HDL tiene un papel importante en la regulación del metabolismo de los triglicéridos y sugieren que, en parte, ello es debido a la alteración en la capacidad de las HDL de modular la actividad LPL.
Apolipoprotein (apo)A-II is the second most abundant HDL protein but its function remains largely unknown. Studies in humans and genetically-modified mice have demonstrated a role for apoA-II in triglyceride metabolism. The main objective of this study was to evaluate the relationship between apoA-II and HDL apolipoprotein composition, as well as HDL-mediated lipoprotein lipase (LPL) coactivation and plasma triglyceride concentration.
MethodsEleven-hour fasting blood samples were taken from 32 healthy volunteers. Anthropometric data and lipid and apolipoprotein parameters were analyzed. HDL isolated by ultracentrifugation was incubated in the presence of a triolein-based emulsion and bovine LPL. In 14 of these volunteers, an additional blood sample was taken 3h after breakfast.
ResultsApoA-II concentration was directly correlated with plasma triglycerides (R=0.55, p<0.05) and inversely correlated with the HDL-apoC-II+apoE/apoC-III ratio (R=−0.43, p<0.05). ApoA-II was also inversely correlated with HDL-mediated LPL coactivation (R=−0.35, p<0.05). ApoA-II concentration was directly correlated with plasma triglycerides 3h after the fat-loading test (R=0.58, p<0.05).
ConclusionThese results show that HDL-apoA-II levels play a crucial role in triglyceride catabolism and suggest that, at least in part, this is due to modulation of LPL activity.
La función de la apolipoproteína (apo) A-II en el metabolismo lipoproteico y su relación con la arteriosclerosis es poco conocida, a pesar de ser la segunda proteína cuantitativamente más importante de las lipoproteínas de alta densidad (HDL)1–4. Los estudios realizados en ratones modificados genéticamente indican que es muy probable que la apoA-II tenga un papel en la regulación del metabolismo de los triglicéridos, ya que los ratones transgénicos de apoA-II murídica y humana presentan un incremento plasmático de ácidos grasos libres (AGL) y del contenido de colesterol y triglicéridos de las lipoproteínas que contienen apoB5–17. Ratones deficientes en apoA-II presentan una disminución de AGL y triglicéridos, hipersensibilidad a la insulina y un catabolismo acelerado de partículas ricas en triglicéridos18. Por contra, la sobreexpresión de apoA-II se ha relacionado con obesidad y resistencia a la insulina15 y una producción aumentada de VLDL12,13,19. Sin embargo, no se ha aclarado completamente si la variabilidad en apoA-II causa un aumento en la síntesis de triglicéridos, una reducción en su catabolismo o ambas cosas10–13,17–20.
Estudios en humanos también han demostrado una relación entre apoA-II y la concentración de AGL y triglicéridos21–23. Varios estudios poblacionales han evaluado la relación entre el polimorfismo −265T>C situado en el promotor del gen de la apoA-II, el metabolismo postprandial de los triglicéridos y la obesidad visceral24–27. Van’t Hooft et al24 encontraron que los portadores del alelo −265C tenían concentraciones reducidas de apoA-II y de apoB100 en las lipoproteínas ricas en triglicéridos. Dos estudios posteriores independientes han demostrado que la concentración de triglicéridos y de VLDL>60nm en situación postprandial estaba disminuida en los portadores −265C26,27, aunque en estos casos la concentración de apoA-II no fue determinada. Algunos de estos estudios han analizado la relación existente entre este polimorfismo y las medidas antropométricas con resultados controvertidos24–26. En el primero de ellos, los portadores de −265C presentaban menos grasa visceral24; sin embargo, en los otros dos estudios se encontró que −265C estaba asociado con un mayor riesgo de obesidad25,26. Más recientemente, un estudio realizado en tres poblaciones independientes de EUA ha demostrado que los portadores de −265C que ingerían una elevada cantidad de grasas saturadas presentaban un mayor índice de masa corporal y obesidad comparados con los portadores de −265T28 Cabe destacar que la región 1q21–24 (la apoA-II está localizada en 1q23) presenta ligamiento genético con la diabetes mellitus tipo 2 (DM2)29–33. Además, en familias holandesas con hiperlipemia familiar combinada (HFC), las concentraciones plasmáticas de apoA-II estaban incrementadas en pacientes con respecto de los individuos normolipémicos22. En este sentido, dos estudios recientes han identificado ligamiento genético entre el factor de transcripción USF1 y la HFC en familias finlandesas y asociación con la concentración de glucosa y parámetros lipídicos en un estudio multicéntrico con individuos sanos europeos34,35. Debido a que el USF1 regula la expresión de apoA-II, estos datos sugieren un papel modulador de la apoA-II en la HFC y DM21,20.
El objetivo de este estudio es evaluar la relación existente entre la apoA-II, los triglicéridos y la composición apolipoproteica de las HDL en sujetos humanos sanos, así como la capacidad de sus HDL para activar la hidrólisis de triglicéridos de las partículas ricas en triglicéridos mediada por la lipoproteína lipasa (LPL).
Materiales y métodosEstudios en sujetos humanosSe seleccionaron 32 voluntarios (25 mujeres y 7 hombres) sanos y homocigotos para el alelo E3. A todos ellos se les realizó una analítica en el laboratorio de bioquímica del hospital y rellenaron un cuestionario para descartar del estudio aquellos individuos con diabetes, enfermedad renal o hepática, historia familiar de enfermedad cardiovascular prematura o que tomaran medicamentos que pudieran afectar la concentración de las diferentes lipoproteínas. Se recogió la sangre por venopunción tras un ayuno de 11h en tubos EDTA-citrato. El estudio fue aprobado por el comité ético del Hospital de la Santa Creu i Sant Pau de Barcelona y ha cumplido las normas éticas de la Declaración de Helsinki de 1975, con la revisión de octubre de 2000.
Determinaciones bioquímicasEl genotipo de apoE fue determinado mediante un ensayo validado (Assays-on-Demand) en un detector Applied Biosystems Prism 7000 para PCR a tiempo real (Applied Biosystems). Se determinó en cada individuo las concentraciones plasmáticas de colesterol, triglicéridos, AGL, apoB, el colesterol de HDL (cHDL), apoA-I, apoA-II, apoE, apoCII y apoCIII a partir de métodos comerciales adaptados a un autoanalizador BM/HITACHI 911 (Roche Diagnostics, Wako y Kamiya Biomedical Company). Las HDL se aislaron mediante ultracentrifugación secuencial y se determinó la composición lipídica y apolipoproteica de las HDL con los métodos comerciales descritos anteriormente36.
Ensayos de activación LPL mediado por las HDLLas HDL aisladas por ultracentrifugación se incubaron con una emulsión de [3H]-triglicéridos marcada radiactivamente en un volumen final de 200μl de una solución que contiene 50mM MgCl2, 0,05% fatty acid-free-BSA y 25mM PIPES, pH 7,5. La concentración final de HDL fue en todos los casos de 0,5μg/μl de proteína. La emulsión se incubó a 37°C durante 60min para inducir la transferencia de apoCs y, posteriormente, se incubó con 0,2U de LPL bovina (Sigma) durante 60min más a 27°C. La actividad LPL se determinó tal y como se ha descrito anteriormente12.
Desayuno graso y toma de muestras posprandialesA 14 de los voluntarios (9 mujeres y 5 hombres), se les extrajo sangre como muestra basal en ayunas de 11h y, posteriormente, tomaron un desayuno conteniendo 1g de grasa por kg de peso en un plazo inferior a 20min. La comida contenía un 65% de su energía en forma de grasa, un 15% de carbohidratos y un 20% de proteína. Permanecieron en reposo 3h pudiendo beber agua. A las 3h, se les tomó una muestra de sangre posprandial y se determinaron las concentraciones de lípidos y apolipoproteínas tal y como se ha descrito en el apartado anterior.
Métodos estadísticosEn primer lugar, se calcularon los datos descriptivos de los datos antropométricos y de las variables bioquímicas así como las pruebas de normalidad con un test de Kolmogorov-Smirnov. La asociación entre la apoA-II y otras variables lipoproteicas y antropométricas se determinó con el test de correlación de Pearson. La influencia de la sobrecarga de grasa sobre las distintas variables bioquímicas se determinó con un test t de Student para datos apareados. Se utilizó el programa GraphPad Prism version 4.00 for Windows (GraphPad Software, San Diego, CA). Se consideraron estadísticamente significativos a los valores de p<0,05.
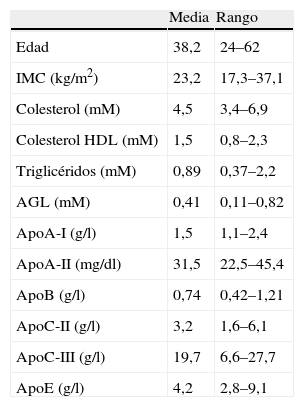
ResultadosLos datos mostrados en la tabla 1 representan los datos bioquímicos y antropométricos en ayunas de los voluntarios del estudio. Todas las variables siguieron una distribución normal. Los datos analíticos demostraron que los varones tenían el cHDL y la concentración plasmática de apoA-I más bajos (1,2±0,08 vs 1,6±0,07 y 1,3±0,04 vs 1,5±0,05, respectivamente, p<0,05), y el IMC y los triglicéridos más altos (26,6±1,6 vs 22,3±0,8 y 1,31±0,25 vs 0,78±0,07, respectivamente, p<0,05). Sin embargo, no había diferencias significativas en el resto de variables (tabla 1). Los datos de las tablas 2 y 3 no mostraron diferencias tanto si los análisis de correlación se realizaban en mujeres, como en mujeres y hombres en conjunto. Por ello, los datos mostrados a lo largo de todo el manuscrito incluyen a todos los varones y mujeres del estudio.
Características antropométricas y bioquímicas en ayunas de los 32 voluntarios (25 mujeres y 7 varones)
| Media | Rango | |
| Edad | 38,2 | 24–62 |
| IMC (kg/m2) | 23,2 | 17,3–37,1 |
| Colesterol (mM) | 4,5 | 3,4–6,9 |
| Colesterol HDL (mM) | 1,5 | 0,8–2,3 |
| Triglicéridos (mM) | 0,89 | 0,37–2,2 |
| AGL (mM) | 0,41 | 0,11–0,82 |
| ApoA-I (g/l) | 1,5 | 1,1–2,4 |
| ApoA-II (mg/dl) | 31,5 | 22,5–45,4 |
| ApoB (g/l) | 0,74 | 0,42–1,21 |
| ApoC-II (g/l) | 3,2 | 1,6–6,1 |
| ApoC-III (g/l) | 19,7 | 6,6–27,7 |
| ApoE (g/l) | 4,2 | 2,8–9,1 |
AGL: ácidos grasos libres; IMC: índice de masa corporal.
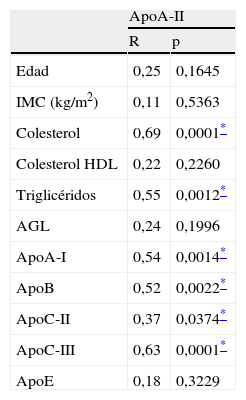
Análisis de correlación de la apoA-II con el resto de parámetros de la tabla 1
| ApoA-II | ||
| R | p | |
| Edad | 0,25 | 0,1645 |
| IMC (kg/m2) | 0,11 | 0,5363 |
| Colesterol | 0,69 | 0,0001* |
| Colesterol HDL | 0,22 | 0,2260 |
| Triglicéridos | 0,55 | 0,0012* |
| AGL | 0,24 | 0,1996 |
| ApoA-I | 0,54 | 0,0014* |
| ApoB | 0,52 | 0,0022* |
| ApoC-II | 0,37 | 0,0374* |
| ApoC-III | 0,63 | 0,0001* |
| ApoE | 0,18 | 0,3229 |
R: coeficiente de correlación de Pearson.
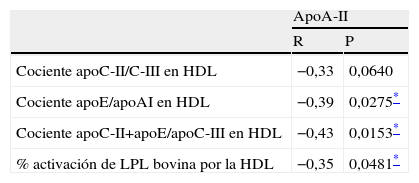
Análisis de correlación de la apoA-II con la relación de apoC-II, apoC-III y apoE en las HDL y la capacidad de estas lipoproteínas para activar la LPL
| ApoA-II | ||
| R | P | |
| Cociente apoC-II/C-III en HDL | −0,33 | 0,0640 |
| Cociente apoE/apoAI en HDL | −0,39 | 0,0275* |
| Cociente apoC-II+apoE/apoC-III en HDL | −0,43 | 0,0153* |
| % activación de LPL bovina por la HDL | −0,35 | 0,0481* |
R: coeficiente de correlación de Pearson.
Con respecto al análisis de correlación de la apoA-II con las variables antropométricas y plasmáticas (tabla 2), los valores de apoA-II correlacionaron con los valores de colesterol, triglicéridos, apoA-I, apoB, apoC-II y apoC-III.
La HDL de cada uno de los individuos se separó por ultracentrifugación y se analizó la correlación entre la apoA-II y la relación de apoC y apoE en estas HDL así como la capacidad de estas lipoproteínas de alterar la actividad de la LPL. La apoA-II correlacionaba inversamente con el cociente apoE/apoA-I y apoC-II+apoE/apoC-III de las HDL y con la capacidad de estas partículas para estimular la acción de la LPL sobre la emulsión radioactiva de triglicéridos (tabla 3).
Los valores posprandiales de los triglicéridos en 14 de estos voluntarios fueron estadísticamente superiores a los basales (fig. 1A). La apoA-II correlacionó positivamente con las concentraciones plasmáticas de colesterol (R=0,82, p=0,0003), triglicéridos (R=0,58, p=0,028; fig. 1B) y apoB (R=0,73, p=0,0032) en situación posprandial. Sin embargo, la concentración de apoA-II no se correlacionó con el cHDL, AGL y apoA-I. Tampoco hubo correlación significativa entre estos 3 parámetros y la concentración de triglicéridos posprandial.
DiscusiónExisten muchos trabajos en la literatura que indican que la apoA-II regula la concentración de triglicéridos en ratones1–4,17,19 y, también, en humanos1,22–24,26,27. Sin embargo, el mecanismo preciso por el cual la apoA-II influye en el metabolismo de los triglicéridos no está claramente definido.
En nuestro estudio, la variabilidad en apoA-II correlacionó con la concentración de triglicéridos en individuos sin patologías previas y con valores de apoA-II humana que oscilaban entre 22,5 y 45,4mg/dl. Un estudio reciente ha demostrado que en una línea de ratones transgénicos de apoA-II humana, la hipertrigliceridemia posprandial era debida, en parte, a un incremento severo en la concentración plasmática de apoA-II humana y del contenido de apoA-II de los quilomicrones que actuaba directamente como inhibidor de LPL17. Esta observación tiene algunos precedentes en estudios realizados con humanos37,38. En cambio, la concentración de apoA-II en los voluntarios de este estudio no se alteró en la situación posprandial y la concentración de apoA-II en quilomicrones fue inferior a 0,1mg/dl en todos los casos y no correlacionó con los triglicéridos posprandiales. Así, nuestros datos sugieren que un incremento notable de apoA-II en quilomicrones y la consecuente inhibición de LPL no parece ser un mecanismo fisiológico en humanos. Sin embargo, no podemos descartar que la apoA-II pueda inhibir directamente a la LPL en determinadas situaciones patológicas como en la enfermedad de Tangier y en las hiperlipemias de tipo V37,38.
Nuestros datos indican que la apoA-II puede influir directamente en la composición de las HDL, alterar la transferencia de determinadas apolipoproteínas a los quilomicrones e influir en la capacidad lipolítica de la LPL in vitro. Así, los individuos con elevadas concentraciones de apoA-II tenían un cociente apoC-II+apoE/apoC-III disminuido en HDL y unas HDL con menor capacidad de activar la LPL frente a una emusión artificial de triglicéridos (tabla 3). ApoC-II es un conocido activador de LPL, mientras que apoC-III es un inhibidor39. ApoE puede también ejercer efectos sobre la LPL, aunque su función principal está relacionada con la unión a receptores de la lipoproteínas ricas en triglicéridos40. De hecho, una parte importante de apoC-II, apoC-III y apoE son transferidos desde HDL a los quilomicrones en situación posprandial y, ello, puede afectar al catabolismo de estas lipoproteínas y, consecuentemente, la concentración de triglicéridos41–43. Parece así concebible que una alteración en la concentración de estas apolipoproteínas en HDL y una transferencia anómala a los quilomicrones pueda alterar su catabolismo en individuos con elevadas concentraciones de apoA-II. Otra posibilidad, consistente con estudios previos, es que la apoA-II humana desplace otras proteínas de la superficie de las HDL, como la apoA-I, la paraxonasa, apoC-II, C-III y apoE44–49. El desplazamiento de algunas de estas proteínas, especialmente la apoC-II, de HDL podría explicar, en parte, la asociación de apoA-II con los triglicéridos y la capacidad anómala de estas HDL para activar la LPL. En este contexto, la disminución relativa de HDL2 que presentan los hipertrigliceridémicos47 podría tener un papel activo en la fisiopatología de estos individuos reduciendo la actividad LPL.
Una limitación importante de este estudio es que no se realizó un análisis de la curva posprandial de triglicéridos en cada individuo y la determinación de triglicéridos en situación posprandial solo se realizó 3h después de la ingestión del desayuno. Todo ello podría subestimar la correlación de la apoA-II con los triglicéridos posprandiales en estos individuos.
En conclusión, nuestro estudio demuestra que un exceso de apoA-II en HDL puede contribuir a la hipertrigliceridemia mediante la alteración de la composición de las HDL, probablemente alterando la transferencia de las apoC-II, apoC-III y apoE y, por ello, la actividad de la LPL.
Contribución autoresJJ analizó los datos del estudio y participó en su interpretación. CMG y DS realizaron los análisis bioquímicos. JCEG y FBV realizaron el diseño del estudio y participaron en su interpretación. Todos los autores colaboraron en la redacción del borrador del artículo y revisión crítica de su contenido y dieron su aprobación final de la versión a publicar.
FinanciaciónEste estudio ha sido financiado gracias a una beca de la Sociedad/Fundación Española de Arteriosclerosis para Investigación Básica (2008). CIBER de Diabetes y Enfermedades Metabólicas Asociadas es un proyecto del Instituto de Salud Carlos III.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses