El objetivo del estudio fue estimar la prevalencia de enfermedad arterial periférica (EAP) no diagnosticada, mediante el índice tobillo-brazo (ITB), en pacientes diabéticos tipo 2 de una zona urbana seguidos en Atención Primaria (AP) y los factores asociados a la misma.
MétodosEstudio descriptivo transversal (de prevalencia). Muestreo aleatorio sistemático de pacientes diabéticos tipo 2, entre 50–80 años, seguidos en AP. Nuestra variable dependiente fue la presencia de EAP diagnosticada mediante un ITB<0,9. Variables independientes: demográficas, clínicas y de laboratorio. Para determinar las variables asociadas a un ITB patológico se utilizó la regresión logística binaria por pasos hacia adelante.
ResultadosMuestra de 456 pacientes, de los que 243 (53%) eran hombres, con una edad media de 61±6 años. Presentaron ITB<0,9: 126 pacientes (27,6%), ITB entre 0,9 y 1,3: 310 pacientes (68%) y un ITB>1,3: 20 pacientes (4,4%). Mediante análisis multivariante las variables relacionadas con un ITB<0,9 fueron el ser o haber sido fumador, los años de evolución de la diabetes, el número de plaquetas y la hipertrigliceridemia, mientras que con un ITB>1,3 fueron el perímetro de cintura y las complicaciones microvasculares.
ConclusionesLa prevalencia de enfermedad arterial periférica es elevada en diabéticos tipo 2, consistente con lo publicado. Esta alta prevalencia de ITB alterado refuerza la recomendación de realizar el índice tobillo-brazo a todos los diabéticos tipo 2 mayores de 50 años valorados y seguidos en AP.
The aim of our study was to estimate the prevalence and associated factors of occult peripheral arterial disease (PAD) assessed by the ankle-brachial index (ABI) in subjects with type 2 diabetes mellitus followed up in a single urban Primary Care Center.
MethodsThis is a cross-sectional study involving subjects who were sampled randomly from patients with type 2 diabetes and aged 50 to 80 years-old. The dependent variable was the presence of PAD, assessed by an ABI below 0.9. Demographic, clinical and laboratory parameters were also recorded. A forward, stepwise, logistic binary regression was built in order to examine variables associated with abnormal ABI.
ResultsFour-hundred and fifty-six patients were included; they were 61±6 years-old, of which 243 (53%) were men. An ABI<0.9 was found in 126 patients (27.6%), 310 (68%) patients had an ABI 0.9–1.3 and only 20 patients (4.4%) had and ABI higher than 1.3. Using multivariate analyses, past or present smoking, duration of diabetes, platelet count and hypertriglyceridemia, were independently associated to PAD; on the contrary, only waist cincumference and the presence of microvascular disease were associated to an ABI higher than 1.3.
ConclusionThe prevalence of PAD was high and consistent with the literature, thus reinforcing the measurement of ABI for all patients with type 2 diabetes followed up in primary care. Smoking, duration of diabetes, platelet count and hypertriglyceridemia were independently associated to a low ABI.
La enfermedad arterial periférica (EAP) suele caracterizarse por oclusión de la luz arterial de las extremidades inferiores y aparece dentro del contexto de la aterosclerosis1. El riesgo de enfermedad aterosclerótica aumenta notablemente en los diabéticos y los estudios epidemiológicos han confirmado la existencia de una asociación entre la diabetes y el aumento de la prevalencia de la EAP2,3. El diagnóstico clínico de la enfermedad suele realizarse en estadios avanzados con síntomas de claudicación intermitente e incluso con la aparición de ulceraciones. La utilización de la técnica del índice tobillo-brazo (ITB) permite un diagnóstico precoz de la EAP. Las principales razones para diagnosticar una EAP en individuos con diabetes son las de instaurar tratamientos que reduzcan el riesgo de episodios aterotrombóticos, mejorar la calidad de vida y reducir la discapacidad. Un diagnóstico de EAP indica la presencia de una aterosclerosis sistémica que comporta un riesgo cardiovascular adicional en el paciente con diabetes, y nos lleva a realizar un tratamiento intensivo de los factores de riesgo vascular en este grupo de alto riesgo4–6.
La prevalencia de la EAP es diferente según las poblaciones analizadas: población general, pacientes con alto riesgo vascular, población laboral7–10. La determinación exacta de la prevalencia de la EAP en los diabéticos se ve dificultada por diversos factores: frecuentemente es asintomática, la neuropatía periférica puede modificar la percepción del dolor, los signos clínicos (abolición de los pulsos periféricos y presencia de claudicación) son indicadores diagnósticos poco precisos. El tiempo de evolución y gravedad de la diabetes están correlacionados con la incidencia y grado de afectación de la EAP11,12. La prevalencia de EAP en diabéticos en España oscila entre 11–32% según los diversos estudios13–15, ya que la metodología no es uniforme: consultas externas hospitalarias, unidades especializadas hospitalarias, AP, población consultante, pacientes con síndrome metabólico, diferentes edades, etc.
El objetivo de nuestro estudio es estimar la prevalencia de enfermedad arterial periférica no diagnosticada, mediante el índice tobillo-brazo, en pacientes diabéticos tipo 2 de una zona urbana seguidos en AP y estudiar los factores asociados a la misma.
Pacientes y métodosEstudio descriptivo transversal (de prevalencia), con una segunda fase analítica. Realizado en el ámbito de la AP, en el Centro de Salud de Ciudad Jardín (Málaga), que atiende a una población de 38.000 habitantes. Población urbana con un nivel socioeconómico medio-bajo. En el CS trabajan 20 médicos de familia, 5 pediatras y 20 enfermeros. El estudio se realizó entre los meses de septiembre de 2008 y marzo de 2009. Se realizó un muestreo aleatorio sistemático entre los pacientes diabéticos mayores de 50 años incluidos en el proceso de diabetes (2.044). Con la intención de reclutar al menos 100 pacientes con enfermedad arterial y para una prevalencia estimada de EAP del 25%, el tamaño de la muestra debía de ser superior a 390 pacientes.
Criterios de inclusión: diabéticos tipo 2, mayores de 50 años, incluidos en la base de datos del proceso diabetes del CS y que firmaron el consentimiento informado. No hubo negativas a participar en el estudio.
Criterios de exclusión: diabetes de debut antes de los 40 años, presencia de polinureuropatía diabética o de EAP previas conocidas, pacientes inmovilizados que no puedan acudir al centro, amputación de miembros, enfermedad mental que dificulte la comunicación y negativa a participar en el estudio.
Variables del estudio: la variable dependiente fue la presencia de EAP diagnosticada mediante ITB. Las variables independientes fueron recogidas de una historia clínica completa donde constaban los antecedentes personales, la presencia de factores de riesgo, la comorbilidad y la toma de los diferentes fármacos. Se consideró sedentarios a los sujetos que no realizaban en su tiempo libre un ejercicio equivalente a caminar a paso moderado al menos 150min a la semana. Se consideró que existía dislipemia si, con independencia de los niveles de lípidos, el paciente tomaba fármacos hipolipemiantes, si estaba diagnosticado previamente de dislipemia o si en la analítica se detectaban concentraciones de colesterol total ≥200mg/dl, cLDL≥160mg/dl, cHDL<40mg/dl en hombres o <50mg/dl en mujeres, o triglicéridos ≥200mg/dl). En la exploración física se registraron el peso, talla, perímetro de cintura y las presiones arteriales sistólicas y diastólicas según las recomendaciones habituales. El ITB se determinó con un doppler portátil con sonda de 8Mhz (Dopplex®H, D900/D920) y esfigmomanómetro calibrado. A todos los pacientes se les examinó con el test del monofilamento como método de cribado de la polineuropatía. Tras 12h de ayunas se extrajo una muestra de sangre para hemograma, hemoglobina glicada y bioquímica. En suero se determinaron la glucemia, creatinina, ácido úrico, colesterol, triglicéridos, HDL colesterol, AST, ALT, fosfatasa alcalina, GGT, insulinemia, HOMA (Homeostasis Assessment Model). El filtrado glomerular (eGFR) se estimó mediante la fórmula de Cockroft-Gault16. A efectos del análisis multivariante, se definió hipertrigliceridemia cuando los triglicéridos >200mg/dl. En la muestra de orina aislada se determinó el cociente albúmina/creatinina. Estas determinaciones se efectuaron en el Laboratorio Clínico del Hospital Materno-Infantil de Málaga, sobre un autoanalizador Dimensión Vista 1500, Siemens Diagnostics, Newaks, USA. El colesterol de las HDL se midió por métodos directos y el de las LDL se calculó mediante la fórmula de Friedewald.
El estudio ha contado con el informe favorable de la Comisión de Ética e Investigación Clínica del Hospital Universitario «Virgen de la Victoria» de Málaga.
Métodos estadísticos: Se han empleado estadísticos descriptivos de los grupos de estudio. La variable principal de estudio es la presencia de EAP, evaluada con el índice tobillo/brazo. Con fines de este estudio, esta variable se ha categorizado en 3: sujetos con ITB<09 (diagnóstico de EAP), sujetos con ITB entre 0,9–1,30 (normal, sin EAP) y el último grupo de ITB>1,30 (grupo de ITB elevado). Para la comparación entre los 3 grupos se utilizaron los test de la χ2 (variables cualitativas) y el test de ANOVA para aquellas variables cuantitativas que se ajusten a la normal; en caso contrario, las variables fueron trasformadas logarítmicamente. Se estableció un nivel significación para una probabilidad<0,05. Con la intención de analizar qué factores estaban asociados a la presencia de EAP, efectuamos un análisis de regresión logística binaria por pasos hacia adelante (Wald), tomando la presencia de EAP como variable dependiente y como predictoras aquellas significativas en el análisis univariante más aquellas que tengan un valor biológico relevante ya conocido (por ej. edad, sexo, consumo de alcohol, ejercicio, hipertensión arterial, dislipemia, enfermedad macrovascular, enfermedad microvascular, toma de ADO o insulina, tratamientos hipotensor, hipolipemiante y antiagregante, IMC, perímetro abdominal, leucocitos, hemoglobina, glucemia, hemoglobina glicada, HOMA-IR, cociente albúmina/creatinina en orina, aclaramiento de creatinina, ácido úrico, colesterol no HDL).
En un segundo análisis se analizaron las variables asociadas a la presencia de un ITB>1,3. La base de datos y los análisis estadísticos se ejecutaron sobre el programa SPSS 17 (SPSS Inc, Illinois, EE.UU.).
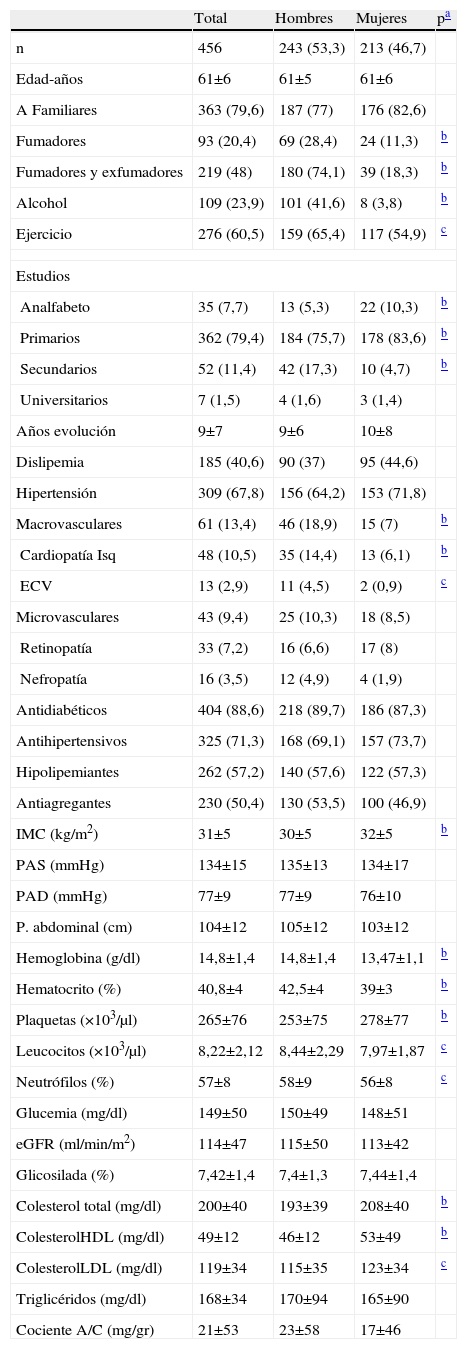
ResultadosSe estudiaron a 456 pacientes, de los que 243 (55,3%) eran hombres, con una edad media de 60,95±5,53 años.
Las principales características generales de la muestra, diferenciadas por sexo, se reflejan en la tabla 1, acompañadas de los valores de significación estadística.
Características generales de la población, total y por sexo*
| Total | Hombres | Mujeres | pa | |
| n | 456 | 243 (53,3) | 213 (46,7) | |
| Edad-años | 61±6 | 61±5 | 61±6 | |
| A Familiares | 363 (79,6) | 187 (77) | 176 (82,6) | |
| Fumadores | 93 (20,4) | 69 (28,4) | 24 (11,3) | b |
| Fumadores y exfumadores | 219 (48) | 180 (74,1) | 39 (18,3) | b |
| Alcohol | 109 (23,9) | 101 (41,6) | 8 (3,8) | b |
| Ejercicio | 276 (60,5) | 159 (65,4) | 117 (54,9) | c |
| Estudios | ||||
| Analfabeto | 35 (7,7) | 13 (5,3) | 22 (10,3) | b |
| Primarios | 362 (79,4) | 184 (75,7) | 178 (83,6) | b |
| Secundarios | 52 (11,4) | 42 (17,3) | 10 (4,7) | b |
| Universitarios | 7 (1,5) | 4 (1,6) | 3 (1,4) | |
| Años evolución | 9±7 | 9±6 | 10±8 | |
| Dislipemia | 185 (40,6) | 90 (37) | 95 (44,6) | |
| Hipertensión | 309 (67,8) | 156 (64,2) | 153 (71,8) | |
| Macrovasculares | 61 (13,4) | 46 (18,9) | 15 (7) | b |
| Cardiopatía Isq | 48 (10,5) | 35 (14,4) | 13 (6,1) | b |
| ECV | 13 (2,9) | 11 (4,5) | 2 (0,9) | c |
| Microvasculares | 43 (9,4) | 25 (10,3) | 18 (8,5) | |
| Retinopatía | 33 (7,2) | 16 (6,6) | 17 (8) | |
| Nefropatía | 16 (3,5) | 12 (4,9) | 4 (1,9) | |
| Antidiabéticos | 404 (88,6) | 218 (89,7) | 186 (87,3) | |
| Antihipertensivos | 325 (71,3) | 168 (69,1) | 157 (73,7) | |
| Hipolipemiantes | 262 (57,2) | 140 (57,6) | 122 (57,3) | |
| Antiagregantes | 230 (50,4) | 130 (53,5) | 100 (46,9) | |
| IMC (kg/m2) | 31±5 | 30±5 | 32±5 | b |
| PAS (mmHg) | 134±15 | 135±13 | 134±17 | |
| PAD (mmHg) | 77±9 | 77±9 | 76±10 | |
| P. abdominal (cm) | 104±12 | 105±12 | 103±12 | |
| Hemoglobina (g/dl) | 14,8±1,4 | 14,8±1,4 | 13,47±1,1 | b |
| Hematocrito (%) | 40,8±4 | 42,5±4 | 39±3 | b |
| Plaquetas (×103/μl) | 265±76 | 253±75 | 278±77 | b |
| Leucocitos (×103/μl) | 8,22±2,12 | 8,44±2,29 | 7,97±1,87 | c |
| Neutrófilos (%) | 57±8 | 58±9 | 56±8 | c |
| Glucemia (mg/dl) | 149±50 | 150±49 | 148±51 | |
| eGFR (ml/min/m2) | 114±47 | 115±50 | 113±42 | |
| Glicosilada (%) | 7,42±1,4 | 7,4±1,3 | 7,44±1,4 | |
| Colesterol total (mg/dl) | 200±40 | 193±39 | 208±40 | b |
| ColesterolHDL (mg/dl) | 49±12 | 46±12 | 53±49 | b |
| ColesterolLDL (mg/dl) | 119±34 | 115±35 | 123±34 | c |
| Triglicéridos (mg/dl) | 168±34 | 170±94 | 165±90 | |
| Cociente A/C (mg/gr) | 21±53 | 23±58 | 17±46 | |
A/C: albúmina/creatinina; ECV: enfermedad cerebrovascular; eGFR: filtrado glomerular por la fórmula de Cockroft y Gault; HDL: lipoproteínas de alta densidad; HTA: hipertension arterial; IMC: índice de masa corporal; LDL: lipoproteínas de baja densidad; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
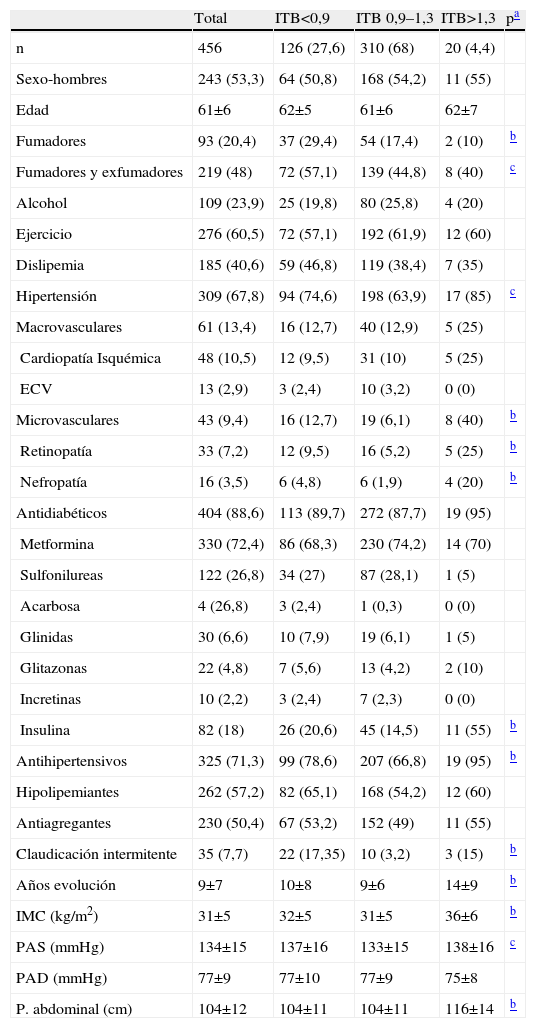
Según los valores de ITB encontramos que 126 pacientes (27,6%) presentaban un ITB<0,9, 310 pacientes (68%) presentaban un ITB entre 0,9–1,3 y solamente 20 pacientes (4,4%) tenían un ITB>1,3. Por lo tanto 146 pacientes (32%) presentaban un ITB fuera de la normalidad. En las tablas 2 y 3 se aprecian las características clínicas y de laboratorio para cada uno de los grupos.
Características clínicas de la muestra según el grado de ITB*
| Total | ITB<0,9 | ITB 0,9–1,3 | ITB>1,3 | pa | |
| n | 456 | 126 (27,6) | 310 (68) | 20 (4,4) | |
| Sexo-hombres | 243 (53,3) | 64 (50,8) | 168 (54,2) | 11 (55) | |
| Edad | 61±6 | 62±5 | 61±6 | 62±7 | |
| Fumadores | 93 (20,4) | 37 (29,4) | 54 (17,4) | 2 (10) | b |
| Fumadores y exfumadores | 219 (48) | 72 (57,1) | 139 (44,8) | 8 (40) | c |
| Alcohol | 109 (23,9) | 25 (19,8) | 80 (25,8) | 4 (20) | |
| Ejercicio | 276 (60,5) | 72 (57,1) | 192 (61,9) | 12 (60) | |
| Dislipemia | 185 (40,6) | 59 (46,8) | 119 (38,4) | 7 (35) | |
| Hipertensión | 309 (67,8) | 94 (74,6) | 198 (63,9) | 17 (85) | c |
| Macrovasculares | 61 (13,4) | 16 (12,7) | 40 (12,9) | 5 (25) | |
| Cardiopatía Isquémica | 48 (10,5) | 12 (9,5) | 31 (10) | 5 (25) | |
| ECV | 13 (2,9) | 3 (2,4) | 10 (3,2) | 0 (0) | |
| Microvasculares | 43 (9,4) | 16 (12,7) | 19 (6,1) | 8 (40) | b |
| Retinopatía | 33 (7,2) | 12 (9,5) | 16 (5,2) | 5 (25) | b |
| Nefropatía | 16 (3,5) | 6 (4,8) | 6 (1,9) | 4 (20) | b |
| Antidiabéticos | 404 (88,6) | 113 (89,7) | 272 (87,7) | 19 (95) | |
| Metformina | 330 (72,4) | 86 (68,3) | 230 (74,2) | 14 (70) | |
| Sulfonilureas | 122 (26,8) | 34 (27) | 87 (28,1) | 1 (5) | |
| Acarbosa | 4 (26,8) | 3 (2,4) | 1 (0,3) | 0 (0) | |
| Glinidas | 30 (6,6) | 10 (7,9) | 19 (6,1) | 1 (5) | |
| Glitazonas | 22 (4,8) | 7 (5,6) | 13 (4,2) | 2 (10) | |
| Incretinas | 10 (2,2) | 3 (2,4) | 7 (2,3) | 0 (0) | |
| Insulina | 82 (18) | 26 (20,6) | 45 (14,5) | 11 (55) | b |
| Antihipertensivos | 325 (71,3) | 99 (78,6) | 207 (66,8) | 19 (95) | b |
| Hipolipemiantes | 262 (57,2) | 82 (65,1) | 168 (54,2) | 12 (60) | |
| Antiagregantes | 230 (50,4) | 67 (53,2) | 152 (49) | 11 (55) | |
| Claudicación intermitente | 35 (7,7) | 22 (17,35) | 10 (3,2) | 3 (15) | b |
| Años evolución | 9±7 | 10±8 | 9±6 | 14±9 | b |
| IMC (kg/m2) | 31±5 | 32±5 | 31±5 | 36±6 | b |
| PAS (mmHg) | 134±15 | 137±16 | 133±15 | 138±16 | c |
| PAD (mmHg) | 77±9 | 77±10 | 77±9 | 75±8 | |
| P. abdominal (cm) | 104±12 | 104±11 | 104±11 | 116±14 | b |
ECV: enfermedad cerebrovascular; HTA: hipertension arterial; IMC: índice de masa corporal; ITB: índice tobillo-brazo; PAD: presión arterial diastólica; PAS: presión arterial sistólica.
Valores de laboratorio según el grado de ITB*
| Total | ITB<0,9 | ITB 0,9–1,3 | ITB>1,3 | pa | |
| n | 456 | 126 (27,6) | 310 (68) | 20 (4,4) | |
| Sexo-hombres | 243 (53,3) | 64 (50,8) | 168 (54,2) | 11 (55) | |
| Edad | 61±6 | 62±5 | 61±6 | 62±7 | |
| Hemoglobina (g/dl) | 14,8±1,4 | 14,1±1,5 | 14,2±1,4 | 13,4±1,2 | |
| Hematocrito (%) | 40,8±3,9 | 40,6±4,2 | 41±3,8 | 39,3±3,5 | |
| Plaquetas (×103/μl) | 265±76 | 283±75 | 259±77 | 229±62 | b |
| Leucocitos (×103/μl) | 8,22±2 | 8,46±2 | 8,12±2 | 8,19±2 | |
| Neutrófilos (%) | 57±8 | 57±8 | 57±8 | 60±10 | |
| Glucemia (mg/dl) | 149±50 | 154±58 | 146±46 | 160±56 | |
| eGFR (ml/min/m2) | 114±47 | 116±5 | 114±44 | 114±57 | |
| Creatinina (mg/dl) | 0,8±0,3 | 0,8±0,3 | 0,8±0,2 | 1±0,4 | b |
| Ácido úrico (mg/dl) | 5,2±1,5 | 5,2±1,6 | 5,2±1,5 | 5,2±2 | |
| Glicosilada (%) | 7,42±1,39 | 7,51±1,56 | 7,36±1,29 | 7,8±1,82 | |
| Colesterol total (mg/dl) | 200±40 | 209±45 | 197±38 | 190±34 | b |
| Colesterol HDL (mg/dl) | 49±12 | 49±12 | 50±12 | 44±9 | |
| Colesterol LDL (mg/dl) | 119±3 | 124±35 | 117±34 | 114±28 | |
| Triglicéridos (mg/dl) | 168±34 | 186±106 | 161±87 | 159±67 | c |
| Cociente A/C (mg/dl) | 21±53 | 20±34 | 21±60 | 22±30 | |
| TSH (mcU/ml) | 2,95±1,97 | 2,85±1,78 | 2,99±2,05 | 3,06±1,9 | |
| HOMA | 5±11 | 4,3±4 | 5,3±13 | 6,3±7 |
A/C: albúmina/creatinina; eGFR: filtrado glomerular por la fórmula de Cockroft y Gault); HDL: lipoproteínas de alta densidad; HOMA: homeostasis assessment model; ITB: índice tobillo-brazo; LDL: lipoproteínas de baja densidad; TSH: hormona estimulante de la tiroides.
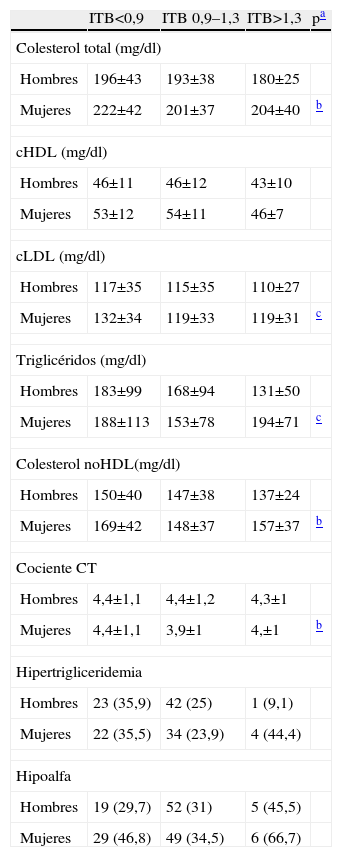
En la tabla 4 se especifican, diferenciados por sexo, los valores de las fracciones lipídicas.
Valores de las fracciones lipídicas según grado de ITB y sexo*
| ITB<0,9 | ITB 0,9–1,3 | ITB>1,3 | pa | |
| Colesterol total (mg/dl) | ||||
| Hombres | 196±43 | 193±38 | 180±25 | |
| Mujeres | 222±42 | 201±37 | 204±40 | b |
| cHDL (mg/dl) | ||||
| Hombres | 46±11 | 46±12 | 43±10 | |
| Mujeres | 53±12 | 54±11 | 46±7 | |
| cLDL (mg/dl) | ||||
| Hombres | 117±35 | 115±35 | 110±27 | |
| Mujeres | 132±34 | 119±33 | 119±31 | c |
| Triglicéridos (mg/dl) | ||||
| Hombres | 183±99 | 168±94 | 131±50 | |
| Mujeres | 188±113 | 153±78 | 194±71 | c |
| Colesterol noHDL(mg/dl) | ||||
| Hombres | 150±40 | 147±38 | 137±24 | |
| Mujeres | 169±42 | 148±37 | 157±37 | b |
| Cociente CT | ||||
| Hombres | 4,4±1,1 | 4,4±1,2 | 4,3±1 | |
| Mujeres | 4,4±1,1 | 3,9±1 | 4,±1 | b |
| Hipertrigliceridemia | ||||
| Hombres | 23 (35,9) | 42 (25) | 1 (9,1) | |
| Mujeres | 22 (35,5) | 34 (23,9) | 4 (44,4) | |
| Hipoalfa | ||||
| Hombres | 19 (29,7) | 52 (31) | 5 (45,5) | |
| Mujeres | 29 (46,8) | 49 (34,5) | 6 (66,7) | |
HDL: lipoproteínas de alta densidad; ITB: indice tobillo-brazo; LDL: lipoproteínas de baja densidad.
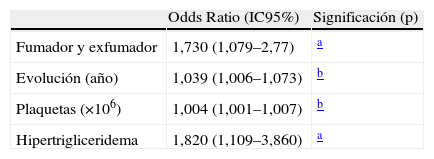
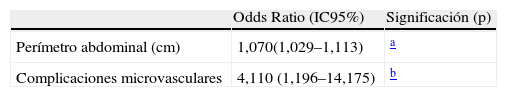
En los análisis multivariantes, las variables asociadas con ITB patológicos quedan resumidas en las tablas 5 y 6. A un ITB patológico,<0,9, se asociaron de forma significativa el tiempo de evolución de la diabetes, el antecedente actual o pasado de fumar cigarrillos, la presencia de hipertrigliceridemia en la muestra en ayunas y la cifra de plaquetas. Por el contrario, las variables asociadas con ITB>1,3 sólo fueron el perímetro abdominal (o IMC cuando el perímetro abdominal fue sacado de la ecuación, datos no mostrados) y la presencia de complicaciones microvasculares, en forma de retinopatía o nefropatía, pues la polineuropatía fue motivo de exclusión del estudio al poder influir en la medición del ITB.
En nuestra población de estudio, pacientes diabéticos tipo 2 seguidos en AP, más de del 25% de la muestra presentaba un ITB por debajo de 0,9 y no llegaban al 5% los pacientes con ITB por encima de 1,3. Esto significa que casi un tercio de los pacientes presentaban un ITB fuera de los rangos aceptados como normales.
Comparar la prevalencia de EAP en pacientes diabéticos es difícil debido a las apreciables diferencias de las poblaciones de los diferentes estudios. Nuestros datos son similares a los encontrados en el estudio MERITO15, 26,2%, llevado a cabo en una amplia muestra de población española valorada en consultas externas hospitalarias de riesgo vascular. Otros estudios encuentran aún una prevalencia superior al 30%14,17,18. Por el contrario, en población asiática la prevalencia es menor 16–17%9,19,20 lo que concuerda con una menor prevalencia de enfermedades cardiovasculares en esta región.
En AP la prevalencia es bastante variable. Existen diferentes estudios con resultados discordantes, pero adolecen de una metodología deficiente y de estar realizado con unas poblaciones muy reducidas. Entre los trabajos bien diseñados metodológicamente se encontró una prevalencia del 18% en pacientes diabéticos con síndrome metabólico21 en la provincia de Toledo (aunque se trataba de una muestra reducida). En una población de diabéticos tipo 2 en Madrid, entre 60–80 años, se encontró una prevalencia de 11,3%13. En la tesis doctoral de Taboada, con una muestra de 339 diabéticos gallegos, la prevalencia encontrada fue del 29%22. A diferencia de los estudios anteriores, nuestro estudio cuenta, entre otras características de interés, el que se ha realizado en base a un muestreo aleatorio de diabéticos tipo 2 seguidos en la comunidad, lo que ha evitado los sesgos de los trabajos realizados en el ámbito hospitalario y ofrece pues información relevante sobre la prevalencia real de la EAP en población diabética atendida en AP. Por otra parte, la amplitud de la muestra estudiada representa un valor añadido a la validez de nuestro estudio. Además observamos que, al igual que en otros estudios, la prevalencia de ITB<0,9 se relaciona con la edad13,22,23 con los años de evolución de la diabetes7,13,24 y con el hábito tabáquico22,23. Estos datos aportan consistencia a nuestros resultados.
Los hombres presentan mayor prevalencia de complicaciones macrovasculares que las mujeres. Sin embargo, es llamativo que la prevalencia de EAP es similar en ambos sexos; es probable que nuestro estudio refleje un menor nivel diagnóstico de la cardiopatía isquémica en las mujeres24, ya descrito en la literatura, puesto que es bien conocido que la diabetes anula el efecto protector del sexo femenino sobre la arteriosclerosis. Una circunstancia a destacar en relación a los lípidos es que sólo las mujeres con ITB<0,9 comparadas con el grupo de ITB 0,9–1,3 tuvieron elevaciones significativas en las cifras de colesterol total, cLDL, triglicéridos, colesterol noHDL y cociente CT, hecho que no ocurrió en los hombres.
En el análisis univariante, se observan apreciables diferencias clínicas y de laboratorio entre los diabéticos dependiendo de los valores encontrados de ITB. Así hay más fumadores y exfumadores en el grupo de ITB bajo. Por otra parte el IMC, la PAS y el perímetro abdominal son más altos en los pacientes con ITB>1,3. Además los pacientes con ITB bajo tienen un mayor número de plaquetas y el colesterol total y los triglicéridos más elevados. En el análisis multivariante el ITB<0,9 se asoció con el hábito de fumar o ser exfumador, los años de evolución de la diabetes, el número de plaquetas y la presencia de hipertrigliceridemia. Estos hallazgos no son sorprendentes. El hábito de fumar, el tiempo de duración de la diabetes y los niveles de triglicéridos en ayunas, además de la edad, estuvieron asociados de forma independiente con la presencia de EAP en sujetos con diabetes de tipo 210; en un grupo más pequeño de diabéticos de nuestra área demostramos que los triglicéridos posprandiales son mejores marcadores que los medidos en ayunas25. Es interesante recalcar el papel de las plaquetas, que son predictores independientes en todo tipo de análisis multivariante que hemos medido. Sin embargo, esto tampoco es novedoso, pues se conoce bien que no sólo la actividad plaquetar está elevada en la diabetes, sino que su número y el volumen plaquetar medio están significativamente elevados en pacientes diabéticos con enfermedad vascular periférica26,27. Desgraciadamente, no hemos medido parámetros de función plaquetar. El grupo de pacientes con ITB>1,3, a pesar de representar escasamente un 5% de la muestra, presentan unas características muy interesantes. En ellos las complicaciones microvasculares son más frecuentes, reciben más tratamiento insulínico, toman más medicación antihipertensiva, tienen un perímetro abdominal más alto y unas cifras de creatinina más elevadas. En el análisis multivariante las variables asociadas que permanecen son las complicaciones microvasculares y el perímetro abdominal. Es plausible que los pacientes con mayor tiempo de exposición a y mayor grado de hiperglucemia, muestren mayor grado de calcificación de la media arterial que la vuelva incompresible. La significación de un ITB elevado es objeto de discusión; un estudio mostró un aumento del riesgo relativo de 2,0 para morbilidad y mortalidad cardiovascular en sujetos con ITB>1,428, otro más reciente, asoció ITB>1,4 con la presencia de úlceras en los pies y una tendencia a fallo cardiaco, ictus y neuropatía29. Por el contrario, en el estudio ARIC los sujetos con ITB>1,3 tuvieron una menor prevalencia de hipertensión arterial y de hábito de fumar, sin que en ellos se demostrase mayores tasas de eventos cardiovasculares que los sujetos con ITB dentro de la normalidad30.
La principal limitación de este estudio radica en la exactitud del ITB en el diagnóstico de EAP. En el contexto de nuestro estudio con pacientes diabéticos la calcificación de la pared arterial y la coexistencia de polineuropatía diabética suponen una limitación a la técnica del ITB. Es bien conocido que la presencia de neuropatía está estrechamente asociada a calcificación de la media arterial y a elevación del ITB31. De hecho, la sensibilidad para detectar de forma correcta la EAP mediante ITB en presencia de neuropatía diabética decrece al 50%32. Con la intención de atenuar esta limitación, se procedió a excluir a los pacientes con signos de neuropatía mediante el test del monofilamento; quizás sea este el motivo por el cual la prevalencia de ITB>1,3 fue sólo del 5%, mucho menor de lo que podría ser esperado33.
A la vista de los resultados obtenidos concluimos que la prevalencia de enfermedad arterial periférica en sujetos con diabetes de tipo 2 es elevada y consistente con lo publicado. Esta alta prevalencia de ITB alterado refuerza la recomendación de realizar el índice tobillo-brazo a todos los diabéticos valorados y seguidos en Atención Primaria. Además de los factores clásicos asociados a EAP, como el tabaco, la duración de la enfermedad diabética y la hipertrigliceridemia, mostramos que las plaquetas están potentemente asociadas a EAP, aunque el mecanismo patogénico de ésta última asociación no es conocido.
FinanciaciónEste trabajo se ha realizado con una beca FEA/SEA 2008 para Atención Primaria.
A los médicos del CS de Ciudad Jardín (Mercedes Antón, María Luisa Fernández, Leovigildo Ginel, Manuel Izquierdo, María Kuhn, Lourdes Linares, Carmen Mateos, Silvia Mes, Manuel Miranda, Luz Pilar de la Mota, Antonio Pérez, Juan Antonio Retamero, Rosa Sánchez, Jaime Sasporte, Francisco Taboada y Manuel Torregrosa), por su inestimable colaboración en la valoración clínica de sus pacientes.
A los enfermeros ( María Dolores Bravo, Cristina Fuerte, Juan Carlos Millán, Francisca Palacios, Rafael Poyatos, Eduardo Rodríguez, Juan Alfonso Rodríguez y Antonio Ruiz) y a las auxiliares de clínica (Aurelia Bravo, Lola Reche y Lola Tirado) del CS de Ciudad Jardín por su trabajo en la recogida de muestras para los análisis.