La inflamación desempeña un papel en la formación y complicación de la placa aterosclerótica1. En este proceso es clave la activación del factor de transcripción nuclear *B (NF-*B), que regula al alza la expresión de múltiples genes que codifican proteínas involucradas en la inflamación2-4. Este factor está activado en la aterosclerosis humana, especialmente en la zona de los hombros de las lesiones5,6 y también muestra una mayor activación en los leucocitos de pacientes con angina inestable que en los que tenían enfermedad coronaria estable7. Entre las proteínas reguladas por NF-*B se encuentran el MCP-1 (monocyte chemoattractant protein-1) y la ciclooxigenasa 2 (COX-2)2-4. La primera de ellas es probablemente la quimioquina más importante que participa en el reclutamiento de monocitos al interior de la pared vascular8. En cuanto a la COX-2, es una isoforma de la COX. Aunque cataliza la misma reacción que la COX-1, es decir, el paso de ácido araquidónico a prostaglandina G2 (PGG2), se expresa en tejidos inflamatorios junto a la PGE-sintasa. Esta enzima ha-
rá que la PGG2 se derive hacia la síntesis de PGE2, que tiene actividad proinflamatoria9.
Las estatinas han demostrado reducir la incidencia de episodios cardiovasculares y la mortalidad de modo consistente en múltiples estudios10-12. Una parte de estos beneficios podría deberse a su acción antiinflamatoria13. Así, se ha objetivado que estos fármacos reducen las concentraciones de proteína C reactiva14, y datos de nuestro grupo muestran que disminuyen la activación de NF-*B, así como el infiltrado de macrófagos y la expresión de COX-2 y MCP-1 en un modelo de aterosclerosis experimental de conejo15,16. Recientemente, se ha visto que el tratamiento agresivo con estatinas reduce más la incidencia de episodios cardiovasculares e interfiere más significativamente con la progresión de la placa aterosclerótica que un régimen de tratamiento moderado17. En el presente estudio hemos analizado los efectos antiinflamatorios del tratamiento agresivo con atorvastatina 80 mg/día sobre la placa aterosclerótica de arterias carótidas humanas.
Materiales y métodos
Pacientes
De un total de 77 pacientes con estenosis carotídea del 70% o mayor, que iban a sufrir endarterectomía carotídea electiva en el Hospital Clínico San Carlos de Madrid entre enero de 2002 y enero de 2004, se incluyó a 21 en el presente estudio. Previamente se excluyó a los que presentaban enfermedad inflamatoria o neoplasia, cirugía mayor o infarto de miocardio en los 6 meses previos, intolerancia o contraindicaciones para el uso de estatinas y a aquellos que hubieran recibido estatinas o fármacos antiinflamatorios en el año previo, exceptuando aspirina a dosis de hasta 325 mg/día. De los pacientes incluidos, 2 habían tenido un accidente isquémico reciente ipsilateral, 1 tuvo un episodio de amaurosis fugaz 6 meses antes y 2 presentaban una historia antigua de ictus isquémico contralateral y accidente isquémico transitorio. Los restantes no tenían antecedentes de síntomas neurológicos.
Cuando se determinaba la indicación de endarterectomía electiva, se proponía a los pacientes su entrada en el estudio. En caso de aceptación se obtenía el consentimiento informado y el cirujano vascular que les atendía les distribuía de manera aleatoria, usando una tabla de números aleatorios, para recibir atorvastatina 80 mg/día (n = 11) o para continuar sin estatinas hasta el momento de la intervención quirúrgica (n = 10). Se excluyó a uno de los pacientes del grupo que no recibía la estatina debido a un diagnóstico de linfoma durante el estudio, por lo que en este grupo quedaron 9 pacientes. Durante la intervención quirúrgica, las placas extraídas en el procedimiento de endarterectomía eran recogidas para su análisis. El estudio fue aprobado por el comité ético de la institución.
Inmunohistoquímica en muestras de endarterectomía carotídea
Las placas ateroscleróticas se mantuvieron en formaldehído durante 24 h y posteriormente en etanol al 70% hasta su inclusión en parafina. Se escogían para el estudio las zonas de la placa que presentaban un mayor espesor.
Las muestras incluidas en parafina se cortaban en piezas de 4 µm de espesor a intervalos de 5 mm. Se utilizaron como anticuerpos primarios monoclonales antihumanos (macrófagos, HAM-56, DAKO), anticuerpos monoclonales anti-* actina de células musculares lisas (HHF-35, SIGMA), COX-2 (Cayman) y MCP-1 (Abcam), que se administraban durante la noche. Los anticuerpos secundarios se administraban durante 1 h y se añadía ABComplex/HRP (DAKO) durante 30 minutos. Las secciones se teñían con 3,3'-diaminobencidina (DAB, DAKO) y con hematoxilina, y se montaban en Pertex (Medite, Alemania). Para descartar que existiera tinción no específica, en cada experimento se incluía un control negativo sin el anticuerpo primario.
Técnica de Southwestern
La distribución y actividad de unión al ADN de NF-*B in situ se detectaba usando una sonda de ADN marcada con digoxigenina con una secuencia específica de consenso para este factor de transcripción, como ha descrito previamente nuestro grupo18. A continuación, las preparaciones se incubaban con un anticuerpo antidigoxigenina conjugado con fosfatasa alcalina y, finalmente, se detectaban con nitroazul de tetrazolio (NBT). Como controles negativos se usaban ensayos de competición con un exceso de sonda no marcada de 200 veces.
Cuantificación
La cuantificación de los resultados la realizó un patólogo que no conocía el tratamiento que habían recibido los pacientes. Se usó un análisis computarizado con el sistema de análisis de imagen semiautomático Cue-2 (Olympus) y el programa Micro ImageTM (versión 1.0 de Windows). Las secciones arteriales teñidas con los anticuerpos se digitalizaron vía un microscopio Olympus (BH-2), a 400 aumentos, conectado a una videocámara CCD como hemos descrito5. Se seleccionaron aleatoriamente 5-10 áreas de cada preparación. Tras la adquisición de la imagen se asignó a cada píxel un intervalo de valores de grises de 0 a 225. Las áreas marcadas se delimitaron y de esta forma el análisis automático se llevó a cabo estableciendo en primer lugar un nivel umbral, seguido de una mejora en la imagen (convirtiendo los píxels próximos al blanco a blanco, los próximos al negro a negro y extendiendo los restantes uniformemente sobre los intervalos de valores de la escala de grises) y, finalmente, se realizó una segmentación (transformando la imagen en otra imagen binaria). Los resultados se expresaron como porcentaje del área total que mostraba tinción positiva en la inmunohistoquímica y como núcleos positivos por mm2 en la técnica de Southwestern.
Análisis estadístico
Se realizó con los programas GraphPAD Instat (GraphPAD) y SPSS 11.0. Los datos se presentan como media ± error estándar. Los cambios en las concentraciones lipídicas en cada grupo de tratamiento se analizaban mediante análisis de la covarianza usando los valores basales como covariable. Los datos obtenidos con la técnica de Southwestern e inmunohistoquímica se analizan con la prueba de Mann-Whitney. Se consideraron significativas diferencias con p < 0,05 (bilateral).
Resultados
Concentraciones lipídicas
Los datos clínicos y los valores basales de lípidos no eran significativamente diferentes entre ambos grupos (tabla 1). Al final del estudio la atorvastatina redujo el colesterol total (118 ± 10 frente a 191 ± 10 mg/dl; p = 0,016) y LDL (63 ± 9 frente a 125 ± 9 mg/dl; p = 0,038), mientras que no hubo cambios en el grupo no tratado. Los triglicéridos y las HDL no variaron significativamente en ninguno de los grupos.
Efectos de la atorvastatina en la composición de la placa de ateroma
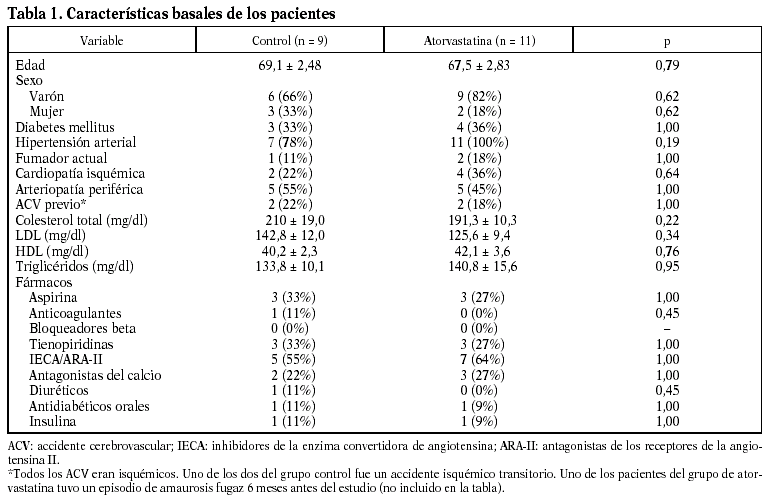
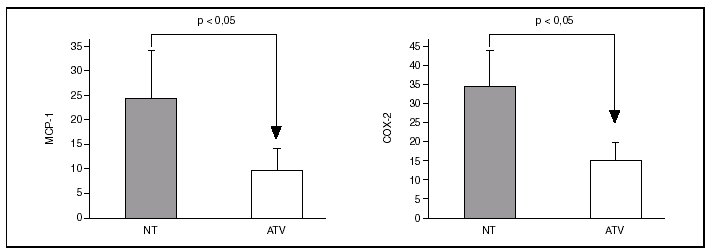
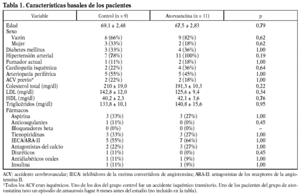
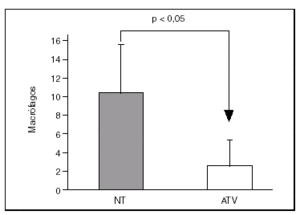
Los especímenes de endarterectomía carotídea de los pacientes tratados con atorvastatina tenían menos infiltración de macrófagos (2,5 ± 1% frente a 9,3 ± 2,4%; p < 0,05) que los del grupo no tratado (figs. 1 y 2). Por el contrario, no había diferencias significativas entre el número de células musculares lisas vasculares ni en el número total de células entre ambos grupos.
Figura 1. El infiltrado de macrófagos en la placa aterosclerótica era menor en las procedentes de pacientes que habían recibido atorvastatina (ATV) que en los que no recibieron tratamiento (NT).
Figura 2. Inmunohistoquímica para macrófagos en especímenes de endarterectomía carotídea. La que corresponde a un paciente tratado con 80 mg/día de atorvastatina (ATV) muestra una menor tición positiva para macrófagos (marrón) que la procedente de un paciente que no recibió la estatina (NT).
La técnica de Southwestern demostró que el tratamiento con atorvastatina disminuía la activación de NF-*B en las placas ateroscleróticas (5.706 ± 1.260 frente a 8.063 ± 1.308; p < 0,05). En los controles negativos no había tinción nuclear.
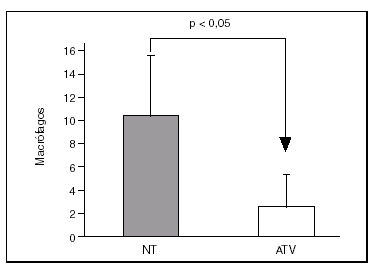
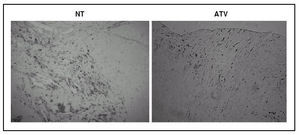
Por inmunohistoquímica objetivamos que la expresión de MCP-1 y COX-2 estaba reducida en las lesiones de los pacientes tratados con la estatina (11 ± 1% frente a 24 ± 4% y 16 ± 2,3% frente a 34 ± 4,4%, respectivamente; p < 0,05 para ambas comparaciones) (fig. 3).
Figura 3. El área de la placa que mostraba tinción positiva para MCP-1 y COX-2 era significativamente menor en los pacientes tratados con atorvastatina (ATV) que en los que no habían recibido tratamiento (NT).
Discusión
En el presente trabajo hemos analizado el efecto de un ciclo de tratamiento corto e intensivo con atorvastatina sobre la actividad inflamatoria de la placa de aterosclerosis carotídea humana. Las placas de los pacientes que habían recibido atorvastatina mostraban un menor infiltrado de macrófagos, lo que indica una menor actividad inflamatoria. Este resultado es similar al obtenido en estudios previos, en los que pravastatina y simvastatina disminuían el contenido en macrófagos de las lesiones ateroscleróticas, aunque tras 3 o 4 meses de tratamiento, con dosis estándar. Esta reducción de la actividad inflamatoria es probablemente la causante en parte de la disminución de la incidencia de ictus mostrada en diversos estudios y confirmada en el Heart Protection Study, publicado durante la fase de reclutamiento del presente estudio19.
El tratamiento intensivo con atorvastatina no sólo redujo el infiltrado de macrófagos, sino también la actividad del factor de transcripción nuclear NF-*B. Este hallazgo concuerda con trabajos previos en modelos animales de aterosclerosis15,16,20. Sin embargo, es de interés que, en un estudio similar a éste, la administración de pravastatina 40 mg/día durante 3 meses no afectó la actividad de NF-*B en arteria carótida humana21. Esto sugiere que los beneficios clínicos recientemente demostrados por el tratamiento intensivo con atorvastatina 80 mg/día frente a regímenes estándar podrían deberse, en parte, a una acción antiinflamatoria más consistente22. Así, el ensayo PROVE-IT mostró que el tratamiento intensivo con atorvastatina (80 mg/día) reducía la incidencia de episodios cardiovasculares frente a 40 mg/día de pravastatina en pacientes que habían tenido un síndrome coronario agudo17. Un dato más importante: aquellos pacientes cuyos valores de proteína C reactiva descendían por debajo de 2 mg/l tenían aún menos episodios23, lo que apoya la tesis de que el efecto antiinflamatorio de estos fármacos contribuye a su beneficio clínico. Análogamente, el ensayo TNT demostró que una dosis de atorvastatina de 80 mg/día disminuye la incidencia de episodios cardiovasculares frente a una de 10 mg/día en pacientes con enfermedad coronaria estable24. Finalmente, la atorvastatina de 80 mg/día reducía la progresión de la aterosclero-sis coronaria, mientras que la pravastatina de 40 mg/día no conseguía este efecto25. Esta reducción se correlacionaba significativamente no sólo con el descenso de lipoproteínas, sino también con el de proteína C reactiva26.
Finalmente, también hemos demostrado que el tratamiento intensivo con atorvastatina reducía la expresión de MCP-1 y COX-2 en las placas ateroscleróticas carotídeas. Dado que el NF-*B regula al alza la expresión de estas proteínas proinflamatorias, este dato sugiere que la disminución de su actividad causada por la atorvastatina podría ser la causante de la disminución de la expresión de MCP-1 y COX-2. MCP-1 se sobreexpresa en la región vulnerable de las aterosclerosis humana27 y se ha visto que su expresión es reducida por las estatinas en modelos animales de aterosclerosis15,20. Además, las estatinas y los bloqueadores de MCP-1 han mostrado recientemente efectos similares en la estabilización de lesiones ateroscleróticas establecidas, según Kitamoto et al28. Más aún, la COX-2 está sobreexpresada en las lesiones ateroscleróticas carotídeas causantes de ictus recientes29. Su expresión es reducida por el tratamiento con estatinas de células musculares lisas vasculares in vitro y en modelos animales16. La simvastatina también disminuía su expresión en placas de aterosclerosis carotídea, pero este efecto se observó tras 4 meses de tratamiento30.
Por tanto, nuestros datos muestran que la reducción de macrófagos en las lesiones ateroscleróticas observada tras el tratamiento intensivo con atorvastatina se asocia con una disminución de la actividad de NF-*B y la consiguiente reducción de la expresión de COX-2 y MCP-1, y probablemente de otras moléculas proinflamatorias involucradas en el reclutamiento de monocitos, cuya expresión es controlada por este factor de transcripción y que no han sido exploradas en este estudio.
En conclusión, este estudio muestra que el tratamiento intensivo con atorvastatina disminuye la actividad inflamatoria en las placas de ateroma carotídeo humano en sólo 1 mes. Estos datos sugieren que el efecto antiinflamatorio de las altas dosis de estatinas en seres humanos pueden estar presentes muy pronto tras el comienzo del tratamiento.