En la actualidad se dispone de métodos muy variados para introducir ADN exógeno en las células y conseguir así que éstas expresen en mayor grado una proteína concreta o, incluso, que expresen proteínas que no poseen en condiciones normales. También se puede reducir la expresión de una determinada proteína empleando, por ejemplo, vectores recombinantes con ADN antisentido1 o ARN de interferencia (ARNi)2. Estas técnicas son teóricamente aplicables en terapia génica, pero, por el momento, no existe un vector de transferencia de ADN cuyos efectos asociados hayan sido completamente definidos y, por tanto, considerado apto para su uso terapeútico.
Entre estos vectores se encuentran los adenovirales, que ofrecen diversas ventajas para la transferencia génica y pueden transducir material genético a una amplia variedad de células proliferantes y no proliferantes. Durante la pasada década se han desarrollado diversas versiones de vectores adenovirales con distintos grados de deleción de las secuencias codificantes del genoma viral3. Estos vectores se han evaluado en numerosos estudios de transferencia génica y se han identificado algunos aspectos limitantes para su aplicación clínica. El desarrollo tecnológico más reciente en el diseño de vectores adenovirales y los métodos de administración han mejorado su potencial en aplicaciones de terapia génica, y los mayores retos han sido las respuestas inmunes innata y adaptativa4,5.
Los vectores basados en el adenovirus humano serotipo 5 se utilizan de forma habitual en investigación básica y en estudios preclínicos. Está establecido que tras su administración los adenovirus se concentran principalmente en el hígado6. De hecho, diversos trabajos han demostrado que estos vectores pueden transformar más del 90% de los hepatocitos tras la inyección intravenosa de dosis relativamente bajas6,7, induciendo la producción de las proteínas codificadas por el recombinante8,9. Aunque el perfil de respuesta inmunitaria y los efectos tóxicos tras la administración de adenovirus está bien documentada4,5, el conocimiento de la respuesta de otros procesos fisiológicos y, en particular, de los procesos secretores hepáticos, es limitada.
La producción y secreción de VLDL es un proceso complejo en el que están implicadas rutas metabólicas de provisión de lípidos que se desarrollan entre diferentes compartimentos celulares: en el citosol se almacena la mayoría del triglicérido que formará parte del núcleo de las VLDL10,11, en el retículo endoplasmático se producen las principales etapas de ensamblaje de la lipoproteína y en el aparato de Golgi parece que se produce la maduración mayoritaria de las VLDL12. La infección con determinados virus, como el de la hepatitis C, interfieren en estos procesos, inhiben la secreción de partículas de VLDL y además causan esteatosis hepática13-15. Por tanto, el ensamblaje y la secreción de VLDL, así como el almacenaje de lípido intracelular, son procesos potencialmente susceptibles de ser modificados como consecuencia de una infección viral.
El objetivo de este trabajo fue analizar in vitro, en hepatocitos de rata en cultivo, si la infección con adenovirus recombinantes afecta a la cantidad y la composición de las VLDL secretadas y si, de ser así, afecta también al lípido almacenado en el citosol.
Materiales y métodos
Construcción de vectores adenovirales
Se obtuvieron 2 construcciones adenovirales: una con un ADNc completo clonado en la dirección del sentido de la traducción (AdSS) y otra con los 1.291 primeros nucleótidos de esa secuencia en dirección contraria a la traducción (AdAS). El método para generar estas construcciones adenovirales fue la recombinación homóloga16, que se basa en el empleo de
2 plásmidos: el pACCMV, que contiene el ADNc que se va a expresar, y el pJM17, que contiene el genoma del adenovirus tipo 5. Ambos plásmidos poseen fragmentos homólogos gracias a los cuales se produce la recombinación entre ellos. En el adenovirus recombinante resultante la región E1A del genoma viral está sustituida por el ADNc clonado, por lo que el virus no puede propagarse.
El primer paso fue clonar los fragmentos de interés en un vector pACCMV, vector desarrollado por Gómez-Foix et al8, a partir de modificaciones del pAC17. Seguidamente, este vector se cotransfecta junto al plásmido pJM17 para su recombinación en células humanas embrionarias de riñón (HEK) 293, donde el virus generado puede multiplicarse, ya que este tipo celular contiene en su genoma la región E1A del adenovirus. El método utilizado para la cotransfección fue el del fosfato cálcico18. De los cultivos donde ocurrió la recombinación se recogieron los adenovirus producidos, se aislaron las diferentes poblaciones y se amplificó el clon que resultó más efectivo para cada construcción, tal y como describe19. Los dos tipos de adenovirus, AdSS y AdAS, se alicuotaron y mantuvieron a 80 °C hasta su uso.
Aislamiento y cultivo de hepatocitos de rata. Infección con adenovirus
Se emplearon ratas hembra de la raza Sprague-Dawley de 180-200 g de peso. El método de perfusión del hígado que se utilizó para obtener los hepatocitos es una modificación20 del descrito por Seglen21, que utiliza colagenasa como enzima disgregante del tejido conectivo.
Los hepatocitos recién aislados se lavaron y suspendieron en el medio de cultivo y se midieron su concentración y viabilidad mediante la prueba de exclusión del azul de tripán. Después se sembraron en placas cubiertas de fibronectina (3,5 g/cm2) a una densidad de 8 * 104 células/cm2 y se cultivaron a 37 °C y en atmósfera con 5% de CO2. Las suspensiones celulares cuya viabilidad fue inferior al 85% fueron desechadas. El medio de cultivo utilizado fue F12/L15 (1:1, vol:vol) suplementado con 2% de suero fetal bovino, 0,2% de seroalbúmina bovina (BSA) libre de ácidos grasos, 5 mM de glucosa, 2 mM de L-glutamina, 5 U/ml de penicilina, 5 mg/ml de estreptomicina, 50 µg/ml de gentamicina y 14 * 10-3 U/ml de insulina. Tras 1 h de adhesión, se cambió el medio por medio fresco de igual composición. Cada 24 h se cambiaba el medio por un medio similar, pero sin suero y con 10-5 mM de dexametasona.
La infección se realizó a las 24 h de la siembra, y se sustituyó el medio de cultivo por medio sin suero que contenía la dosis seleccionada de adenovirus. Tras 90 min de infección se cambió el medio por medio fresco, lo que marcó el inicio del experimento. Del medio se analizaron las VLDL secretadas y de las células la viabilidad celular, la cantidad de proteína, el grado de infección y el contenido de fosfolípido y lípidos neutros en su fracción citosólica.
Viabilidad celular. Cuantificación de proteína
Para determinar el grado de necrosis en los cultivos se valoró la actividad lactato deshidrogenasa (LDH) en las células y el medio según el método descrito por Bergmeyer22. La viabilidad celular se expresa como el porcentaje de actividad LDH presente en las células respecto a la actividad total. La concentración de proteínas se determinó por el método de Bradford23, utilizando BSA como patrón.
Extracción de ADN genómico y detección de la presencia de adenovirus
El ADN adenoviral se extrajo junto al ADN genómico de las células mediante el kit QIAamp®DNA blood mini kit (QIAGEN), siguiendo las instrucciones del fabricante. Para detectar la presencia de adenovirus en las células y evaluar el grado de infección se realizó PCR con ADN extraído como molde y con los oligonucleótidos 5'-CTGGATTTGGGAGGGAGTGG-3'
y 5'-GCTGTGGTCGTTCTGGTAGTTCA-3', que amplifican la región comprendida entre los nucleótidos 14.010 y 14.400 del genoma del adenovirus tipo 5. La temperatura de hibridación utilizada fue de 56 °C. Se obtuvo un fragmento de 390 pb en los positivos que se visualizó y cuantificó por densitometría bidimensional por reflexión, empleando el software Quantity One de Bio-Rad tras su separación mediante electroforesis horizontal.
Preparación de la fracción citosólica
La suspensión de hepatocitos se homogeneizó mecánicamente y el homogenado se sometió a centrifugaciones seriadas (750 xg, 10 min; 22.000 xg, 10 min; 105.000 xg, 60 min), siguiendo la metodología descrita por Cristobal et al24. El sobrenadante de la última centrifugación contenía la fracción soluble del citoplasma y los cuerpos lipídicos y se denominó fracción citosólica. De ella se extrajeron y analizaron los lípidos.
Aislamiento de las VLDL secretadas
El medio de 24 h de cultivo se recogió y se centrifugó durante 18 h a 83.400 xg, 10 °C y sin freno25. Se recogieron los 2 ml superiores, que contenían las lipoproteínas de densidad inferior a 1,015 g/ml, ya que ésta fue la densidad del medio tras el cultivo celular (media de 10 determinaciones). De esta fracción se separaron 1,5 ml para extraer apo B y el resto se utilizó para extraer los lípidos.
Extracción, separación y cuantificación de lípidos y de apo B
Los lípidos de VLDL y citosol se extrajeron con una variante del método de Folch et al26 y los fosfolípidos y los lípidos neutros se separaron por cromatografía en capa fina, tal y como describen Ruiz et al27. La cuantificación de fosfolípido, triglicéridos, colesterol libre y éster de colesterol se realizó mediante densitometría bidimensional por reflexión empleando el software Quantity One de Bio-Rad. Para la extracción de la apo B de las VLDL se siguió básicamente el método descrito por Vance et al28. La apo B48 y la apo B100 presentes en el extracto se separaron por electroforesis desnaturalizante en un gradiente continuo de poliacrilamida del 3 al 10%. Los geles se tiñeron con azul de Coomassie y se cuantificaron las bandas de interés mediante densitometría bidimensional y el software arriba citado.
Análisis estadístico
Los valores se expresan como la media ± error estándar de un número n de cultivos por condición experimental analizados por duplicado, siendo éste el correspondiente a 2-4 cultivos por rata y 3-4 las ratas utilizadas. Las diferencias significativas se establecieron mediante la aplicación de la prueba de la t de Student para datos no emparejados (programa Microsoft Excel) cuando se comparan dos grupos, y el análisis de la varianza (ANOVA) de una vía cuando se comparan 3 grupos, seguido de la prueba de Bonferroni cuando se observaron diferencias significativas para identificar las diferencias existentes entre cada grupo (programa GraphPad Prism V4.01). Las diferencias se consideraron significativas para los valores de p < 0,05.
Resultados
Los adenovirus recombinantes pueden ser útiles para transferir material genético a los hepatocitos y causar el aumento o descenso de la expresión de una proteína determinada, dependiendo del sentido del ADNc que introduzcan. Sin embargo, además de la modificación en la expresión de la proteína diana, se han descrito efectos debidos a la propia infección, especialmente de carácter humoral, llegando incluso a causar graves disfunciones hepáticas cuando se administran en grandes dosis7,29. En este estudio se ha evaluado el efecto de la infección con adenovirus recombinantes sobre la secreción de partículas VLDL en hepatocitos en cultivo. Para ello se infectaron los hepatocitos con un vector adenoviral recombinante bien portando un ADNc (AdSS) o una secuencia del mismo ADNc, pero clonado en dirección antisentido (AdAS). Se ha visto que estos adenovirus son efectivos para aumentar o disminuir, respectivamente, la expresión de la cadena polipeptídica codificada por el ADNc (datos no mostrados). Cuando las diferencias entre los parámetros de los hepatocitos sin infectar y de los infectados con AdSS o AdAS son de la misma magnitud y del mismo sentido se asume que son consecuencia de la infección y no del producto del ADN que portan los adenovirus.
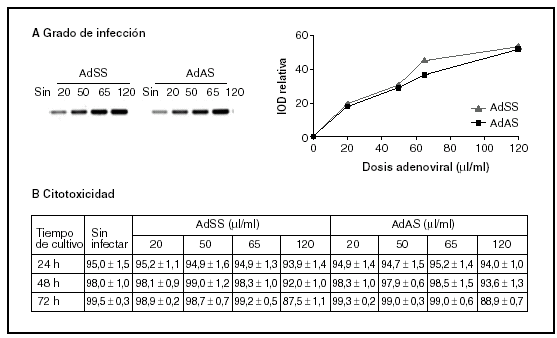
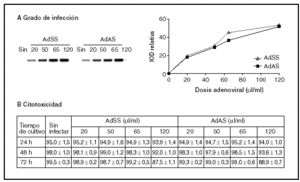
En primer lugar, y con el fin de establecer las dosis de trabajo adecuadas para ambos vectores recombinantes (AdSS y AdAS), se trataron los cultivos con diferentes cantidades de extractos adenovirales, determinándose el grado de infección y su efecto sobre la viabilidad celular. El grado de infección se evaluó cuantificando el producto resultante de una PCR específica que amplifica un fragmento del genoma del adenovirus empleando como molde ADN genómico extraído de los cultivos de hepatocitos infectados con concentraciones crecientes de cada adenovirus. En la figura 1A se puede observar la correlación entre las dosis infectivas de adenovirus y el grado de infección de los hepatocitos. La viabilidad celular de los cultivos infectados a lo largo del tiempo se evaluó comparando la actividad LDH celular respecto a la total (fig. 1B). Aunque la viabilidad a las 24 h de la infección es alta para todas las dosis estudiadas, conforme avanza el tiempo comienza a detectarse muerte celular en los hepatocitos infectados con una dosis de 120 µl/ml, y disminuye la tasa de viabilidad por debajo del 90%. La dosis seleccionada para los dos adenovirus recombinantes fue de 65 µl de stock/ml de medio, ya que no es citotóxica y posee una alta capacidad infectiva.
Figura 1. Grado de infección (A) y citotoxicidad (B) de diferentes dosis de AdSS y AdAS. A) Imagen representativa de las bandas correspondientes a los productos de la amplificación de un fragmento de 390 pb de la secuencia del adenovirus y su cuantificación. Se utilizó como molde ADN genómico extraído de hepatocitos en cultivo pasadas 24 horas de la infección con la cantidad indicada de adenovirus en µl/ml de medio. B) Porcentaje de actividad LDH que permanece en las células respecto a la total para hepatocitos no infectados o infectados con la dosis de adenovirus que se indica, a las 24, 48 y 72 h de la infección. Los datos corresponden a la media ± error estándar de 15 cultivos por condición procedentes de 4 animales en el caso de las muestras recogidas a las 24 h de la infección, y de 8 cultivos para 48 h y 5 para 72 h procedentes de 3 animales, todos ellos analizados por duplicado.
Posteriormente, se estudió el efecto de la infección con la dosis establecida de adenovirus sobre la secreción de partículas lipoproteicas de muy baja densidad. Para ello, en los cultivos de hepatocitos infectados y sin infectar se recogieron las lipoproteínas secretadas al medio con d < 1,015 g/ml durante los 3 períodos de 24 h siguientes a la infección. En esta fracción, que contendría casi exclusivamente partículas VLDL, se cuantificó el número y tipo de moléculas de apo B y la cantidad de sus lípidos mayoritarios: triglicérido, fosfolípido, colesterol libre y colesterol esterificado.
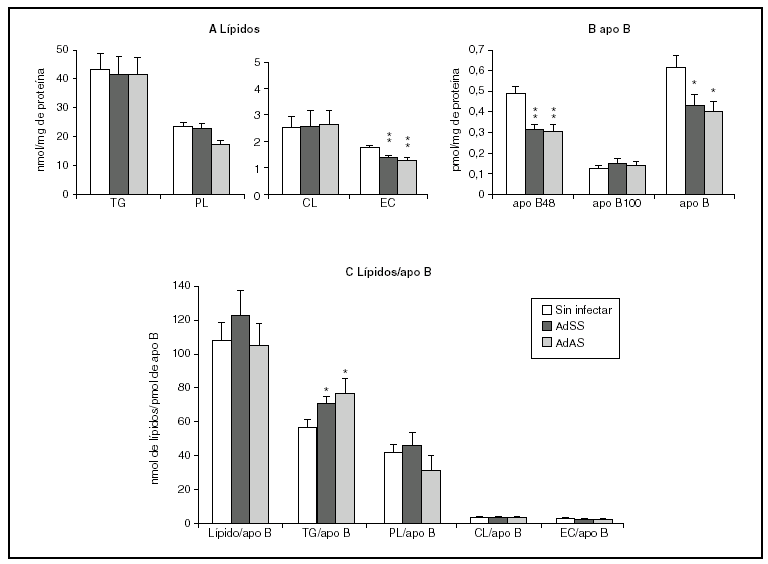
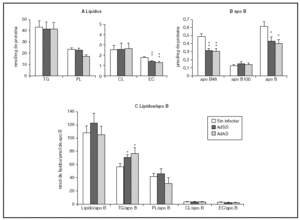
La figura 2 muestra los resultados correspondientes al estudio del efecto de la infección durante el primer período de 24 h. En ella se puede apreciar que la infección causa una menor secreción de apo B48 sin afectar la de apo B100, que resulta en un descenso en la cantidad de apo B secretada (fig. 2B). Se produce, además, un descenso en la secreción al medio de ésteres de colesterol, sin cambios en las concentraciones de los demás lípidos (fig. 2A). En la figura 2C se observa también el aumento de la cantidad de triglicéridos por molécula de apo B, que sugiere que las partículas secretadas durante las primeras 24 h por los hepatocitos infectados podrían tener un tamaño medio mayor que el basal. Sin embargo, la relación entre la cantidad de los lípidos que ocupan el núcleo de la partícula, triglicéridos y ésteres de colesterol, y la de los lípidos de su cubierta, fosfolípidos y colesterol libre, no se modifica, lo que indica que el tamaño de las VLDL secretadas no se ve afectado por la infección. Esto se ve apoyado por el hecho de que las proporciones molares de los lípidos analizados por partícula no variaran significativamente (datos no mostrados).
Figura 2. Efecto de la infección adenoviral sobre las concentraciones de lípidos y de apo B secretados en VLDL por hepatocitos de rata en cultivo durante las primeras 24 h postinfección. Los hepatocitos aislados se cultivaron e infectaron y las VLDL (d < 1,015 g/ml) secretadas se aislaron y caracterizaron como se describe en "Materiales y métodos". A) nmoles de triglicérido (TG), fosfolípido (PL), colesterol libre (CL) y éster de colesterol (EC) secretados. B) pmoles de apo B48, apo B100 y su suma, por mg de proteína celular. C) Contenido de lípido por molécula de apo B secretada. Los datos corresponden a la media ± error estándar de 10 cultivos por condición procedentes de 3 animales, analizados por duplicado. Las diferencias estadísticamente significativas respecto al grupo no infectado según la prueba de la t de Student se indican con *p < 0,05 y **p < 0,01, respectivamente. El análisis mediante ANOVA obtuvo significaciones estadísticas similares.
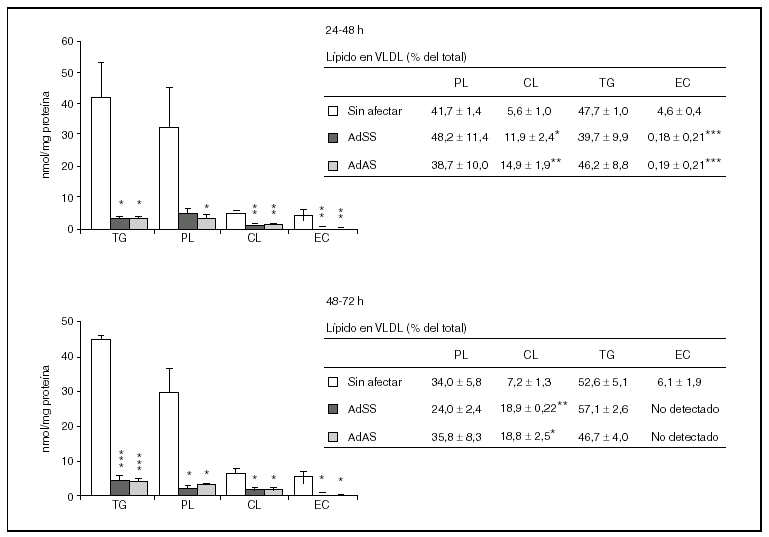
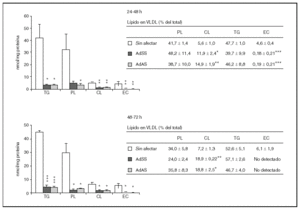
Durante los dos siguientes períodos de 24 h el descenso en la secreción de partículas VLDL debido a la infección es mucho más acusado y afecta tanto a la producción de apo B48 como a la de apo B100, que sólo son detectables mediante la tinción, no cuantitativa, con plata (datos no mostrados). Por el contrario, en los cultivos no infectados la cantidad de apo B secretada aumentó significativamente (p < 0,001) respecto al primer período de 24 h pasando de ser 0,62 ± 0,07 a 1,51 ± 0,29 y 1,83 ± 0,10 pmol/mg proteína celular (media ± error estándar) en el segundo y tercer períodos, respectivamente. En cuanto a los lípidos secretados en las VLDL durante el segundo y tercer períodos de 24 h (fig. 3), como era previsible, se produjo un descenso muy marcado en todas las clases analizadas como consecuencia de la infección. Además, es destacable el aumento de la proporción de colesterol libre y la disminución de la de colesterol esterificado en las lipoproteínas secretadas por los cultivos infectados, y las concentraciones de éster de colesterol llegaron a estar por debajo del límite de detección del método (4,6 pmol27), durante el tercer período de 24 h. Por otra parte, la relación, tanto en cantidades absolutas como en porcentajes molares, de los lípidos del núcleo respecto de los de la cubierta tampoco varió durante estos dos períodos.
Figura 3. Efecto de la infección adenoviral sobre las concentraciones de lípidos y su proporción molar en VLDL secretadas por hepatocitos de rata en cultivo durante el segundo y el tercer período de 24 h tras la infección. Los hepatocitos aislados se cultivaron e infectaron y las VLDL (d < 1,015 g/ml) secretadas se aislaron y caracterizaron como se describen en "Materiales y métodos". En los gráficos se muestran los nmoles de lípido secretados por mg de proteína celular, y en las tablas, los porcentajes molares que representa cada lípido analizado respecto al total analizado. Los datos corresponden a la media ± error estándar de 5 cultivos por condición procedentes de 3 animales, analizados por duplicado. Las diferencias estadísticamente significativas según la prueba de la t de Student respecto al grupo no infectado se indican con *p < 0,05, **p < 0,01 y ***p < 0,001, respectivamente. El análisis mediante ANOVA rindió significaciones estadísticas similares.
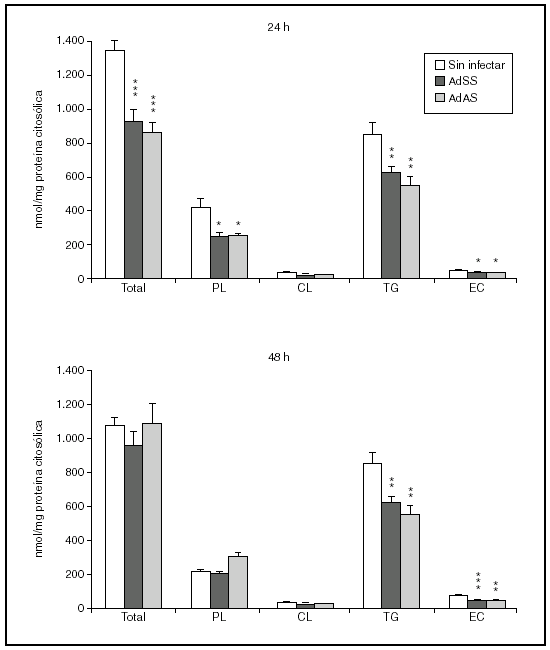
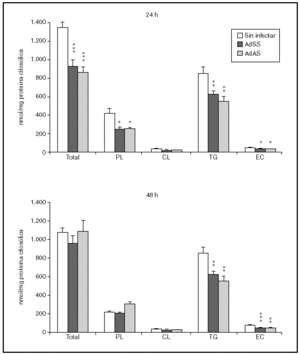
Se valoró a continuación si la baja salida de lípidos en VLDL generaba esteatosis hepatocelular. Para ello determinamos tras 24 o 48 h de la infección las concentraciones de triglicéridos, fosfolípidos, colesterol libre y colesterol esterificado de la fracción denominada citosólica, que contiene la fracción soluble del citoplasma así como los cuerpos lipídicos, el lugar de almacenamiento de triglicéridos y ésteres de colesterol en las células. Como se aprecia en la figura 4, el bloqueo en la secreción de VLDL no parece ir acompañado de una acumulación de lípido intracelular. A las 24 h de la infección, en los hepatocitos infectados no sólo no se observó un aumento en la cantidad de ninguno de los lípidos analizados sino que sus concentraciones, salvo las de colesterol libre, disminuyeron. Aunque a las 48 h de la infección las concentraciones de triglicéridos y fosfolípidos se equiparan a las existentes en el citosol de hepatocitos no infectados, el contenido de ésteres de colesterol fue todavía menor, suponiendo en torno al 50% del existente en el citosol de hepatocitos sin infectar.
Figura 4. Contenido en fosfolípido (PL), colesterol libre (CL), triglicéridos (TG) y éster de colesterol (EC) y su suma en la fracción citosólica de hepatocitos de rata no infectados o infectados con AdSS o AdAS. Los hepatocitos aislados se cultivaron e infectaron y la fracción citosólica se aisló; su contenido en lípidos se caracterizó como se describe en "Materiales y métodos". Los gráficos muestran los nmoles de lípido por mg de proteína citosólica en hepatocitos a las 24 y 48 h de la infección. Los datos corresponden a la media ± error estándar de 8 cultivos por condición procedentes de 3 animales, analizados por duplicado. Las diferencias estadísticamente significativas según la prueba de la t de Student respecto al grupo no infectado se indican con *p < 0,05, **p < 0,01 y ***p < 0,001, respectivamente. El análisis mediante ANOVA rindió significaciones estadísticas similares.
Discusión
Los adenovirus recombinantes, muy prometedores en un principio como vectores de transferencia génica a órganos tales como el hígado6,7,30, producen efectos asociados a la propia infección. Estos efectos secundarios, independientes del ADNc que contengan para ser transferido al tejido receptor, han de tenerse en cuenta a la hora de diseñar adenovirus recombinantes como vectores para una posible terapia génica. En este estudio se demuestra que, pese a que se utilizan dosis no citotóxicas, la infección causa alteraciones en una de las características específicas de este tipo celular: la secreción de VLDL. Aunque no es un estudio in vivo sino realizado en hepatocitos de rata en cultivo sobre colágeno y fibronectina, este modelo parece ser un buen sistema para estudiar el efecto del adenovirus en la secreción de VLDL, ya que los hepatocitos no infectados mantienen una elevada capacidad para metabolizar lípidos y secretar VLDL, al menos durante el tiempo estudiado. De hecho, la cantidad de apo B secretada no sólo se mantiene sino que aumenta conforme avanza el tiempo de cultivo, lo que indica que en estas condiciones hay una activa síntesis de apo B, una adecuada disponibilidad de lípido celular y un correcto funcionamiento de la proteína transferidora de triglicéridos (MTP), lo que evidencia un mantenimiento de la funcionalidad del hepatocito para ensamblar y secretar VLDL.
Los adenovirus recombinantes se han utilizado con éxito como vectores de transferencia génica en cultivos de hepatocitos para estudios funcionales de proteínas relacionadas con el metabolismo de lípidos31,32. Aun así, el bloqueo que producen en la secreción de VLDL a partir de las 24 h impide su utilización en estudios de caracterización de proteínas relacionadas con la producción de VLDL, durante períodos superiores a 24 h. Es destacable también el efecto de la infección sobre la esterificación del colesterol. El adenovirus induce claramente una menor presencia de éster de colesterol tanto en el interior celular como en las VLDL secretadas. Parece que la infección adenoviral favorece la hidrólisis de los ésteres de colesterol y/o inhibe su formación a partir del colesterol y ácidos grasos; esto sugiere que la infección puede tener una acción directa activando las colesterol esterasas, CEH, neutras y/o inhibiendo la acil-CoA:colesterol aciltransferasa, ACAT.
En ocasiones, el virus de la hepatitis C (VHC) causa un descenso en la secreción de VLDL, pero, a diferencia del efecto descrito en este trabajo, éste va asociado a una esteatosis hepatocelular. La causa del descenso en la secreción de triglicéridos y su consecuente acumulación celular parece deberse a la inhibición de la actividad MTP por la proteína NS5A, una de las proteínas no estructurales del virus de la hepatitis C15. Nuestros resultados descartan este tipo de relación causal en el caso de la infección con adenovirus y, por tanto, no estaría vinculada en principio a la transferencia de lípidos, sino quizá a su disponibilidad o, incluso, podría estar relacionada con la inhibición de la producción de apo B. En esta línea, un estudio reciente ha mostrado que cuando se reducen in vivo las concentraciones de apo B, mediante oligonucleótidos antisentido, se produce una disminución de las concentraciones de triglicéridos en VLDL y de colesterol de las lipoproteínas de baja densidad circulantes, sin producirse esteatosis en el hígado33.
Aunque limitar los estudios de caracterización funcional de proteínas del metabolismo de lípidos en cultivos de hepatocitos a 24 h puede suponer un inconveniente en investigación básica, el descenso de la secreción de VLDL debido a la infección adenoviral per se podría abrir nuevos horizontes en diferentes campos de la biomedicina.
En conclusión, los vectores adenovirales, además de actuar como vehículo de transferencia de ADN, provocan in vitro una disminución en la secreción de partículas VLDL por los hepatocitos, sin causar acumulación intracelular de lípidos.
Agradecimientos
A M. Busto y E. Belenchón por la asistencia técnica.