El aneurisma de aorta abdominal (AAA) es una grave enfermedad vascular en la que la inflamación, el estrés oxidativo y el remodelado destructivo de la aorta juegan un papel fundamental. Previamente, habíamos demostrado el incremento de la forma fosforilada de la ATP citrato liasa (p-ACLY) en el AAA y que el ácido bempedoico (BemA), inhibidor específico de este enzima, atenúa la formación de aneurismas en un modelo experimental. En este trabajo hemos profundizado en los mecanismos que median el efecto beneficioso del BemA.
MétodosSe indujo AAA a ratones ApoE-/- mediante la infusión de angiotensina II (AngII) y se evaluó la formación de aneurismas mediante ultrasonografía. Se realizaron análisis histológicos (hematoxilina-eosina, tinción de orceína) e inmunohistoquímicos. Las subpoblaciones de células T en el bazo se caracterizaron por citometría de flujo y la producción de anión superóxido en la pared vascular mediante tinción con dihidroetidio (DHE). La expresión de enzimas implicadas en el control del estrés oxidativo se analizó mediante RT-PCR en tiempo real.
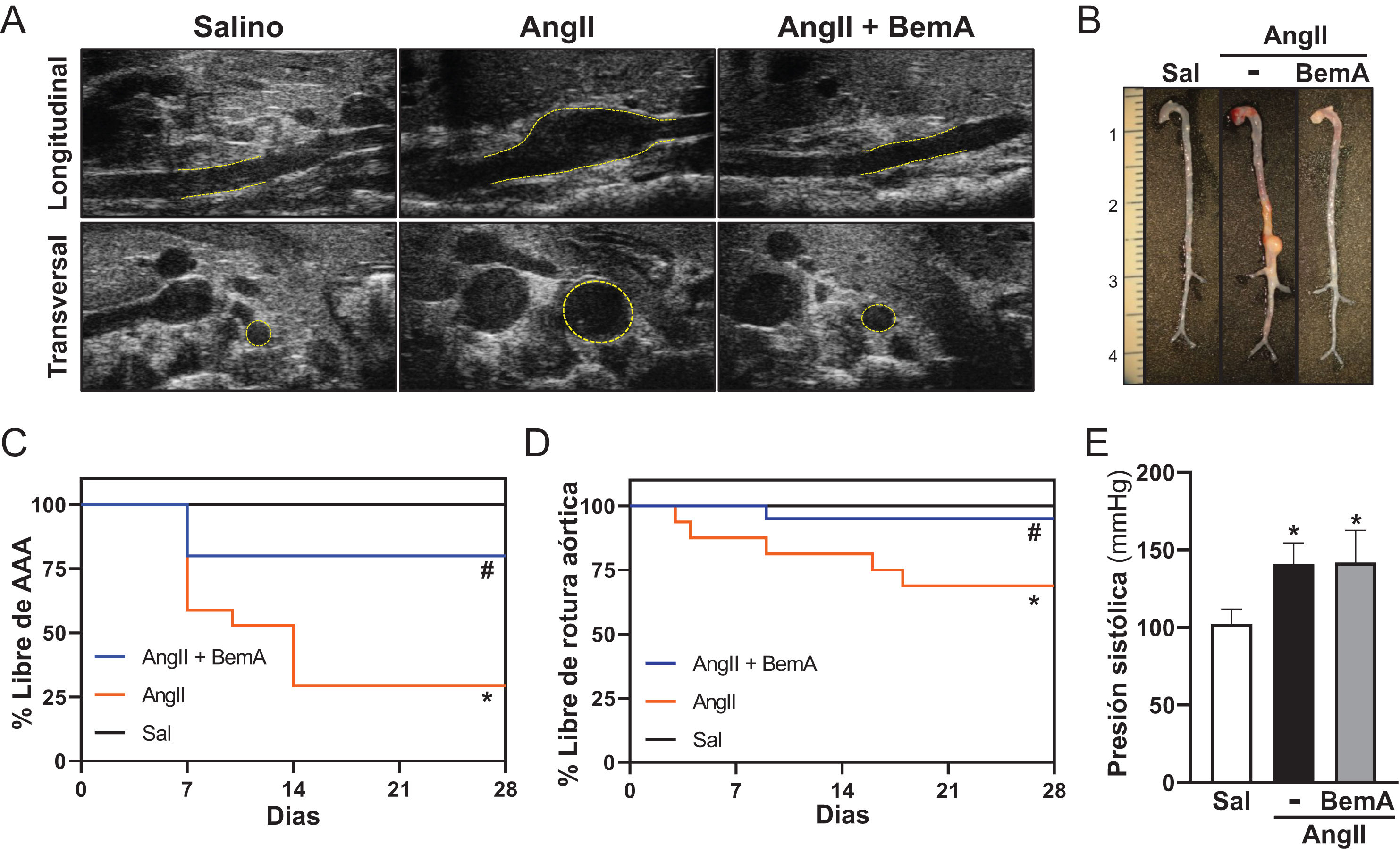
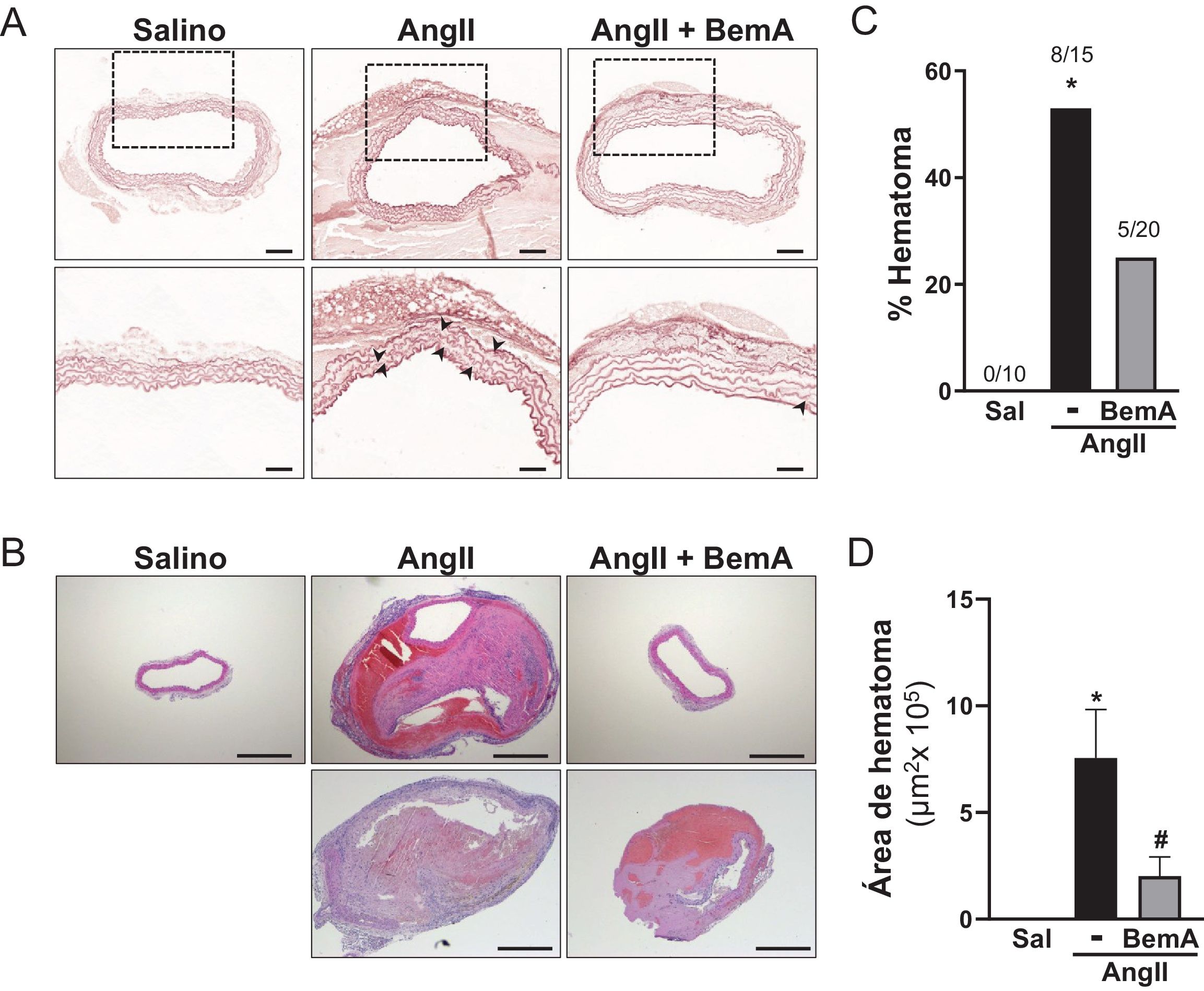
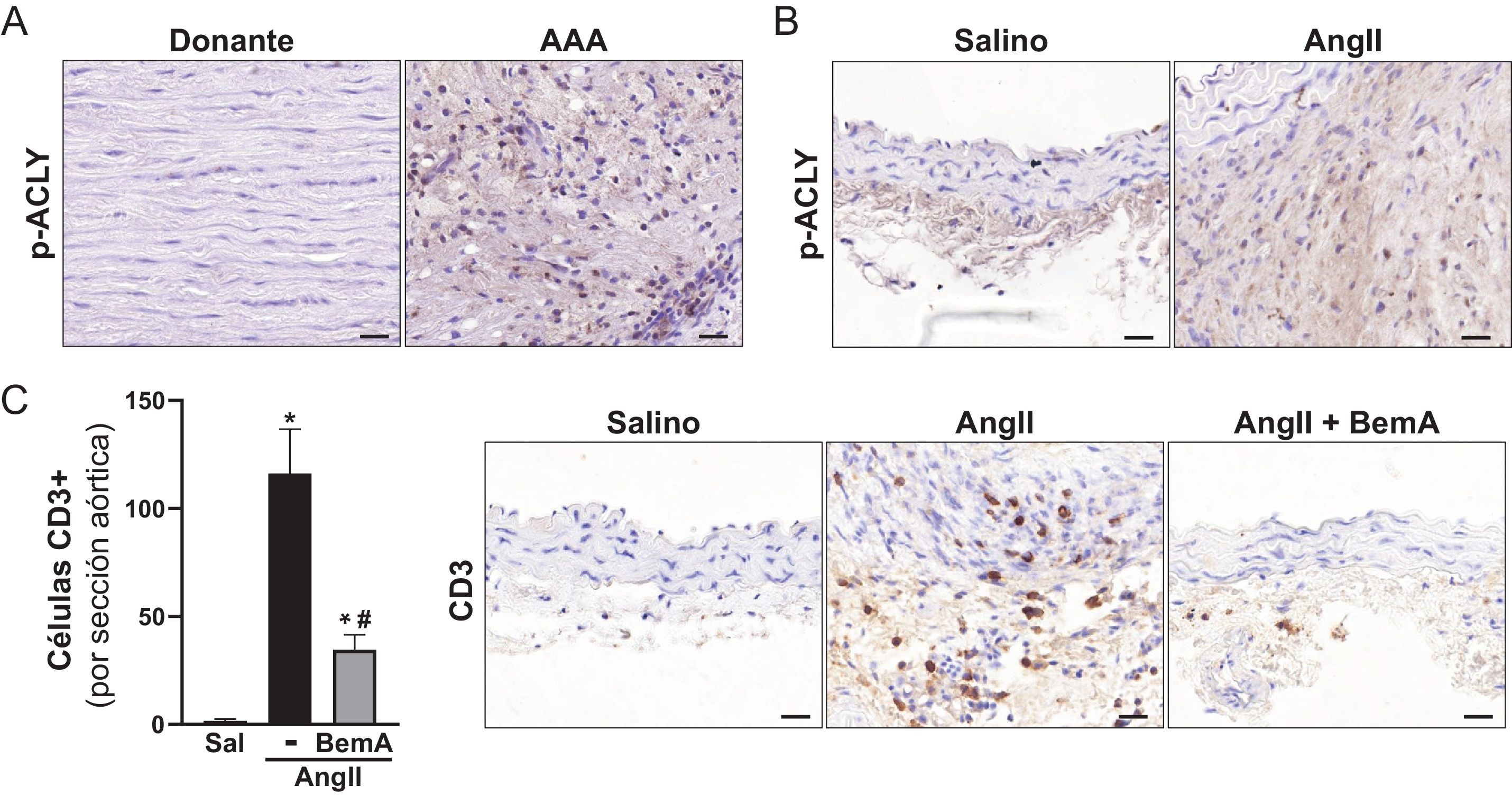
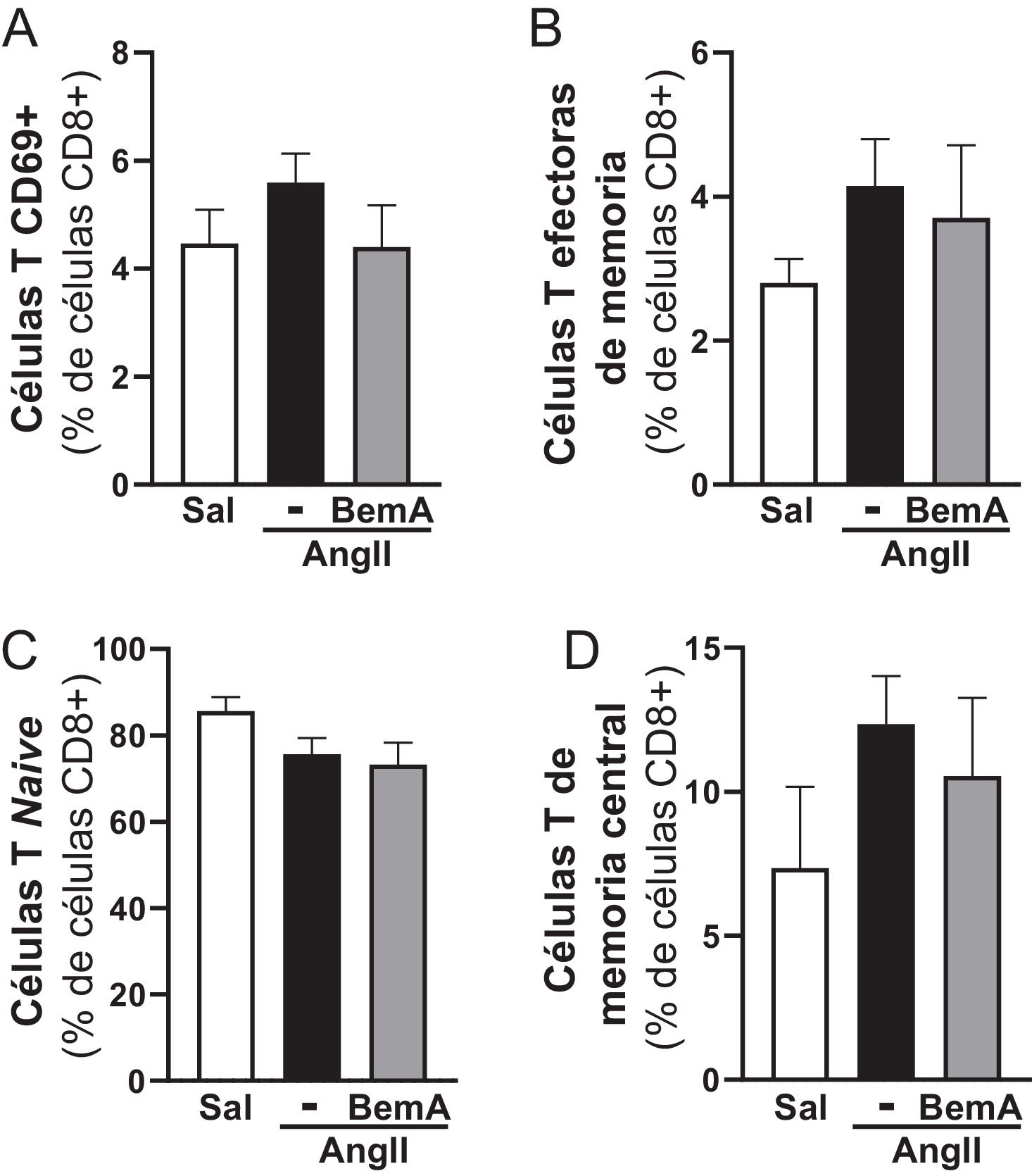
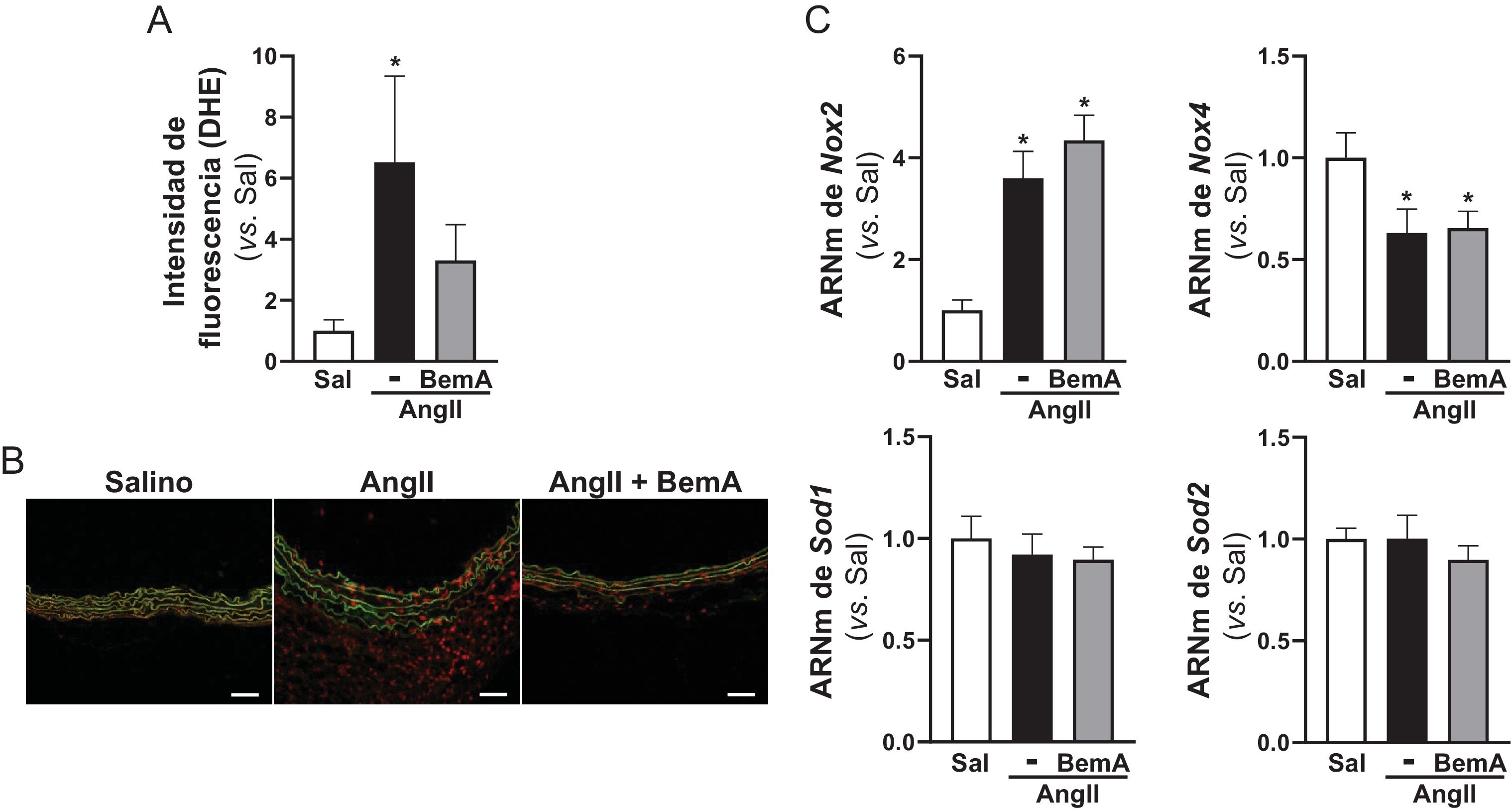
ResultadosLos análisis por ultrasonografía a punto final de ratones ApoE-/- infundidos con AngII confirmaron que el tratamiento con BemA limita la formación de aneurismas. De hecho, la administración de BemA a ratones infundidos con AngII, incrementó de manera significativa tanto el porcentaje de animales que no desarrollaron aneurisma como el de ratones libres de rotura aórtica, sin que se viera alterado el efecto presor de la AngII. Histológicamente, el BemA preservó la integridad de la pared aórtica y redujo la proporción de animales que presentaban trombos intramurales, con una disminución en el área del hematoma. Los análisis inmunohistoquímicos mostraron el incremento en el nivel de p-ACLY en el infiltrado inflamatorio de las lesiones aneurismáticas humanas y murinas, así como la capacidad del BemA para atenuar el incremento en el contenido de linfocitos T CD3+ en la pared vascular inducido por la AngII. A su vez, el análisis de las subpoblaciones de linfocitos T CD8+ en bazo no reveló cambios significativos ni en los animales infundidos con AngII, ni en aquellos que fueron tratados con BemA. Finalmente, la inhibición de la actividad ACLY disminuyó la producción de especies reactivas de oxígeno, pero sin modificar la expresión de isoformas clave de las familias de NADPH oxidasas (Nox2, Nox4), ni de superóxido dismutasas (Sod1, Sod2).
ConclusionesEn conjunto, estos hallazgos posicionan a la ACLY como una diana terapéutica relevante en el AAA, y al BemA como un fármaco con potencial protector frente al desarrollo y progresión de esta enfermedad vascular.
Inflammation, oxidative stress, and vascular remodeling play a key role in the pathophysiology of abdominal aortic aneurysm (AAA), a severe vascular disease. Previously, we had demonstrated an increase in the phosphorylated form of ATP citrate lyase (p-ACLY) in AAA and that bempedoic acid (BemA), a specific inhibitor of this enzyme, attenuates aneurysm formation in an experimental model. In this study, we further investigated the mechanisms mediating the beneficial effect of BemA.
MethodsAAA was induced by angiotensin II (AngII) infusion in ApoE-/- mice, and aneurysm formation was assessed by ultrasonography. Histological analyses (hematoxylin-eosin, orcein staining) and immunohistochemistry were performed. T cell subpopulations in the spleen were characterized by flow cytometry, and superoxide anion production in the vascular wall was evaluated by dihydroethidium (DHE) staining. The expression of enzymes involved in the control of oxidative stress was analyzed by real-time RT-PCR.
ResultsEndpoint ultrasonography analyses in AngII-infused ApoE-/- mice confirmed that BemA limits aneurysm formation. Indeed, BemA administration in AngII-infused mice significantly increased both the percentage of animals that did not develop aneurysms and those free of aortic rupture, without altering the pressor effect of AngII. Histologically, BemA preserved the integrity of the aortic wall and reduced the proportion of animals presenting intramural thrombi, with a decrease in hematoma area. Immunohistochemical analyses showed increased levels of p-ACLY in the inflammatory infiltrate of human and murine aneurysmal lesions, as well as BemA's capacity to attenuate the AngII-induced increase in CD3+ T lymphocyte content in the vascular wall. Additionally, analysis of splenic CD8+ T cell subpopulations revealed no significant changes in either AngII-infused animals or those treated with BemA. Finally, ACLY activity inhibition decreased reactive oxygen species production without modifying the expression of key isoforms of the NADPH oxidase (Nox2, Nox4) or superoxide dismutase (Sod1, Sod2) families.
ConclusionsTaken together, these findings position ACLY as a relevant therapeutic target in AAA and BemA as a drug with potential protective effects against the development and progression of this vascular disease