La evaluación y prevención del riesgo cardiovascular (RCV) que persiste en los pacientes con dislipidemia a pesar del tratamiento y de haber alcanzado los objetivos específicos de la concentración plasmática de colesterol unido a lipoproteínas de baja densidad (c-LDL) es un reto clínico en la actualidad, y sugiere que los biomarcadores lipídicos convencionales resultan insuficientes para una evaluación precisa del RCV. Más allá de su contenido lipídico, existen otras características propias de las partículas lipoproteicas que determinan su potencial aterogénico y su influencia en el RCV. Sin embargo, dichas características adicionales no pueden ser analizadas por las técnicas utilizadas habitualmente en los laboratorios clínicos. La espectroscopia por resonancia magnética nuclear (RMN) es una técnica que permite un análisis detallado de la cantidad, composición y tamaño de las lipoproteínas y proporciona información más detallada del estado del metabolismo lipídico y del RCV en los pacientes dislipémicos. En este artículo un grupo de lipidólogos de la Sociedad Española de Arteriosclerosis revisa la evidencia existente sobre los mecanismos aterogénicos de las partículas lipoproteicas y describen el fundamento técnico y la interpretación de los perfiles lipoproteicos obtenidos mediante RMN, haciendo especial referencia al test disponible en España (Liposcale®). Asimismo, se definen los principales perfiles de pacientes en los que dicho análisis aportaría una información de mayor interés clínico, los cuales son: a) sospecha de discordancia entre las concentraciones de lípidos y el número de partículas, situación frecuente en la diabetes, la obesidad, el síndrome metabólico y la hipertrigliceridemia; b) enfermedad cardiovascular aterotrombótica (ECVA) precoz o recurrente sin factores de RCV que la justifiquen; c) trastornos lipídicos infrecuentes o complejos como las concentraciones extremas de c-HDL, y d) situaciones clínicas en las que las técnicas analíticas clásicas no pueden aplicarse, como los valores de c-LDL muy bajos.
The assessment and prevention of cardiovascular risk (CVR) that persists in patients with dyslipidaemia despite treatment and achievement of goals specific to the plasma concentration of cholesterol linked to low density (c-LDL) is a clinical challenge today, and suggests that conventional lipid biomarkers are insufficient for an accurate assessment of CVR.
Apart from their lipid content, there are other lipid particle characteristics. The results of this study show that there are a number of lipoprotein compounds that determine atherogenic potential and its influence on the CVR. However, such additional characteristics cannot be analysed by the techniques commonly used in clinical laboratories. Nuclear Magnetic Resonance (NMR) is a technique that allows a detailed analysis to be made of the amount, composition, and size of lipoproteins, as well as providing more information about the detailed status of lipid metabolism and CVR in dyslipidaemia patients.
In this article a group of lipidologists from the Spanish Society of Arteriosclerosis review the existing evidence on the atherogenic mechanisms of particles and describe the technical basis and interpretation of the profiles lipoproteins obtained by MRI, with special reference to the test available in Spain (Liposcale®). Likewise, the main patient profiles are defined as such that an analysis would provide information of greater clinical interest. These include: a) Suspected mismatch between lipid concentrations and particles, a common situation in diabetes, obesity, metabolic syndrome; b) Early atherothrombotic cardiovascular disease (ECVA) or recurrent without CVR factors to justify it; c) Lipid disorders, rare or complex, such as extreme concentrations of c-HDL, and d) Clinical situations where classical analytical techniques cannot be applied, such as very low c-LDL values.
La enfermedad cardiovascular (ECV) es la principal causa de mortalidad en Europa, donde es responsable de más de 4millones de muertes anuales. Constituye, asimismo, una importante causa de morbilidad para la población y una enorme carga asistencial y económica para los sistemas sanitarios1. La prevención, tanto primaria como secundaria, a partir de la evaluación del riesgo cardiovascular (RCV) sigue siendo una estrategia fundamental para reducir el impacto y las consecuencias de la ECV de origen aterotrombótico (ECVA)2,3.
La dislipidemia, una alteración cuantitativa o cualitativa de las lipoproteínas plasmáticas, y entre ellas el aumento de la concentración de colesterol transportado por lipoproteínas de baja densidad (c-LDL), es primordial en la evaluación del riesgo de enfermedad aterosclerótica y constituye un factor modificable y fundamental de las estrategias de prevención en las últimas décadas2,3. Sin embargo, a pesar de los avances logrados, se observan episodios de ECVA en pacientes que no se clasifican de riesgo alto con las escalas de evaluación actuales e incluso en sujetos cuya concentración plasmática de c-LDL se encuentra dentro de los objetivos marcados por las guías. Dichos episodios conforman el denominado riesgo residual, es decir, el que persiste a pesar de la consecución de los objetivos de concentración de c-LDL y de los factores de RCV convencionales4,5. Ello sugiere que concurren otras alteraciones lipídicas y de otra índole que influyen en el RCV. En este sentido, y con referencia al metabolismo lipídico, se ha demostrado que la dislipidemia aterogénica (DA), definida como el desequilibrio entre lipoproteínas aterogénicas que contienen apoB ricas en triglicéridos y lipoproteínas antiaterogénicas que contienen apoA1, el incremento del colesterol remanente y las alteraciones cualitativas de las partículas LDL se relacionan con el riesgo residual5–7. Estas alteraciones pueden incrementar el riesgo de eventos CV hasta un 71%, incluso en pacientes tratados con fármacos y concentración plasmática de c-LDL en el objetivo8.
Por tanto, existen otras magnitudes relacionadas con el metabolismo lipídico involucradas en la aterogénesis y que van más allá de la concentración plasmática de colesterol, tanto del total como del c-LDL y del colesterol asociado al conjunto de lipoproteínas aterogénicas (colesterol-no HDL [c-no HDL]). Así, las características de las propias partículas lipoproteicas definen su potencial aterogénico9. Además, en el plano asistencial, es frecuente encontrar pacientes en quienes los biomarcadores lipídicos convencionales son insuficientes o que presentan limitaciones para su determinación, pudiendo ser infraestimado su RCV10.
Conocer el número, el tamaño y la composición de las lipoproteínas completa la información sobre el metabolismo lipídico y permite una evaluación más completa de la situación clínica de los pacientes. El estudio de las partículas lipoproteicas mediante resonancia magnética nuclear (RMN) permite esta evaluación metabólica. En esta revisión se ha considerado el análisis avanzado de lipoproteínas mediante el Liposcale®, desarrollado en España, que acerca esta técnica a la práctica clínica. Se basa en el análisis de una muestra de suero o de plasma mediante RMN bidimensional de difusión que permite ir un paso más allá en el estudio de lipoproteínas por RMN, ya que en un mismo análisis se puede obtener la concentración y composición lipídica de las lipoproteínas por un lado y el tamaño de las partículas por otro. La RMN bidimensional de difusión se basa en el estudio de la movilidad de las partículas dentro de un fluido (suero o plasma) que está asociada al tamaño de las mismas, lo que permite considerarla como una nueva generación en el contexto de esta metodología. Dicha técnica permite medir directamente la cantidad, el tamaño y la composición de las fracciones y subfracciones lipoproteicas11.
El objetivo de este artículo es establecer una serie de recomendaciones para su uso en la práctica clínica a partir de la revisión de la evidencia científica actual sobre el uso del análisis avanzado de lipoproteínas Liposcale®.
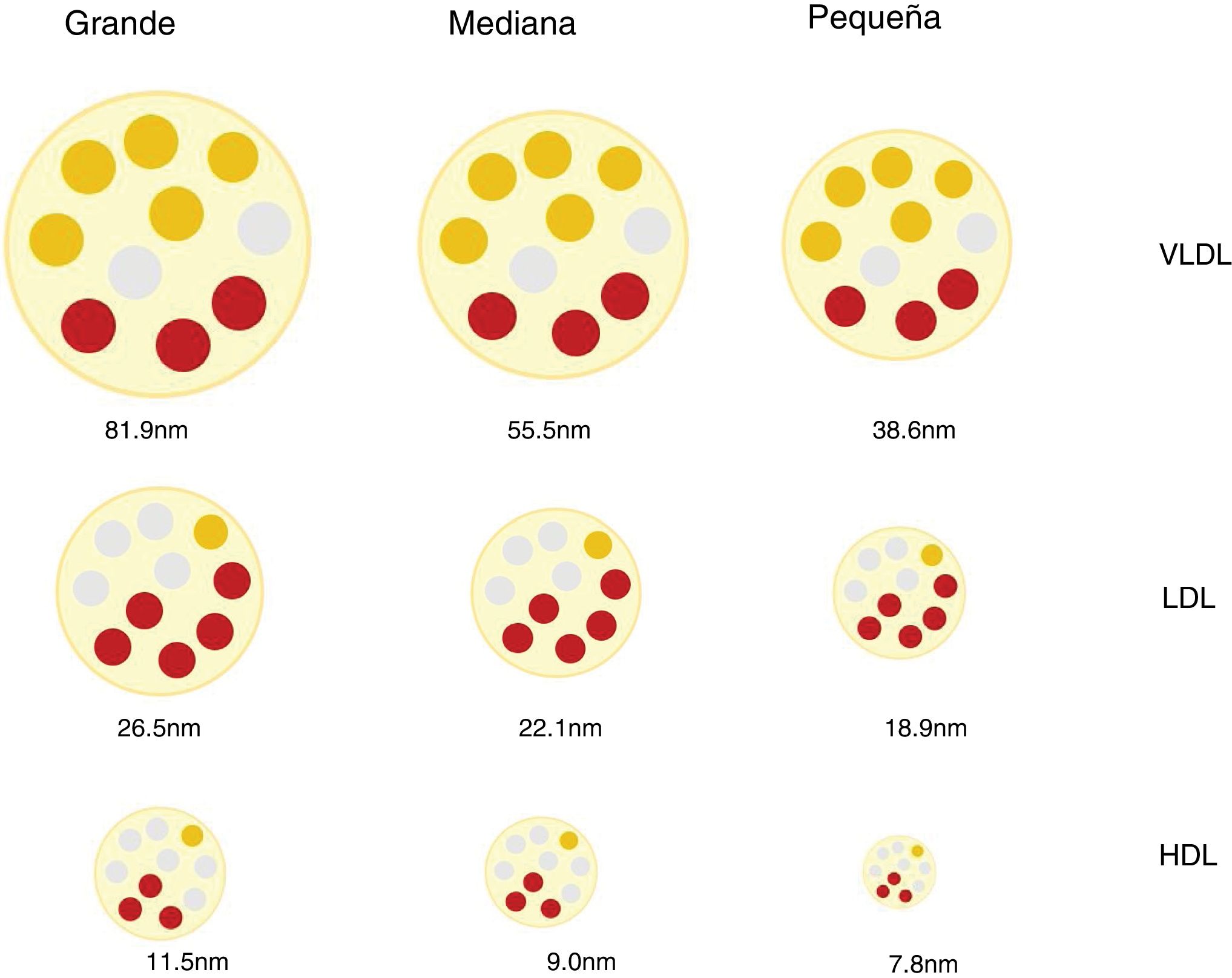
Partículas lipoproteicas, más allá de la concentración de colesterolInteracción con la pared arterial y mecanismos aterogénicosLas lipoproteínas son partículas esféricas cuyo núcleo se compone principalmente de lípidos no polares (ésteres de colesterol y triacilgliceroles) y cuya superficie está formada por una monocapa de lípidos polares (fosfolípidos y colesterol libre) y proteínas (apoproteínas). Son las encargadas de transportar el colesterol y los triglicéridos hasta los tejidos12. La diferente proporción entre lípidos y proteínas de las lipoproteínas condiciona su distinta densidad y permite clasificarlas en quilomicrones, lipoproteínas de muy baja densidad (VLDL), lipoproteínas de densidad intermedia (IDL), lipoproteínas de baja densidad (LDL) y lipoproteínas de alta densidad (HDL). Existe una relación inversa entre densidad y tamaño de las partículas lipoproteicas. Así las primeras son las de mayor tamaño y menor densidad y las últimas las de menor tamaño y mayor densidad12. A su vez, las diferentes clases de lipoproteínas pueden dividirse en subclases, ya que ni el tamaño ni la densidad de las lipoproteínas son realmente valores discretos (fig. 1).
Estas diferencias en el número, tamaño y composición de las lipoproteínas son relevantes en el proceso aterosclerótico e influyen en su aterogenicidad9,13 (p.ej., partículas LDL pequeñas y densas en la diabetes mellitus y el síndrome metabólico14,15) y en el RCV asociado16,17.
La aterogénesis es un proceso de progresiva y compleja interacción entre las células y moléculas circulantes, la pared vascular y las modificaciones en las características del flujo sanguíneo que dan lugar a la formación de depósitos lipídicos en la íntima arterial y a la activación de la respuesta inflamatoria. Las lipoproteínas desempeñan un papel principal en este proceso18.
La pared arterial intacta puede ser atravesada libremente por las partículas LDL y otras lipoproteínas asociadas con la apoB (IDL, VLDL) cuyo diámetro sea inferior a 70nm, pudiendo interaccionar con los proteoglicanos de la pared y siendo susceptibles de quedar retenidos en la matriz extracelular9,19. De acuerdo con el modelo de retención y respuesta, una vez atravesada la barrera endotelial, puede producirse, en sitios susceptibles, una retención selectiva de las LDL, particularmente de las de pequeño tamaño, debido a su capacidad de unión a los proteoglicanos de la matriz extracelular de la íntima, lo que constituye el evento primario del proceso aterogénico y desencadena una serie de modificaciones en las lipoproteínas y de respuestas locales, incluyendo alteraciones del endotelio con aumento de permeabilidad a las partículas LDL, reclutamiento de monocitos que facilitarán la formación de células espumosas y cambios inflamatorios que resultan a su vez en más retención y progresión de la placa de ateroma9,20–22.
La concentración y el tamaño de las partículas circulantes y la permeabilidad de la pared arterial son factores que condicionan el influjo transendotelial de las lipoproteínas, de modo que la elevada concentración de partículas y un diámetro reducido favorecen el paso hacia la íntima, aumentando su potencial aterogénico9,20. Además, el potencial de retención de las LDL está condicionado por la afinidad de estas por los proteoglicanos, en la cual influye la composición lipídica y proteica de las lipoproteínas22.
En cuanto a las lipoproteínas IDL y VLDL ricas en triglicéridos altamente heterogéneas en tamaño, densidad y composición, también existe una relación inversa entre su tamaño y la capacidad de atravesar el endotelio vascular23. Las VLDL remanentes generadas tras la acción enzimática de la lipoproteína lipasa (LPL) son más pequeñas y enriquecidas en colesterol. Las partículas de menor diámetro pueden penetrar en la pared arterial y ser captadas directamente por los macrófagos, originando células espumosas que quedan atrapadas en la íntima, donde interaccionan con otras enzimas y mediadores que contribuyen a la respuesta inflamatoria y a la formación de la placa9,24.
Las HDL no contienen apoB y desempeñan un papel esencial en el transporte del colesterol desde los tejidos periféricos al hígado, dentro de una heterogénea y compleja función biológica que incluye efectos antiinflamatorios y citoprotectores. La composición de las HDL es un condicionante importante de dichas funciones, y se modifica en situaciones asociadas a inflamación, obesidad o hipertrigliceridemia25. Se ha demostrado que la función de las HDL está alterada en los pacientes con diabetes mellitus, ECVA, enfermedad renal crónica (ERC) o enfermedades autoinmunes y sistémicas, como la sarcoidosis, de modo que la función originalmente protectora de estas lipoproteínas se transformaría hacia un efecto aterogénico como resultado de las modificaciones producidas por la respuesta inflamatoria25,26. Respecto a esto, se ha observado que la correlación inversa existente en individuos sanos entre c-HDL y mortalidad CV es menor en pacientes con enfermedad coronaria estable y desaparece en aquellos con enfermedad inestable25.
Discordancia entre la concentración plasmática de c-LDL y la concentración de partículas LDLEl tamaño de las lipoproteínas LDL es variable y depende del contenido lipídico de su núcleo, lo que a su vez condiciona la densidad de la partícula. Aplicando diversas técnicas de análisis se han identificado diferentes partículas de LDL que se han clasificado de forma arbitraria y práctica en pequeñas, medianas y grandes, y cuya densidad es inversamente proporcional a su tamaño27.
En la cantidad de colesterol de las LDL y en la génesis de las lipoproteínas LDL pequeñas y densas (sdLDL), que contienen menos colesterol esterificado y no esterificado que las LDL grandes, intervienen diferentes mecanismos, entre los que se incluyen la acción de la proteína transportadora de ésteres de colesterol (CETP) y la lipoproteína lipasa (LPL). En situaciones de alteración metabólica, como el exceso producción de partículas VLDL grandes, las LDL resultantes quedan relativamente deplecionadas de colesterol y enriquecidas en triglicéridos (TG). Posteriormente, estos últimos disminuyen por la acción de la lipasa hepática (LH), lo que reduce el tamaño de las LDL, dando como resultado un aumento de partículas sdLDL27,28. Este mismo mecanismo afecta a las HDL29, lo que explica, en parte, la relación observada entre hipertrigliceridemia, sdLDL y el déficit de c-HDL27. Cabe mencionar que estos mecanismos favorecedores de la producción de sdLDL tienen lugar sobre todo en situaciones metabólicas asociadas a la resistencia a la insulina como las que existen en la DA, la obesidad abdominal, el síndrome metabólico, la enfermedad renal y en los procesos inflamatorios crónicos30.
Debido a la variabilidad en el contenido de colesterol de las partículas LDL, la concentración de c-LDL no refleja fielmente la cantidad de partículas existentes (p-LDL), especialmente en las condiciones antes mencionadas. Así, una cantidad elevada de p-LDL puede asociarse a unas concentraciones de c-LDL normales, lo que significaría que existe un exceso de partículas de pequeño tamaño, cuyo contenido en colesterol es bajo, pero cuyo potencial aterogénico es elevado. Al contrario, una concentración elevada de c-LDL puede coexistir con una cantidad normal de partículas, lo que significaría que estas son predominantemente ricas en colesterol y de mayor tamaño, con menor aterogenicidad relativa30. Estas situaciones sirven de base al concepto de discordancia c-LDL:p-LDL, cuya definición varía dependiendo de los valores de corte elegidos, de la mediana poblacional para cada parámetro o de los valores absolutos de cada uno establecidos como umbral de normalidad30. Diversos estudios han demostrado que las p-LDL muestran mejor asociación con el riesgo de progresión de aterosclerosis y de episodios de ECVA que el c-LDL y, de hecho, en pacientes que presentan discordancia, el número de p-LDL es mejor indicador del RCV16,31,32. A la inversa, una cantidad baja de p-LDL también ha demostrado ser un indicador más sensible de menor RCV que el c-LDL o el c-no HDL33.
La consecuencia más importante que se deriva de la discordancia entre la concentración de c-LDL y la cantidad de p-LDL es que puede implicar infra- o sobreestimaciones del RCV de un paciente16,30,31. Dado que toda la estrategia terapéutica de las dislipidemias tiene como objetivo la prevención de la ECVA y el tratamiento de cada paciente se basa en su nivel de RCV, una valoración imprecisa o insuficiente del grado de RCV debido a esta discordancia es de gran importancia práctica. De hecho, se conoce que en la monitorización del tratamiento con estatinas el objetivo del c-LDL resulta a menudo insuficiente a los efectos del control del RCV, habiéndose demostrado que la monitorización terapéutica basada en el número de partículas de LDL permite una mejor valoración del riesgo residual10.
Importancia pronóstica del número, el tamaño y la composición de las lipoproteínas en las enfermedades cardiovascularesComo se ha expuesto previamente y de acuerdo con los factores que influyen y condicionan la aterogénesis, el potencial aterogénico de las lipoproteínas ricas en colesterol varía, siendo mayor en las LDL pequeñas y densas. Además, las lipoproteínas ricas en triglicéridos y sus partículas residuales derivadas, también se consideran aterogénicas, dado que pueden atravesar el endotelio y alcanzar la pared arterial20,23. El valor pronóstico del tamaño, número y composición de las lipoproteínas se ha evaluado en múltiples estudios clínicos17,31,33,34.
Un estudio realizado en la cohorte de Framingham mostró que la baja concentración de p-LDL (por debajo del percentil 25) era un indicador más sensible de menor riesgo de ECVA que una concentración equivalente de c-LDL y de c-no-HDL33. También se ha observado que las concentraciones plasmáticas de colesterol transportado por sdLDL tienen una fuerte correlación con un perfil lipídico aterogénico y se asocian significativamente con la enfermedad coronaria incidente, incluso en individuos con bajo RCV según su concentración de c-LDL34. Resultados similares se obtuvieron en otro amplio estudio realizado por el grupo de Samia Mora, en el que se observó que un número elevado de p-LDL era un mejor predictor de enfermedad coronaria entre mujeres con baja concentración plasmática de c-LDL respecto a la concentración de c-LDL31. Asimismo, en mujeres con una concentración elevada de c-LDL, la presencia de una baja concentración de p-LDL fue un mejor predictor de RCV31. Incluso el tratamiento basado en la concentración de p-LDL ha mostrado mejores resultados en cuanto a incidencia de ECVA que el basado en las concentraciones de c-LDL17.
Estudios recientes han corroborado que las partículas LDL de menor tamaño son un factor independiente de RCV35 y que el tamaño de las partículas dentro del espectro VLDL-LDL también se relaciona con el riesgo residual en los pacientes tratados con estatinas36. La proporción de las subfracciones de partículas LDL de mayor y menor tamaño también se relaciona con el RCV, de modo que una menor proporción de subfracciones grandes y mayor de subfracciones pequeñas se ha asociado con un incremento del RCV. Incluso el cambio de patrón de composición, con aumento de la cantidad relativa de partículas pequeñas y disminución de la de partículas grandes, se asocia con un aumento del RCV37. En resumen, la cantidad y el tamaño de las partículas han demostrado una relación más robusta con la enfermedad vascular que los biomarcadores lipídicos tradicionales (c-LDL, c-HDL, TG)38.
Por otra parte, el colesterol asociado a partículas remanentes de quilomicrones y VLDL, que se define como el colesterol transportado por las partículas lipoproteicas que no son HDL ni LDL, ha sido identificado como un factor predictor de enfermedad coronaria independiente de la concentración de c-HDL y c-LDL39,40, con un incremento del riesgo de 2,8 veces por cada 39mg/dl de aumento39, y como factor predictor de mortalidad por cualquier causa41. A la inversa, la baja concentración de colesterol remanente se asocia con una disminución del riesgo de enfermedad isquémica42. Sin embargo, y a pesar de su importancia pronóstica, la concentración de colesterol remanente no puede obtenerse de forma fiable con las técnicas de laboratorio de determinación más habituales, lo que sí permiten las técnicas de RMN24.
A la luz de lo anterior y dado que la aterogenicidad del colesterol y de los TG depende de las lipoproteínas en las que están contenidos, la determinación del número, el tamaño y la composición de estas partículas puede proporcionar información de alto valor para una evaluación más precisa del RCV en la práctica clínica.
Métodos disponibles en la práctica clínica actual para el estudio del perfil lipídico y de las lipoproteínas plasmáticasA) Perfil lipídico estándarEl perfil lipídico estándar se realiza mediante análisis bioquímico a partir de una muestra de suero midiéndose la concentración de colesterol, triglicéridos, y colesterol de las lipoproteínas -HDL.
La concentración de c-LDL se estima en la práctica habitual de forma indirecta, mediante la fórmula de Friedewald (c-LDL=CT−c-HDL−TG/5 [o TG/2,21 en SI])43. Este método no está exento de limitaciones derivadas de los propios principios de los que parte, ya que el resultado de la fórmula también incluye el colesterol de las IDL y de la lipoproteína (a) [Lp(a)]. La fórmula asume que existe una proporción de colesterol vs. TG constante en las partículas VLDL y desprecia tanto los quilomicrones como un posible exceso de partículas remanentes. En la práctica, ello significa que la fórmula infraestima el c-LDL conforme los TG aumentan, de modo que a partir de una concentración de TG de 200mg/dl el resultado de la concentración de c-LDL calculado comienza a infraestimarse. Según las publicaciones más relevantes, la fórmula no debe aplicarse cuando la concentración de triglicéridos es superior a 400mg/dl, en los que se ha comprobado que existe un error total superior al permisible tras compararlo con el método de referencia. Además, en pacientes con concentraciones plasmáticas de c-LDL inferiores a 70mg/dl podría obtenerse un valor calculado de c-LDL inferior a cero44,45. Sin embargo, la mayoría de estudios y los valores de referencia en diversas poblaciones se han realizado con esta fórmula, aplicándola cuando es posible teniendo en cuenta sus limitaciones.
También existen métodos que miden directamente el c-LDL en la muestra de suero sin separación previa, aunque tienen algunas limitaciones, entre las que se encuentra la concentración elevada de triglicéridos y la discrepancia entre los resultados obtenidos con reactivos de diferentes fabricantes.
Una alternativa al c-LDL calculado es obtener el colesterol perteneciente a las lipoproteínas excluyendo el colesterol de las HDL, comúnmente denominado colesterol no-HDL. Se calcula restando de la concentración de colesterol la del colesterol obtenido de las HDL. Es un cálculo que refleja la concentración de colesterol transportado por todas las partículas aterogénicas24,44. Su valor como factor predictor de RCV ha sido establecido en diferentes estudios36,46–48 y se considera un indicador de riesgo residual dado que incluye el colesterol de las partículas remanentes24,44. El c-no HDL ha sido incluido como objetivo terapéutico en múltiples guías clínicas2,3,49,50, aunque debe tenerse en cuenta que las situaciones de hipertrigliceridemia también pueden afectar a la precisión de los métodos de medición del c-HDL necesario para su cálculo.
Cabe considerar que el perfil lipídico básico aporta información de la concentración de colesterol total y no-HDL, y de las lipoproteínas HDL, LDL y de los triglicéridos totales, pero no de otros aspectos como el número de partículas, su composición o el tamaño de las mismas, que son características relacionadas con su distinto potencial aterogénico.
B) ApoB y apoA1La medición de la concentración de masa de apoB-100 se considera actualmente una posible alternativa al cálculo del c-no HDL. Su análisis se realiza por métodos inmunoturbidimétricos que no requieren la situación de ayuno y que son trazables a un patrón de calibración (OMS/IFCC SP3-07)44. Por cada lipoproteína VLDL inicialmente secretada por el hígado solo hay una molécula de apoB, que además permanece en la lipoproteína a lo largo de toda su vida metabólica, de modo que la concentración de apoB se considera una medida directa del número total de partículas lipoproteicas aterogénicas. Las últimas guías sobre el manejo de la dislipidemia publicadas por las Sociedades Europeas de Cardiología y de Aterosclerosis3 establecen que este marcador es importante para evaluar el metabolismo lipídico. En situación de normotrigliceridemia, la concentración de masa de apoB se corresponde en su mayoría con la contenida en las LDL, debido a su mayor vida media (días) comparada con las VLDL (horas)24. Su valor como factor predictor de RCV ha sido demostrado y es superior al del c-LDL44. Una de las limitaciones de la medición de apoB es el haber no constituido un objetivo terapéutico en los ensayos clínicos44. Sin embargo, varias guías de práctica clínica recomiendan su determinación y establecen objetivos terapéuticos secundarios a los del c-LDL. Hay que tener en cuenta que si bien se asocia al número de partículas aterógenas, no aporta información sobre el tipo de partícula, su tamaño, ni sobre la distribución de las lipoproteínas en las que se encuentra24,51. En otras palabras, una molécula de apoB señala tanto la presencia de una VLDL grande como de una sdLDL.
La concentración de masa de apoA1 también se analiza por inmunoturbidimetría y los métodos actuales poseen calibradores trazables a estándares internaciones OMS/IFCC SP1-01 sin necesidad de obtener la muestra en ayunas. El índice ApoB:ApoA1 puede usarse para la valoración de la DA y el RCV6,44. Algunos estudios han demostrado que el aumento de apoA1, pero no el de c-HDL, se asocia a una reducción del RCV en pacientes tratados con estatinas52. A diferencia de lo que sucede con la apoB, cada partícula de HDL puede contener de 1 a 5 moléculas de apoA1, por lo que su medición no puede considerarse equivalente a la cantidad de lipoproteínas HDL. Además, la medición de apoA1 tampoco refleja la funcionalidad de las lipoproteínas HDL.
C) Estudio de las partículas lipoproteicasExisten diversas técnicas analíticas que permiten la separación y caracterización de las partículas lipoproteicas.
La ultracentrifugación con gradiente de densidad es la técnica de referencia para la separación y cuantificación de las lipoproteínas plasmáticas. Esencialmente, se crea un gradiente discontinuo de densidad durante la centrifugación que permite que las lipoproteínas se vayan separando y acumulando en capas de acuerdo a sus densidades, pudiendo determinarse la concentración de los distintos lípidos de cada una de ellas. Sin embargo, su principal limitación es que es muy laboriosa y consume mucho tiempo de análisis, lo cual se traduce en un elevado coste y en una falta de viabilidad para los laboratorios de análisis clínicos con un gran volumen de muestras53,54.
Diversas técnicas cromatográficas como la cromatografía líquida de alta resolución en gel (GP-HPLC) permiten la separación de las lipoproteínas basándose en el diámetro de las partículas, ya que las de pequeño tamaño presentan tiempos de elución más prolongados que las grandes. Con esta técnica se pueden fraccionar las lipoproteínas según su tamaño, pero requiere combinación con métodos enzimáticos para la cuantificación de los lípidos, son técnicas laboriosas y dependientes del operador55.
Los métodos electroforéticos permiten la separación y análisis de las lipoproteínas basándose en su tamaño. Permiten una aproximación al tamaño de las partículas LDL, HDL, VLDL y sus subclases, pero requiere la preparación ad hoc de los geles y existe una falta de intercambiabilidad de resultados entre laboratorios al no existir patrones internacionales54,56, lo que supone un claro inconveniente para su uso clínico.
El análisis de la movilidad iónica (ion mobility) se basa en el principio de que las lipoproteínas se comportan de forma diferente según el tamaño cuando son transportadas por un flujo laminar de aire sometido a un campo eléctrico. Estas diferencias de movilidad electroforética de las partículas lipoproteicas en fase gaseosa permiten determinar su tamaño y cuantificación por subfracciones57,58. Esta técnica requiere de un pretratamiento de la muestra complejo que introduce una elevada variabilidad de resultados entre laboratorios, además de requerir una importante infraestructura técnica, haciéndola poco apta para su uso clínico.
En cualquier caso, y aparte de las limitaciones intrínsecas de cada técnica, respecto a los biomarcadores medidos y que incluyen los procedimientos de preparación y manipulación de las muestras, una elevada cualificación del personal del laboratorio y gran consumo de tiempo y recursos, entre otras.
Liposcale® y perfiles lipoproteicosFundamento técnico de la medición directa de las partículas lipoproteicasDesde hace años se ha utilizado la RMN para determinar la concentración en suero o plasma de las partículas lipoproteicas, así como su tamaño e inferir su composición.
Su fundamento parte de que el colesterol esterificado y los triglicéridos que son transportados en el interior de las lipoproteínas contienen en su estructura molecular grupos metilo que, bajo la influencia de pulsos de radiofrecuencia, resuenan a frecuencias ligeramente diferentes en función del tamaño de la lipoproteína que los transporta, generando así un espectro de dichas frecuencias. A menor tamaño de la lipoproteína, más baja es la frecuencia de resonancia de los lípidos de su núcleo. Por tanto, empleando técnicas analíticas basadas en la RMN es posible medir el tamaño de las lipoproteínas de forma directa.
El test Liposcale® es un método basado en la espectroscopia de RMN en 2 dimensiones, en el que se analiza la atenuación de las señales de los picos lipídicos cuando estos son sometidos a un gradiente de campo magnético conocido. La diferencia en la atenuación de las señales se asocia a una difusión de las partículas lipoproteicas diferencial (Diffusion Ordered Nuclar Magnetic Resonance Spectroscopy [DOSY-NMR]). Del estudio DOSY-RMN bidimensional se pueden conocer las características hidrodinámicas de las moléculas, como el coeficiente de difusión asociado a cada subclase de lipoproteína. A partir de la medición de los coeficientes de difusión se calculan directamente los tamaños de las diferentes subclases de lipoproteínas a través de la ecuación de Stokes-Einstein11,59. La medida directa del tamaño es de particular importancia ya que se utiliza para calcular finalmente el número de partículas de lipoproteínas dividiendo el volumen espacial de las moléculas de lípidos totales por el volumen medio.
Liposcale® es el resultado de un proyecto desarrollado en España que ofrece una nueva generación tecnológica basada en el uso de la RMN para el estudio de las lipoproteínas.
El espectro generado por Liposcale® se traduce en información acerca del número y tamaño de las partículas lipoproteicas distribuidas de forma arbitraria en tres fracciones (VLDL, LDLy HDL) y tres subfracciones en cada una de ellas. De forma adicional se determina el contenido de colesterol y TG en cada tipo de lipoproteína11. La concentración de c-LDL, así como el número de partículas LDL, incluyen Lp(a) no pudiendo ser cuantificada de forma individualizada con esta técnica.
Los estudios de validación de Liposcale® han demostrado superioridad frente a Lipoprofile® en cuanto a la correlación entre el número de partículas lipoproteicas y la concentración de apoproteínas en las subfracciones aisladas por ultracentrifugación. Asimismo, se ha demostrado su excelente correlación con datos sobre el tamaño de partículas circulantes determinados por microscopia electrónica11.
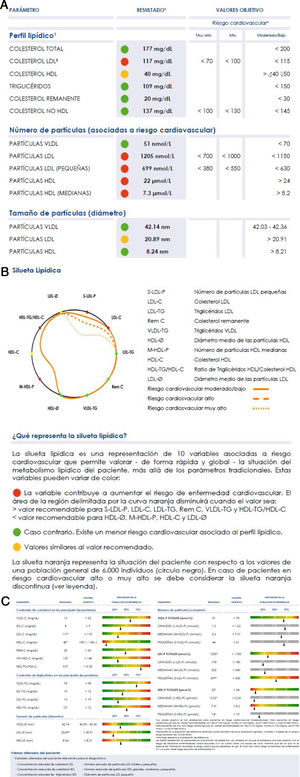
Valores lipoproteicos y silueta lipídicaEl análisis de Liposcale® produce más de 25 variables relacionadas con las partículas lipoproteicas:
- •
concentración de partículas de las lipoproteínas VLDL, LDL y HDL y de sus respectivas subclases (grandes, medianas y pequeñas);
- •
tamaño (diámetro) medio de las lipoproteínas VLDL, LDL y HDL;
- •
concentración de colesterol y triglicéridos de las clases principales de lipoproteínas (VLDL, IDL, LDL y HDL).
El amplio número de datos, si bien subraya el enorme potencial de la técnica, dificulta su uso clínico, que requiere simplicidad interpretativa, por ello se ha diseñado una representación gráfica de los principales resultados que de forma sencilla informa sobre la situación del perfil lipoproteico del paciente con respecto al perfil de referencia que mostramos en la figura 2. La silueta naranja representa la situación del paciente con respecto a los valores de una población general de 6.000 individuos (círculo negro). La silueta del individuo delimita un área menor cuando las variables presentan valores asociados a mayor riesgo de desarrollar enfermedades cardiovasculares (valores por encima del percentil 70 en VLDL-C, VLDL-TG, VLDL-P, LDL-C, LDL-TG, S-LDL-P, HDL-TG o por debajo del percentil 30 en LDL-Ø, HDL-Ø, HDL-C y M-HDL-P); y un área mayor en caso contrario. En caso de que las variables contribuyan a disminuir claramente el área de la región delimitada por la curva, aparecen en rojo; en caso contrario aparecen en verde. Si el valor resulta similar al percentil 70 o 30, según la clasificación de las variables mencionadas anteriormente, se representa en amarillo.
El test Liposcale® caracteriza los perfiles de lipoproteínas plasmáticas y detecta las alteraciones que predisponen a la ECVA, lo que permite una actuación clínica preventiva37,60–62 más allá de los valores del colesterol aterogénico (c-LDL o c-no HDL) o de los triglicéridos totales.
Indicaciones del estudio del perfil lipoproteico completo con RMNEs un hecho notorio que la ECVA sigue apareciendo en pacientes que mantienen unas concentraciones de c-LDL dentro de los objetivos. Ello es debido a que existe el denominado riesgo residual5, en el que la DA tiene un papel principal5–7.
La DA es frecuente en los pacientes con diabetes mellitus, obesidad, síndrome metabólico, enfermedad renal crónica, hiperlipemia familiar combinada y síndrome del ovario poliquístico, entre otras patologías, todas ellas asociadas a un mayor RCV6. En estos pacientes, la medición de las concentraciones de c-LDL se considera insuficiente para evaluar el RCV relacionado con las alteraciones del metabolismo lipídico y, por ello, se recomienda la determinación de biomarcadores adicionales, como el c-no HDL o la apoB6,44. Sin embargo, como ya se ha comentado, las concentraciones de c-no HDL se ven directamente influidas por la concentración de TG hasta el punto de que la correlación entre el c-LDL y el c-no HDL disminuye conforme aumentan los TG63, con lo que no nos informa del tipo de lipoproteínas presentes. La apoB es un biomarcador que de forma directa da información sobre el número de partículas lipoproteicas, sin embargo, no distingue el tipo de partículas aterógenas ni sus tamaños.
Si bien Liposcale® ofrece una información de utilidad clínica, sobre el número, composición y tamaño de las partículas lipoproteicas, su coste, que es superior al de los parámetros estándar, obliga a definir los grupos de pacientes en los que tiene una mayor utilidad clínica para contribuir a la toma de decisiones diagnósticas y terapéuticas.
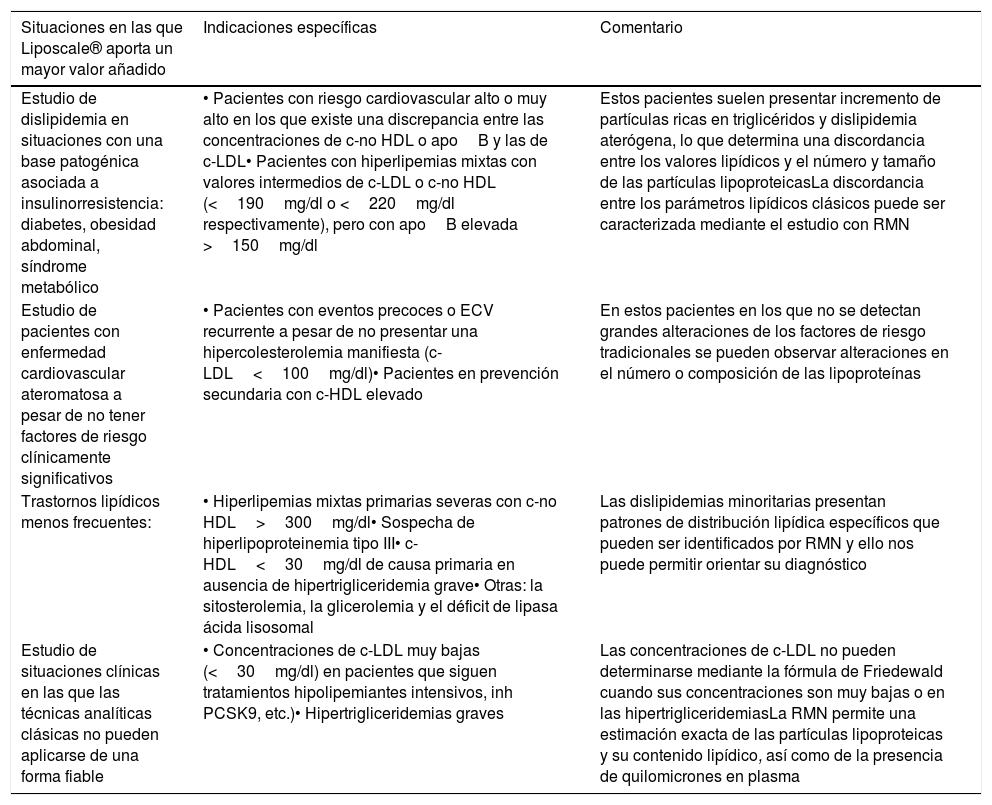
En la tabla 1 se muestran los grupos de pacientes en los que el test avanzado de lipoproteínas (Liposcale®) puede ser de mayor utilidad clínica.
Pacientes en los que el test avanzado de lipoproteínas (Liposcale®) puede ser de mayor utilidad clínica
| Situaciones en las que Liposcale® aporta un mayor valor añadido | Indicaciones específicas | Comentario |
|---|---|---|
| Estudio de dislipidemia en situaciones con una base patogénica asociada a insulinorresistencia: diabetes, obesidad abdominal, síndrome metabólico | • Pacientes con riesgo cardiovascular alto o muy alto en los que existe una discrepancia entre las concentraciones de c-no HDL o apoB y las de c-LDL• Pacientes con hiperlipemias mixtas con valores intermedios de c-LDL o c-no HDL (<190mg/dl o <220mg/dl respectivamente), pero con apoB elevada >150mg/dl | Estos pacientes suelen presentar incremento de partículas ricas en triglicéridos y dislipidemia aterógena, lo que determina una discordancia entre los valores lipídicos y el número y tamaño de las partículas lipoproteicasLa discordancia entre los parámetros lipídicos clásicos puede ser caracterizada mediante el estudio con RMN |
| Estudio de pacientes con enfermedad cardiovascular ateromatosa a pesar de no tener factores de riesgo clínicamente significativos | • Pacientes con eventos precoces o ECV recurrente a pesar de no presentar una hipercolesterolemia manifiesta (c-LDL<100mg/dl)• Pacientes en prevención secundaria con c-HDL elevado | En estos pacientes en los que no se detectan grandes alteraciones de los factores de riesgo tradicionales se pueden observar alteraciones en el número o composición de las lipoproteínas |
| Trastornos lipídicos menos frecuentes: | • Hiperlipemias mixtas primarias severas con c-no HDL>300mg/dl• Sospecha de hiperlipoproteinemia tipo III• c-HDL<30mg/dl de causa primaria en ausencia de hipertrigliceridemia grave• Otras: la sitosterolemia, la glicerolemia y el déficit de lipasa ácida lisosomal | Las dislipidemias minoritarias presentan patrones de distribución lipídica específicos que pueden ser identificados por RMN y ello nos puede permitir orientar su diagnóstico |
| Estudio de situaciones clínicas en las que las técnicas analíticas clásicas no pueden aplicarse de una forma fiable | • Concentraciones de c-LDL muy bajas (<30mg/dl) en pacientes que siguen tratamientos hipolipemiantes intensivos, inh PCSK9, etc.)• Hipertrigliceridemias graves | Las concentraciones de c-LDL no pueden determinarse mediante la fórmula de Friedewald cuando sus concentraciones son muy bajas o en las hipertrigliceridemiasLa RMN permite una estimación exacta de las partículas lipoproteicas y su contenido lipídico, así como de la presencia de quilomicrones en plasma |
Por último, cabe destacar que el estudio del perfil lipídico mediante RMN puede ser de gran utilidad en las situaciones de riesgo cardiovascular o de dislipidemia mal definidas mediante los estudios clínicos y de laboratorio convencionales. En estas situaciones, los datos aportados por la RMN permiten definir con mayor precisión las alteraciones de la estructura y composición de las lipoproteínas y el RCV asociado.
ConclusionesLa espectrometría de RMN 2D en la que se basa Liposcale® permite un análisis directo del metabolismo lipídico más allá de los parámetros clínicos habituales, ya que permite diferenciar propiedades de las distintas lipoproteínas en sus respectivas subfracciones, y caracterizarlas en cuanto a composición y tamaño, y cuantificar el número de cada una de estas partículas. De esta información más completa y detallada de las alteraciones del metabolismo lipoproteico y del RCV asociado se pueden beneficiar especialmente ciertos perfiles de pacientes, entre los que se incluyen los que presentan: a) sospecha de discordancia entre las concentraciones de lípidos y el número de partículas, como por ejemplo en casos de diabetes, obesidad, síndrome metabólico e hipertrigliceridemia; b) ECVA precoz o recurrente sin factores de RCV que la justifiquen; c) trastornos lipídicos infrecuentes o complejos, como las concentraciones extremas de c-HDL, y d) situaciones clínicas en las que las técnicas analíticas clásicas no pueden aplicarse, como los valores de c-LDL muy bajos.
FinanciaciónAgradecemos a Laboratorios Rubió la financiación de la reunión en la que se inició el debate que ha dado origen a este artículo así como la labor de la redactora médica. Laboratorios Rubió no han influido en el contenido del manuscrito y los autores han realizado su labor científica con total independencia.
Conflicto de interesesXP, LM, FC, JR, DI, JP, JLD y PV: han recibido honorarios por conferencias y/o trabajos de asesoría de diversos laboratorios farmacéuticos involucrados en terapias hipolipemiantes. NA y LM son accionistas de la spin-off de la Universidad Rovira i Virgili: BiosferTeslab; CB y EM no presentan ningún conflicto de interés.