Los pacientes con artritis reumatoide tienen 2 a 3 veces mayor riesgo cardiovascular; se debe en parte al patrón de los lípidos los cuales aumentan el índice aterogénico.
MétodosSe incluyó a 82 pacientes, a quienes se les determinó el perfil lipídico. Se registraron variables asociadas a la enfermedad y los fármacos empleados. Se calculó el riesgo aterogénico. Se empleó la chi al cuadrado para las variables categóricas y la prueba de Mann-Whitney para las continuas. Se realizó ANOVA para determinar relación entre las medias del perfil lipídico y un modelo de regresión logística para determinar la asociación de las variables con la presencia de dislipidemia.
ResultadosEl 54,9% presentó dislipidemia. Se encontró diferencia significativa entre la presencia de dislipidemia y factor reumatoide positivo (p=0,005), obesidad (p=0,007), remisión de la enfermedad (p=0,037) y PCR ≥ 2mg/dl (p=0,024); no se encontró diferencia significativa entre la presencia de dislipidemia y el género, la edad y la evolución de la enfermedad. La obesidad (RR 4,79, IC del 95%, 1,5-5,1; p=0,008) se asoció independientemente a la presencia de dislipidemia. El uso de hidroxicloroquina (RR 0,31, IC del 95%, 0,1-0,92; p=0,035) se asoció independientemente a la ausencia de dislipidemia. La media del índice aterogénico de Castellí fue 4,36, la del índice de Kannel fue 2,59 y la del índice triglicéridos/c-HDL fue 3,83. El 61% presentó síndrome metabólico.
ConclusionesLos pacientes con artritis reumatoide presentan un perfil de lípidos proaterogénico; es importante conocerlo y tratarlo para disminuir el riesgo cardiovascular.
Dyslipidaemia is one of the main risk factors for atherosclerotic cardiovascular disease. Patients with rheumatoid arthritis have 2-3 times more cardiovascular risk, which is partly due to the pattern of lipids which increase the atherogenic index.
MethodsA descriptive, cross-sectional, observational and prospective study was conducted on 82 patients, selected for their lipid profile. Variables associated with the disease and the drugs used were recorded. Atherogenic risk was calculated, with Chi square being used for categorical variables, and the Mann-Whitney test for the continuous ones.
ResultsThe dyslipidaemia frequency was 54.9%. The most frequent age range of dyslipidaemia was between 51 and 60 years. Patients with type i obesity had a higher frequency of dyslipidaemia. Less dyslipidaemia was found with a lower rate of disease activity. Patients with cyclic citrullinated anti-peptide antibodies and positive rheumatoid factor, erythrocyte sedimentation rate>13mm or CRP>2mg/L had a higher frequency of dyslipidaemia. The mean Castelli atherogenic index was 4.36, the index of Kannel was 2.59, and triglycerides/HDL-c ratio was 3.83.Patients with dyslipidaemia showed a higher frequency of positive rheumatoid factor (P=.0008), and those patients who were taking hydroxychloroquine had a lower frequency of dyslipidaemia P=.03.
ConclusionsPatients with rheumatoid arthritis have a pro-atherogenic lipid profile. It is important to know this and treat it to reduce cardiovascular risk.
La artritis reumatoide (AR) es una enfermedad autoinmune sistémica, inflamatoria y crónica, con una prevalencia aproximadamente del 0,5-1%1,2.
Se define como dislipidemia (DLP) un conjunto de patologías asintomáticas en las cuales existe anormalidades en los niveles plasmáticos de colesterol, triglicéridos, colesterol HDL (c-HDL) (lipoproteína de alta densidad) y colesterol LDL (c-LDL) (lipoproteína de baja densidad)3.
La DLP es uno de los principales factores de riesgo cardiovascular presentes en la población en general, con una prevalencia del 50-80% según los diferentes autores4,5.
Los pacientes con AR tienen 2 a 3 veces mayor riesgo cardiovascular en comparación con la población en general; este riesgo es atribuible a los efectos desfavorables que produce la inflamación mediada por citocinas sobre el endotelio, así como su efecto en los factores de riesgo tradicionales, como la resistencia a la insulina y la DLP6.
El papel de la DLP en la ateroesclerosis es sumamente conocido, de igual manera se ha observado la presencia de DLP hasta en el 49% de los pacientes con AR como consecuencia de la liberación de citocinas como IL-1, IL-6 y factor de necrosis tumoral (TNF), produciendo un estado proaterogénico7,8.
El patrón de los lípidos en la AR es igual al de otras enfermedades inflamatorias9, la inflamación crónica y la actividad de la enfermedad condicionan una reducción de las lipoproteínas totales y c-LDL, y una disminución más marcada de c-HDL, aumentado así el índice aterogénico10. El perfil de lípidos que presentan los pacientes con AR es claramente prooxidativo, favoreciendo, junto con el daño endotelial, el desarrollo de una placa de ateroma subclínica y rápidamente progresiva11,12.
Las citocinas ejercen efectos sobre el tejido adiposo liberando ácidos grasos libres; a nivel hepático incrementan la síntesis de ácidos grasos libres y triglicéridos; a nivel del endotelio vascular disminuyen la actividad de la lipoproteína lipasa, enzima catabólica de los lípidos ricos en triglicéridos. Los niveles elevados de triglicéridos traen como consecuencia reducción del c-HDL por intercambio neutral de lípidos y promueven la síntesis de c-LDL13.
La actividad de la enfermedad y el estado inflamatorio crónico se invierte con el empleo de glucocorticoides y fármacos antirreumáticos modificadores de la enfermedad (FARME), y en menor grado con los bloqueadores del TNF14. El empleo crónico de glucocorticoides se ha asociado a elevación de lipoproteína de muy baja densidad y c-LDL, pero no de c-HDL, con la consiguiente elevación de los triglicéridos y colesterol total15,16. La hidroxicloroquina (HCQ) produce disminución de los niveles de colesterol total, c-LDL y triglicéridos, y aumento del c-HDL17-19. Se ha observado que la azatioprina eleva los niveles plasmáticos de c-LDL, colesterol total y triglicéridos17. El metotrexato disminuye los niveles de triglicéridos, eleva los niveles de c-HDL y disminuye el riesgo de presentar síndrome metabólico (SM)20,21. La leflunomida produce elevación del colesterol y los triglicéridos22.
La inflamación produce efectos sobre el perfil de lípidos, tanto en el nivel de concentración como de composición23,24. En la AR se pueden encontrar diferentes concentraciones de lípidos en diferentes etapas de la enfermedad: en los años previos al inicio de la enfermedad existe elevación de triglicéridos y c-LDL, en la enfermedad temprana y con datos de actividad existe reducción del colesterol y c-HDL25. Por lo tanto, las concentraciones de lípidos pueden fluctuar debido a la inflamación crónica, haciendo menos claro el impacto de estos cambios sobre el riesgo cardiovascular. Sin embargo, el índice aterogénico es menos susceptible a las fluctuaciones de la actividad de la enfermedad, por lo que es adecuado para evaluar el efecto de los lípidos en el riesgo cardiovascular en los pacientes con AR. El índice de actividad de la enfermedad puede ser medida por medio del DAS-28 basado en el conteo de 28 articulaciones dolorosas e inflamadas, a menor grado de control de la enfermedad nos habla de mayor proceso inflamatorio26.
Es bien sabido que la DLP es uno de los principales factores de riesgo para la cardiopatía isquémica, de tal manera que realizar detecciones tempranas y un intervención terapéutica precoz disminuye el riesgo de desarrollo de enfermedad cardiovascular, por lo que se realizó el siguiente estudio con el objetivo determinar las características del perfil de lípidos en los pacientes con AR.
Material y métodosSe realizó un estudio descriptivo, transversal, observacional y prospectivo. El universo estuvo conformado por los pacientes con el diagnóstico de AR según los criterios ACR/EULAR 2010 que acudieron a la consulta externa del servicio de Reumatología del Hospital Regional de Alta Especialidad Dr. Gustavo A. Rovirosa Pérez, durante el periodo de enero a diciembre del 2014, siendo un total de 126 pacientes, de los cuales solo 82 cumplieron con los criterios de inclusión. Se incluyó a aquellos pacientes mayores de 18 años que desearon participar en el estudio; se excluyó a los pacientes con el diagnóstico previo de DLP independientemente de la causa, que presentaron otras enfermedades reumatológicas, que tomen estatinas, fibratos u otros hipolipidemiantes, y pacientes con diagnóstico de diabetes mellitus (DM) o algún tipo de cardiopatía o evento vascular cerebral previo. Se revisaron los expedientes clínicos y se registraron como variables la edad, el género, el colesterol total, c-HDL y c-LDL, los triglicéridos y la glucosa sérica, así como factores asociados a la AR, como la duración de la enfermedad, la actividad de la enfermedad mediante DAS-28 PCR, los niveles de proteína C reactiva (PCR), el factor reumatoide (FR) positivo y el empleo de FARME (azatioprina, metotrexato, HCQ, leflunomida) y los glucocorticoides.
La participación en el estudio fue autorizada por cada paciente firmando un consentimiento informado, con la aprobación previa del Comité de Bioética del Hospital.
Medición de variables antropométricasSe pesó a los pacientes con una balanza, previamente calibrada, descalzos y con ropa ligera, expresando los resultados en kilogramos. Se midió la estatura por medio de un tallímetro estándar con el paciente en posición de pie, expresando los resultados en metros. Con estos resultados se calculó el índice de masa corporal (IMC) por medio de la fórmula peso/talla2 (kg/m2), clasificando los resultados en los rangos de bajo peso:<18,5 kg/m2; normal: 18,5-24,9 kg/m2; sobrepeso: 25-29,9 kg/m2, y obesidad>30 kg/m2.
Con el paciente en posición de bipedestación, se midió con cinta métrica el perímetro de la cintura, considerándose como normal valores<102cm en hombres y<88cm en mujeres.
Determinación de los parámetros bioquímicosA cada paciente se le extrajo 10ml de sangre venosa en la región antecubital por la mañana (8:00-9:00h), con un ayuno previo mínimo de 8 h, para obtener resultados de triglicéridos, colesterol total, c-HDL, PCR y glucosa. Los niveles de c-LDL se obtuvieron de manera indirecta a través de la fórmula de Friedewald.
Se definió como hipercolesterolemia niveles de c-LDL>160mg/dl, hipertrigliceridemia niveles de triglicéridos>200mg/dl, hipoalfalipoproteinemia niveles de c-HDL<40mg/dl, hiperlipidemia mixta cuando presentaron c-LDL>160mg/dl y triglicéridos>200mg/dl, tríada lipídica cuando presentaron c-LDL>160mg/dl, triglicéridos>200mg/dl y c-HDL<40mg/dl.
Se consideraron como niveles positivos de PCR>2mg/l y niveles de glucosa ≥ 100mg/dl.
Determinación de factores relacionados con la enfermedadSe registró el tiempo de duración de la enfermedad, se evaluó la actividad de la enfermedad mediante el DAS-28 PCR clasificándose como remisión<2,3, actividad leve ≥ 2,3 a<3,8, actividad moderada ≥ 3.8 a<4,9 y actividad grave ≥ 4,9. Se consideró FR positivo con valores por encima de 15 UI/ml.
Determinación de índice aterogénicoSe determinó el índice aterogénico de Castellí (colesterol total/c-HDL), se consideró como riesgo bajo un valor<4,5, moderado los valores entre 4,5 y 7, y riesgo alto valores>7. Se calculó el índice de Kannel (c-LDL/c-HDL) con riesgo bajo los resultados<3 y alto ≥ 3. Se obtuvo el índice triglicéridos/c-HDL; se consideraron como riesgo bajo los resultados<3 y alto ≥ 3.
Determinación de síndrome metabólicoCon el paciente sentado, después de un reposo de 20 min, se tomó la presión arterial con un esfigmomanómetro manual de mercurio adecuado al grosor del brazo de cada paciente, considerándose como cifras normales la presión arterial sistólica (PAS)<130mmHg y la presión arterial diastólica (PAD)<85mmHg.
Con los resultados obtenidos, se clasificó a los pacientes con presencia de SM según los criterios del ATP-III27.
Análisis estadísticoSe realizó un análisis estadístico por medio del paquete estadístico SPSS 15.0 para Windows, considerando como resultado significativo un valor de p ≤ 0,05.
Las variables categóricas se presentaron como frecuencias y porcentajes, y fueron comparadas con la prueba de la chi al cuadrado. Las variables continuas se presentaron como media ± desviación estándar o media y rango intercuartil, y fueron comparadas con la prueba no paramétrica de Mann-Whitney. Se realizó el análisis de varianza (ANOVA) de un factor para determinar relación entre las medias del perfil lipídico. Finalmente, se utilizó un modelo de regresión logística multivariante para determinar la asociación de las variables estudiadas con la presencia de DLP.
ResultadosDurante el periodo establecido acudieron a la consulta externa de reumatología 126 pacientes con el diagnóstico de AR; solo 82 cumplieron los criterios de inclusión.
El 54,9% de los pacientes estudiados presentaron DLP. El 26,8% presentó descenso del c-HDL, el 24,4% elevación de triglicéridos y el 40,2% elevación del c-LDL. La distribución de las alteraciones en el perfil de lípidos se resume en la tabla 1, siendo más frecuente la hipercolesterolemia.
Distribución por frecuencia de los pacientes con AR y DLP según el número de alteraciones que presentaron en el perfil de lípidos
| Total (%) | ||
|---|---|---|
| Una | Hipercolesterolemia | 13(28,9) |
| Hipertrigliceridemia | 5(11,1) | |
| Hipoalfalipoproteinemia | 5(11,1) | |
| Dos | Hipercolesterolemia e hipoalfalipoproteinemia | 7(15,6) |
| Hiperlipidemia mixta | 5(11,1) | |
| hipertrigliceridemia e Hipoalfalipoproteinemia | 3(6,6) | |
| Tres | Triada lipídica | 7(15,6) |
Total de pacientes dislipidémicos 45.
Total de pacientes no dislipidémicos 37.
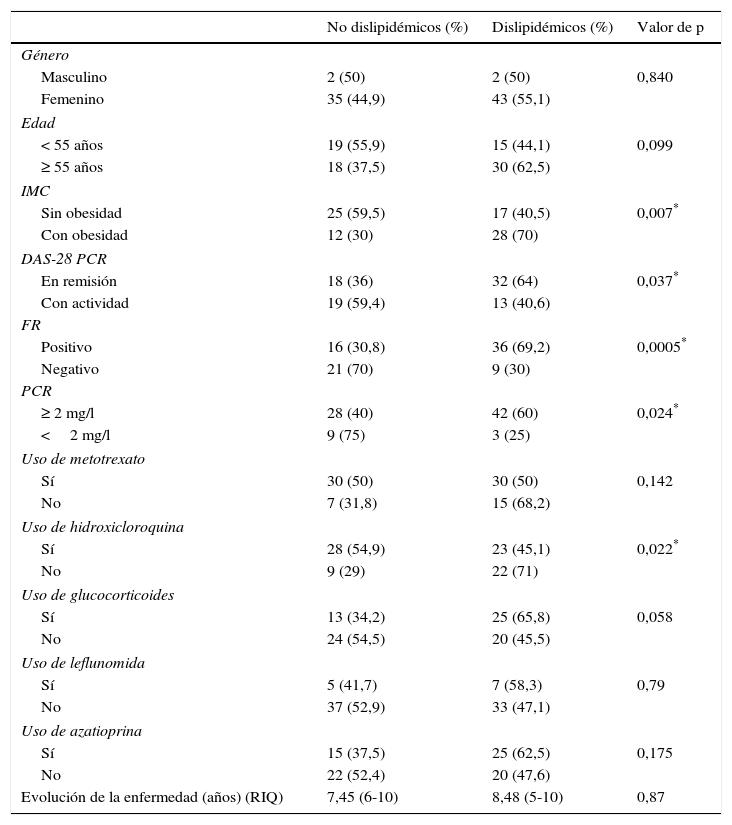
La tabla 2 resume las características generales de los pacientes dislipidémicos y no dislipidémicos, determinando la asociación entre estas y la presencia de DLP mediante la chi al cuadrado y la prueba de Mann-Whitney. Predominó el género femenino con un 95,1%, no se encontró diferencia significativa entre el género y el desarrollo de DLP (p=0,84). La media de la edad de diagnóstico fue de 56,7±12,5 años, no se encontró significación entre la edad y el desarrollo de DLP. Con respecto al IMC, predominó el sobrepeso con el 31,4%, seguido de la obesidad tipo i con el 29,3%, el 19,5% tuvo peso normal, un 9,8% presentó obesidad tipo ii y un 9,8% obesidad mórbida; se encontró significación entre la presencia de obesidad y el desarrollo de DLP (p=0,007). Según el índice de actividad, el 61% de los pacientes se encontraban en remisión, el 31,7% tenía actividad leve, el 4,9% moderada y el 2,4% grave. Se encontró relación significativa entre la remisión de la enfermedad y la presencia de DLP (p=0,037). Se encontró un relación significativa entre la presencia de DLP y el FR positivo (p=0,0005) y la presencia de DLP y niveles de PCR ≥ 2mg/dl (p=0,024). Con lo que respecta al empleo de FARME y glucocorticoides, solo se encontró diferencia significativa para la ausencia de DLP en aquellos pacientes que empleaban HCQ (p=0,022).
Distribución de los pacientes dislipidémicos y no dislipidémicos según sus características generales
| No dislipidémicos (%) | Dislipidémicos (%) | Valor de p | |
|---|---|---|---|
| Género | |||
| Masculino | 2 (50) | 2 (50) | 0,840 |
| Femenino | 35 (44,9) | 43 (55,1) | |
| Edad | |||
| < 55 años | 19 (55,9) | 15 (44,1) | 0,099 |
| ≥ 55 años | 18 (37,5) | 30 (62,5) | |
| IMC | |||
| Sin obesidad | 25 (59,5) | 17 (40,5) | 0,007* |
| Con obesidad | 12 (30) | 28 (70) | |
| DAS-28 PCR | |||
| En remisión | 18 (36) | 32 (64) | 0,037* |
| Con actividad | 19 (59,4) | 13 (40,6) | |
| FR | |||
| Positivo | 16 (30,8) | 36 (69,2) | 0,0005* |
| Negativo | 21 (70) | 9 (30) | |
| PCR | |||
| ≥ 2 mg/l | 28 (40) | 42 (60) | 0,024* |
| <2 mg/l | 9 (75) | 3 (25) | |
| Uso de metotrexato | |||
| Sí | 30 (50) | 30 (50) | 0,142 |
| No | 7 (31,8) | 15 (68,2) | |
| Uso de hidroxicloroquina | |||
| Sí | 28 (54,9) | 23 (45,1) | 0,022* |
| No | 9 (29) | 22 (71) | |
| Uso de glucocorticoides | |||
| Sí | 13 (34,2) | 25 (65,8) | 0,058 |
| No | 24 (54,5) | 20 (45,5) | |
| Uso de leflunomida | |||
| Sí | 5 (41,7) | 7 (58,3) | 0,79 |
| No | 37 (52,9) | 33 (47,1) | |
| Uso de azatioprina | |||
| Sí | 15 (37,5) | 25 (62,5) | 0,175 |
| No | 22 (52,4) | 20 (47,6) | |
| Evolución de la enfermedad (años) (RIQ) | 7,45 (6-10) | 8,48 (5-10) | 0,87 |
FR: factor reumatoide; IMC: índice de masa corporal; PCR: proteína C reactiva; RIQ: rango intercuartil.
La media de tiempo de evolución de la enfermedad fue 8±4,5 años, no se encontró diferencia significativa entre el tiempo de evolución de la enfermedad y la presencia de DLP.
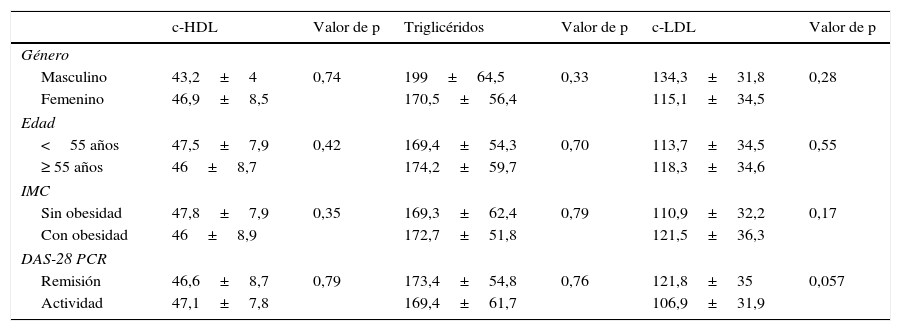
La media de los triglicéridos fue 171,9±57,2mg/dl, la media del c-HDL fue 46,8±8,4mg/dl y la media del c-LDL fue 116±34,6mg/dl. Se distribuyeron las medias del perfil de lípidos según el género, la edad, el IMC y el índice de actividad de la enfermedad y se realizó análisis de varianza de las mismas, el cual se resume en la tabla 3. A pesar de que se observó que el género masculino presentó menor nivel de c-HDL y mayores niveles de triglicéridos y c-LDL, no se encontraron diferencias significativas, lo mismo ocurrió con la edad ≥ 55 años, el IMC con presencia de obesidad y con el DAS-28 PCR en remisión.
Análisis de varianza del perfil lipídico y las características generales de los pacientes con AR
| c-HDL | Valor de p | Triglicéridos | Valor de p | c-LDL | Valor de p | |
|---|---|---|---|---|---|---|
| Género | ||||||
| Masculino | 43,2±4 | 0,74 | 199±64,5 | 0,33 | 134,3±31,8 | 0,28 |
| Femenino | 46,9±8,5 | 170,5±56,4 | 115,1±34,5 | |||
| Edad | ||||||
| <55 años | 47,5±7,9 | 0,42 | 169,4±54,3 | 0,70 | 113,7±34,5 | 0,55 |
| ≥ 55 años | 46±8,7 | 174,2±59,7 | 118,3±34,6 | |||
| IMC | ||||||
| Sin obesidad | 47,8±7,9 | 0,35 | 169,3±62,4 | 0,79 | 110,9±32,2 | 0,17 |
| Con obesidad | 46±8,9 | 172,7±51,8 | 121,5±36,3 | |||
| DAS-28 PCR | ||||||
| Remisión | 46,6±8,7 | 0,79 | 173,4±54,8 | 0,76 | 121,8±35 | 0,057 |
| Actividad | 47,1±7,8 | 169,4±61,7 | 106,9±31,9 | |||
c-HDL: lipoproteína de alta densidad; c-LDL: lipoproteína de baja densidad; IMC: índice de masa corporal; PCR: proteína C reactiva.
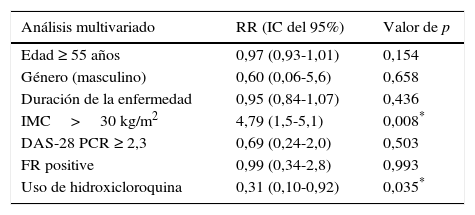
La regresión logística multivariante ajustada por edad ≥ 55 años, género masculino, IMC>30kg/m2, duración de la enfermedad, DAS-28 PCR ≥ 2,3, FR positivo y uso de HCQ se resume en la tabla 4. El IMC>30kg/m2 (RR 4,79, IC del 95%, 1,5-5,1; p=0,008) se asoció independientemente a la presencia de DLP. El uso de HCQ (RR 0,31, IC del 95%, 0,1-0,92; p=0,035) se asoció independientemente a la ausencia de DLP.
Análisis multivariado de las variables estudiadas y su asociación con el desarrollo de dislipidemia
| Análisis multivariado | RR (IC del 95%) | Valor de p |
|---|---|---|
| Edad ≥ 55 años | 0,97 (0,93-1,01) | 0,154 |
| Género (masculino) | 0,60 (0,06-5,6) | 0,658 |
| Duración de la enfermedad | 0,95 (0,84-1,07) | 0,436 |
| IMC>30 kg/m2 | 4,79 (1,5-5,1) | 0,008* |
| DAS-28 PCR ≥ 2,3 | 0,69 (0,24-2,0) | 0,503 |
| FR positive | 0,99 (0,34-2,8) | 0,993 |
| Uso de hidroxicloroquina | 0,31 (0,10-0,92) | 0,035* |
FR: factor reumatoide; IC: intervalo de confianza; IMC: índice de masa corporal; PCR: proteína C reactiva; RR: riesgo relativo.
Se calculó el índice aterogénico, encontrándose que 52 (63,4%) presentaron índice bajo de Castellí, 29 (35,4%) moderado y uno (1,2%) alto. Se calculó el índice de Kannel, del cual 56 (68,3%) presentaron índice bajo y 26 (31,7%) índice alto. Con respecto al índice triglicéridos/c-HDL, 22 (26,8%) presentaron índice bajo y 60 (73,2%) presentaron índice alto. La media del índice de Castellí fue 4,36±1,12, la del índice de Kannel fue 2,59±0,99 y la del índice triglicéridos/c-HDL fue 3,83±1,54.
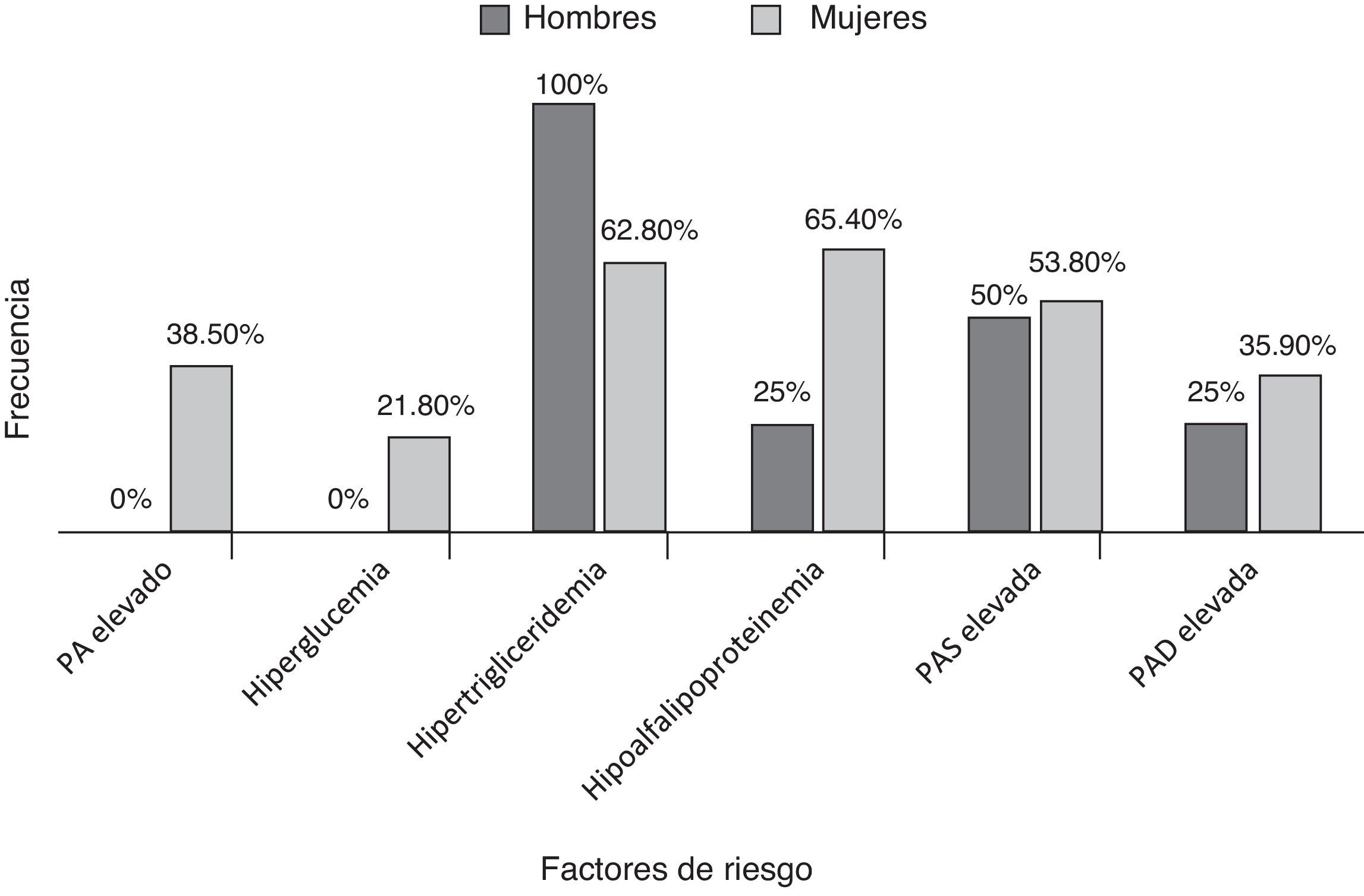
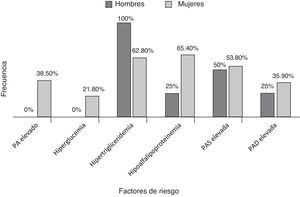
El 61% de nuestros pacientes presentó SM, la media del perímetro de cintura en las mujeres con AR fue 89,8cm y en los hombres 88,3cm. La media de la PAS fue 125,7mmHg y el 53,7% presentó PAS ≥ 130mmHg, la media de la PAD fue 77,9mmHg y el 35,4% presentó PAD ≥ 85mmHg. La media de los niveles de glucosa fue de 94,8mg/dl, el 20,7% tuvo glucosa ≥ 100mg/dl. En la figura 1, se observa la frecuencia de los factores de riesgo para SM distribuidos por género.
DiscusiónEn México, el 48,4% de la población adulta presenta hipoalfalipoproteinemia, el 42,3% tiene hipertrigliceridemia y el 27,1% tiene hipercolesterolemia, siendo su prevalencia mayor en pacientes con DM, hipertensión arterial y obesidad3. Nuestro estudio reporta menores frecuencias de hipertrigliceridemia e hipoalfalipoproteinemia; esto puede deberse a que más de la mitad de nuestros pacientes empleaban HCQ, la cual se ha demostrado que disminuye los niveles de triglicéridos en un 15% respecto a los valores basales y aumenta el mismo porcentaje los niveles de c-HDL17-19.
Comparando nuestros resultados con población latinoamericana, encontramos menor frecuencia de DLP, tal es el caso de los resultados reportados por Heye et al.28 en un estudio realizado en pacientes con AR argentinos, quienes presentaron una menor frecuencia de DLP (43%), a pesar de que el índice de actividad, los niveles de PCR, FR e IMC eran semejantes al de nuestra población; así mismo la frecuencia de empleo de glucocorticoides era mayor y la de HCQ era menor. Esta diferencia podría deberse a que la población mexicana ocupa el primer lugar en DLP y obesidad en Latinoamérica29. De igual manera, un estudio realizado por Galindo et al.13 en pacientes peruanos con AR presentaron menor frecuencia de hipercolesterolemia (27,3%); esto puede deberse a que tenían menor frecuencia de obesidad (18,2%).
Con respecto a resultados obtenidos en población no latina, la frecuencia de DLP que reportamos es mayor a la encontrada por Nurmohamed y Dijkmans8 (49%) y por Nisar et al.30 en Pakistán (44.87%), quien también reportó menor frecuencia de hipertrigliceridemia (15,4%) e hipoalfalipoproteinemia (15,4%), a pesar de que presentaban mayor frecuencia de actividad de la enfermedad en comparación con nuestra población. En la población mexicana las DLP más comunes son la hipertrigliceridemia y la hipoalfalipoproteinemia31; esto se debe a que son frecuentes las mutaciones en la variante R230C del gen ABCA132.
Curtis et al.14 encontraron en población estadounidense con AR una frecuencia de DLP del 49,3%, medias de triglicéridos de 133,1mg/dl, c-LDL de 113,1mg/dl, c-HDL de 56,6mg/dl y un índice aterogénico de Castellí 3,8; esta menor frecuencia y mejor perfil lipídico comparado con el encontrado en nuestra población podrían deberse al efecto farmacológico, ya que la población estudiada por Curtis et al.14 empleó menor frecuencia de glucocorticoides, emplearon anti-TNF, así como estatinas. Kerr et al.33 estudiaron el mismo tipo de población que Curtis et al.14 y encontraron menores niveles de triglicéridos (140,3mg/dl) y c-LDL (105,9mg/dl) comparados con nuestros resultados; esto puede deberse a que esta población estudiada presentaba menores frecuencias de empleo de glucocorticoides y menor IMC, así como menores niveles de PCR.
En un estudio realizado por Singh et al.34 en una población de la India con AR se reportaron menores niveles de triglicéridos (131,5mg/dl) y de c-LDL (105mg/dl) en el género masculino comparado con nuestro estudio; esto puede deberse a que la población estudiada por Singh et al.34 tenía menor duración de la enfermedad y menor frecuencia de FR positivo, y que la edad promedio era menor; de igual manera, se ha encontrado que el género masculino en la población mexicana presenta niveles más altos de triglicéridos, colesterol total y c-LDL29. Al igual que en nuestro estudio, en el realizado por Singh et al.34 la población femenina presentó menores medias de triglicéridos (119,6mg/dl), c-LDL (103mg/dl) y mayores de c-HDL (47,9mg/dl) que la población masculina; sin embargo, estas fueron menores a las reportadas en nuestro estudio, lo cual puede deberse a los factores ya comentados.
En un estudio realizado por Georgiadis et al.35 en pacientes con AR, se encontraron menores niveles de triglicéridos (131,5mg/dl) y mayores niveles de c-HDL (60,7mg/dl) y un menor índice aterogénico de Castellí (3,8) comparados con nuestra población; esto puede deberse a que la población estudiada tenía menos tiempo de evolución, mayor frecuencia de empleo de metotrexato y menor IMC, además de la mayor frecuencia de hipoalfalipoproteinemia e hipertrigliceridemia que presenta la población mexicana secundaria a las mutaciones en la variante R230C del gen ABCA132.
Predominó el género femenino, debido a que las enfermedades autoinmunes son más frecuentes en las mujeres1.
Se ha observado que existe una asociación entre el FR con diferentes aspectos del metabolismo lipoproteico, con un predominio de lipoproteínas aterogénicas36; en nuestro estudio el FR positivo se asoció a la presencia de DLP con un valor de p=0,0005.
Los trastornos de los lípidos están fuertemente relacionados con los procesos inflamatorios37; la PCR es sintetizada y secretada por los hepatocitos, cifras mayores de 2mg/l se han asociado a mayor riesgo cardiovascular; se ha observado que pacientes con niveles altos de PCR tienen mayor elevación del colesterol total, triglicéridos y c-LDL, y un descenso significativo del c-HDL38. Esto coincidió con lo reportado en nuestro estudio, donde se encontró una asociación significativa entre los niveles de PCR ≥ 2mg/dl y la presencia de DLP.
La inflamación desempeña un papel crucial en el desarrollo de la ateroesclerosis, aumentando el riesgo cardiovascular, y también conduce a cambios proaterógenicos en el metabolismo de las lipoproteínas, de tal manera que, a mayor actividad de la enfermedad, existen niveles más bajos de triglicéridos y colesterol total y niveles mucho más bajos de c-HDL38. Este patrón también se presentó en nuestro estudio, donde los pacientes con actividad de la enfermedad según DAS-28 PCR tenían menor frecuencia de DLP (p=0,037) y tenían menores niveles de triglicéridos y c-LDL en comparación con los pacientes en remisión.
Existe un aumento en la tendencia de DLP con aumento del IMC, en un estudio realizado por Barquera et al.39 en población mexicana se reportó que las medias más altas de triglicéridos y colesterol para ambos géneros se encontraban en los pacientes con obesidad y las más bajas de c-HDL en los pacientes con sobrepeso; esto coincide con lo encontrado en nuestra población de estudio, donde las medias bajas para c-HDL y las más altas para triglicéridos y c-LDL se encontraron en el grupo de obesidad.
Con lo que respecta al uso de FARME y DLP, los resultados obtenidos indican que el uso de HCQ se asocia de manera independiente a la ausencia de DLP; esta observación concuerda con lo informado en otros estudios, donde se ha reportado que los agentes antipalúdicos se asocian a un perfil lipídico favorable17-19. En un estudio realizado en pacientes con el diagnóstico de AR se encontró asociación entre el empleo de HCQ y bajos niveles de colesterol, triglicéridos y c-LDL40. El mecanismo por el cual la HCQ produce beneficio sobre el perfil de lípidos es incierto; tiene un efecto antiinflamatorio débil, por lo cual es poco probable que el beneficio sobre los lípidos se deba al control de la inflamación. Se ha encontrado que la cloroquina, un medicamento con estructura semejante a la HCQ, puede inhibir la biosíntesis de colesterol en hepatocitos de ratas; de igual manera, inhibe la hidrólisis de ésteres de colesterol en los lisosomas al aumentar el pH e inactivar las proteasas ácidas41, por lo cual se puede pensar que la HCQ emplea un mecanismo semejante a la cloroquina para producir una mejoría en el perfil lipídico.
Dado que la asignación de la HCQ en este estudio no fue al azar, podrían presentarse sesgos por indicación; sin embargo, la media del índice de actividad DAS-28 en los pacientes que emplearon HCQ fue de 2,37 y los que no la emplearon tuvieron un índice de actividad de 1,99. El empleo de glucocorticoides en los pacientes que consumían y que no consumían HCQ era muy semejante (72,5% y 74,2%) y el empleo de metotrexato en los pacientes que consumían HCQ y los que no también fue muy semejante (47% y 45%). Estas similitudes en el empleo de glucocorticoides y metotrexato, y que los pacientes que consumían HCQ tuviesen mayor actividad, podrían descartar un sesgo por indicación.
Los pacientes con AR presentan una ateroesclerosis acelerada, difusa y más propensas a la rotura causando eventos clínicos, teniendo un riesgo cardiovascular igual que los pacientes con DM42. López et al.43, en un estudio realizado en pacientes con DM tipo 1 y 2, encontraron un índice aterogénico de Castellí de 4,4±1,6 y 4,7±1,8, respectivamente, y el 58% de los pacientes con DM tipo 1 y el 55,1% con DM tipo 2 presentaron un índice menor de 4,5; estos resultados se asemejan a los encontrados en nuestra población con AR. A pesar de que se clasifican dentro del riesgo bajo, se encuentra en el límite con el riesgo moderado. Georgiadis et al.35 en un estudio realizado en pacientes con AR en tratamiento con metotrexato y prednisona encontraron una media de índice de Kannel de 2,4±0,6 y de índice triglicéridos/c-HDL de 3,8±0,8; estos resultados coinciden con los encontrados en nuestra población, en especial si tenemos en cuenta que el 73% recibía tratamiento con metotrexato y el 49% con prednisona. La media del índice aterógenico presentado por nuestra población de estudio se encontró entre los límites de un riesgo bajo y alto, y poco menos de la mitad de los pacientes se encontró dentro de un riesgo aterogénico alto.
La frecuencia de SM encontrado en nuestra población fue mayor al reportado en la población mexicana en general (56%)44 y mayor a la reportada en pacientes con AR. En un estudio realizado por Dao et al.45 en pacientes con AR se encontró una frecuencia de SM del 40,9%, da Cunha et al.46 encontraron una frecuencia del 39% y Rostom et al.47 encontraron una frecuencia del 32,4%. Esta diferencia puede deberse a que, además de la relación que existe entre el SM y la DM, en nuestra población de estudio se suma la alta frecuencia de DLP y obesidad que existe en la población mexicana.
Aunque el número de pacientes incluidos en este estudio puede ser visto como una limitación, la estricta selección de los mismos sin medicación hipolipidemiante, sin eventos isquémicos previos y sin DM debe ser considerada, por el contrario, como una fortaleza del mismo.
En conclusión, nuestros pacientes con AR tienen una elevada prevalencia de DLP y de SM, lo que, junto a los factores de riesgo no tradicionales, aumenta su riesgo cardiovascular de manera importante. La prevención y el tratamiento de la obesidad y el sobrepeso, y primar el uso de HCQ frente a otros fármacos cuando el contexto clínico del paciente lo permita, podrían reducir la DLP y el SM en estos pacientes, y, por consiguiente, mejorar su riesgo cardiovascular.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.