MicroRNAs (miRs) regulate gene expression post-transcriptionally and are transported by high-density lipoproteins (HDL). Hypercholesterolemic HDL particles are enriched with miR-126-3p/5p, which can be delivered to endothelial cells, leading to the downregulation of hypoxia-inducible-factor-1α (HIF-1α), a key transcription factor involved in metabolic responses to hypoxia and cell survival during myocardial ischemia/reperfusion (I/R).
ObjectiveTo investigate the effects of miR-126 mimic and inhibitor transfection on the HIF-1α/apoptosis axis in cardiac cell constituents under experimental I/R.
MethodsFirstly, specific durations of I/R were established for cardiac cells (cardiomyocytes, fibroblasts, endothelial cells, and macrophages) based on their susceptibility to metabolic changes and cell death. Then, we assessed the impact of transfecting these cells with mimic-miR-126-5p and anti-miR-126-5p to the selected timings of I/R on the HIF-1α/apoptosis axis.
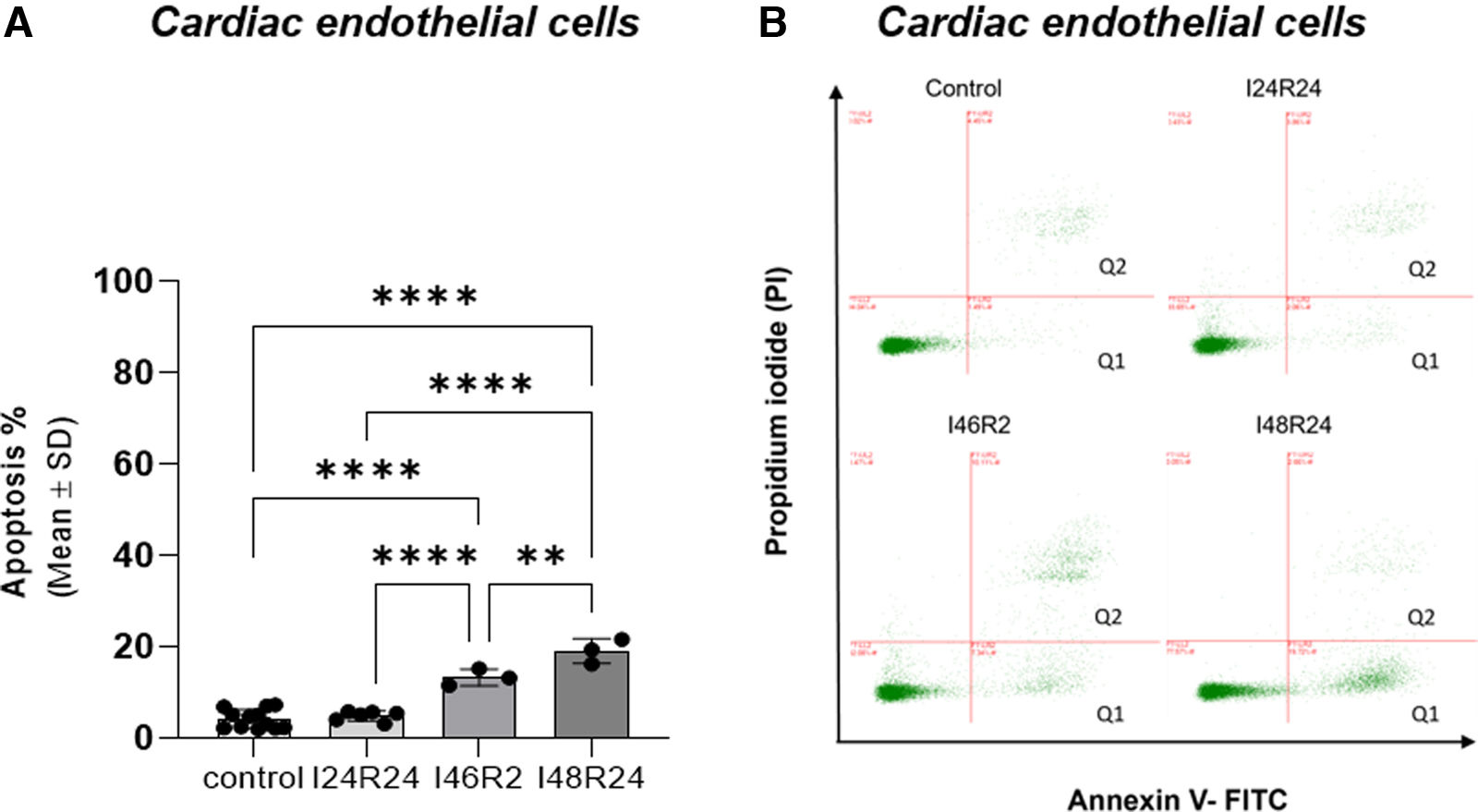
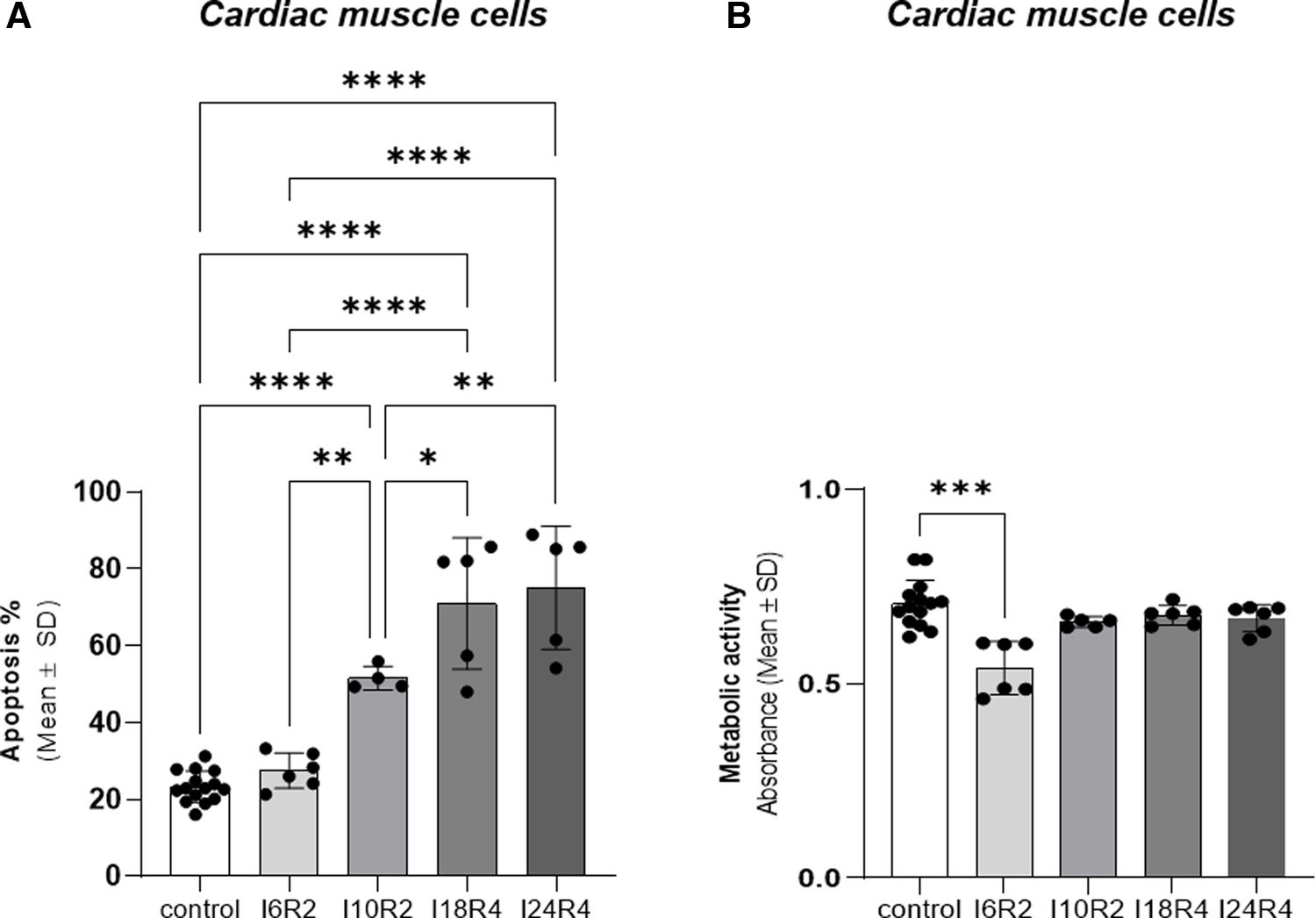
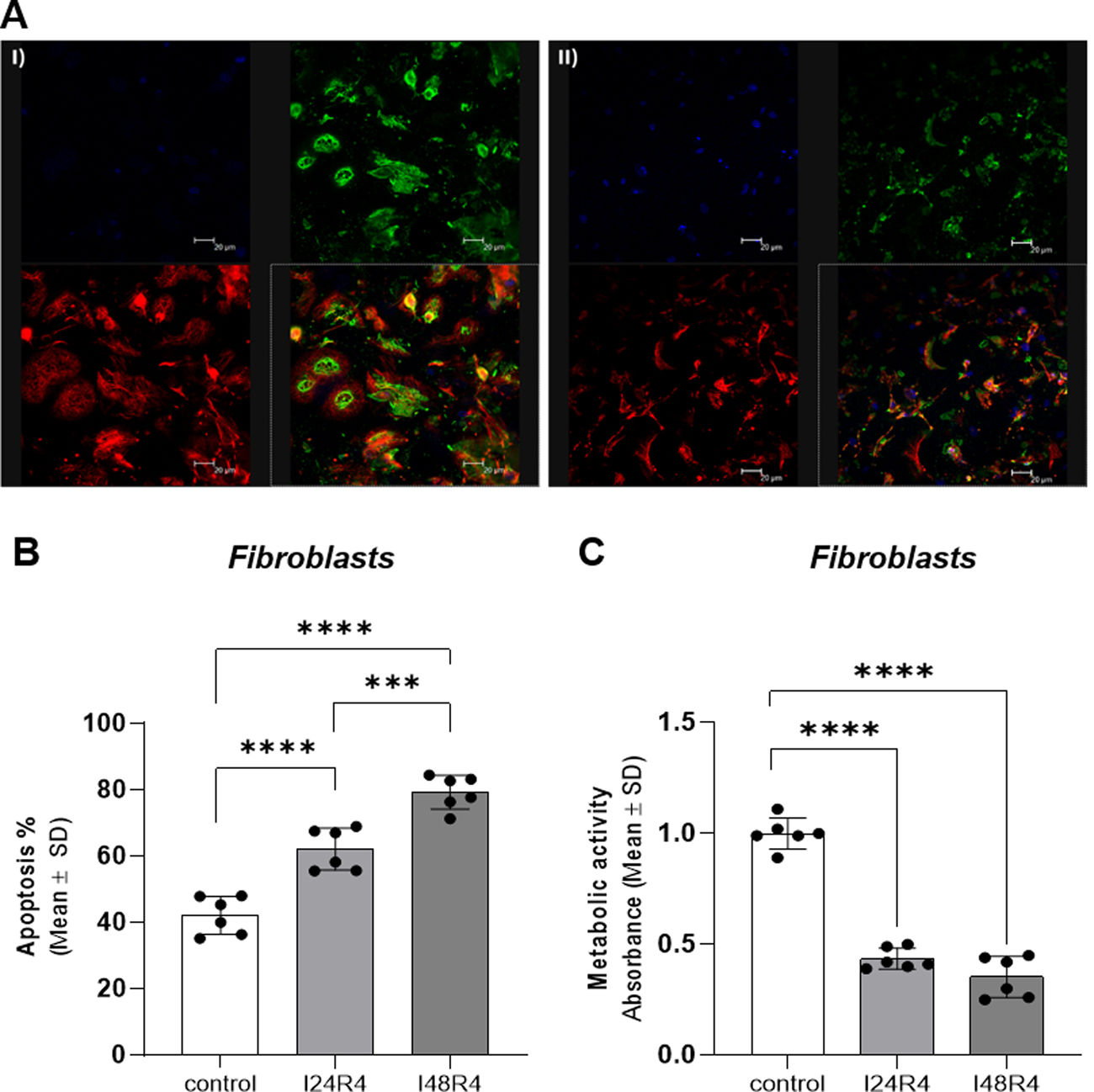
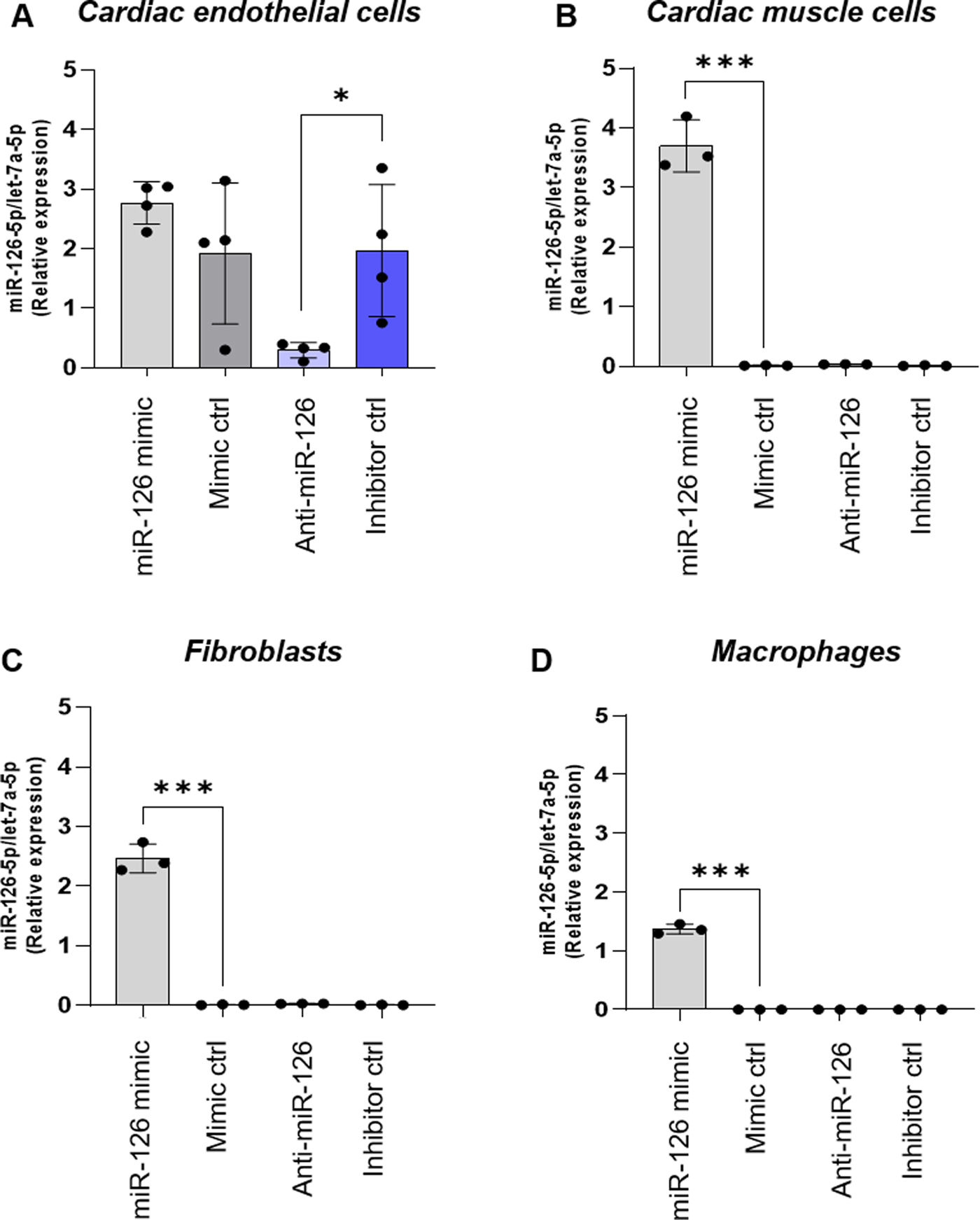
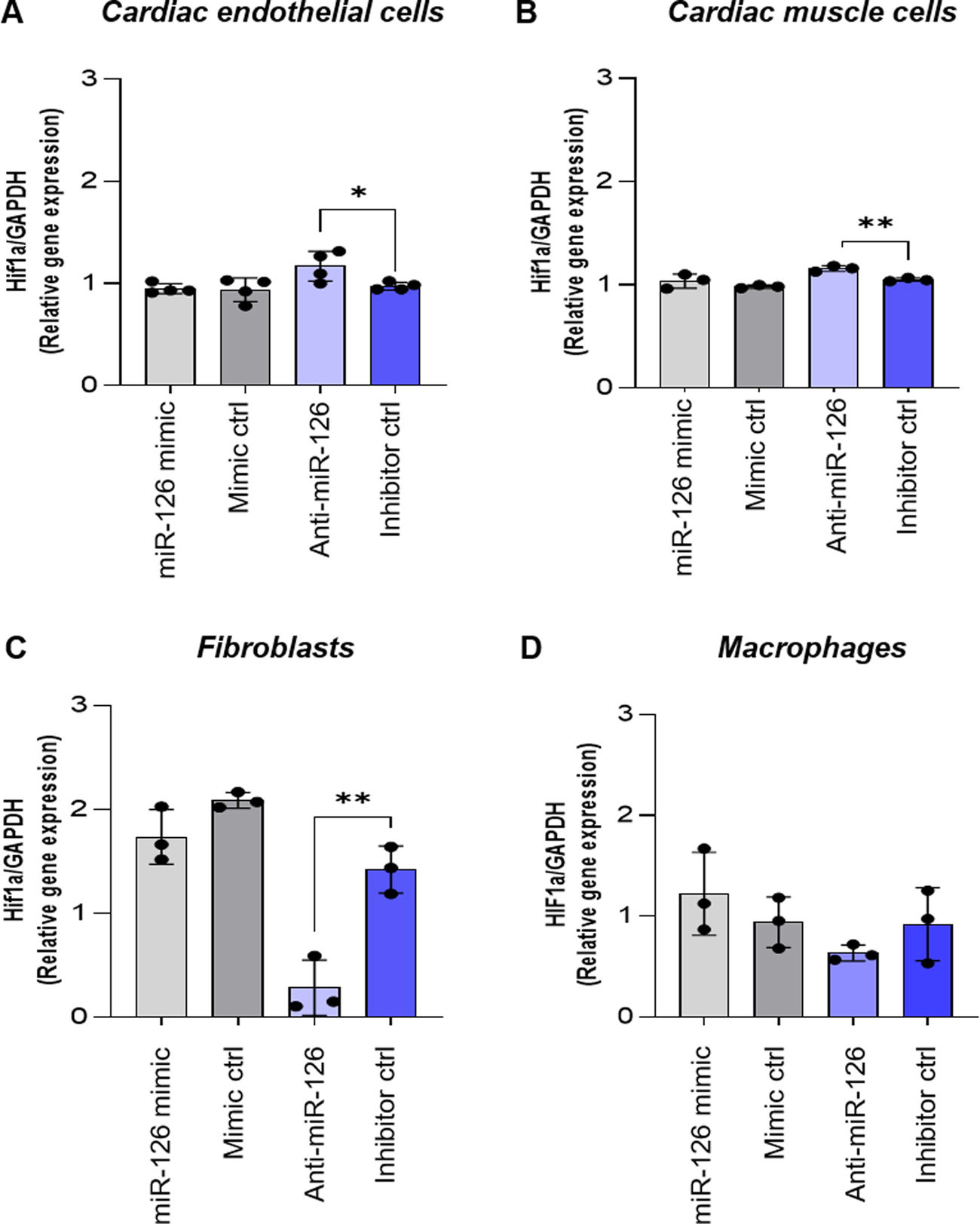
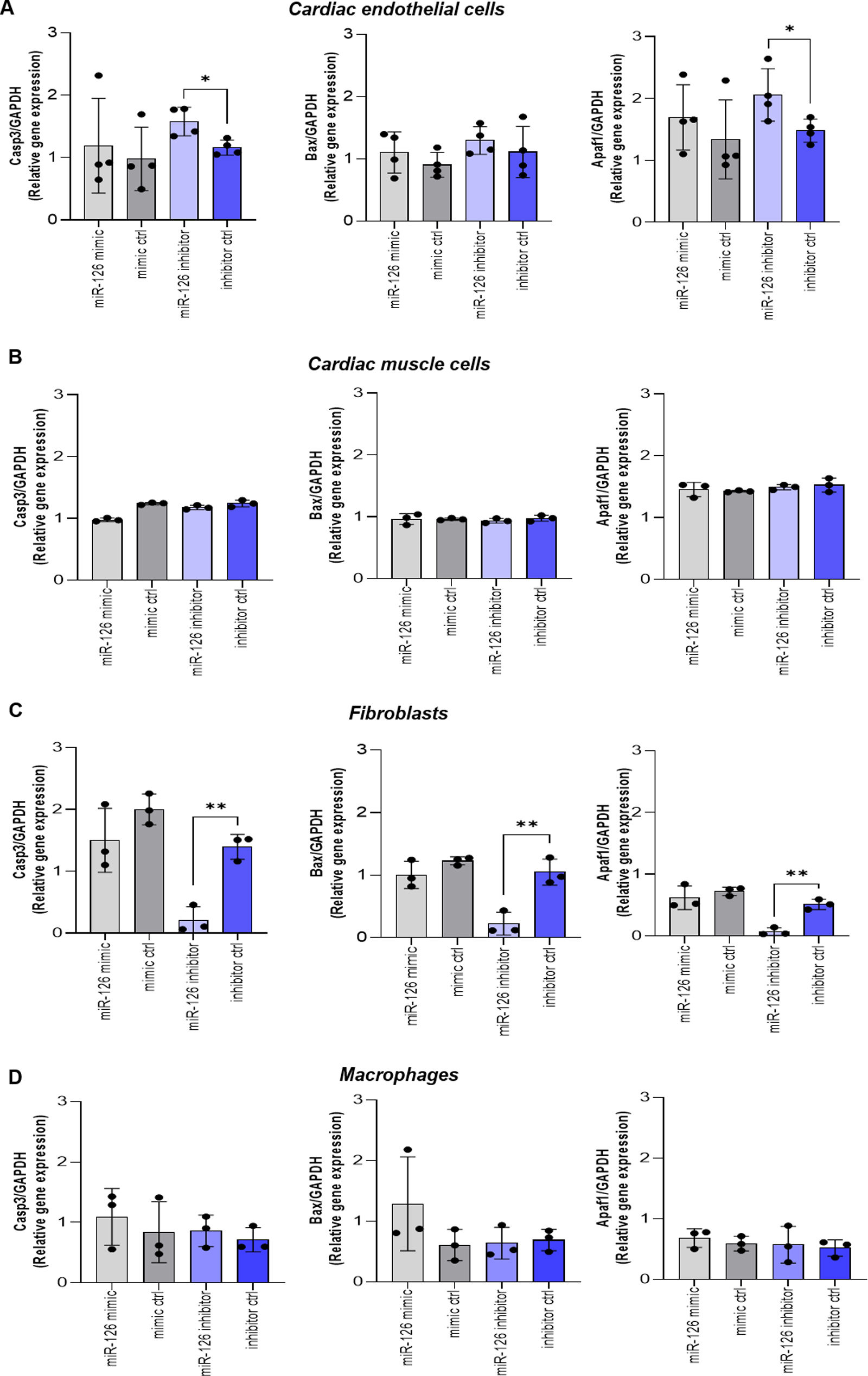
ResultsEndothelial cells were resistant to I/R and fibroblasts were sensitive to ischemia whereas cardiomyocytes displayed high metabolic flexibility. Endogenous miR-126 expression was exclusively found in endothelial cells. Transfection with anti-miR-126 increased HIF-1α transcription in endothelial cells and cardiomyocytes, while reducing HIF-1α levels in fibroblasts, resulted in decreased transcript levels of apoptotic markers. HIF-1α transcript levels remained unchanged in macrophages and transfection with mimic-miR-126 exerted no changes in the HIF-1α/apoptosis axis in all tested cells.
ConclusionsmiR-126 differentially regulates HIF-1α/apoptosis expression in cardiac cells exposed to experimental I/R and may serve as a potential therapeutic target for enhancing myocardial resilience in the setting of myocardial infarction.
Los micro-ARN (miR) regulan la expresión génica a nivel postranscripcional y son transportados por lipoproteínas de alta densidad (HDL). Las HDL hipercolesterolémicas están enriquecidas con miR-126-3p/5p, que se transfiere a las células endoteliales y reduce la expresión del factor-1α inducido por hipoxia (HIF-1α), un factor de transcripción clave en las respuestas metabólicas a la hipoxia y la supervivencia celular durante la isquemia/reperfusión (I/R).
ObjetivoInvestigar los efectos de la transfección con miR-126 mimic y con anti-miR-126 sobre el eje HIF-1α/apoptosis en los componentes celulares cardiacos sometidos a I/R experimental.
MétodosPrimeramente, se establecieron los tiempos de I/R para cada tipo celular cardiaco (cardiomiocitos, fibroblastos, células endoteliales y macrófagos) en función de su susceptibilidad a cambios metabólicos y muerte celular. Después, se evaluó el impacto de la transfección de estas células con mimic-miR-126-5p y anti-miR-126-5p al someterlas a los tiempos seleccionados de I/R en el eje HIF-1α/apoptosis.
ResultadosLas células endoteliales mostraron resistencia a la I/R y los fibroblastos fueron sensibles a los tiempos de isquemia, mientras que los cardiomiocitos mostraron una elevada flexibilidad metabólica. La expresión endógena de miR-126 se detectó exclusivamente en células endoteliales. La transfección con anti-miR-126 incrementó la expresión génica de HIF-1α en las células endoteliales y en HL-1, mientras que los redujo en los fibroblastos y se asoció a menor apoptosis. Los niveles de HIF-1α permanecieron inalterados en macrófagos y el mimic-miR-126 no indujo cambios en el eje HIF-1α/apoptosis en ningún tipo celular.
ConclusionesEl miR-126 regula de manera diferencial la expresión de HIF-1α en células cardiacas expuestas a I/R y puede servir como un potencial objetivo terapéutico para mejorar la resiliencia miocárdica en el contexto del infarto.