La porfiria aguda intermitente (PAI) es una enfermedad metabólica infrecuente. Los pacientes suelen ser asintomáticos, o controlan sus síntomas evitando los factores desencadenantes y administrando hemina intravenosa en las crisis neuroviscerales1,2. Un número reducido de enfermos presentan crisis resistentes al tratamiento, produciéndoles muy mala calidad de vida1,2. En 2004, se publicó el primer trasplante hepático como tratamiento de la PAI2. Hemos efectuado una revisión sistemática de la literatura en Pubmed sin límites con la búsqueda «liver transplantation and acute intermittent porphyria» encontrando 41 artículos pero solo en 9 se presentaban un total de 17 pacientes trasplantados por PAI (tabla 1)1. Presentamos una paciente afecta de PAI sin respuesta al tratamiento convencional, tratada con trasplante hepático (TH).
Casos publicados de PAI tratada mediante trasplante hepático
| Autor/año | N | Edad | Género | Tiempo sintomas(años) | Clínica | Indicación TOH | Tipo trasplante | Complicaciones inmediatas pos-TOH | NormalizaciónBioquímica | Ataques porfiria pos-TOH | Seguimiento(meses) | Retrasplante | Fallecimiento |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Wahlin et al. /201011 | 2 | 24 | Mujer | NE | Dolor abdominal, Neuropatía, hipertensión, Fallo renal | Clínica PAI no controlablemédicamente | TOH+trasplante renal | No | Sí | No | 16 | No | No |
| 55 | Mujer | 10 | Neuropatía, fallo renal | Clínica PAI no controlable médicamente | TOH+trasplante renal | Fuga biliarRechazo renal | Sí | No | 11 | No | No | ||
| Dowman et al., 20126 | 10* | 31 | 9/10 Mujer | NE | Dolor abdominal, Labilidad TA y neuropatía | Clínica PAI no controlable médicamente | TOH | 4 TAH1 Fuga biliar | Sí (10/10) | No (10/10) | 23,4 | 1/10 por TAH (13 días pos-TOH) | 2/10(98 Días y 26 Meses pos-TOH) |
| Frei et al., 20124 | 1 | 58 | Mujer | 35 | Insuficienciarenal e hipertensión | Fallo hepáticoSobredosis hemina | TOH | No | Sí | No | 12 | No | No |
| Yasuda et al., 20153 | 1 | 36 | Mujer | 11 | Neuropatía | Clínica PAI no controlable médicamente | TOH | No | Sí | No | 24 | No | No |
| Malinzak et al., 20181 | 1 | 30 | Mujer | 14 | Dolor abdominal,Neuropatía | Clínica PAI no controlable médicamente | SPLITHígado derecho | Insuficiencia renalColección perihepática | Sí | No | 15 | No | No |
| Spiritos et al., 201910 | 1 | 16 | Mujer | NE | Dolor abdominal | Clínica PAI no controlable médicamente | SPLITHígado derecho | No | Sí | No | 12 | No | No |
| Al Samkari et al., 20199 | 1 | 59 | Mujer | 18 | Dolor abdominal | Clínica PAI no controlable médicamente+cirrosis por depósito hierro | T. donante vivo | NE | Al 4.° año pos-TH, el donante tenía PAI no conocida I | Al 4.° año pos-TH, el donante tenía PAI no conocida | 48 | No | No |
| H. G. Alicante | 1 | 42 | Mujer | 8,5 | Dolor abdominalSíntomas SNC | Clínica PAI no controlable médicamente | TOH | No | Sí | No | 15 | No | No |
| Total Series | 18 | 35 | Mujer17/18 | 16 | Dolor abdominal (15:/18:84%) | Clínica PAI (17)Fallo hepático (1) | 15 TOH 2 SPLIT, 1 Donante vivo | 6/18 (33%) | No 17/18 (94,5%) | No 17/18 (94,5%) | 21,5 | 1/18 (5,5%) | 2/18 (11%) |
NE: no especificado; TA: tensión arterial; TAH: trombosis arteria hepática;TOH: trasplante ortotópico de hígado.
Mujer, 42 años, que en 2011 inició cuadro de dolor abdominal intenso, orinas oscuras e hiponatremia. Test de Hoesch positivo, comprobándose elevación de porfobilinígeno (PBG) (54,4mg/24h) y 5-ácido aminolevulínico (ALA) en orina (172μmol/24h). El estudio genético presentó mutación 669-698 del 30 en el gen que codifica la enzima PBG-desaminasa. Con diagnóstico de PAI se inició tratamiento con hemina intravenosa cuando presentaba crisis, logrando inicialmente mejoría clínica.
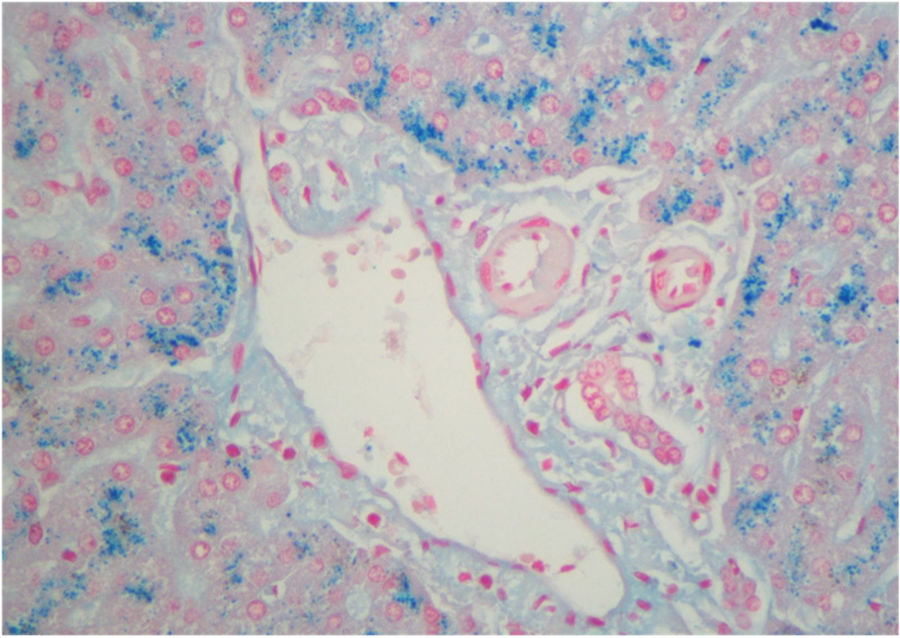
La paciente continuó con crisis cada vez más frecuentes, desencadenadas por estrés o menstruación, precisando hemina profiláctica mensual. Se intentaron terapias genéticas (incluida en estudio DIGNA-2011 con el vector genético rAAV2/5-PBGD) y ooferectomía profiláctica, sin eficacia. El cuadro se complicó con osteoporosis, crisis neuroviscerales semanales difíciles de controlar con hemina y analgesia, sintomatología del SNC –alucinaciones visuales, agitación, delirio– y aumento progresivo del consumo de opiáceos, desarrollando adicción secundaria. Se decidió incluirla en lista de espera para TH. En marzo de 2019, recibió un órgano de donante en muerte encefálica (índice de riesgo del donante: 2,5). Se realizó inducción con basiliximab, mofetil micofenolato y corticoides, e introducción de tacrolimus en el 4.° día postrasplante. Las porfirinas en orina se negativizaron el 2.° día postrasplante. La estancia en UCI fue de 10 h y el alta hospitalaria al 6.° día. En el explante se observó gran cantidad de hierro en los hepatocitos, consecuencia del tratamiento con hemina (fig. 1). Tras 15 meses de seguimiento, los valores de PBG y ALA son normales, y la paciente no ha presentado crisis, ni ha precisado tratamiento analgésico.
La PAI es la porfiria aguda más frecuente y pertenece al grupo de las porfirias hepáticas1–5. Es una enfermedad de transmisión autosómica dominante producida por una deficiencia parcial de la porfobilinógeno deaminasa, lo que provoca un acúmulo de ALA y PBG1–5, siendo más frecuente en mujeres1.
El 90% de los enfermos son asintomáticos2. Los sintomáticos presentan crisis neuroviscerales de dolor abdominal sin fotosensibilidad cutánea, desencadenadas por factores que incrementan la demanda del grupo hemo (estrés, drogas, alcohol, ingesta, cambios hormonales,...)1,2,4,6. Otros síntomas que pueden acompañar las crisis son: vómitos, estreñimiento, retención urinaria, taquicardia, alteraciones de la tensión arterial, neuropatía motora y convulsiones1–3. El diagnóstico se obtiene demostrando un incremento urinario de ALA y PBG5.
El tratamiento se basa en evitar los factores desencadenantes de los ataques mediante supresión de la ovulación, analgesia, hidratación, y dieta rica en hidratos de carbono, y administrar hemina intravenosa durante los ataques1,2,4,6. El 90% de las porfirias evolucionan satisfactoriamente con estas medidas, pero un reducido grupo de pacientes siguen presentando crisis frecuentes1,2. Además, el tratamiento crónico con hemina causa múltiples complicaciones como la fibrosis hepática por almacenamiento de hierro y/o una progresiva resistencia al tratamiento1,2,6–8. La sintomatología recurrente y los múltiples ingresos hospitalarios provocan que estos pacientes tengan mala calidad de vida e inferior expectativa vital1,2.
La patogenia de los ataques es desconocida, se cree que ocurren por la producción hepática de precursores de la porfirina por el déficit metabólico subyacente2,6. Por tanto, el TH es el único tratamiento curativo, ya que se reemplaza la enzima deficitaria1,2,4. Las indicaciones más admitidas de TH en la PAI son los ataques que no responden al tratamiento con hemina, mala calidad de vida, enfermedad neurológica progresiva o fallo hepático por sobredosificación de hemina1,4,5. Los resultados obtenidos con el TH en PAI son difíciles de interpretar por el reducido número de casos publicados (tabla 1)1,6,9–11. Solo existe una serie de 10 pacientes trasplantados con PAI perteneciente al registro británico, en la que la indicación de TH fue por mala calidad de vida, bien por crisis abdominales recurrentes y/o por clínica neurológica. La mediana de seguimiento fue 23,4 meses con dos fallecimientos a los 98 días y 26 meses, objetivándose una tasa de trombosis arterial muy superior a la habitual6, ya que observaron cuatro casos, uno de los cuales requirió retrasplante, sin poder encontrar una explicación etiológica entre la PAI y la elevada tasa de trombosis, pero que puede hacer recomendable realizar profilaxis antitrombótica. Los valores de PBG y ALA se normalizaron siempre en las 72 h pos-TH, sin recurrencia de las crisis abdominales aunque sin recuperación de los déficits neurológicos. El 70% de los explantes presentaba hemosiderosis como nuestro caso6.
No hay casos descritos de recurrencia de la PAI tras TH cadavérico. Se ha publicado una recurrencia en un receptor al que se le realizó un trasplante de donante vivo de un hermano que tenía PAI asintomática9. En nuestro caso, se intentaron todos los tratamientos disponibles sin mejoría, presentado resistencia al tratamiento con hemina. Se decidió realizar TH como última opción, con excelente resultado clínico. Como en la mayoría de las enfermedades benignas susceptibles de TH, decidir el momento óptimo de trasplante es siempre difícil, pero no debería esperarse a la existencia de sintomatología neurológica grave por la alta posibilidad de no mejorar tras el TH6.