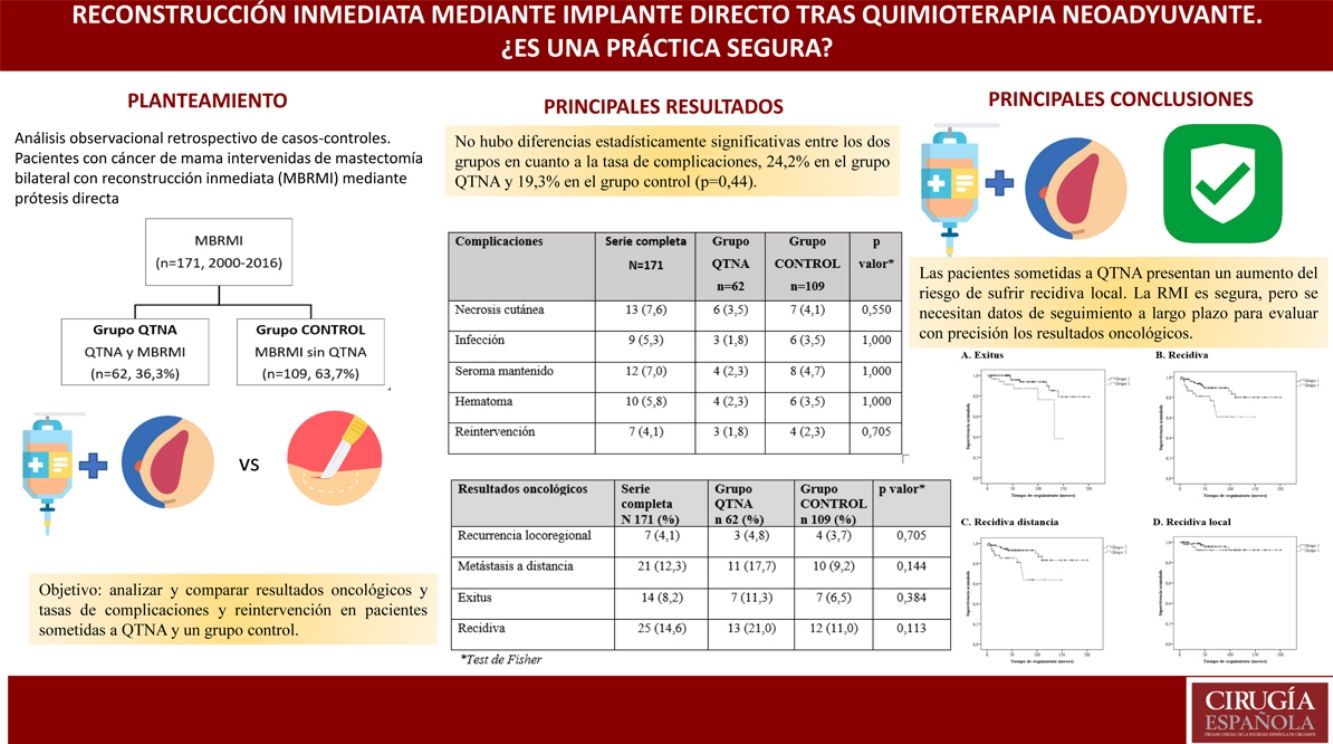
La reconstrucción inmediata (RMI) tras mastectomía en pacientes que han recibido quimioterapia neoadyuvante (QTNA) sigue siendo controvertida. El objetivo de este estudio es analizar y comparar resultados oncológicos y las tasas de complicaciones y reintervención en pacientes sometidas a QTNA y un grupo control.
MétodosAnálisis observacional retrospectivo de casos-controles. Pacientes con cáncer de mama intervenidas de mastectomía bilateral con RMI (MBRMI) mediante prótesis directa durante el periodo 2000-2016. Grupo que recibió QTNA emparejadas máximo 1:5 respecto a las pacientes sin QTNA (grupo control).
Evaluamos diferencias entre grupos mediante test χ2 o Fisher (variables cualitativas), U de Mann-Whitney o t de Student (variables cuantitativas). Análisis de supervivencia mediante curvas de Kaplan-Meier y test de log-rank (SPSS 22.0).
ResultadosUn total de 171 pacientes con MBRMI, 62 pacientes (36,3%) tras QTNA y 109 pacientes (63,7%) en grupo control sin QTNA. Mediana de seguimiento de 52,0 (RIQ: 23,0-94,0) meses.
La indicación para practicar una MBRMI más frecuente en ambos grupos es la elección de la paciente (32,7%). No hay diferencias estadísticamente significativas entre los grupos en cuanto a tasa de complicaciones (24,2% en el grupo QTNA y 19,3% en el grupo control [p=0,44]).
Sí existen diferencias en resultados oncológicos. Las pacientes del grupo QTNA tienen 3 veces más riesgo que las pacientes del grupo control de presentar recidiva en un momento determinado del tiempo (3,009 [1,349-6,713]) según el análisis univariante.
ConclusionesLa RMI mediante prótesis directa tras mastectomías ahorradoras de piel es una opción viable de tratamiento para pacientes con cáncer de mama que reciben QTNA.
Immediate reconstruction (IBR) after mastectomy in patients who have received neoadjuvant chemotherapy (NACT) remains controversial. The aim of this study is to analyze and compare oncological results as well as complication and reoperation rates in patients undergoing NACT and a control group.
MethodsRetrospective observational case-control study of patients with breast cancer who underwent bilateral mastectomy and direct-to-implant IBR (BMIBR) from 2000-2016. The group that received NACT was matched 1:5 to patients without NACT (Control group).
We evaluated differences between groups using the χ2 or Fisher test (qualitative variables), Mann-Whitney U or Student's t-test (quantitative variables). The survival analysis was performed using Kaplan-Meier curves and log-rank test (SPSS 22.0).
ResultsThe study included a total of 171 patients with BMIBR: 62 patients (36.3%) after NACT and 109 patients (63.7%) in the control group without NACT. Median follow-up was 52.0 (IQR: 23.0-94.0) months.
In both groups, the indication for BMIBR was patient choice (32.7%). There were no statistically significant differences between groups in terms of complication rate (24.2% in the NACT group and 19.3% in the control group [P=.44]), but differences in oncological results were found.
Patients in the NACT Group had three times more risk of recurrence at a given time than patients in the control group (3.009 [1.349-6.713]) according to the univariate analysis.
ConclusionsDirect-to-implant IBR after skin-sparing mastectomy is a viable option for breast cancer patients undergoing NACT.
El gold standard para el tratamiento quirúrgico del cáncer de mama es la cirugía conservadora seguida de radioterapia. Sin embargo, y a pesar de los avances terapéuticos, hasta un 45% de pacientes serán intervenidas mediante mastectomía1 y hasta un 20-40% asociarán alguna técnica reconstructiva con objeto de mejorar la calidad de vida y disminuir el impacto sociopsicológico de la mastectomía2,3.
En la última década la mastectomía bilateral está experimentando un aumento y también las tasas de reconstrucción4,5, que puede ser diferida o inmediata (RMI) mediante reconstrucción autóloga o heteróloga colocando implantes directos.
Aunque varios estudios aseguran viable realizar la RMI tras mastectomías ahorradoras de piel en pacientes que previamente han recibido quimioterapia neoadyuvante (QTNA)6, todavía resulta controvertido7,8.
El objetivo de este estudio retrospectivo de casos y controles es analizar y comparar las tasas de complicaciones, secuelas y reintervención, así como los resultados oncológicos entre las pacientes sometidas a QTNA y mastectomía bilateral con reconstrucción inmediata (MBRMI) y las que no la precisaron.
No se dispone hasta la fecha de ningún estudio de casos y controles emparejados prospectivo sobre reconstrucción mamaria tras tratamiento neoadyuvante, por lo que el presente trabajo a pesar de contar con las limitaciones de ser un estudio retrospectivo puede aportar información útil, que permita aumentar el número de indicaciones de RMI tras QTNA al demostrarse segura.
MétodosSe realizó un análisis observacional retrospectivo para identificar a las pacientes intervenidas de mastectomía bilateral como tratamiento de un cáncer de mama con RMI mediante prótesis directa en nuestro centro durante el periodo 2000-2016. De ellas se seleccionaron pacientes sometidas a MBRMI tras QTNA (grupo QTNA), que fueron emparejadas como máximo 1:5 respecto a las pacientes que no recibieron QTNA (grupo control).
Se recopilaron datos sobre variables demográficas (edad, comorbilidades como obesidad, HTA, DM, y tabaquismo activo), clínico-patológicas (indicación, estadio clínico, etc.), en relación con el tratamiento quirúrgico incluyendo el tipo de intervención, las técnicas reconstructivas empleadas y la morbilidad postoperatoria. Se evaluaron las complicaciones postoperatorias (aquellas que aparecieron dentro de los 30 días tras la intervención) y secuelas (pasados 30 días). Asimismo, se evalúan los resultados oncológicos.
Este estudio se adhiere a los principios éticos de la Declaración de Helsinki y fue aprobado por el comité ético del centro y por el Comité Ético de Investigación Clínica de Aragón (CEICA) con número de registro C.P.-C.I. PI16/002.
Selección de pacientesLos criterios de inclusión para realizar la MBRMI fueron:
- –
Carcinoma multicéntrico o multifocal no susceptible de cirugía conservadora. Multifocalidad: 2 o más focos tumorales en un mismo cuadrante y a menos de 5cm del foco primario; y multicentricidad: 2 o más focos tumorales en distintos cuadrantes de la misma mama o a más de 5cm del foco primario.
- –
Gran componente in situ del tumor infiltrante.
- –
Alto riesgo por historia familiar (sin mutación conocida): definido por 2 o más familiares (al menos uno de ellos de primer grado afectados de cáncer de mama u ovario a edades tempranas, antes de los 50 años).
- –
Mutación conocida en genes BRCA1 y BRCA2.
Se excluyeron las pacientes con carcinoma inflamatorio, así como las MBRMI sin enfermedad oncológica presente o pasada (mastectomía profiláctica pura).
Los criterios para la administración de QTNA siguieron las guías y recomendaciones actualizadas en el momento del tratamiento, así como las pautas y duraciones de los mismos, teniendo en cuenta que han variado durante los años del estudio.
Se excluyeron pacientes con metástasis a distancia al diagnóstico y progresión de la enfermedad durante la QTNA puesto que no se les practicó RMI tras la mastectomía.
Las pacientes con tumores mayores de 5cm de diámetro y/o 4 o más ganglios linfáticos axilares positivos recibieron además radioterapia adyuvante.
Técnica quirúrgicaLa técnica quirúrgica consiste en resección del tejido mamario, dejando finos colgajos de piel, variando en la incisión cutánea y la preservación completa o un injerto libre de CAP. Las incisiones varían según el tamaño y configuración de la mama afecta y la contralateral, del tamaño y localización del tumor, de cicatrices previas y de la preferencia del cirujano.
- –
Mastectomía subcutánea por incisión lateral externa.
- –
Técnica de Spira modificada: prótesis con doble cubierta mediante un colgajo desepitelizado unido al músculo pectoral mayor e injerto libre del CAP tras biopsia intraoperatoria negativa de la base del pezón.
- –
Mastectomía ahorradora de piel según patrón de Wise corto: incisión periareolar con prolongación vertical hacia el surco submamario y extensión lateral y medial a lo largo del surco.
- –
Mastectomía ahorradora de piel y pezón por incisión radial externa.
La RMI se realizó mediante implante directo de silicona de perfil anatómico.
Evaluación patológica y resultados oncológicosEl estadio clínico se establece según la clasificación de la séptima edición de la AJCC9.
La respuesta clínica completa se definió como la ausencia de tumor palpable y/o visible en RMN tras QTNA, y la respuesta parcial, como reducción tumoral. Cualquier aumento en el tamaño del tumor se consideró progresión.
La recurrencia locorregional se definió como aparición de nuevo tumor en la pared torácica ipsilateral (piel, tejido subcutáneo y músculo pectoral) o recurrencia en la axila ipsilateral, ganglios linfáticos supraclaviculares, en cadenas mamarias internas o infraclaviculares.
La metástasis a distancia fue definida como cualquier recurrencia en todas las demás áreas no incluidas en la recurrencia locorregional.
Análisis estadísticoPara evaluar las diferencias entre los grupos a estudio, se emplearon los test estadísticos de χ2 o test de Fisher en el caso de variables cualitativas; los test de U de Mann-Whitney o t de Student fueron usados para variables cuantitativas según criterios de normalidad.
Para evaluar la supervivencia global (SG), supervivencia libre de enfermedad (SLE), supervivencia libre de metástasis a distancia (SLMD) y supervivencia libre de recurrencia locorregional (SLRLR) se utilizaron curvas de Kaplan-Meier y test de log-rank.
El punto primario del estudio fue la SLE; se ajustaron diferentes modelos de regresión de Cox para evaluar el tiempo hasta el evento. Un valor de p de 0,05 se consideró estadísticamente significativo. Para toda la investigación se ha utilizado el programa SPSS 22.0.
ResultadosDurante el periodo de estudio se realizaron 171 intervenciones de MBRMI como tratamiento de un cáncer de mama en nuestro centro: 62 pacientes (36,3%) tras QTNA y 109 pacientes (63,7%) que no recibieron tratamiento neoadyuvante.
Resultados generalesLas pacientes tenían una edad media de 48,3±9,8 años (rango 31-87) al momento de la intervención quirúrgica. En el grupo de QTNA fue de 46,6±7,0 años (rango 31-61), y en el grupo control fue de 49,3±11,0 años (rango 31-87), p=0,183.
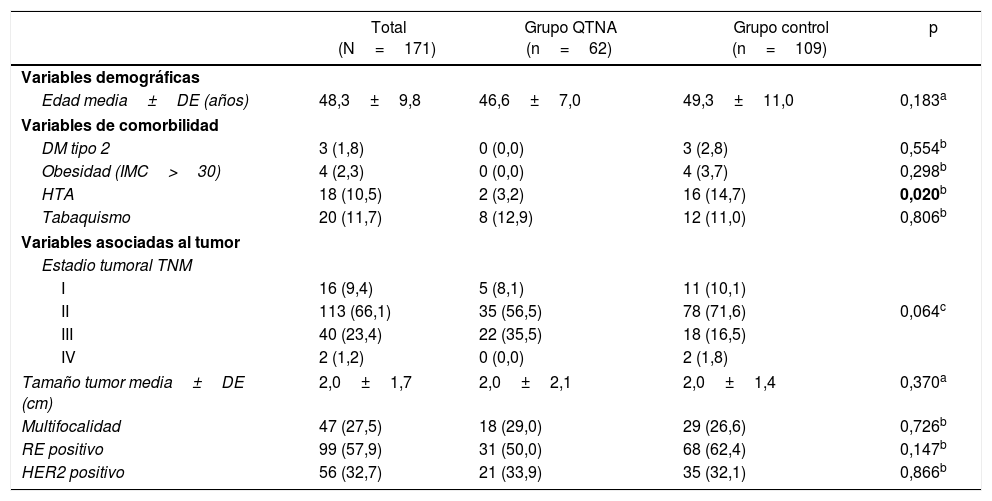
Los datos clínico-patológicos relativos al tumor y las comorbilidades que pudiesen afectar a la técnica quirúrgica y el desarrollo de complicaciones se exponen en la tabla 1. La distribución de estos factores entre los grupos del estudio fue homogénea, únicamente se encuentran diferencias estadísticamente significativas para HTA, siendo superior en el grupo control (14,7% vs. 3,2%; p=0,020).
Variables demográficas y comorbilidades de las pacientes y datos clínico-patológicos del tumor
| Total (N=171) | Grupo QTNA (n=62) | Grupo control (n=109) | p | |
|---|---|---|---|---|
| Variables demográficas | ||||
| Edad media±DE (años) | 48,3±9,8 | 46,6±7,0 | 49,3±11,0 | 0,183a |
| Variables de comorbilidad | ||||
| DM tipo 2 | 3 (1,8) | 0 (0,0) | 3 (2,8) | 0,554b |
| Obesidad (IMC>30) | 4 (2,3) | 0 (0,0) | 4 (3,7) | 0,298b |
| HTA | 18 (10,5) | 2 (3,2) | 16 (14,7) | 0,020b |
| Tabaquismo | 20 (11,7) | 8 (12,9) | 12 (11,0) | 0,806b |
| Variables asociadas al tumor | ||||
| Estadio tumoral TNM | ||||
| I | 16 (9,4) | 5 (8,1) | 11 (10,1) | |
| II | 113 (66,1) | 35 (56,5) | 78 (71,6) | 0,064c |
| III | 40 (23,4) | 22 (35,5) | 18 (16,5) | |
| IV | 2 (1,2) | 0 (0,0) | 2 (1,8) | |
| Tamaño tumor media±DE (cm) | 2,0±1,7 | 2,0±2,1 | 2,0±1,4 | 0,370a |
| Multifocalidad | 47 (27,5) | 18 (29,0) | 29 (26,6) | 0,726b |
| RE positivo | 99 (57,9) | 31 (50,0) | 68 (62,4) | 0,147b |
| HER2 positivo | 56 (32,7) | 21 (33,9) | 35 (32,1) | 0,866b |
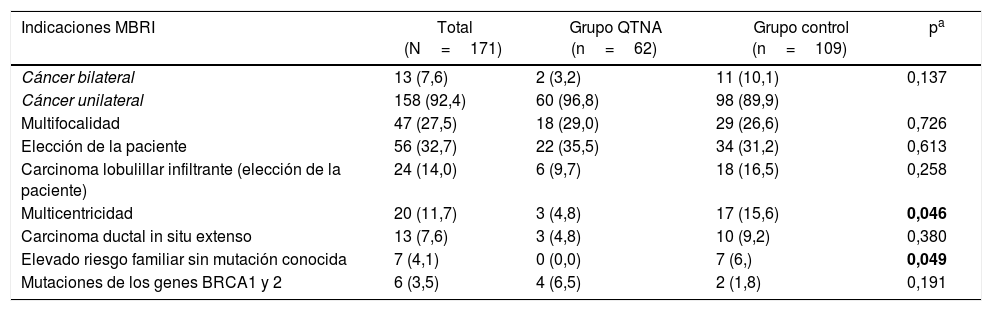
La indicación para practicar una MBRMI más frecuente en ambos grupos es la elección de la paciente (32,7%), seguida de multifocalidad (27,5%), como se expone en la tabla 2.
Indicaciones MBRI
| Indicaciones MBRI | Total (N=171) | Grupo QTNA (n=62) | Grupo control (n=109) | pa |
|---|---|---|---|---|
| Cáncer bilateral | 13 (7,6) | 2 (3,2) | 11 (10,1) | 0,137 |
| Cáncer unilateral | 158 (92,4) | 60 (96,8) | 98 (89,9) | |
| Multifocalidad | 47 (27,5) | 18 (29,0) | 29 (26,6) | 0,726 |
| Elección de la paciente | 56 (32,7) | 22 (35,5) | 34 (31,2) | 0,613 |
| Carcinoma lobulillar infiltrante (elección de la paciente) | 24 (14,0) | 6 (9,7) | 18 (16,5) | 0,258 |
| Multicentricidad | 20 (11,7) | 3 (4,8) | 17 (15,6) | 0,046 |
| Carcinoma ductal in situ extenso | 13 (7,6) | 3 (4,8) | 10 (9,2) | 0,380 |
| Elevado riesgo familiar sin mutación conocida | 7 (4,1) | 0 (0,0) | 7 (6,) | 0,049 |
| Mutaciones de los genes BRCA1 y 2 | 6 (3,5) | 4 (6,5) | 2 (1,8) | 0,191 |
Hay pacientes en las que coexisten más de una indicación.
La mediana de seguimiento fue de 52,0 (RIQ: 23,0-94,0) meses, de 34,5 (RIQ: 13,0-77,3) meses para el grupo de QTNA y de 62,0 (RIQ: 36,5-110,0) para el grupo control, respectivamente (p<0,001).
Técnicas quirúrgicasLa distribución de los diferentes tipos de reconstrucción en los dos grupos del estudio fue homogénea, atendiendo a razones puramente técnicas, individualizando en cada paciente y eligiendo la técnica más idónea. No se encontraron diferencias estadísticamente significativas.
Presentamos los resultados de las diferentes técnicas utilizadas en la tabla 3.
Técnica quirúrgica y complicaciones durante el primer mes postoperatorio
| Técnica | Serie completa (N=171) | Grupo QTNA (n=62) | Grupo control (n=109) | pa |
|---|---|---|---|---|
| Subcutánea incisión lateral externa | 77 (45,1) | 25 (40,3) | 52(47,7) | 0,750 |
| Técnica Spira | 71 (41,5) | 27 (43,5) | 44 (40,4) | 0,748 |
| Patrón Wise corto | 21 (12,3) | 10 (14,5) | 11 (10,1) | 0,460 |
| Incisión radial externa | 2 (1,2) | 0 (0,0) | 2 (1,8) | 0,535 |
| Complicaciones | Serie completa (N=171) | Grupo QTNA (n=62) | Grupo control (n=109) | pa |
|---|---|---|---|---|
| Necrosis cutánea | 13 (7,6) | 6 (3,5) | 7 (4,1) | 0,550 |
| Infección | 9 (5,3) | 3 (1,8) | 6 (3,5) | 1,000 |
| Seroma mantenido | 12 (7,0) | 4 (2,3) | 8 (4,7) | 1,000 |
| Hematoma | 10 (5,8) | 4 (2,3) | 6 (3,5) | 1,000 |
| Reintervención | 7 (4,1) | 3 (1,8) | 4 (2,3) | 0,705 |
Los datos se expresan como n (%).
La tasa global de complicaciones fue del 29,8% para todo el grupo y no hubo diferencias estadísticamente significativas entre los dos grupos en cuanto a la tasa de complicaciones: 32,2% en el grupo QTNA y 28,4% en el grupo control (p=0,44).
La complicación postoperatoria más frecuente fue necrosis cutánea (7,6%), seguida de seroma mantenido (7,0%) y hematoma (5,8%), tal como se expone en la tabla 3. La necrosis cutánea fue la más frecuente en el grupo QTNA y el seroma mantenido fue la más frecuente en el grupo control.
La tasa de reintervención en el postoperatorio temprano fue del 1,8% para el grupo QTNA y del 2,3% para el grupo control (p=0,705).
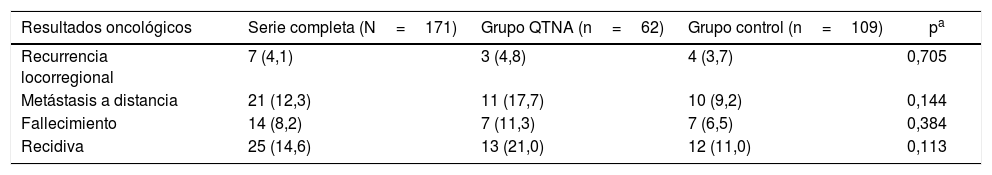
Resultados oncológicosUn 8,2% de las pacientes fallecieron a causa de cáncer de mama durante el estudio, de las cuales 7 pacientes fallecieron en el grupo de QTNA (11,3%) y 7 en el grupo control (6,5%) (tabla 4).
Resultados oncológicos
| Resultados oncológicos | Serie completa (N=171) | Grupo QTNA (n=62) | Grupo control (n=109) | pa |
|---|---|---|---|---|
| Recurrencia locorregional | 7 (4,1) | 3 (4,8) | 4 (3,7) | 0,705 |
| Metástasis a distancia | 21 (12,3) | 11 (17,7) | 10 (9,2) | 0,144 |
| Fallecimiento | 14 (8,2) | 7 (11,3) | 7 (6,5) | 0,384 |
| Recidiva | 25 (14,6) | 13 (21,0) | 12 (11,0) | 0,113 |
Los datos se expresan como n (%).
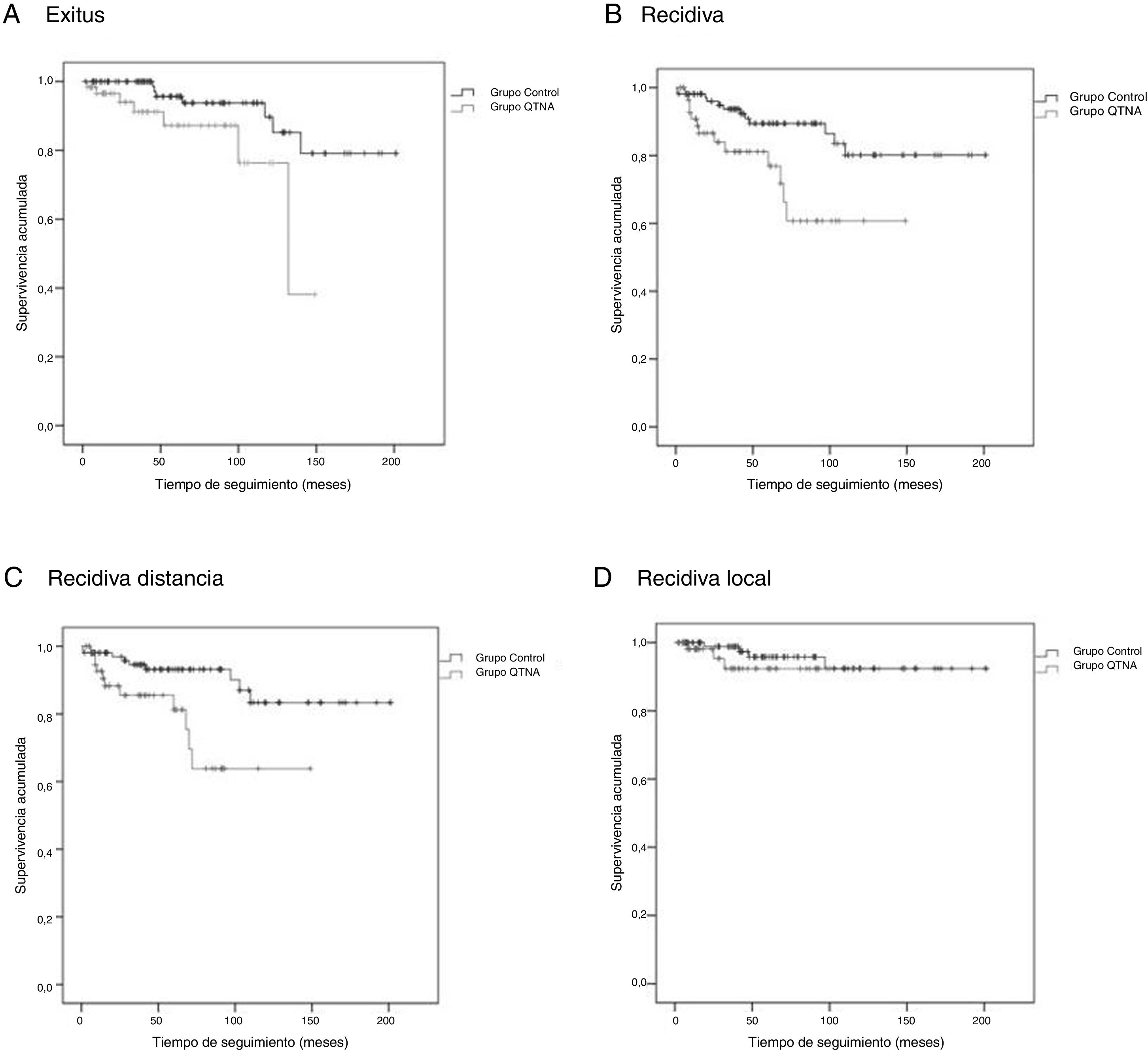
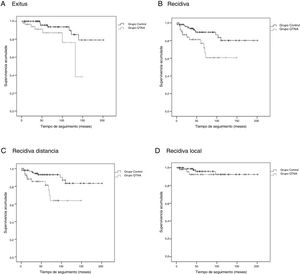
Las curvas de supervivencia de Kaplan-Meier para SG (test de log-rank, p=0,016), SLE (test de log-rank, p=0,005), SLMD (test de log-rank, p=0,004) y SLRLR (test de log-rank, p=0,368) se exponen en la figura 1.
Grupo QTNA:
El tiempo medio de SG fue de 46,1 (IC 95%: 36,2-55,9) meses, el tiempo medio de SLE fue de 40,6 meses (IC 95%: 31,7-49,5), el tiempo medio de SLMD fue de 39,8 meses (IC 95%: 31,2-48,5) y el tiempo medio de SLRLR fue de 43,0 meses (IC 95%: 33,5-52,5).
Grupo control:
El tiempo medio de SG fue de 75,9 (IC 95%: 65,8-86,1) meses, el tiempo medio de SLE fue de 72,5 meses (IC 95%: 62,4-82,6), el tiempo medio de SLMD fue de 70,8 (IC 95%: 60,7-80,9) meses y el tiempo medio de SLRLR fue de 71,3 (IC 95%: 61,4-81,2) meses.
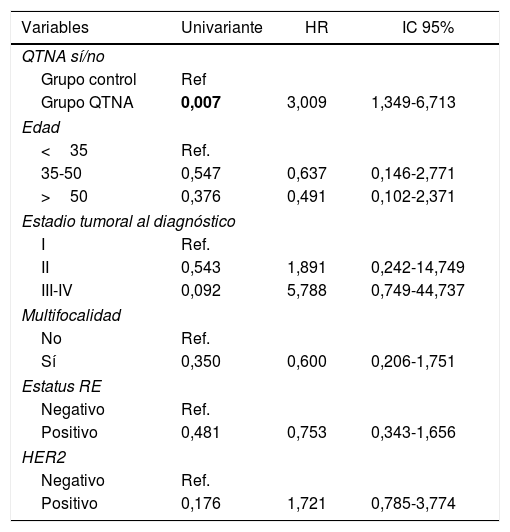
Existen diferencias estadísticamente significativas entre los grupos para todas las variables excepto recidiva local. Se observa en las curvas de supervivencia (fig. 1) y el análisis univariante muestra que las pacientes del grupo QTNA tienen 3 veces más riesgo que las pacientes del grupo control de presentar recidiva en un momento determinado del tiempo 3,009 (1,349-6,713) (tabla 5).
Análisis uni- y multivariante para recurrencia
| Variables | Univariante | HR | IC 95% |
|---|---|---|---|
| QTNA sí/no | |||
| Grupo control | Ref | ||
| Grupo QTNA | 0,007 | 3,009 | 1,349-6,713 |
| Edad | |||
| <35 | Ref. | ||
| 35-50 | 0,547 | 0,637 | 0,146-2,771 |
| >50 | 0,376 | 0,491 | 0,102-2,371 |
| Estadio tumoral al diagnóstico | |||
| I | Ref. | ||
| II | 0,543 | 1,891 | 0,242-14,749 |
| III-IV | 0,092 | 5,788 | 0,749-44,737 |
| Multifocalidad | |||
| No | Ref. | ||
| Sí | 0,350 | 0,600 | 0,206-1,751 |
| Estatus RE | |||
| Negativo | Ref. | ||
| Positivo | 0,481 | 0,753 | 0,343-1,656 |
| HER2 | |||
| Negativo | Ref. | ||
| Positivo | 0,176 | 1,721 | 0,785-3,774 |
Como resultado de los recientes avances en los tratamientos quimioterápicos y agentes dirigidos contra HER2, el uso de QTNA ha aumentado10, viéndose aumentado también el número de pacientes intervenidas de RMI tras QTNA.
La seguridad oncológica de la RMI tras mastectomías ahorradoras de piel, o de piel y pezón, practicadas en pacientes con cáncer de mama en estadio avanzado, aún es controvertida, especialmente cuando se administra QTNA.
En nuestro estudio, encontramos diferencia en SG, SLE, SLMD y SLRLR entre los 2 grupos tras ser apareados por edad y estadio clínico.
Muchos cirujanos dudan en realizar RMI tras QTNA porque podría aumentar la tasa de complicaciones, lo que se traduciría en un retraso en la administración de los tratamientos adyuvantes, como la radioterapia o trastuzumab11,12.
Aurilio et al.13 informaron tasas de recurrencia local significativamente altas en comparación con el grupo de mastectomía simple sin reconstrucción en pacientes con receptores estrogénicos negativos.
Sin embargo, muchos otros estudios no mostraron un aumento significativo en las complicaciones en pacientes intervenidas mediante RMI tras QTNA14-17. Song et al.18 informaron que un metaanálisis que incluyó 11 estudios demostró que la QTNA no aumenta la tasa de complicaciones en pacientes con RMI.
En un estudio prospectivo publicado por Donker et al.19 no solo no se demostró aumento de las complicaciones a corto plazo, sino que estas fueron significativamente inferiores (15% vs. 29%; p=0,042) en las pacientes con RMI tras QTNA comparadas con las que recibieron QT adyuvante tras la RMI.
Los resultados de nuestro estudio están en consonancia con estos datos ya que no encontramos diferencias estadísticamente significativas en cuanto a las tasas de complicaciones, secuelas y/o necesidad de reintervención entre los grupos de estudio.
Sí se observan algunas diferencias como el mayor riesgo de presentar recidiva en las pacientes del grupo QTNA, que nos hacen pensar que las pacientes que reciben QTNA a pesar de presentar un estadio tumoral más desfavorable, son discretamente más jóvenes y con menor número de comorbilidades que pudieran afectar al desarrollo de complicaciones.
Aunque un ensayo controlado aleatorizado prospectivo sería el ideal, existen muchas dificultades en cuanto a la realización de la RMI, no solo de índole técnica establecidas por el cirujano sino también las preferencias de las pacientes; y además, es difícil predecir con precisión la respuesta clínica a la QTNA, lo que dificulta la planificación quirúrgica.
Existen pocos estudios de casos-controles pareados al respecto, por ello estudios de este tipo pueden aportar información útil, que permita aumentar el número de indicaciones de RMI tras la QTNA al demostrarse segura.
No obstante, existen varias limitaciones en este estudio que no permiten generalizar los resultados. En primer lugar, se trata de un estudio retrospectivo con un tiempo de seguimiento relativamente corto teniendo en cuenta la supervivencia actual del cáncer de mama. En segundo lugar, al tratarse de la experiencia de una única institución el tamaño de la muestra es pequeño para establecer un análisis preciso de los resultados oncológicos. Por otro lado, la diferencia de seguimiento en ambos grupos constituye asimismo una limitación para la generalización de resultados. Sería necesario llevar a cabo estudios multicéntricos con un tiempo de seguimiento mayor para poder generalizarlos.
ConclusionesLa RMI mediante prótesis directa tras mastectomías ahorradoras de piel puede ser una opción viable de tratamiento para pacientes con cáncer de mama que reciben QTNA.
Estas pacientes presentan un aumento del riesgo de desarrollar recidiva local, pero se necesitan datos de seguimiento a largo plazo para evaluar con precisión los resultados oncológicos.
FinanciaciónEl trabajo no ha recibido financiamiento.
Conflicto de interesesNo existe conflicto de intereses.
A los integrantes de Unidad de Mama del Hospital Clínico Universitario Lozano Blesa de Zaragoza, cirujanos, personal de enfermería y a las pacientes.