Recientemente, han publicado la oclusión portal derecha más split in situ como un nuevo método para hipertrofiar en 7 días el volumen residual (VR) tras las resecciones hepáticas en dos tiempos. Es una técnica compleja, fundamentada en ocluir las colaterales intrahepáticas entre ambos lóbulos. Presentamos una técnica original para hipertrofiar el VR ocluyendo la vena porta derecha y las colaterales intrahepáticas: mujer de 35 años con un tumor estromal intestinal y 14 metástasis bilobares, siendo el VR estimado del 24%. Una vez extirpadas las lesiones del lóbulo izquierdo, ocluimos la porta derecha y aplicamos un torniquete en la línea de Cantlie mediante maniobra de hanging. Al 7.° día hipertrofió el VR un 57% y al 8.° día se realizó una hepatectomía derecha. Nuestra técnica es eficaz y sencilla de realizar y, de corroborarse en futuros estudios, esta técnica sería de elección en las resecciones hepáticas en 2 tiempos.
Right portal vein occlusion plus «in situ split» has recently been reported as a new method to hypertrophy the functional remnant volume (FRV) in 7 days after two-stage liver resection. It is a complex procedure associated with the occlusion of the intrahepatic collaterals between both lobes. We present an original technique for hypertrophying the FRV by occluding the right portal vein and the intrahepatic collaterals: a case is presented of a 35-year-old woman with an intestinal stromal tumour, 14 bilobar metastases and an estimated 24% FRV. Once the lesions were removed from the left lobe, we performed a right portal vein transection and applied a tourniquet on the Cantlie line, using the hanging manoeuvre. A 57% hypertrophy of the FRV was achieved by day 7, and the right hepatectomy was performed on day 8. Our technique is effective and simple to perform and if corroborated in future studies, this technique would be of choice in 2-stage liver resection.
La insuficiencia hepática postoperatoria (IHP) es la complicación más temida tras las resecciones hepáticas, debido a su elevada morbimortalidad1. El volumen funcional residual (VFR) mínimo exigido por la mayoría de autores para evitar la IHP es del 25% en hígados sanos y del 35-40% en pacientes que han sido sometidos a quimioterapia2–8. En el caso de metástasis bilobares múltiples que requieran la resección hepática en dos tiempos9, una vez resecadas las lesiones del lóbulo izquierdo, puede ser necesario utilizar una técnica de oclusión portal para hipertrofiar el lóbulo derecho, bien con la ligadura portal intraoperatoria (LPI)5–7 durante la primera intervención bien con embolización portal2 a la semana de la primera intervención.
Recientemente, Baumgart et al.10 describen una nueva técnica revolucionaria de hepatectomía en 2 tiempos en la que, una vez realizada la LPI derecha, realizan una bipartición hepática in situ con el fin de evitar la circulación por colaterales intrahepáticas. En 3 pacientes consiguen una regeneración eficaz a los 7 días de la primera intervención sin progresión tumoral. Otros autores11–13, utilizando esta misma técnica, obtienen los mismos resultados.
El objetivo de este artículo es presentar una paciente con resección hepática en 2 tiempos, en la que empleamos una nueva técnica para conseguir la hipertrofia en una semana combinando la oclusión portal derecha y la aplicación de un torniquete en la línea de bipartición, y que consideramos presenta ventajas respecto al método descrito recientemente por Baumgart et al.10.
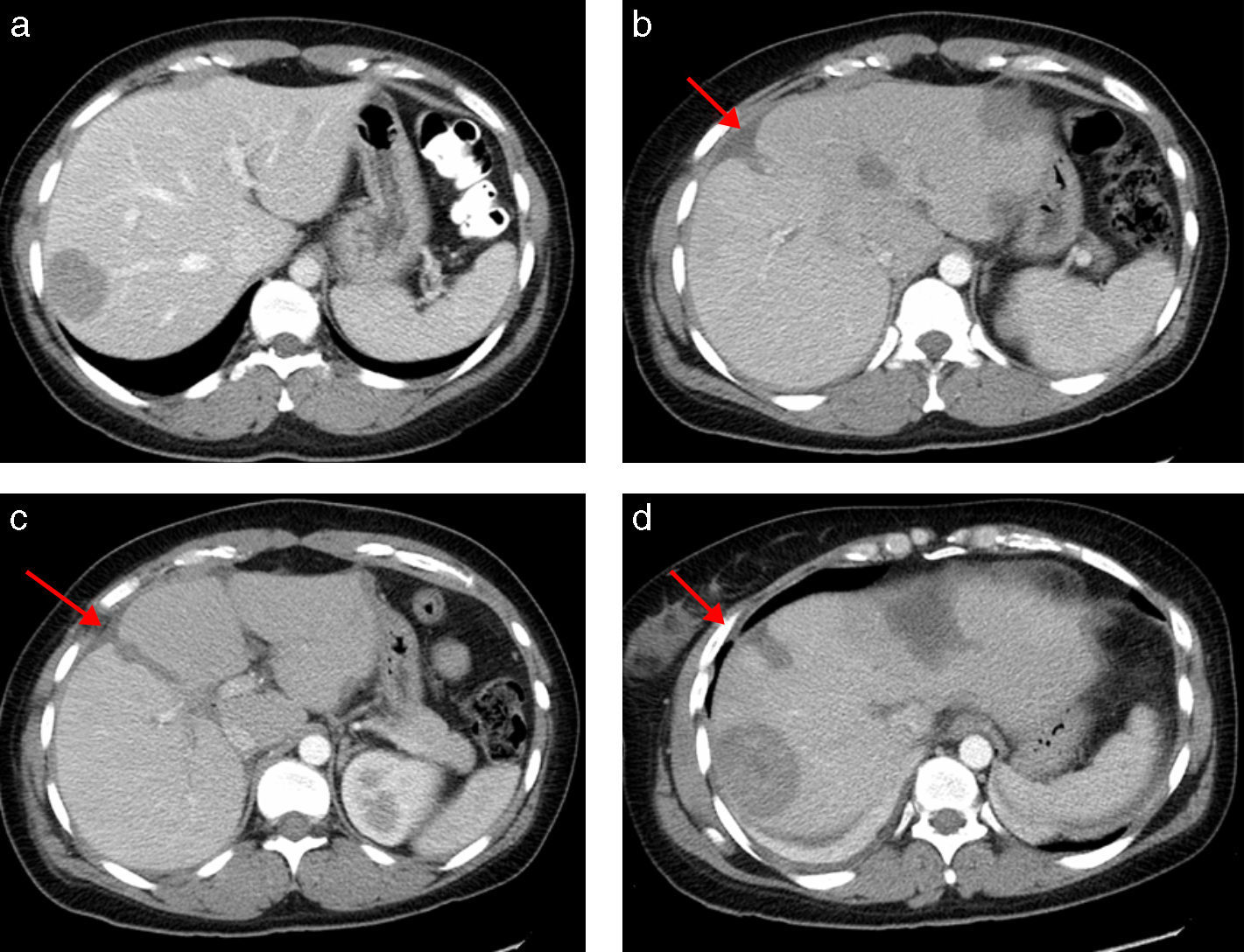
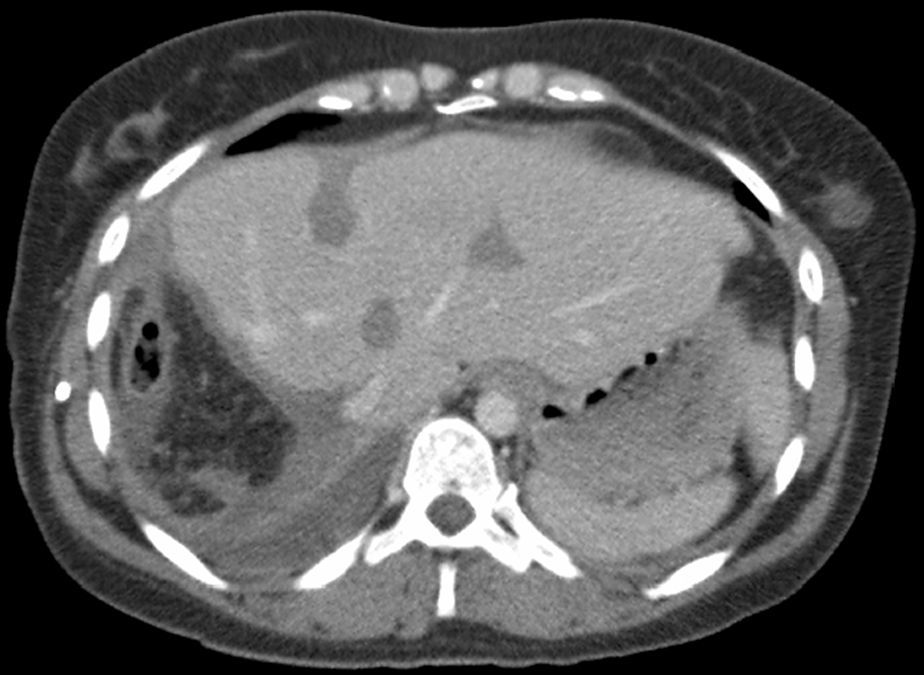
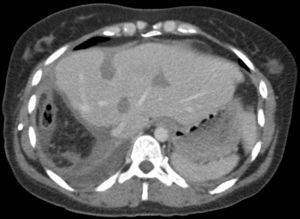
Caso clínicoMujer de 35 años de edad, que se interviene en abril de 2008 de un tumor estromal de intestino delgado mixto epitelial y fusiforme de 6cm que invade la serosa, ulcera la mucosa, ganglios negativos, CD kit y CD34 positivos, con un Ki-67 de 5%, y un índice mitótico de 15-20%/50 CGA. Recibe tratamiento continuado con imatinib y en un control de TC realizado en septiembre de 2011 se detectan 3 metástasis hepáticas en s II (2cm), s IVa (1,5cm) y s VIII (5cm). Se realiza PET que detecta una sola metástasis hepática de 5cm en s VIII con un SUV de 6, sugestiva de malignidad. Se programa para resección de las 3 metástasis y se interviene en septiembre de 2011 mediante laparotomía subcostal bilateral. Por ecografía y palpación se detectan en el lóbulo hepático izquierdo las 2 lesiones descritas en el TC (segmentos II y IVa) y otras 4 más subcentimétricas; y, en el lóbulo derecho, la lesión de 5cm en segmento VIII y otras 7 lesiones más, subcentimétricas. El VFR del lóbulo izquierdo era de 566ml (volumen hepático total de 1.441ml) (39% del VFR) mientras que el VFR estimado tras la resección de las lesiones del lóbulo izquierdo era del 24% (fig. 1a), por lo que se decide realizar la resección hepática en 2 tiempos, siguiendo nuestros criterios volumétricos14.
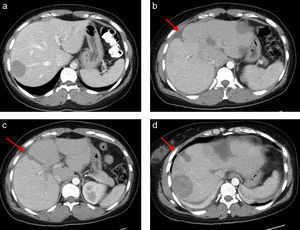
a) Tomografía Computerizada (TC) preoperatoria con un volumen lóbulo izquierdo de 566ml (volumen intraoperatorio calculado tras resección de las metástasis del lóbulo izquierdo de 350ml). b, c y d) TC al 7° día postoperatorio con un volumen lóbulo izquierdo de 790ml. La flecha señala la línea del torniquete. Se observa un área hipodensa central correspondiente a radiofrecuencia.
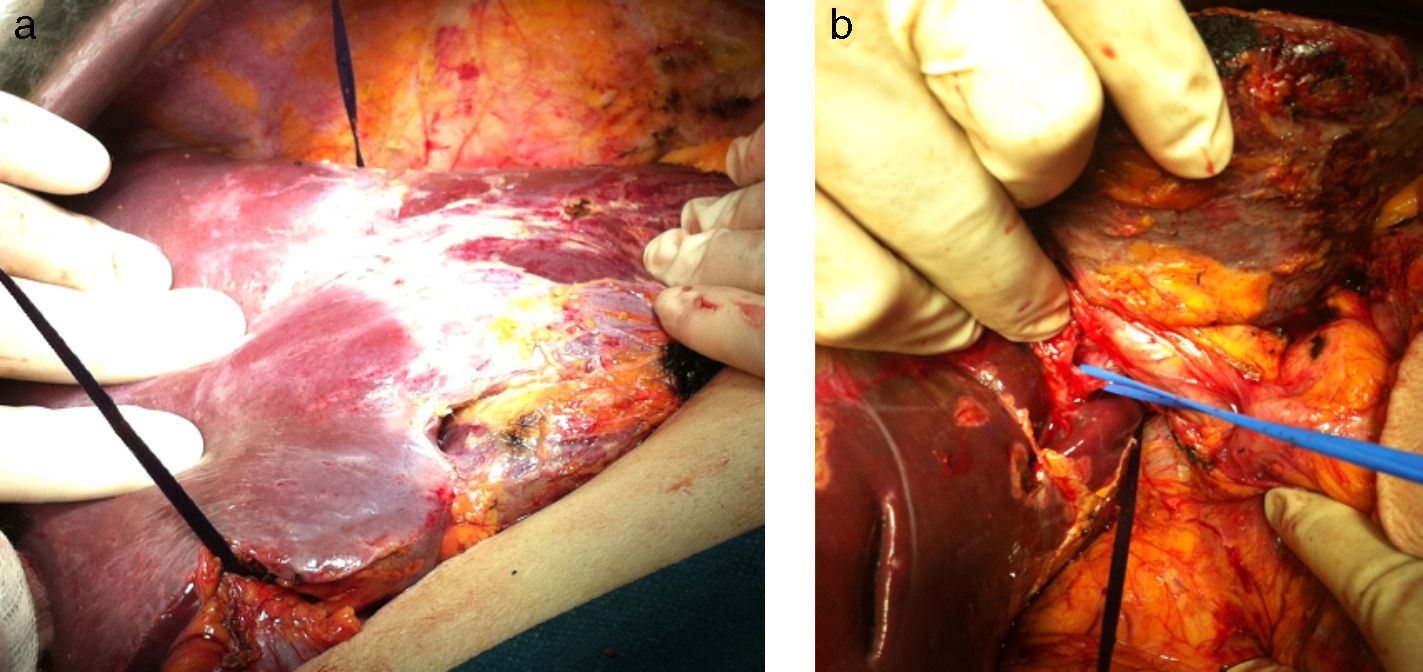
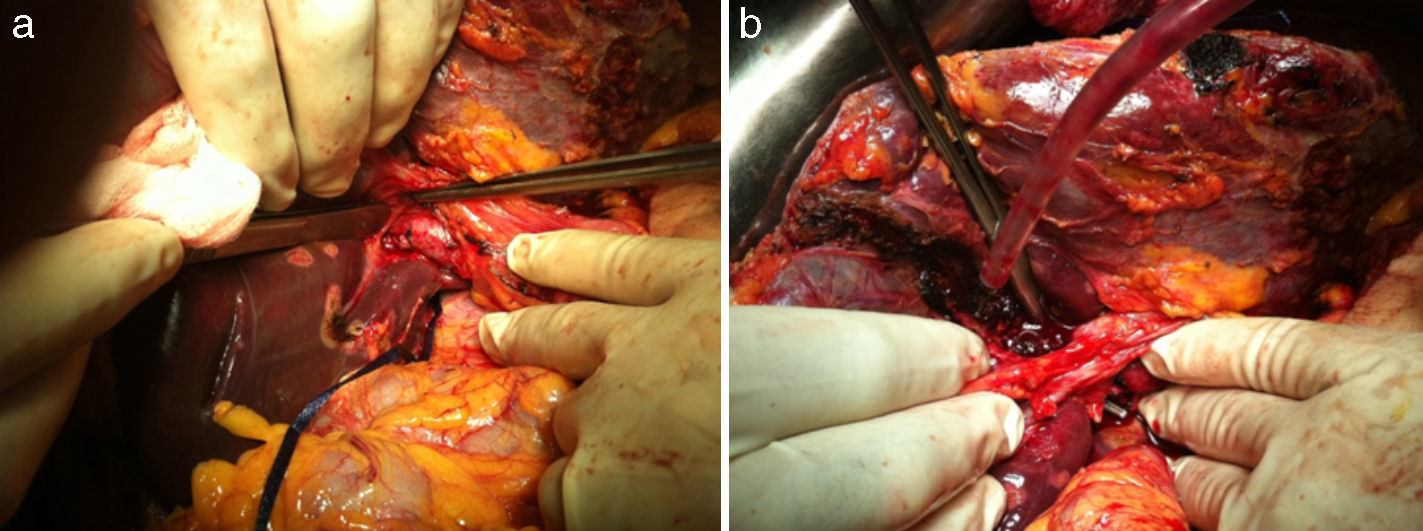
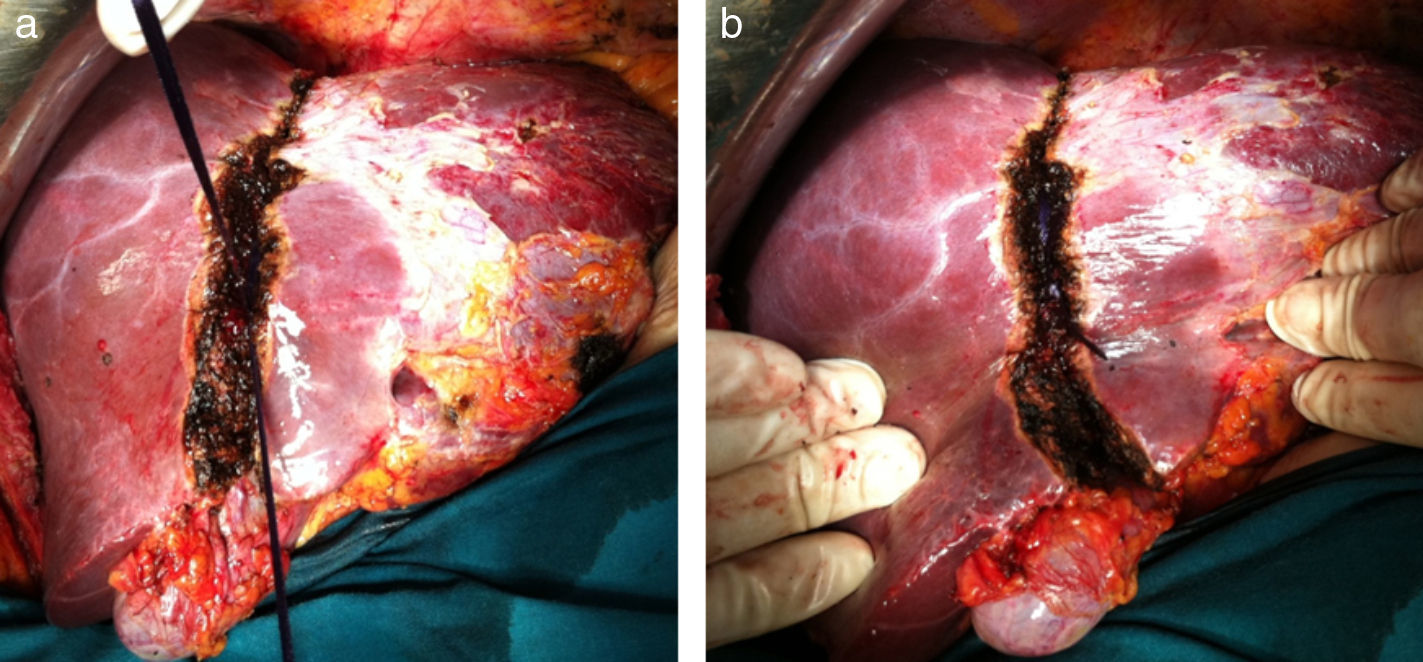
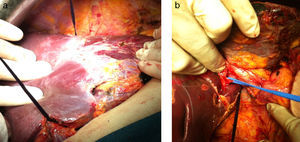
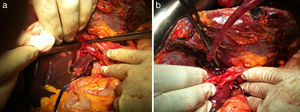
Se extirpan 3 lesiones en lóbulo izquierdo (1 en s II, 1 en s IVa y 1 en s III) más radiofrecuencia de 3 metástasis subcentimétricas (1 en s II, 2 en s IVa). La técnica de hipertrofia se inicia con la maniobra de hanging pasando una pinza de Pean desde la parte inferior del caudado hasta salir entre las venas hepática derecha y media. Se pasa un hilo de sutura de parénquima hepático (Vicryl 3mm - V152- Ethicon®) que rodea todo el parénquima hepático (fig. 2a). A continuación se realiza la disección de la vena porta derecha posterior al hilio hepático derecho (fig. 2b), sin colecistectomía, y se procede a la ligadura y sección de la vena porta derecha (fig. 3a). El torniquete se pasa extraglissoniano salvando la vía biliar derecha y la arteria hepática derecha (fig. 3b), quedando solamente incluido en el torniquete el parénquima hepático correspondiente a la línea de bipartición.
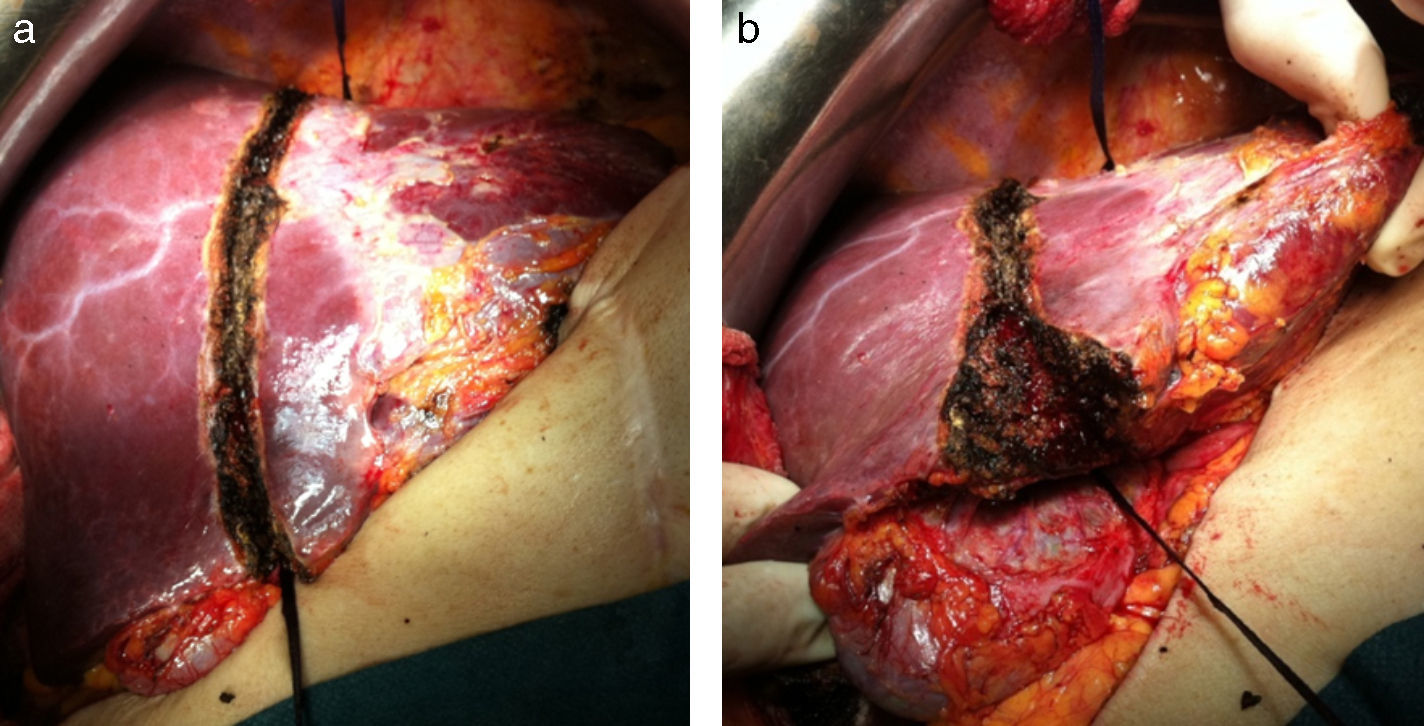
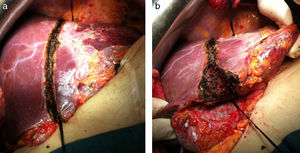
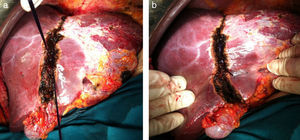
Se realiza un surco de unos 2cm en el parénquima hepático en la línea de bipartición (fig. 4a y b), que se debe continuar hasta el caudado, teniendo cuidado en el lecho vesicular de separar la vesícula en su margen izquierdo hasta la mitad del lecho vesicular. A continuación se anuda el torniquete lo suficientemente fuerte como para ocluir los vasos que comunican ambos lóbulos a nivel de la línea de bipartición (fig. 5a y b). Con ecografía podemos observar la zona isquémica del parénquima ocluido por la ligadura, la ausencia de circulación colateral y la congestión que se ocasiona en el lóbulo izquierdo con hipertrofia de los vasos portales y hepáticos. El tiempo quirúrgico fue de 180min con unas pérdidas hemáticas de 100ml.
La paciente presenta a las 24 horas un descenso de la actividad de protrombina desde el 100 hasta el 58% y una elevación de GPT hasta 600 U/L, normalizándose ambos a las 72h de la cirugía. Se realiza TC con volumetría al 4.° día apreciando hígado con amputación de vena porta derecha y lóbulo izquierdo hipertrofiado sin metástasis, con un VFR de 680ml (40% del VHT) y un % de hipertrofia del 46%. Nueva volumetría al 7.° día con un VFR de 790ml (46% del VHT) y un % de hipertrofia del 57% (fig. 1; figs. 1 b-d).
Técnica quirúrgica del segundo tiempoSe realiza al 8.° día postoperatorio con la misma incisión. Es evidente la ausencia de adherencias. Se ligan y seccionan la arteria hepática derecha y la vía biliar derecha con facilidad ya que son las únicas estructuras hasta llegar al torniquete. Se vuelve a realizar hanging y se realiza la bipartición parenquimatosa in situ (con CUSA y ligasure Impact) al mismo nivel de la ligadura del parénquima. La vena suprahepática derecha es seccionada con endogía vascular. Tiempo quirúrgico de 120 minutos con un tiempo de bipartición de 20 minutos, y pérdidas hemáticas nulas. La paciente fue alta hospitalaria al 14 día postoperatorio, habiendo presentado un bilioma que precisó drenaje radiológico durante 7 días.
El VFR del lóbulo izquierdo, al mes de la intervención, fue de 1.087ml (fig. 6).
DiscusiónEn la última década se busca el método ideal para la resección de metástasis bilobares múltiples en dos tiempos quirúrgicos. Este término fue introducido por Adam et al.9 en el año 2000, al extirpar varias lesiones en el primer tiempo, sin emplear técnica de oclusión portal, y aprovechando la regeneración hepática tras la resección hepática para después realizar el segundo tiempo quirúrgico. Este método es muy eficaz ya que experimentalmente se ha comunicado que la regeneración hepática fue más importante cuando se realizó una resección hepática parcial15 que cuando se realizó la ligadura o la embolización portal. Posteriormente, Kianmanesh et al., en 2003, realizan la ligadura portal derecha, tras la resección de las lesiones hepáticas del lóbulo izquierdo, durante el primer tiempo16. Jaeck et al.2, en 2004, proponen realizar la resección de las lesiones del lóbulo izquierdo en el primer tiempo quirúrgico, y realizar la embolización portal percutánea antes del segundo tiempo quirúrgico ya que consideran que esta técnica de oclusión portal consigue una hipertrofia mayor que la ligadura portal. Todas estas técnicas tienen el inconveniente de que la hipertrofia se alcanza a las 4-8 semanas y algunos pacientes presentan fracaso de la hipertrofia2–8 o bien presentan progresión tumoral8,17 en cuyo caso no pueden ser sometidos a la resección hepática mayor. Algunos autores utilizan quimioterapia entre los dos tiempos quirúrgicos para evitar la progresión tumoral9. El fracaso o retraso de la hipertrofia del VFR, especialmente en pacientes con ligadura portal5,7,16, se ha relacionado con la presencia de colaterales intrahepáticas entre el sistema portal izquierdo y el derecho isquémico por la oclusión portal derecha.
Recientemente Baumgart et al.10 comunican un nuevo método de regeneración hepática en 3 pacientes previamente a la realización de una trisectionectomía derecha, realizando «sección portal derecha y bipartición hepática in situ». Los autores comunican10 incrementos de hipertrofia del VFR al 7.° día postoperatorio del 62, 75 y 80%, respectivamente. Estos resultados son similares a los obtenidos por otros autores12–14. De Santibáñes et al.11, también en 3 pacientes, consiguen una hipertrofia al 7.° día del 40, 65 y 83%, respectivamente. El mecanismo de hipertrofia parece estar relacionado con el mismo mecanismo que consigue la hepatectomía derecha9,15: la sección de la línea de bipartición que evita la neoformación y la utilización de colaterales, manteniendo el lóbulo derecho con isquemia venosa por la ligadura portal para evitar la IHP por un VFR insuficiente. La redistribución de los factores hepatotróficos hacia el lóbulo izquierdo (insulina, hormona de crecimiento, factor de crecimiento hepatocitario, interleucina-6, etc.) y la ausencia de colaterales intrahepáticas consiguen la regeneración hepática en 7 días.
De Santibáñez et al.11 consideran que la técnica de Baumgart et al.10 representa uno de los más importantes avances en la cirugía oncológica del hígado de la última década ya que permite la resección R0 en pacientes con enfermedad tumoral hepática declarados inoperables con una regeneración rápida en una semana, evitando los inconvenientes de las técnicas clásicas (LPI y embolización portal preoperatoria), la progresión tumoral y el fracaso de la regeneración.
Sin embargo, de Santibáñez et al.11 describen que es una técnica compleja ya que hay que realizar un split in situ y que solo se debe reservar para centros especializados con un alto volumen de hepatectomías. Los autores que emplean esta técnica10–13 no han especificado las pérdidas hemáticas, las necesidades transfusionales, ni el tiempo quirúrgico, pero es bien conocido que realizar un split in situ sin oclusión portal (ya que no es conveniente la oclusión hiliar completa porque el VFR es insuficiente) o bien tras la oclusión portal derecha lo que obliga a que toda la sangre pase por la porta izquierda, es una técnica compleja como describen los autores, con pérdidas hemáticas importantes y puede requerir transfusión, aspectos desfavorables en estos pacientes. Nuestra técnica presenta una diferencia fundamental y es la sencillez de realización, tanto en el primer tiempo quirúrgico como en el segundo. En el primer tiempo, tras la resección de las metástasis de lóbulo izquierdo, se procede a la sección portal derecha sin colecistectomía y sin movilización del lóbulo derecho para evitar adherencias (es importante la sección portal para evitar que al anudar el torniquete se produzca una acodadura de la vena porta izquierda quedando isquémico el VFR). La colocación del torniquete mediante la maniobra de hanging fue sencilla de realizar y también es importante realizar el surco de 2cm, que se debe prolongar hasta el caudado, en cuyo fondo queda el torniquete una vez anudado. Con nuestra técnica no ligamos la vía biliar derecha como realiza Baumgart10, consiguiendo una hipertrofia adecuada, por lo que parece no ser necesaria esta maniobra, que tampoco tiene un fundamento científico claro como indica de Santibáñez et al.11. Al ser una técnica poco agresiva, las pérdidas hemáticas son mínimas lo que permite una recuperación precoz del paciente. Con nuestra nueva técnica hemos conseguido al 7.° día una hipertrofia del 57%, suficiente para indicar la resección hepática mayor y en las mediciones volumétricas al 4.° día también hemos comprobado que se consigue una hipertrofia del 46%, lo que podría ser suficiente para indicar la resección hepática mayor más precozmente, si fuese necesario. Esto indica que la regeneración hepática puede ser más precoz que la descrita en la actualidad (se ha descrito que la regeneración hepática alcanza su pico máximo a las 2 semanas, logrando un desarrollo de 12–21ml por día en hígados sanos)16 por lo que son necesarios estudios de investigación que expliquen los mecanismos de la regeneración hepática que se consigue con esta técnica (a los 7 días se consigue una regeneración eficaz, e incluso al 4.° día se alcanzan volúmenes adecuados).
Respecto a la progresión tumoral descrita con las técnicas de oclusión portal8,17, al realizar con nuestra técnica la segunda intervención al 8.° día, no se ha evidenciado crecimiento tumoral de las lesiones detectadas en el lóbulo derecho, ni han aparecido nuevas lesiones en el lóbulo izquierdo.
En el segundo tiempo, la bipartición también es sencilla debido a que existe una zona isquémica en la línea de bipartición con los vasos ocluidos lo que permite realizar la intervención con un tiempo quirúrgico corto, realizar la bipartición en menos de 20min, sin transfusión y con unas pérdidas hemáticas mínimas.
En conclusión, la técnica original que presentamos para conseguir la regeneración hepática realizando sección de la vena porta derecha más torniquete en la línea de bipartición, destaca por su sencillez y su efectividad permitiendo la segunda intervención antes de los 10 días, por lo que consideramos la técnica indicada en metástasis bilobares múltiples que requieran la resección hepática en 2 tiempos. Al ser una técnica eficaz y con una regeneración rápida, se puede emplear como sustituta de la embolización portal preoperatoria en el caso de tumores unilobares grandes que requieren resecciones extendidas en un solo tiempo quirúrgico con un VFR insuficiente. Debido a su sencillez, es una técnica que podría ser empleada, no solo por centros con grandes volúmenes de resecciones hepáticas y expertos en bipartición, sino también por la mayoría de las unidades especializadas en cirugía hepática.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.