La causa más frecuente de los empiemas pleurales son los derrames paraneumónicos, siendo el cáncer de pulmón el origen de los mismos en muy pocas ocasiones. EL objetivo de nuestro trabajo es analizar los resultados del tratamiento del empiema por vía toracoscópica previo al tratamiento oncológico definitivo.
MétodosEstudio descriptivo retrospectivo en el que se recogen las diferentes variables clínicas durante el tratamiento de 332 pacientes entre 2002 y 2010.
ResultadosEn 332 pacientes con empiema, la etiología de esta enfermedad fue el cáncer de pulmón en 11 casos. Entre ellos había 10 varones y una mujer (mediana de edad, 57,9 años; rango: 46-76). El tratamiento inicial fue la colocación de un tubo de toracostomía en 8 pacientes y la cirugía toracoscópica videoasistida en 3 pacientes. Se llevó a cabo un desbridamiento toracoscópico en 4 pacientes en los que el resultado del tubo de toracostomía no fue satisfactorio debido a un drenaje insuficiente. Se llevó a cabo una resección quirúrgica en 7 pacientes cuyas características eran apropiadas tras el control de la infección. Se produjo una fístula broncopleural y un empiema postoperatorio tras la neumectomía en un caso. No se observó mortalidad operatoria. La media de supervivencia fue de 32,8 meses en los pacientes tratados con resección.
ConclusionesEl empiema puede ser una forma de presentación muy poco frecuente del cáncer de pulmón cuyo abordaje puede realizarse por toracoscopia, si bien el mismo tiene sus limitaciones.
The most common cause of pleural empyema are parapneumonic effusions, and lung cancer is a rare cause of empyema. The aim of the present study is to analyse the results of the thoracoscopic treatment of empyema before definitive oncological treatment.
MethodsRetrospective descriptive study of 332 patients including different clinical variables between 2002 and 2010.
ResultsAmong 332 patients with empyema, the etiology of this disease was lung cancer in 11 patients. Ten of these patients were male and one was female (median age, 57.9 years; range, 46–76). The initial treatment was tube thoracostomy in 8 patients and video-assisted thoracoscopic surgery in 3 patients. Thoracoscopic debridement was performed in 4 patients whose tube thoracostomy underperformed because of insufficient drainage. The methods used for diagnosis of lung cancer were fiberoptic bronchoscopy and video-assisted thoracoscopic surgery. Surgical resection was performed on 7 suitable patients following infection control. Postoperative bronchopleural fístula and empyema occurred after pneumonectomy in one case. No operative mortality was observed. The mean survival time was 32.8 months for patients undergoing resection.
ConclusionsEmpyema could be a rare presentation of lung cancer and those suitable for surgical treatment should undergo standard treatment with reasonable results.
El empiema se define como una colección de pus en la cavidad pleural y continúa siendo un trastorno de posible gravedad, con múltiples causas. Aunque lo más frecuente es que se produzca después de un derrame paraneumónico, se da también como complicación del cáncer de pulmón en un 0,1-7,9% de los casos de empiema y en un 0,7% de los pacientes con cáncer de pulmón primario operable1,2.
El empiema puede controlarse mediante el drenaje de la cavidad torácica y el tratamiento sistémico con antibióticos. El drenaje se obtiene con un tubo de toracostomía o con cirugía toracoscópica videoasistida (VATS). Si el cáncer de pulmón es la causa del empiema, debe determinarse el estadio, y si el estadio del cáncer es apropiado para ello, se realizará la resección pulmonar.
Dado que el número de casos publicados en la literatura es limitado, evaluamos el tratamiento del empiema con cáncer de pulmón primario resecable.
MétodosCon el empleo de la base de datos de nuestro hospital, investigamos retrospectivamente a 332 pacientes a los que se diagnosticó un empiema entre los años 2002 y 2010. Todos los pacientes que fueron tratados en nuestra clínica dieron su consentimiento informado mediante la firma de una declaración que permitía el uso de sus datos para ensayos clínicos. Los pacientes se clasificaron según la etiología, que se determinó en función de la historia clínica del paciente; los resultados de la exploración física, la radiología y el análisis del líquido del empiema, así como otros factores clínicamente relevantes. En este estudio no se incluyó a pacientes con empiema postoperatorio, postraumático, posneumónico, ni cáncer de pulmón metastásico. Nuestro estudio incluyó a pacientes con un diagnóstico de cáncer de pulmón primario durante el tratamiento del empiema. Los datos recogidos fueron los de características demográficas, subtipo de tumor pulmonar, diagnóstico, estadio tumoral, intervenciones quirúrgicas, resultados clínicos y seguimiento.
Se evaluaron los resultados del hemograma completo, parámetros bioquímicos y la presencia en esputo de gérmenes de tuberculosis u otros gérmenes en todos los pacientes. Se realizaron también exploraciones de imagen (radiografía de tórax posteroanterior y de perfil, ecografía, tomografía computarizada [TC] torácica y tomografía de emisión de positrones). Se utilizó la TC de tórax para evaluar las lesiones del parénquima del pulmón.
Se realizó una toracocentesis en todos los casos. Se enviaron muestras del líquido pleural para un examen bioquímico, microbiológico y anatomopatológico. El empiema se definió como un líquido pleural con cultivo positivo, aspecto purulento, maloliente, y por los parámetros bioquímicos. Todos los pacientes en los que había una sospecha de infección pleural recibieron un tratamiento antibiótico apropiado desde el momento del primer examen.
En primer lugar se colocó el tubo de toracostomía o se aplicó la VATS, según cuál fuera el estado físico del paciente, para el drenaje del empiema. Si en un paciente el drenaje era insuficiente con el tubo de toracostomía, se aplicaba la VATS como intervención secundaria.
Se obtuvo una ventilación unipulmonar con el empleo de un tubo endotraqueal de doble luz en el momento de la VATS. Se limpiaron los depósitos de fibrina del parénquima del pulmón, las costillas y el diafragma, y se lavó el espacio torácico con una solución salina durante la operación. Una vez liberado el pulmón de la pared torácica y el diafragma, se verificó la capacidad pulmonar mediante la insuflación pulmonar para llenar la cavidad pleural. Obtuvimos biopsias de la pleura parietal y el parénquima para confirmar la histopatología. Se dejó un drenaje 32-French en el tórax al final de la operación. Todos los pacientes fueron extubados en el quirófano tras la VATS y se les trasladó a la sala de reanimación postoperatoria. Los criterios para finalizar el drenaje fueron la ausencia de fuga de aire, la expansión completa del pulmón en la radiografía de tórax y una cantidad de 50 cc/día o menos de drenaje seroso y estéril.
Se realizó una fibrobroncoscopia si con la VATS no se alcanzaba un diagnóstico de una lesión pulmonar observada en la TC. En los pacientes con un diagnóstico de cáncer de pulmón se determinó el estadio tras el tratamiento del empiema.
En algunos pacientes seleccionados se realizó una resección pulmonar y una disección ganglionar mediastínica mediante toracotomía. Si la intervención quirúrgica no estaba indicada, se derivaba al paciente al departamento de oncología médica.
ResultadosLos 11 pacientes de este estudio eran 10 varones y una mujer; en todos ellos se diagnosticó un cáncer de pulmón primario con empiema. El rango de edades fue de 46-76 años (media: 57,9 años). Las manifestaciones más frecuentes fueron fiebre, disnea y dolor torácico. La disminución del murmullo vesicular en el hemitórax afectado fue una observación destacada a la exploración física. No se detectó la presencia de Mycobacterium tuberculosis en el esputo ni en el líquido pleural de ninguno de los pacientes.
Se colocó un tubo de toracostomía como primera intervención en 8 pacientes con fiebre alta, disnea y leucocitosis. En 4 de ellos se utilizó una VATS debido a un drenaje insuficiente. Con objeto de reducir el tiempo, la VATS fue el abordaje quirúrgico inicial en 3 pacientes clínicamente estables en los que se observó una loculación en la TC y la ecografía. El periodo medio de drenaje fue de 7,6 días (rango: 3-14).
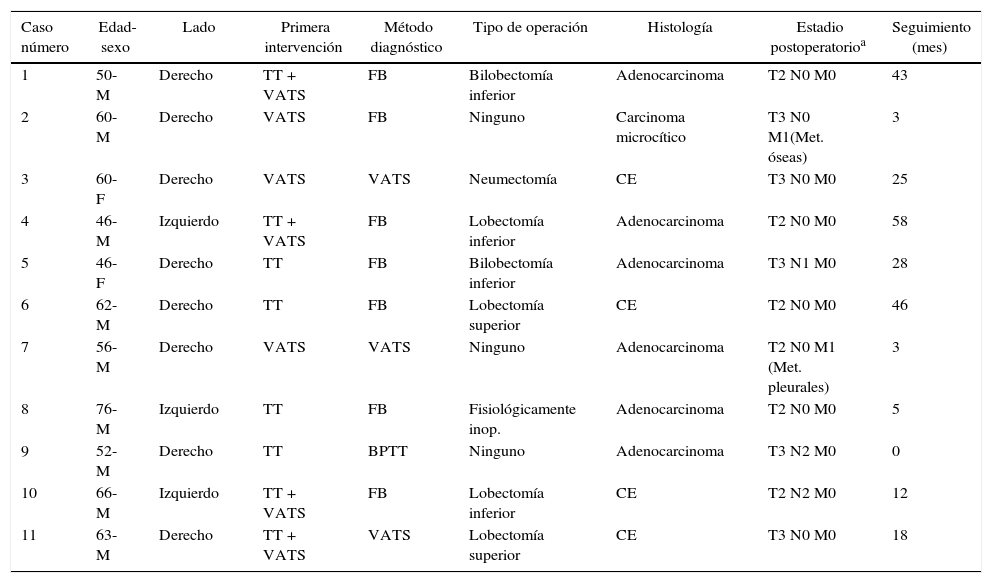
La exploración diagnóstica para el cáncer de pulmón primario consistió en una fibrobroncoscopia en 7 pacientes, una biopsia por aspiración con aguja fina transtorácica en uno y la VATS en 3. Los resultados histopatológicos fueron de carcinoma microcítico en un paciente, adenocarcinoma en 6 y carcinoma espinocelular en 4 casos. En la tabla 1 se muestran las características demográficas y clínicas de los pacientes. El examen citológico no reveló la presencia de células malignas en los pacientes a los que se practicó una toracostomía.
Características demográficas y clínicas de los pacientes
| Caso número | Edad-sexo | Lado | Primera intervención | Método diagnóstico | Tipo de operación | Histología | Estadio postoperatorioa | Seguimiento (mes) |
|---|---|---|---|---|---|---|---|---|
| 1 | 50-M | Derecho | TT + VATS | FB | Bilobectomía inferior | Adenocarcinoma | T2 N0 M0 | 43 |
| 2 | 60-M | Derecho | VATS | FB | Ninguno | Carcinoma microcítico | T3 N0 M1(Met. óseas) | 3 |
| 3 | 60-F | Derecho | VATS | VATS | Neumectomía | CE | T3 N0 M0 | 25 |
| 4 | 46-M | Izquierdo | TT + VATS | FB | Lobectomía inferior | Adenocarcinoma | T2 N0 M0 | 58 |
| 5 | 46-F | Derecho | TT | FB | Bilobectomía inferior | Adenocarcinoma | T3 N1 M0 | 28 |
| 6 | 62-M | Derecho | TT | FB | Lobectomía superior | CE | T2 N0 M0 | 46 |
| 7 | 56-M | Derecho | VATS | VATS | Ninguno | Adenocarcinoma | T2 N0 M1 (Met. pleurales) | 3 |
| 8 | 76-M | Izquierdo | TT | FB | Fisiológicamente inop. | Adenocarcinoma | T2 N0 M0 | 5 |
| 9 | 52-M | Derecho | TT | BPTT | Ninguno | Adenocarcinoma | T3 N2 M0 | 0 |
| 10 | 66-M | Izquierdo | TT + VATS | FB | Lobectomía inferior | CE | T2 N2 M0 | 12 |
| 11 | 63-M | Derecho | TT + VATS | VATS | Lobectomía superior | CE | T3 N0 M0 | 18 |
BPTT: biopsia por punción transtorácica; CE: carcinoma espinocelular; F: mujeres; FB: fibrobroncoscopia; inop.: inoperable; M: varones; Met.: metástasis; TT: tubo de toracostomía; VATS: cirugía toracoscópica videoasistida.
Se realizó una tomografía de emisión de positrones (PET) tan solo en 3 pacientes, puesto que en los demás no se tuvo acceso a esta técnica. Esta exploración resultó útil para la detección de metástasis a distancia en la fase infecciosa, pero no para la evaluación local, debido a la alta tasa de resultados falsos positivos.
Se realizó una mediastinoscopia en 6 pacientes que presentaban tumores resecables quirúrgicamente. Los tipos de resección fueron una neumectomía en un paciente, una lobectomía inferior en 2, una bilobectomía inferior en otros 2 y una lobectomía superior en 2 pacientes. Se observaron adherencias inflamatorias importantes en los pacientes a los que se practicó una neumectomía derecha. El muñón bronquial se reforzó con un colgajo de músculo intercostal, tejido adiposo mediastínico o vena ácigos en todos los pacientes. Entre las complicaciones postoperatorias se observó una fístula broncopleural y empiema en un paciente al que se practicó una neumectomía en el día 23 del postoperatorio, y una taquicardia supraventricular en un paciente al que se practicó una bilobectomía inferior. Realizamos un drenaje abierto con el empleo de un colgajo de Eloesser en el paciente con la fístula broncopleural.
En 4 pacientes no pudo realizarse un tratamiento quirúrgico debido a la presencia de metástasis (óseas, pleurales) y a la inoperabilidad por motivos fisiológicos. El tiempo transcurrido entre la hospitalización y el diagnóstico de cáncer de pulmón fue de entre 13 y 24 días.
No esperamos para realizar la toracotomía en los pacientes con tumores resecables después de tratar el empiema; la resección pulmonar se llevó a cabo como una intervención de seguimiento para la erradicación inmediata de la infección. El tiempo de seguimiento de nuestros pacientes fue de entre uno y 58 meses. El tiempo de supervivencia fue de 12-58 meses (media: 32,8 meses) en el grupo quirúrgico y de entre 3 y 5 meses en el grupo no quirúrgico (tabla 1).
DiscusiónEl empiema pleural es un problema grave que afecta a todos los grupos de edad; sin embargo, en la actualidad no hay un enfoque estándar para el tratamiento de esta enfermedad. La etiología del empiema incluye los derrames paraneumónicos, las intervenciones quirúrgicas, el traumatismo torácico, la perforación del esófago, la infección subdiafragmática y las enfermedades malignas.
Los síntomas de un paciente con empiema pueden consistir en fiebre, taquipnea y una necesidad creciente de oxígeno. Las técnicas de imagen son de gran importancia para el diagnóstico y el tratamiento del empiema pleural. La TC de tórax con contraste intravenoso puede usarse para diferenciar los procesos parenquimatosos de los pleurales, identificando el engrosamiento pleural y las loculaciones y masas. La PET-TC es un instrumento eficiente para el examen de todo el organismo, pero la infección pulmonar puede causar resultados falsos positivos en los pacientes con cáncer de pulmón3. Nosotros observamos la presencia de metástasis óseas en un paciente mediante PET-TC.
Existen múltiples enfoques posibles para tratar los derrames paraneumónicos, desde los antibióticos hasta la intervención quirúrgica radical. Los métodos para drenar un derrame paraneumónico incluyen la toracocentesis, la colocación tan solo de un tubo de toracostomía, el tubo de toracostomía junto con un desbridamiento químico/enzimático, y el desbridamiento mediante VATS.
En la actualidad, la VATS mínimamente invasiva es el patrón de referencia para el tratamiento operatorio de la enfermedad fibrinopurulenta del espacio pleural4–6. Nosotros recomendamos el desbridamiento mediante VATS para evitar el engrosamiento pleural. La VATS es útil para determinar la presencia de un cáncer de pulmón (3 pacientes en este estudio) o la implantación pleural de una enfermedad maligna (un paciente en este estudio) y para evaluar la invasión mediastínica del tumor. La VATS se puede realizar con facilidad utilizando un acceso de puerto único7.
Después de observar una masa/nódulo en el pulmón, puede hacerse una verificación histopatológica mediante fibrobroncoscopia. Nosotros observamos una lesión endobronquial en 7 pacientes en este estudio. La biopsia por punción transtorácica se utilizó para evaluar la enfermedad maligna en un paciente. La estadificación del cáncer de pulmón se realizó en nuestro estudio mediante TC, PET-TC y mediastinoscopia. El intervalo de tiempo transcurrido entre la primera evaluación y la determinación del estadio fue de 7-23 días en el programa de detección sistemática del cáncer de pulmón de España8. En nuestro estudio, este periodo fue de 13-24 días.
El posible mecanismo de la infección pleural en los pacientes con un cáncer de pulmón y empiema concomitantes puede consistir en: 1) una infección del espacio pleural como resultado de toracocentesis repetidas en pacientes con pleuritis (yatrogénico); 2) la aparición de una fístula broncopleural debido a la rotura de un carcinoma cavitario (como parte de la progresión natural de la enfermedad maligna); 3) la obstrucción del bronquio por una masa que da lugar a una neumonía y atelectasias (debido a la localización del cáncer) y 4) el empiema puede producirse por necrosis tumoral después de la quimioterapia. En este estudio, el empiema se produjo de forma secundaria a atelectasias en el primero, segundo y sexto casos; una fístula broncopleural en el quinto caso y por una causa yatrogénica en el tercero y cuarto casos. No pudimos determinar la causa en los demás casos. Algunos autores han indicado que el empiema puede producirse después de una biopsia de pulmón transbronquial1. También se ha indicado que la inmunosupresión es una causa de infección pleural2.
Cuando el estado general del paciente mejoró, se llevó a cabo la cirugía electiva; la resección quirúrgica durante una infección torácica grave comporta un riesgo demasiado elevado de complicaciones.
En una revisión de la literatura determinamos que 25 pacientes con presencia concomitante de cáncer de pulmón y empiema han sido tratados con una resección pulmonar1,2,9–12. La colocación de un tubo de toracostomía fue el método utilizado con mayor frecuencia para el tratamiento del empiema. Subotic et al. describieron el tratamiento del empiema en 4 pacientes antes de la neumectomía9. Estos autores diagnosticaron peroperatoriamente el empiema en uno de los casos, y mencionaron que no pudo descartarse el tratamiento quirúrgico a causa de la infección pleural en los pacientes con carcinoma bronquial. Quince pacientes fueron tratados simultáneamente del empiema y el cáncer de pulmón en el estudio de Riquet; en dicho estudio, se aplicó un tratamiento fibrinolítico para tratar la infección del espacio pleural. Siete de los pacientes fueron tratados farmacológicamente y en 9 se practicaron intervenciones quirúrgicas, como una neumectomía (8 casos) o una lobectomía (un caso)2.
En un estudio de Japón, los autores examinaron y comentaron 7 casos de presencia concomitante de empiema y cáncer de pulmón en pacientes a los que se practicó una resección pulmonar. El tiempo transcurrido entre el drenaje y la intervención quirúrgica osciló entre 0 y 39 días en los casos descritos1. En nuestro estudio, el periodo medio de tiempo fue de 7 días (rango: 9-18 días).
Nosotros sugerimos que la neumectomía debe evitarse debido al riesgo de fístula broncopleural. Si la neumectomía es necesaria, el muñón bronquial puede reforzarse con tejido adiposo mediastínico, epiplón, vena ácigos, músculo intercostal u otros músculos.
En conclusión, la presencia concomitante de un empiema y un cáncer de pulmón resecable es una situación difícil de tratar. Los tumores de pulmón primarios pueden no ser detectados durante el tratamiento de una infección pleural, ya que el empiema y el cáncer de pulmón se observan juntos de manera muy poco frecuente. El tratamiento del empiema debe realizarse lo antes posible, y debe identificarse la causa subyacente de la inflamación. Hay que tener presente la posibilidad de una enfermedad maligna como posible factor etiológico en los casos de empiema. Debe determinarse el estadio del cáncer de pulmón y debe practicarse una resección en pacientes seleccionados, después del tratamiento del empiema. El drenaje del espacio pleural y su esterilización deben realizarse de manera completa con objeto de reducir las complicaciones postoperatorias después de la resección pulmonar.
Conflictos de interesesNinguno