Introducción
La resección de la vena cava inferior (RVCI) es un procedimiento quirúrgico poco frecuente cuya indicación principal es la afección de la vena por un tumor urológico, un sarcoma retroperitoneal o un tumor hepático maligno. Aunque en estos casos se considera que la enfermedad está avanzada, la resección tumoral en bloque puede mejorar la calidad de vida y alargar la supervivencia de algunos pacientes1 .
La mayoría de los publicados suele tratarse de casos aislados o series cortas dispersos en numerosos centros hospitalarios, y en la actualidad se desconoce cuál es la mejor pauta de sustitución protésica de vena cava inferior.
Presentamos un caso de RVCI infrarrenal intervenido en nuestro hospital en el que empleamos una prótesis de politetrafluoroetileno (PTFE) no anillada asociada a anticoagulación sistémica.
Caso clínico
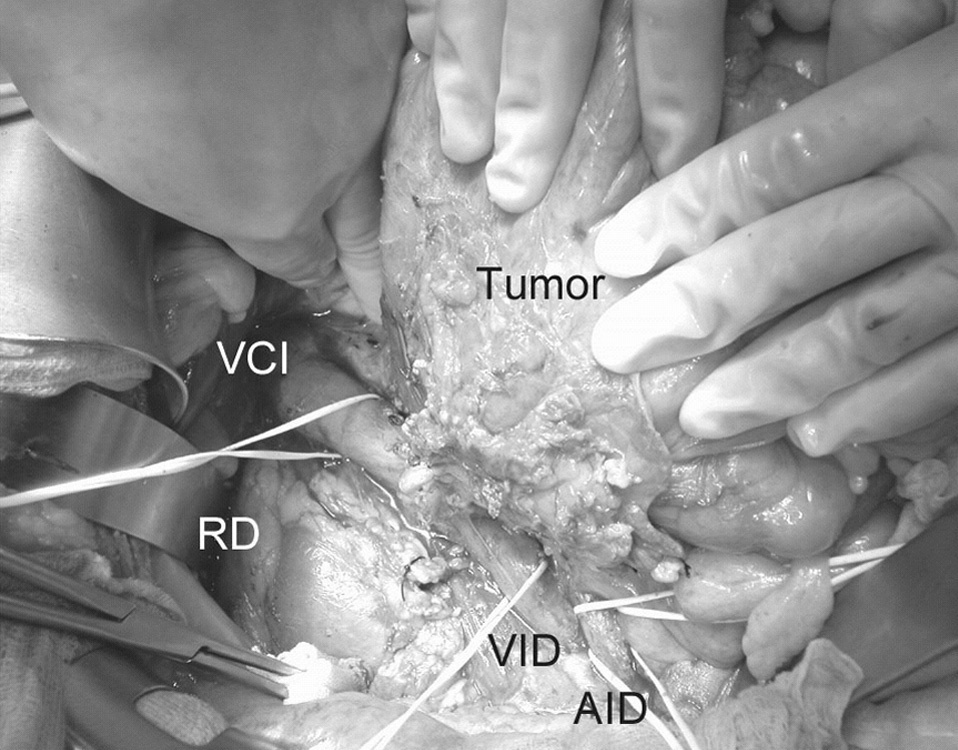
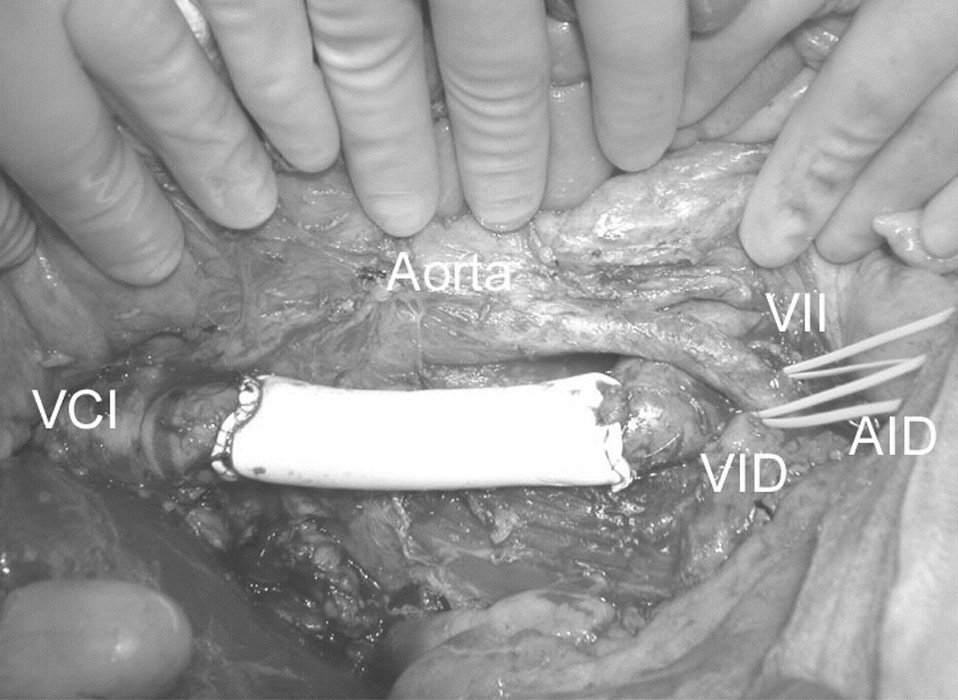
Un varón de 38 años, sin antecedentes de interés, presentaba dolor continuo en hemiabdomen inferior de varias semanas de evolución sin otra sintomatología acompañante. En la exploración clínica se palpaba una masa dolorosa, móvil, de unos 20 cm, que ocupaba todo el hemiabdomen inferior. La radiografía simple de abdomen mostró signos de compresión extrínseca del colon por una masa centroabdominal. La tomografía computarizada (TC) objetivó una tumoración sólida centro-abdominal, intraperitoneal de 20 cm de diámetro y otra tumoración retroperitoneal de 6 cm que incluía vena cava inferior (VCI) infrarrenal, uréter derecho y ciego, compatible con sarcoma o linfoma. El eje mesentérico era permeable y no presentaba signos de infiltración tumoral. El estudio analítico objetivó una anemia normocroma normocítica. La biopsia percutánea de la tumoración fue sugestiva de proliferación sarcomatosa. Con la sospecha diagnóstica de sarcoma retroperitoneal con metástasis intraabdominal única, se realizó intervención quirúrgica programada. En la laparotomía se encontraron 2 metástasis en el epiplón mayor de 20 y de 3 cm, que fueron resecadas en bloque con el epiplón mayor. Se objetivó un tumor retroperitoneal de 10 cm que englobaba ciego, colon derecho, 10 cm de uréter derecho y VCI infrarrenal (fig. 1). Se practicó una resección tumoral en bloque que incluía el colon derecho, VCI infrarrenal hasta la bifurcación de las ilíacas comunes y el uréter derecho, junto con nefrectomía derecha. Se realizó un pinza-miento transversal de la VCI por debajo de las venas renales y en la bifurcación de las ilíacas, sin que se produjera ninguna alteración hemodinámica. La VCI fue reemplazada por una prótesis vascular no anillada de PTFE (22 mm de diámetro y 10 cm de longitud), suturada con 2 continuas de polipropileno 3/0 (fig. 2). Antes de anudar la sutura distal se retiró la pinza distal manteniendo clampado el proximal para rellenar la prótesis de sangre y purgar el aire contenido en su interior. La continuidad intestinal se restableció con una anastomosis ileocólica laterolateral mecánica. Se instauró anticoagulación sistémica con nadroparina cálcica 24 h después de la intervención. El postoperatorio transcurrió con normalidad, y el paciente fue dado de alta al décimo día de la intervención manteniendo el tratamiento anticoagulante con dicumarínicos. El informe anatomopatológico de la pieza de resección informó de fibrohistiocitoma inflamatorio. El paciente recibió 6 ciclos de quimioterapia adyuvante con epirrubicina. La TC y la eco Doppler de control a los 9 meses de la intervención demostró la permeabilidad de la prótesis y la ausencia de recidiva tumoral.
Fig. 1. Sarcoma retroperitoneal que infiltra el colon derecho, el uréter y la VCI. VCI: vena cava inferior; VID: vena ilíaca derecha; AID: arteria ilíaca derecha; RD: riñón derecho.
Discusión
Desde un punto práctico, hay 2 niveles de complejidad técnica según sea el segmento de VCI que se vaya a resecar. La RVCI infrarrenal es más sencilla de realizar por no tener abocamiento de venas viscerales y ser bien tolerado el clampaje de la VCI infrarrenal, y puede ser asumida en cualquier servicio de cirugía general. La RVCI renal y/o retrohepática es técnicamente más compleja y
Fig. 2. Reconstrucción de la VCI infrarrenal con una prótesis de Gore-Tex®no anillada. VCI: vena cava inferior; VID: vena ilíaca derecha; AID: arteria ilíaca derecha; VII: vena ilíaca izquierda.
requiere un equipo quirúrgico más especializado. En el caso de RVCI renal, debe de reimplantarse 1 de las 2 venas renales sobre la prótesis y, en ocasiones, requiere circulación extracorpórea para extraer un trombo tumoral que alcanza la aurícula derecha. La RVCI retrohepática requiere practicar simultáneamente una hepatectomía mayor con exclusión vascular hepática, in vivo o ex vivo, con o sin bypass venovenoso, y puede requerir la reimplantación de alguna vena suprahepática1-11 .
Hasta hace unos años, la mayoría de las publicaciones de RVCI eran de vena cava infrarrenal o renal. Sin embargo, debido a la experiencia adquirida por los grupos de trasplante hepático, está aumentando el número de publicaciones de hepatectomías mayores asociadas a RVCI retrohepática. El desarrollo de estas técnicas permite resecar tumores hepáticos anteriormente considerados irresecables y conlleva una mayor utilización de prótesis de vena cava inferior en centros especializados. Por ello, las recomendaciones actuales de sustitución protésica de la VCI proceden de series algo más amplias y están asociadas a hepatectomías.
A pesar de que la prótesis anillada de PTFE es el sustitutivo de VCI más empleado en la actualidad, no hay estudios clínicos comparativos con otras prótesis y su gran difusión se basa en conceptos teóricos y en estudios experimentales1,5 . Teóricamente, el reforza-miento con anillos resiste mejor la compresión intraabdominal y previene cambios hemodinámicos asociados a la deformación o al colapso de la prótesis, disminuyendo el riesgo de trombosis. La regeneración hepática también podría ser un factor compresivo en los casos de prótesis asociada a hepatectomía. Aunque se han realizado sustituciones protésicas con dacron3,7,9,11 , Madariaga et al7 no la aconsejan por presentar un 50% de trombosis. Algunos autores han resuelto casos de compresión protésica colocando un stent endovascular por vía percutánea que permite restablecer la permeabilidad de la prótesis9 . La tasa de infección protésica varía del 0 al 28% y parece razonable recomendar el recubrimiento de la prótesis con epiplón mayor2 .En nuestro paciente no pudimos recubrir la prótesis con epiplón por haberlo resecado completamente. Las prótesis más empleadas son las de 20 mm, por tener un calibre similar al de la VCI1,6,8,9 , aunque algunos autores recomiendan que la prótesis tenga un diámetro algo inferior para aumentar la velocidad de la sangre y, teóricamente, disminuir el riesgo de formación de trombo5 . Sin embargo, las anastomosis venosas del trasplante hepático se rigen por un principio opuesto que recomienda dejar un “factor de crecimiento” que no reduzca el calibre de la vena para no disminuir el flujo y evitar la formación de trombos. En nuestro caso, escogimos una prótesis de calibre similar al de la VCI y efectuamos una anastomosis no estenosante.
No hay un criterio uniforme respecto a la necesidad de asociar anticoagulación. Algunos autores realizan una profilaxis tromboembólica peroperatoria seguida de administración indefinida de antiagregantes plaquetarios y no anticoagulan a los pacientes3,5,8,10 . Con ello consiguen permeabilidades de 88-100% con prótesis anillada de PTFE5,8 . Sarkar et al5 recomiendan anticoagular únicamente si el paciente tiene un conocido riesgo de trombosis (inmovilización, deshidratación o necesidad de cirugía mayor). Arii et al4 anticoagulan a los pacientes con heparina intravenosa durante la primera semana de postoperatorio y posteriormente suspenden la anticoagulación. Otros autores1,2,9 consideran necesario el mantener una anticoagulación sistémica de por vida, con una tasa de trombosis de 25% con PTFE anillado1 . En nuestro caso preferimos mantener la anticoagulación a largo plazo por no haber ninguna patología que lo contraindicara.
Con la finalidad de aumentar el flujo caval, algunos autores recomiendan realizar una fístula arteriovenosa temporal entre la arteria y la vena femoral, interponiendo la vena safena interna o una prótesis de PTFE9,11 , o definitiva entre una arteria y una vena remanente del campo quirúrgico, por ejemplo, interponiendo la vena gonadal entre la arteria y la vena renal posnefrectomía1 , pero hay pocos casos publicados. En nuestro caso no asociamos una fístula por considerar que el flujo venoso obtenido después de la reconstrucción era bueno.
Aunque es factible la ligadura sin reconstrucción de la VCI infrarrenal3,12,13 , al igual que la mayoría de autores, preferimos realizar la reconstrucción venosa para minimizar los efectos adversos del edema de miembros inferiores. La trombosis venosa previa a la cirugía favorece la aparición de circulación venosa colateral que minimiza el edema de miembros inferiores, pero una disección quirúrgica retroperitoneal extensa puede anular este retorno colateral preexistente y aparecer edema si se liga la VCI1,5 .
Comentarios
La prótesis anillada de PTFE es el sustitutivo de VCI más empleado en la actualidad, aunque carecemos de estudios clínicos que la comparen con prótesis no anilla-das. Del mismo modo, no hay consenso respecto a la necesidad de anticoagular o de asociar una fístula arteriovenosa que aumente el flujo venoso. Por el momento no podemos determinar cuál es la mejor estrategia terapéutica.
Correspondencia: Dr. G. Manzanet. Plaza San Pascual, 15. 12540 Vila-Real. Castellón. España. Correo electrónico: manzanet_ger@gva.es
Manuscrito recibido el 10-5-2004 y aceptado el 5-7-2004.