Los tumores fibrosos hepáticos solitarios (TFHS) son unas lesiones neoplásicas infrecuentes, de características histológicas benignas, desarrollados en el tejido mesenquimal1,2. Este tipo de tumores se desarrollan más frecuentemente en localizaciones como pleura, peritoneo, timo o meninges1, siendo extremadamente raro su crecimiento intrahepático, con unas decenas de casos publicados en la literatura1,2.
Este tipo de tumores presenta unas tasas de supervivencia en torno al 85% a los 5 años, con un riesgo de aparición de metástasis a 5 y 10 años del 26% y del 46% respectivamente3. Los principales factores de riesgo de mal pronóstico son el tamaño tumoral y elevados índices mitóticos.
Estos tumores pueden presentarse asociados a un síndrome paraneoplásico en el 5% de los casos3 que cursa con hipoglucemias severas denominado síndrome de Doege-Potter, descrito en 19304. Este síndrome es más frecuente en pacientes entre 60 y 80 años4 y está asociado a peor pronóstico, más aún si la localización del tumor es extrapleural3,4.
Este síndrome paraneoplásico se presenta con hipoglucemias severas con niveles de péptido C, insulina e IGF-I disminuidos en sangre, ya que se debe a la secreción de IGF-II por parte del tumor, que se une a los receptores de IGF-I4. Dicha unión no solo provoca hipoglucemia, sino que está asociada a un aumento del número de mitosis en el tumor y la transformación maligna del mismo.
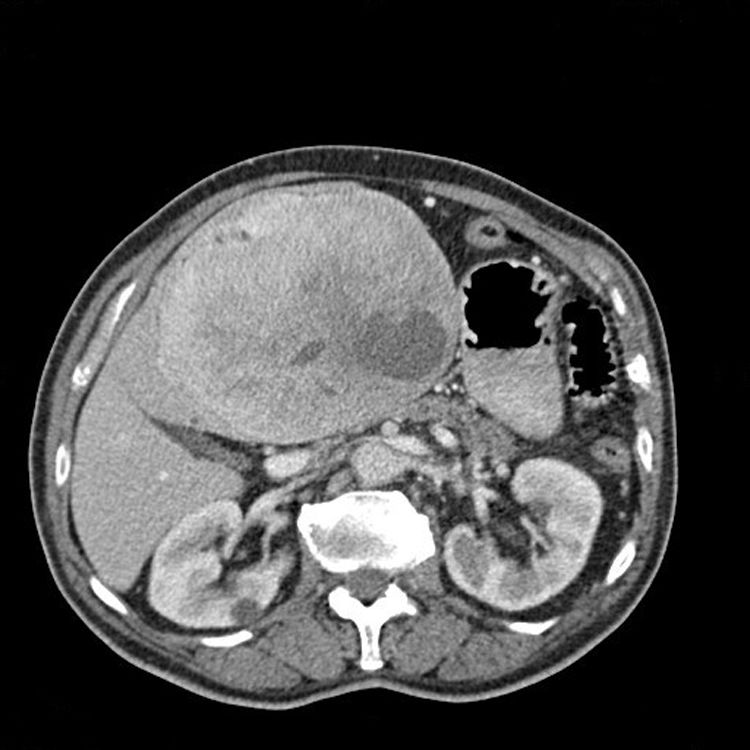
Presentamos el caso de un paciente de 83 años con antecedentes de dislipidemia y glucemia basal alterada en ayunas que acude a urgencias tras hallazgo en analítica de rutina de 33mg/dL de glucemia y tumoración epigástrica indurada de gran tamaño. Se realiza TC toracoabdominal, en la que se observa una masa sugestiva de GIST gástrico en ligamento gastrohepático de 16×12×14cm hipervascular con zonas necróticas en su interior, que ejerce efecto masa sobre los órganos vecinos y provoca colapso del eje portoesplénico con signos de hipertensión portal (fig. 1). Se realiza gastroscopia en la que se observa compresión extrínseca a nivel de la curvatura menor gástrica, realizándose biopsias que no resultan significativas. Se lleva a cabo un estudio analítico para valorar la hipoglucemia, objetivando unas cifras de insulina de 0,2U/ml; 0,11ng/dl de péptido C basal y 46,7ng/ml de IGF-1.
Con la sospecha de GIST gástrico no diseminado se realiza intervención quirúrgica programada, en la que se observa una tumoración de 15×15cm dependiente de los segmentos 2 y 3 hepáticos, sin infiltración de estructuras vecinas, por lo que se realiza bisegmentectomía hepática izquierda sin incidencias. Durante el postoperatorio inmediato el paciente presenta buena evolución, con corrección de los episodios de hipoglucemia e incluso con cierta tendencia a la hiperglucemia. Se realizó una analítica postoperatoria a los 7 días de la intervención en la que los valores de péptido C e IGF-1 se habían normalizado (1,7ng/ml y 103,1ng/ml respectivamente). Fue dado de alta a los 10 días de la intervención sin incidencias.
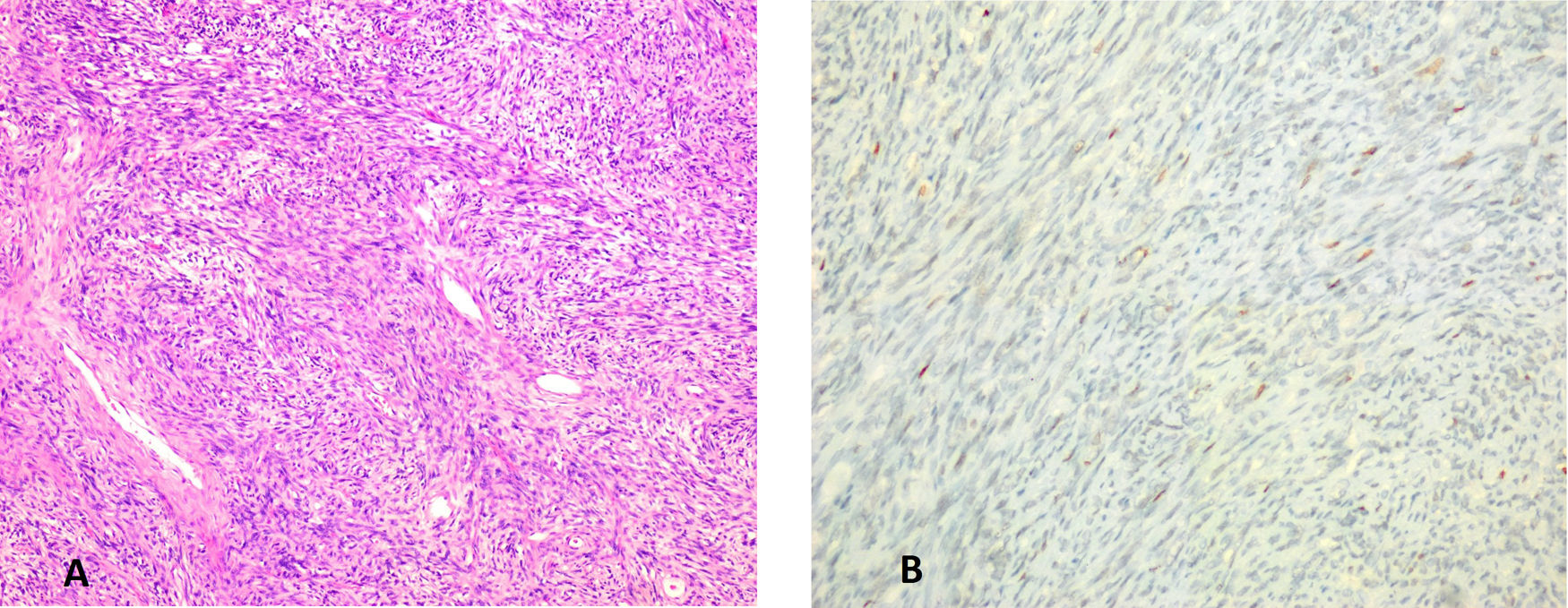
Tras el análisis de la pieza quirúrgica se llega al diagnóstico de TFHS ya que los cortes histológicos muestran una neoformación mesenquimal que se dispone en haces y fascículos en la que se alternan zonas hipercelulares e hipocelulares, con presencia de bandas de colágeno hialinizado, así como con estructuras vasculares, algunas de ellas ramificadas. El número de figuras de mitosis es variable (1-3 mitosis/10cga). Los citoplasmas muestran bordes mal definidos (fig. 2A). En la parte central de la lesión se identifican áreas de necrosis de tipo isquémico y pequeñas calcificaciones.
La neoformación muestra positividad con CD34 (fig. 2B) y Caldesmon y focal con STAT 6 y negatividad con CD117, DOG 1, CK AE1-AE3, S-100, EMA, actina y desmina. El índice de proliferación celular medido con Ki67 es del 5-10%.
Los tumores fibrosos solitarios son neoplasias benignas con potencial de transformación maligna2. Hasta la fecha han sido publicados 89 casos, incluyendo el nuestro, de TFHS5. Suelen ser asintomáticos, pudiendo presentarse asociado a un síndrome paraneoplásico que cursa con hipoglucemias (síndrome de Doege-Potter), por lo que su crecimiento es progresivo y lento, siendo diagnosticados de forma incidental2.
Las características radiológicas en TC y RMN son similares al hepatocarcinoma2, aunque en nuestro caso, dada la proximidad al estómago, la tumoración fue diagnosticada de GIST gástrico.
No es necesaria la realización de biopsia por el riesgo de rotura y siembra tumoral, con el diagnóstico diferencial de hepatocarcinoma2. En nuestro caso, ya que el diagnóstico de sospecha era un GIST gástrico, se decidió realizar biopsias endoscópicas que resultaron no concluyentes. Dado que el tratamiento de elección tanto en el caso del GIST gástrico como en el del TFHS es la cirugía y el paciente se encontraba sintomático por los episodios de hipoglucemia mal controlados se decidió no realizar más estudios preoperatorios para confirmar el diagnóstico de alta sospecha de GIST.
El diagnóstico definitivo es histopatológico, identificando en la muestra grupos celulares separados por extensas bandas de tejido conectivo y cambios mixoides, con focos de necrosis y elevadas tasas de mitosis (≥4/10). Este tipo de tumores suelen ser CD34+ aunque no es constante y STAT6+, que es un marcador mucho más específico1,2,4.
Conflicto de interesesNinguno.