La implantación de la cirugía de preservación esfinteriana en el cáncer de recto ha hecho incrementar el número de resecciones bajas protegidas con una ileostomía en asa. Esto obliga a un posterior cierre del estoma mediante un acto quirúrgico no desprovisto de morbilidad ni mortalidad. Los objetivos del estudio fueron analizar los resultados clínicos de la cirugía de reconstrucción del tránsito y conocer el intervalo entre ambas cirugías, así como el papel que la quimioterapia determina en el mismo.
Pacientes y métodoSe utilizó retrospectivamente la base de datos prospectiva de los pacientes intervenidos previamente de cáncer de recto a los que se les cerró la ileostomía entre mayo de 2004 y septiembre de 2008. Se recogieron y analizaron los datos relativos a indicación de quimioterapia, intervalo entre cirugías, y complicaciones.
ResultadosSe analizaron 54 pacientes consecutivos con edad media de 66 años. El intervalo medio entre cirugías fue de 178 días siendo significativamente menor en el grupo de pacientes que no recibió quimioterapia (p=0,008). La estancia postoperatoria fue de 6,3 días (DE=4,1). La mortalidad fue del 1,8% por causa respiratoria y la morbilidad fue del 22,2% con un porcentaje de reintervenciones del 7,4%.
ConclusionesLa mortalidad y morbilidad del cierre de las ileostomía, no son despreciables, si bien sus ventajas en la protección del estoma justifican su uso. El intervalo de reconstrucción de la ileostomía, se ve afectado significativamente por la quimioterapia postoperatoria.
The introduction of sphincter preservation surgery in rectal cancer has led to an increase in the number of low resections protected with a loop ileostomy. This requires subsequent closure of the stoma, a surgical procedure which is not devoid of morbidity or mortality. The aims of the study were to analyse the clinical results of the passage reconstruction surgery and to find out the interval between both surgeries, as well as the role chemotherapy plays in this.
Patients and methodThe prospective data of patients previously operated on for rectal cancer were used retrospectively with those whose ileostomy was closed between May 2004 and September 2008. Data associated to chemotherapy indication, interval between surgeries and complications were collected and analysed.
ResultsA total of 54 consecutive patients with a mean age of 66 years were analysed. The mean interval between surgeries was 178 days, being significantly less in the patient group that did not receive chemotherapy (p=0.008). The post-operative stay was 6.3 days (SD=4.1). Mortality due to respiratory failure was 1.8% and the morbidity was 22.2%, with 7.4% requiring further surgery.
ConclusionsThe mortality and morbidity of ileostomy closures are not inconsiderable, although its advantages in the protection of the stoma justify its use. The ileostomy construction interval appears to be significantly affected by post-operative chemotherapy.
La progresiva implantación de la exéresis total del meso-recto como técnica de elección en la cirugía del cáncer de recto, así como el aumento de la preservación esfinteriana, ha hecho incrementar el número de resecciones con anastomosis bajas, ultrabajas y coloanales1. El porcentaje de dehiscencia anastomótica en las resecciones rectales varía mucho según las diferentes series, citándose entre el 3 y el 30%2. Esta es la complicación más grave después de una resección de recto, asociada a una elevada morbilidad y mortalidad y su incidencia aumenta en anastomosis realizadas cerca del margen anal2. Está bien documentado el efecto protector que los estomas derivativos tienen no tanto en la prevención de las dehiscencias como en la disminución de la gravedad de las mismas, evitando reintervenciones y facilitando la viabilidad de las anastomosis rectales protegidas3–6. No es unánime en la bibliografía la preferencia entre una colostomía o una ileostomía lateral, existiendo opiniones diversas a pesar de que un reciente metanálisis parece confirmar un mayor beneficio de la ileostomía7,8.
En el momento de valorar los beneficios de las ostomías de protección, debe tenerse en cuenta que el posterior cierre del estoma añade una morbilidad, y en ocasiones mortalidad, que debería sumarse a la del procedimiento inicial y este hecho ha de ser considerado a fin de conocer el verdadero papel de las ostomías derivativas en este tipo de intervenciones.
Habitualmente en ausencia de complicaciones, se suele proponer el cierre de la ileostomía entre los dos y tres meses después de la cirugía inicial9. Sin embargo, en aquellos pacientes en los que es necesario administrar quimioterapia postoperatoria, suele ser necesario retrasar el cierre de la ostomía hasta después del fin de la misma9. Este intervalo para la reconstrucción es otro punto de discusión y cada vez con mayor frecuencia, aparecen opiniones que abogan por un cierre precoz en el mismo ingreso, lo que en pacientes seleccionados puede ser una opción factible10–12.
El objetivo de este estudio fue analizar los resultados clínicos del cierre de las ileostomías en asa en nuestra Unidad de Cirugía Colorrectal en los últimos cuatro años, así como conocer la repercusión de la quimioterapia en el intervalo entre la construcción y el cierre de la ileostomía.
Pacientes y métodoEstudio retrospectivo realizado sobre la base de datos, mantenida de forma prospectiva, de la Unidad de Coloproctología del Hospital Universitari del Mar. Se analizaron los datos relativos a pacientes intervenidos previamente de cáncer de recto y a los que se les reconstruyó una ileostomía en asa entre mayo de 2004 y septiembre de 2008.
Se definió como cáncer de recto aquellos adenocarcinomas que se encontraban entre cero y trece centímetros del margen anal medidos con rectoscopia rígida.
De acuerdo con el protocolo de tratamiento del cáncer de recto de nuestro hospital, se realiza neoadyuvancia en pacientes con neoplasias de recto en estadios ii–iii según ecografía endorrectal y/o resonancia nuclear magnética. De forma concomitante con el tratamiento radioterápico los pacientes reciben a través de un catéter venoso central 5-fluorouracilo 225mg/m2/d en infusión continua de 24h. Dicho tratamiento se lleva a cabo durante las 5 semanas que dura la radioterapia. Todos los pacientes que realizaron neoadyuvancia, recibieron quimioterapia postoperatoria excepto aquellos con un estadio ii que presentaron un grado de regresión tumoral 3–4 (glándulas tumorales aisladas o ausencia de tumor), en los cuales no se realizó la quimioterapia postoperatoria.
La técnica quirúrgica en la cirugía rectal previa había consistido en la exéresis parcial del meso-recto con un margen distal de cuatro centímetros en las neoplasias del recto superior y una exéresis total del meso-recto en las neoplasias de recto medio e inferior. Se protegieron las anastomosis situadas a menos de seis centímetros del margen anal. Se realizó preparación mecánica de colon en aquellos casos en que se preveía realizar una ileostomía de protección.
Se excluyeron las ileostomías que se pudieran haber construido por otro motivo como dehiscencias, cirugía de urgencias o cualquier otra circunstancia. La reconstrucción de la ileostomía en pacientes que precisaban quimioterapia después de la cirugía del recto, se pospuso a la terminación de la misma con el fin de no retrasar dicho tratamiento adyuvante. A aquellos pacientes que no precisaron quimioterapia postoperatoria se les propuso el cierre de la ileostomía a partir de las 12 semanas. En todos los casos se practicó un enema con gastrografín a través de la ileostomía previo a la reconstrucción para comprobar la ausencia de complicaciones en la anastomosis.
Técnica quirúrgicaEl cierre de la ileostomía se realizó en todos los casos a través de una incisión peri-ileostomía. La anastomosis fue mediante una resección del estoma con una anastomosis termino-terminal manual o mediante anastomosis termino-terminal funcional mecánica con GIA 75 y TA 90 a criterio del cirujano. No se dejó drenaje intra-abdominal en ningún caso. Todas las incisiones se cerraron primariamente previo lavado del tejido celular subcutáneo con 500ml de suero fisiológico. Todos los pacientes recibieron profilaxis antibiótica endovenosa con gentamicina 240mg y metronidazol 1g.
ComplicacionesLos pacientes siguieron el programa de rehabilitación multimodal en funcionamiento en nuestra unidad13, con inicio de la ingesta hídrica entre las seis y ocho horas de la intervención y progresión según tolerancia.
Se consideró que existía un íleo postoperatorio cuando la intolerancia a la dieta motivó un retraso en el alta hospitalaria más allá del séptimo día, cuando obligó a retrasar o interrumpir la dieta más de 48h o cuando fue necesaria la colocación de una sonda naso-gástrica.
La infección del sitio quirúrgico fue definida de acuerdo con los criterios aceptados por el NNIS (National Nosocomial Infections Surveillance System)14 y las complicaciones se han referido según la clasificación de Clavien1.
Análisis estadísticoLos resultados se presentan con la media (desviación estándar) y porcentajes. Para la comparación de medias de variables cuantitativas normales se aplicó el test de la t de Student. En aquella variable que no seguía una distribución normal, se utilizó el test de la U de Mann-Whitney. Para comparar variables cualitativas se utilizó la prueba de Chi cuadrado. Se consideró como significación estadística una p inferior a 0,05.
ResultadosSe analizaron los resultados obtenidos de los 54 pacientes consecutivos incluidos en el estudio, cuyas características demográficas y clínicas se detallan en la tabla 1.
Características demográficas y clínicas de los pacientes
| Pacientes | N.° 54 |
| Hombres | 43 |
| Mujeres | 11 |
| Edad (años) | 66 (39–81) |
| Neoadyuvancia | 39 |
| Pre y poscirugía | 33 |
| Solo pre cirugía | 6 |
| Sin neoadyuvancia | 15 |
| Tiempo medio transcurrido entre la cirugía inicial y el cierre de la ileostomía (días)* | 178 (DE=95) |
| Grupo de pacientes que no recibieron quimioterapia después de la cirugía inicial (días) | 145 (DE=99) |
| Grupo de pacientes que si recibieron quimioterapia después de la cirugía inicial (días) | 198 (DE=84) |
| p=0,008** |
En 39 casos la ileostomía protegió una anastomosis directa y en 15 casos lo hizo con un reservorio colónico en «J».
Se indicó neoadyuvancia en 39 pacientes. De ellos a 33 se les administró la pauta de neoadyuvancia completa, mientras que en seis casos el grado de regresión tumoral permitió obviar los ciclos postoperatorios. En 15 pacientes, no se indicó la neoadyuvancia. En total 21 casos no recibieron quimioterapia postoperatoria (tabla 1).
El enema con gastrografín realizado antes del cierre de la ileostomía, no detectó problema alguno que obligara a suspender la intervención.
El tiempo medio transcurrido entre la cirugía inicial y el cierre de la ileostomía fue de 178 días (DE=95). Sin embargo, este periodo de tiempo fue significativamente menor en aquellos enfermos que no recibieron tratamiento quimioterápico después de la cirugía inicial, en los cuales la media fue de 145 días (DE=99), en comparación con el grupo de pacientes que sí recibieron quimioterapia postoperatoria, que presentaron un tiempo medio de 198 días (DE=84), con una p=0,008 (tabla 1).
En cuatro casos se asociaron otras intervenciones. En dos casos se realizó una cirugía de las metástasis hepáticas y en dos casos más se realizó una eventroplastia con malla.
El tipo de anestesia utilizado fue siempre una anestesia general. En ningún caso hubo que modificar la incisión periileostomía prevista. En los casos de cirugía hepática se asoció a una incisión subcostal. En el caso de las eventraciones se asoció la técnica habitual a la colocación de una malla de polipropileno de refuerzo. En un caso existía una hernia paraestomal clínicamente evidente colocándose una malla de refuerzo sobre el cierre de la pared de la ileostomía. No se realizó ninguna laparotomía media.
Las anastomosis fueron termino-terminales manuales con puntos sueltos extramucosos de seda 3/0 en 27 casos, y en los restantes 27 casos se practicó una anastomosis termino-terminal funcional mecánica. El cierre cutáneo de la incisión fue siempre primario y solo en dos casos se colocaron dos drenajes aspirativos subcutáneos. La estancia postoperatoria media fue de 6,3 días (DE=4,1).
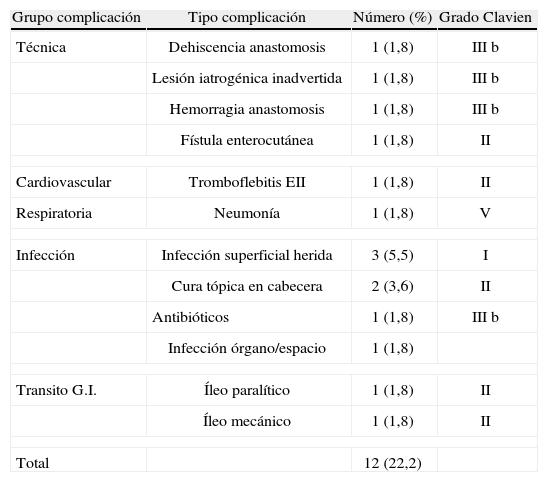
ComplicacionesLas complicaciones se muestran en la tabla 2 representando una morbilidad del 22,2%. De las 12 complicaciones que se presentaron, cuatro de ellas (7,4%) precisaron reintervención (Grado IIIb de Clavien), siendo estas una dehiscencia anastomótica, una lesión intestinal inadvertida, una hemorragia de una sutura lineal de una anastomosis mecánica, y el drenaje de una colección abdominal no abordable percutáneamente. En otro caso, se presentó una sospecha clínica de fístula cutánea intestinal, que precisó reingreso al décimo día de la cirugía por manchado del apósito. No hubo débito cuantificable y el paciente fue dado de alta en siete días.
Complicaciones presentadas. Clasificación según grado de Clavien15
| Grupo complicación | Tipo complicación | Número (%) | Grado Clavien |
| Técnica | Dehiscencia anastomosis | 1 (1,8) | III b |
| Lesión iatrogénica inadvertida | 1 (1,8) | III b | |
| Hemorragia anastomosis | 1 (1,8) | III b | |
| Fístula enterocutánea | 1 (1,8) | II | |
| Cardiovascular | Tromboflebitis EII | 1 (1,8) | II |
| Respiratoria | Neumonía | 1 (1,8) | V |
| Infección | Infección superficial herida | 3 (5,5) | I |
| Cura tópica en cabecera | 2 (3,6) | II | |
| Antibióticos | 1 (1,8) | III b | |
| Infección órgano/espacio | 1 (1,8) | ||
| Transito G.I. | Íleo paralítico | 1 (1,8) | II |
| Íleo mecánico | 1 (1,8) | II | |
| Total | 12 (22,2) | ||
No se encontró asociación entre la edad y las complicaciones así como tampoco se encontraron diferencias significativas según el tipo de anastomosis practicada ya fuera manual o mecánica. Tampoco se encontraron diferencias significativas en las complicaciones, entre los pacientes que habían recibido quimioterapia respecto de los que no la recibieron (tabla 1).
Hubo un único fallecimiento (1,8%) a consecuencia de una sepsis de origen respiratorio, secundario a una neumonía, que motivó el reingreso a los cinco días de su alta hospitalaria tras el cierre de la ileostomía. El paciente falleció a las 24h de su reingreso.
DiscusiónA pesar de la disminución de la morbilidad y mortalidad que la cirugía del recto presenta desde la progresiva implantación de las unidades de cirugía colorrectal16, las complicaciones siguen siendo muy graves y entre ellas la dehiscencia de la anastomosis es la que conlleva un mayor índice de mortalidad asociada. Entre las medidas preventivas adoptadas, solo la realización de ostomías de protección ha demostrado tener efectividad, llegando a proponerse que la ausencia de una ileostomía derivativa es un factor de riesgo para la aparición de una dehiscencia sintomática después de la práctica de una exéresis total del meso-recto en pacientes con cáncer rectal17.
Aunque existen estudios de coste efectividad, en los que se cita que el beneficio económico empieza solo a partir de unos índices de dehiscencia del 16,5%18, parece evidente que la reducción de reintervenciones y el incremento de anastomosis preservadas justifica su uso. A pesar de ello deberán tenerse en cuenta los inconvenientes que la realización de la ileostomía lleva inherentes ya que implica no solo la necesidad de una nueva intervención para proceder al cierre de la misma, sino la disminución de la calidad de vida durante el tiempo en que se mantienen en uso19,20.
En el cáncer de recto el intervalo hasta el cierre de la ileostomía está condicionado en la mayor parte de los casos por la necesidad de completar los ciclos de quimioterapia o iniciar la radio quimioterapia si no se hubiera administrado previamente a la cirugía. Ello determina que, en la mayoría de los casos, se debe retrasar su cierre hasta después de la conclusión del tratamiento.
En el presente estudio, hemos visto cómo en los pacientes a los cuales no se tuvo que administrar quimioterapia postoperatoria, se realizaba el cierre de forma significativamente más precoz que en los pacientes a los cuales se les indicaba este tratamiento. Dado que suele ser prioritaria la conclusión del tratamiento quimioterápico, la única posibilidad de acortar el intervalo de espera, sería realizar un cierre precoz, incluso en el propio ingreso, lo cual en el estudio aleatorizado de Alves et al21 fue posible en el 75% de los casos y con unos resultados incluso ligeramente mejores al cierre tardío excepto en los valores de infección de la herida quirúrgica. Parece esta una opción a tener en cuenta, aunque quizás puede agravar los síntomas del síndrome de la resección anterior baja.
Sin embargo a pesar del efecto de retraso debido a la quimioterapia postoperatoria, pensamos que también nuestros pacientes a los que no se les administra, presentan un periodo medio de espera excesivamente largo de 145 días (DE=99) atribuible a demora en la realización de pruebas y dificultades de programación. La solución a todo ello debe ser un objetivo inmediato a cumplir.
En nuestros pacientes, previo al cierre del estoma, se efectuó sistemáticamente un enema con gastrografín a través del extremo distal de la ileostomía no evidenciando ninguna alteración que obligara a posponer la intervención. En la bibliografía consultada, es mayoritaria la opinión que los enemas previos al cierre de la ileostomía son de escaso valor y por tanto su realización no sería estrictamente necesaria ya que en los casos en que no ha existido previamente ningún problema en la cirugía rectal, la posibilidad de hallar posteriormente alteraciones no conocidas es muy escasa22.
Otro punto conflictivo en estas intervenciones sucede cuando existen metástasis hepáticas cuya exéresis se considera que debe realizarse después de la cirugía del tumor primario. Nosotros en dos ocasiones hemos asociado la cirugía de las metástasis hepáticas con el cierre de la ileostomía sin que ello supusiera un incremento de las complicaciones. Sin embargo, se trataba de resecciones menores, ya que pensamos como otros autores23, que la asociación de resecciones mayores hepáticas con el cierre de la ileostomía, puede asociarse a una mayor morbilidad y estancia hospitalaria más prolongada.
Si bien algunos trabajos24, han señalado que es posible realizar la intervención bajo anestesia local, nosotros optamos siempre por la anestesia general, ya que tampoco somos partidarios de realizarla en régimen ambulatorio como han sugerido otros grupos24,25.
En nuestros pacientes las anastomosis practicadas fueron indistintamente manuales o mecánicas y no hemos observado ningún tipo de diferencia en cuanto a duración del íleo postoperatorio, como sí ha sido referido en otros trabajos26, así como tampoco en complicaciones y estancia hospitalaria. Esta similitud en los resultados coinciden con la mayoría de información disponible que ha comparado ambos tipos de sutura26,27, si bien parece una norma general hallar más cortos los tiempos operatorios con la sutura mecánica26,27.
La mortalidad presentada en nuestro estudio, fue de un caso (1,8%). En la bibliografía, los índices observados son muy amplios, pudiendo oscilar entre el 0,06 y el 6,4%28,29.
Las complicaciones muestran un índice del 22,2%, dentro de los estándares de este tipo de cirugía26–28, siendo el porcentaje de reintervenciones practicadas (7,4%) similar al de otras series19,21,29.
Las dehiscencias en este tipo de cirugía pueden en general tratarse mediante resección y nueva anastomosis como se realizó en el único caso presentado en nuestra serie, por lo que todos los pacientes intervenidos pudieron ser dados de alta con una correcta reconstrucción del tránsito intestinal.
La hemorragia de la anastomosis es una complicación que parece ser más frecuente en las anastomosis mecánicas26,27,29. Pensamos que es debido a la sutura lineal evertida producida, y que la práctica de una sutura sero-serosa invaginante podría disminuir el problema.
El resto de complicaciones como son las médicas o las alteraciones del tránsito digestivo, no difieren tampoco de los resultados hallados en la bibliografía, siendo los esperables en este tipo de cirugía.
A la vista de los datos expuestos, pensamos que las complicaciones de este procedimiento no son despreciables, lo que debe ser tenido en cuenta por pacientes y cirujanos evitando minimizar este procedimiento en relación con la importancia de la cirugía de resección rectal previa.
A menudo el intervalo de espera puede ser largo y la quimioterapia postoperatoria determina un retraso en la reconstrucción del tránsito. Pensamos que el cierre de la ileostomía debería realizarse lo antes posible a fin de devolver la calidad de vida a estos pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.