Introducción
Uno de los avances más importantes en cirugía general en los últimos años ha sido la aplicación de las técnicas laparoscópicas, tras el éxito de la colecistectomía por laparoscopia. La mayor ventaja de la cirugía laparoscópica (CL) es la rápida y cómoda recuperación caracterizada por la reducción del íleo postoperatorio, la menor necesidad de analgesia y una menor alteración de la función respiratoria. La evidencia de estos hallazgos ha hecho suponer que la agresión quirúrgica inducida por la CL es de menor intensidad que la causada por la forma abierta, lo cual ha sido confirmado en múltiples estudios en los que se ha observado una menor modificación de los valores de cortisol y de los marcadores de respuesta de fase aguda1-5. También se ha demostrado que la CL se acompaña de una menor afección de la respuesta inmunitaria1-5.
Hay una evidencia clínica adicional que supone una diferencia radical entre la CL y la cirugía abierta: la menor incidencia de complicaciones infecciosas. Se ha intentado justificar este hecho de diversas formas: por el mantenimiento de una atmósfera sin contacto con el aire ambiente (neumoperitoneo con CO2), la mejor preservación de la fisiología intraperitoneal al mantener la pared abdominal intacta, o el hecho de que la CL provoca un menor grado de inmunodepresión postoperatoria que la cirugía abierta, lo que mantendría una respuesta mejor conservada ante la infección6. En un estudio experimental previo7 comprobamos que la inyección intraperitoneal de un inóculo conocido de Escherichia coli en el ratón se acompañaba de un mayor grado de infección local a las 24 y 72 h, objetivado por un mayor número de hemocultivos positivos y un mayor recuento bacteriano en el contenido peritoneal tras la cirugía abierta respecto a la laparoscópica. A la vez, se demostró una menor respuesta inflamatoria a las 24 y 72 h al observar valores menores de interleucina (IL) 1, factor de necrosis tumoral (TNF) e IL-6 peritoneal en el grupo de CL, con una dinámica diferente respecto al grupo sin contaminación durante las primeras 12 h, lo que permitió suponer un aclaramiento bacteriano más eficaz, con una menor respuesta inflamatoria. Sin embargo, el mecanismo defensivo alrededor del cual pivota la reacción peritoneal a la infección es el macrófago. Diversos estudios han demostrado in vitro que la atmósfera con CO2 altera de forma importante la fisiología del macrófago8-13. La acidificacion inducida por el ambiente con CO2 conlleva una disminución del pH citosólico que inhibe la actividad macrofágica y la producción de citocinas de forma transitoria, lo que en teoría conllevaría una menor capacidad de respuesta a la contaminación peritoneal. Las modificaciones inducidas en el macrófago son dependientes del tiempo y reversibles durante las primeras horas tras la realización del neumoperitoneo. Sin embargo, no se conoce bien la respuesta inmediata intraperitoneal a la infección que pudiera explicar la contradicción que hay entre la afección funcional del macrófago inducida por el CO2 en contraposición con la evidencia de una mejor preservación de la respuesta peritoneal a la sepsis, lo cual ha sido el objetivo de este estudio.
Hipótesis
La respuesta biológica a la agresión quirúrgica secundaria a la CL es de menor intensidad que tras la cirugía abierta. Uno de los aspectos en los que se ha podido objetivar esta mejor respuesta es en la menor incidencia de complicaciones infecciosas intraabdominales. Sin embargo, el neumoperitoneo con CO2 inhibe la capacidad de respuesta de los macrófagos peritoneales, lo que favorecería, en teoría, la proliferación bacteriana. La hipótesis que se plantea en este estudio es que en el balance entre la afección funcional macrofágica por efecto del CO2 frente a la inmunodepresión postoperatoria inducida por la cirugía abierta, la menor agresión inducida por la CL favorece una mejor respuesta peritoneal a pesar de la alteración funcional macrofágica.
Material y método
Animal de experimentación
Se utilizaron ratones swiss albino machos CD-1 (Charles River, Sant Aubin Les Elbeuf, Francia) de 6-8 semanas de edad y con un peso de 25-30 g. Los animales fueron mantenidos en el estabulario del laboratorio de cirugía experimental del Hospital de la Santa Creu i Sant Pau como mínimo durante 3 días antes de practicar cualquier tipo de intervención. El mantenimiento de los animales, así como las situaciones experimentales y de sacrificio de los animales, se realizaron de acuerdo con las normas establecidas de protección a los animales de experimentación (DOGC 2073-10/7/95 llei 5/1995 de 21 de junio).
Grupos experimentales
Grupo I. LP-SC: laparotomía sin contaminación (n = 32).
Grupo II. LP-C: laparotomía más contaminación abdominal (n = 32).
Grupo II. LC-C02-SC: laparoscopia con CO2 sin contaminación (n = 32).
Grupo III. LC-C02-C: laparoscopia con CO2 más contaminación abdominal (n = 32).
Grupo IV. LC-T-SC: laparoscopia mediante tracción de pared (n = 32).
Grupo V. LC-T-C: laparoscopia mediante tracción de pared más contaminación abdominal (n = 32).
Técnica quirúrgica
Los animales recibieron anestesia general mediante inyección intramuscular de ketamina a dosis de 90 mg/kg de peso (3 mg) y xilacina a dosis de 10 mg/kg de peso (0,3 mg).
Modelo laparotomía. Animal en decúbito supino. Desinfección de la piel con antiséptico iodado. Incisión de laparotomía media de 30 mm de longitud. Exteriorización del paquete intestinal durante 30 min. Contaminación del abdomen con 1 ml de una solución de E. coli (0,5 x 104 unidades formadoras de colonias [UFC]/ml) 10 min antes del cierre abdominal. Cierre de la pared con sutura continua de 3/0 de Vycrilr (Ethicon).
Modelo laparoscópico con neumoperitoneo con CO2. Idéntico al anterior. Realización del neumoperitoneo mediante punción con aguja de Veress hasta alcanzar una presión de 5 mmHg a un flujo de 0,2 l/min con un insuflador electrónico de CO2 (Karl Storz, Tuttinlen).
Modelo laparoscópico con tracción de pared. Idéntico al anterior. Tracción de la pared mediante la inserción de un tractor parietal percutáneo y elevación de la pared a una altura similar a la obtenida con el neumoperitoneo.
Inóculo bacteriano
Se administró una inyección de una suspensión en suero fisiológico de 0,5 x 104 UFC/ml de la cepa E. coli TCC 25922. En los análisis preliminares7 se ha demostrado que esta dosis induce una peritonitis reproducible en la que es posible cuantificar el número de bacterias, asociado a un 50% de hemocultivos positivos a las 72 h con una supervivencia del 100%.
Protocolo de estudio
En cada grupo de animales se procedió al sacrificio y la obtención de líquido peritoneal a las 1, 5, 3, 6 y 12 h postintervención quirúrgica.
Parámetros de medición de respuesta inflamatoria peritoneal
Quimiocinas: MCP-1 (monocyte chemotactic protein-1) (ng/ml); citocinas: IL-6 (ng/ml); prostanoides: prostaglandina E2 (PGE-2) (pmoles/ml). Para IL-6 e MCP-1 se realizó la determinación mediante ELISA (BD Biosciences, Palo Alto California), mientras que para la PGE2 se utilizó el enzimoinmunoanálisis (Amersham Biosciences, Barcelona, España).
Obtención de las muestras
En todos los animales, la obtención de las muestras se llevó a cabo tras anestesiarlos con una inhalación de Fluorane® seguida de la preparación del campo estéril. Las muestras de líquido peritoneal se obtuvieron mediante el lavado de la cavidad abdominal con 1 ml de suero fisiológico y aspiración de éste transcurridos 2 min. A la vez se tomó una muestra para cultivo microbiológico. Las muestras se almacenaron en hidrógeno líquido durante el tiempo que duraba la extracción y se mantuvieron en el congelador a 70 °C hasta su posterior análisis.
Criterios de exclusión
Se excluyó del estudio a todos los animales de los grupos sin contaminación abdominal en los que se detectó la presencia de cualquier tipo de germen y todos los animales del grupo con contaminación intraabdominal con E. coli en los que se detectó cualquier tipo de germen diferente del inoculado.
Estudio estadístico
La comparación entre los grupos se efectuó mediante el análisis de la varianza y la prueba de la χ2, para lo que se utilizó un programa estadístico SPSS. Los datos se expresaron como la media y la desviación estándar.
Resultados
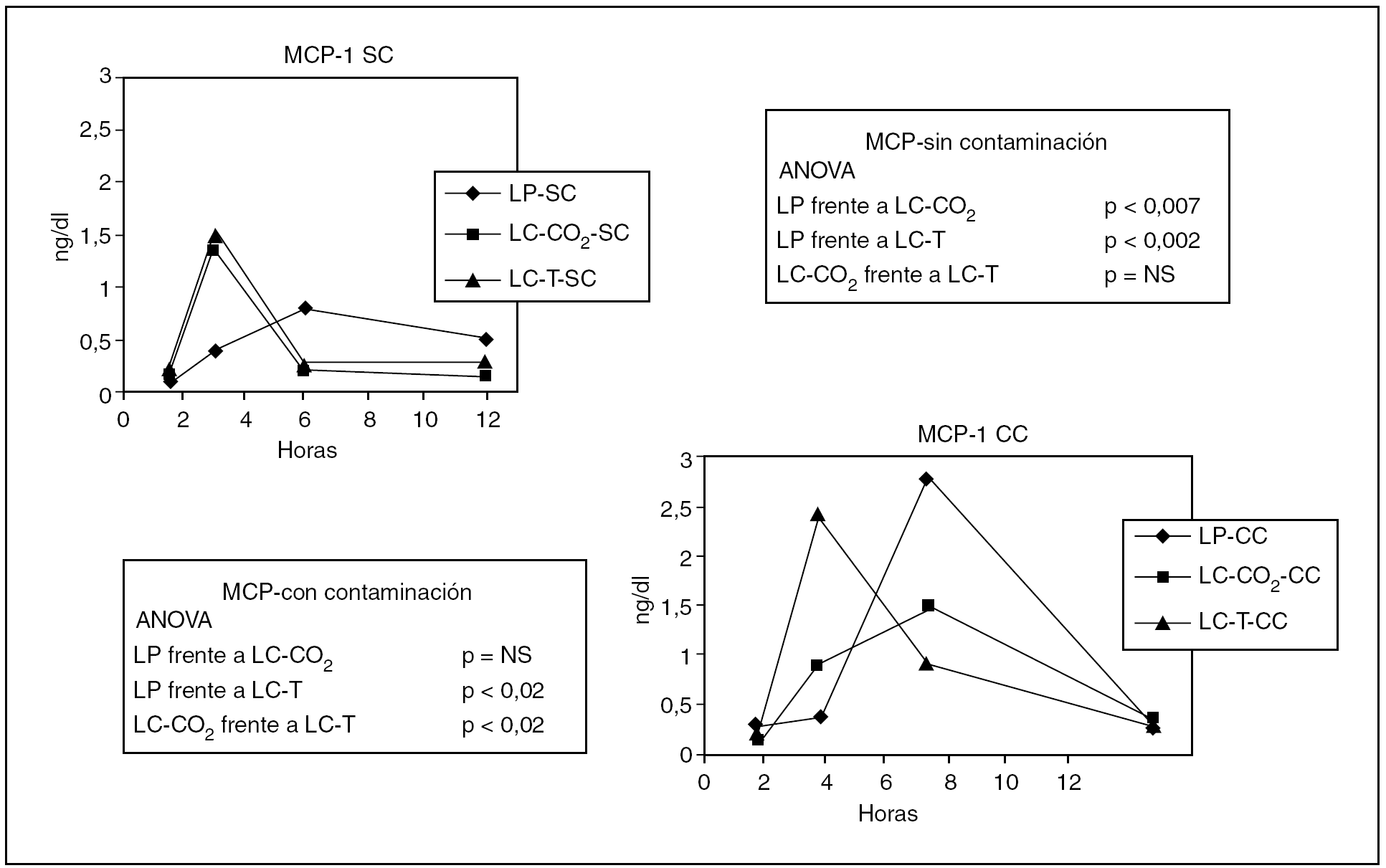
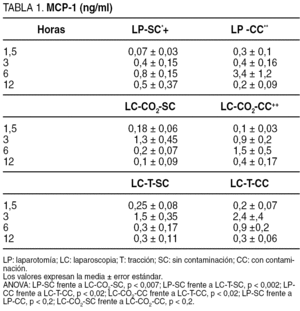
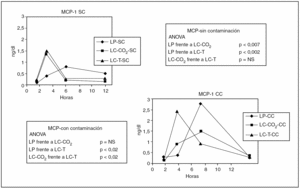
MCP-1 (tabla 1)
Los valores de MCP-1 se elevaron de manera significativa en los grupos sin contaminación. Esta elevación fue significativamente mayor y más precoz en el grupo LC-CO2 que tras la laparotomía (p < 0,007). A la vez, el incremento en el grupo tracción fue significativamente mayor (p < 0,002) que tras la laparotomía, sin diferencias respecto al grupo LC-CO2 (fig. 1). Cuando se añadió la contaminación peritoneal en el grupo de laparotomía se produjo un incremento significativamente mayor respecto al grupo sin contaminación (p < 0,5), y la elevación en el grupo LC-CO2 fue significativamente más tardía, sin que se observaran diferencias significativas entre el grupo LP y LC-CO2. Las modificaciones de los valores de MCP-1 tras la contaminación entre los grupos LP y tracción fueron significativas y más tardías (p < 0,002), así como entre LC-CO2 y LC-T (p < 0,02) (fig. 1).
Fig. 1. Modificaciones de los valores de MCP-1 en los diferentes grupos experimentales en función de la presencia de contaminación peritoneal. LP: laparotomía; LC: laparoscopia; T: tracción; SC: sin contaminación; CC: con contaminación.
Interleucina 6 (tabla 2)
Los tres modelos de agresión se acompañaron de una significativa elevación de la IL-6, que fue significativamente mas tardía en el grupo LP, con diferencias significativas entre los grupos LP y LC-CO2 (p < 0,002) (fig. 2). A la vez, la elevación de IL-6 fue significativamente superior y más precoz en el grupo con tracción respecto al grupo laparotomía (p < 0,003), sin diferencias entre los grupos LC-CO2 y LC-T (fig. 2). Cuando se añadió la contaminación se observó también una significativa modificación, similar a la observada en los grupos sin contaminación. Sin embargo, únicamente se observaron diferencias significativas entre la presencia o no de contaminación en el grupo el grupo LC-CO2. A la vez, el modelo con tracción mantuvo una mayor y más precoz elevación de los valores de IL-6 respecto al grupo LP y LC-CO2 (p < 0,001) (fig. 2).
Fig. 2. Modificaciones de los valores de interleucina (IL)-6 en los diferentes grupos experimentales en función de la presencia de contaminación peritoneal. LP: laparotomía; LC: laparoscopia; T: tracción; SC: sin contaminación; CC: con contaminación.
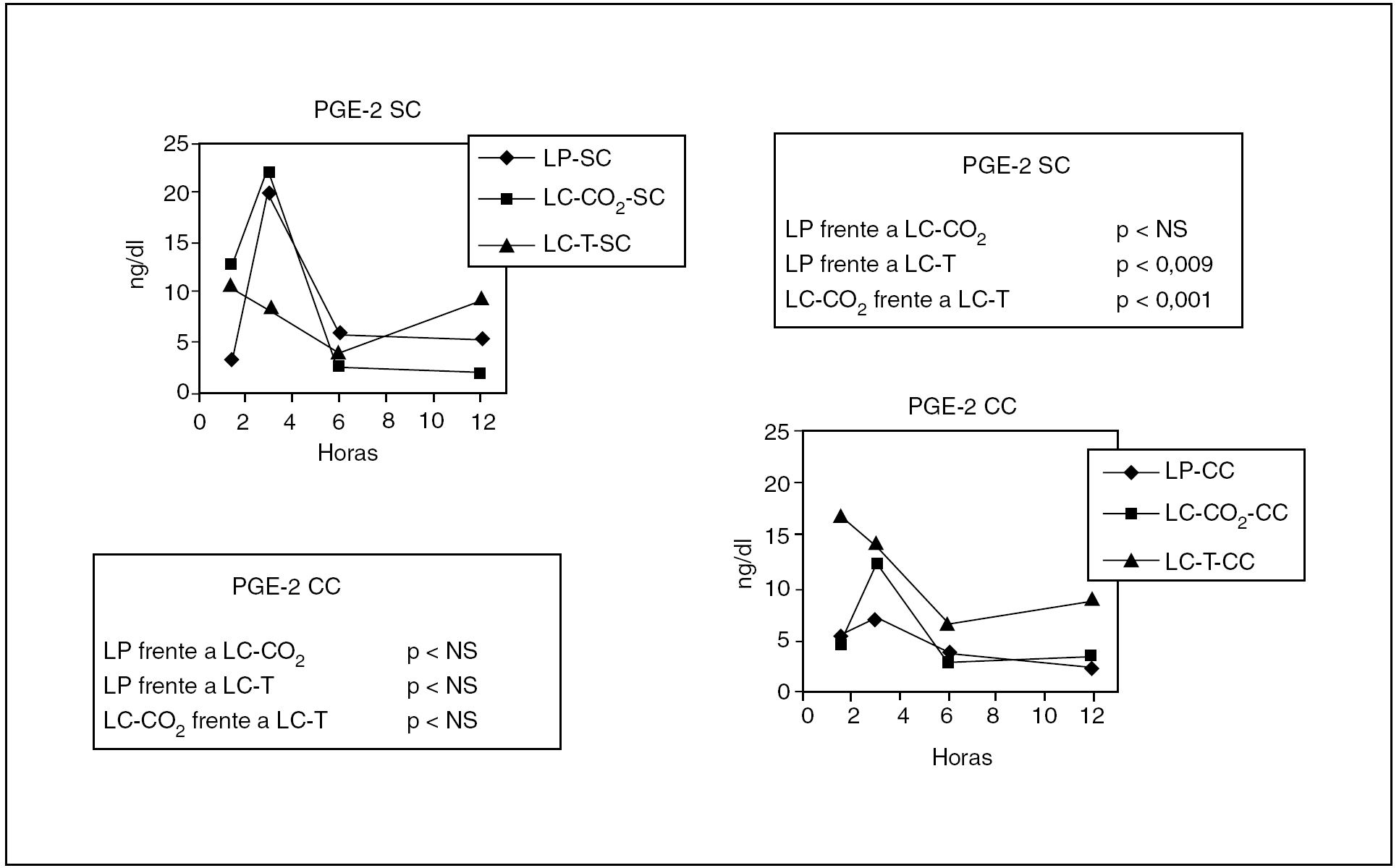
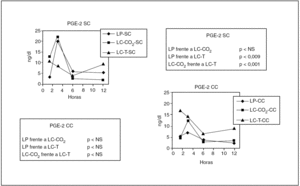
Prostaglandina E2 (tabla 3)
Los tres modelos demostraron un incremento significativo de los valores de PGE-2, aunque no se observaron diferencias significativas entre los grupos LP y LC-CO2 a pesar de que ambos grupos eran significativamente superiores a los observados en el grupo con tracción (p < 0,009 respecto a LP y p < 0,001 respecto a LC-CO2) (fig. 3).
Fig. 3. Modificaciones de los valores de prostaglandina E2 (PGE-2) en los diferentes grupos experimentales en función de la presencia de contaminación peritoneal. LP: laparotomía; LC: laparoscopia; T: tracción; SC: sin contaminación; CC: con contaminación.
En los grupos en que se contaminó el peritoneo se observó una reducción de los valores de PGE-2 respecto a los grupos sin contaminación, sin que se observara una diferencia estadísticamente significativa entre los tres grupos.
Discusión
La observación de una diferente respuesta clínica entre la CL y la cirugía abierta ha estimulado el estudio de la respuesta biológica a la agresión durante la CL1-5. A la vez, el problema clínico representado por la aparición de los implantes en los trocares, junto con la duda razonable sobre la seguridad en el establecimiento de un neumoperitoneo en una infección establecida, ha estimulado el estudio de las modificaciones de la fisiología peritoneal durante la cirugía laparoscópica. En el momento actual se dispone de suficiente información clínica y experimental para asegurar que la CL se puede considerar menos agresiva, al asociarse con una menor respuesta inflamatoria y una menor inmunodepresión evidenciada por la observación de una menor elevación de IL-6, proteína C reactiva (PCR) y diversos marcadores de la respuesta inmunitaria. La mayoría de estas observaciones se ha extraído de experiencias que han analizado la respuesta sistémica, en fases tardías tras la intervención. Sin embargo, la lesión tisular inductora de una respuesta general ocurre en la zona intraperitoneal, de una forma inicialmente intracompartimental para, con posterioridad, difundirse de forma sistémica14.
Si bien la mayoría de las investigaciones se ha dirigido hacia la evaluación de las modificaciones observadas en el peritoneo que podían favorecer la diseminación neoplásica durante la CL, otra situación clínica en la que las modificaciones peritoneales inducidas por el neumoperitoneo podían provocar consecuencias no deseadas corresponde a la contaminación intraperitoneal intraoperatoria, o bien cuando la CL terapéutica se utiliza en casos de infección intraperitoneal establecida (apendicitis, colecistitis)6. La lesión tisular inducida por la CL es cualitativamente diferente respecto a la cirugía abierta15,16. Durante la cirugía abierta, los componentes más importantes de la lesión son la cantidad de tejido lesionado (tamaño de la herida), la tracción visceral, la desecación y el cambio de temperatura. Durante la CL y el mantenimiento de un neumoperitoneo se reduce la lesión tisular secundaria a la herida de la laparotomía, pero se añaden otros componentes lesivos como consecuencia de la distensión de la cavidad abdominal, del gas utilizado y de su duración17. Se ha demostrado que el neumoperitoneo con CO2 produce importantes cambios morfológicos en la cubierta peritoneal, con aumento del espacio intercelular y abultamiento celular18, y que estos cambios y esta desestructuración se incrementan cuando de asocia una contaminación peritoneal19-21. Por otra parte, las características físicas del neumoperitoneo cuando se utiliza CO2 frío y seco reducen la temperatura intraperitoneal y la corporal total, así como el grado de humedad intraperitoneal22,23. Otro posible componente lesivo corresponde al efecto sobre la microcirculación por el aumento de presión intraabdominal, tanto parietal (subperitoneal) como visceral24. La compresión venosa por el aumento de la presión intraperitoneal reduce el flujo venoso visceral, incrementa el metabolismo anaerobio con aumento de lactato y puede comportar un cierto grado de síndrome de isquemia-reperfusión visceral al desuflar el neumoperitoneo. La diferencia más importante en contraste con la cirugía abierta es la inducida por la utilización de CO2, en comparación con otros gases como el He. El CO2 induce una importante acidificación del medio, reduce el pH tisular y provoca la acidificación citosólica de las células residentes en el peritoneo, como el macrófago, así como las células mesoteliales8,12,25,26. West et al13 demostraron que la incubación in vitro de macrófagos intraperitoneales inhibía significativamente la respuesta al estímulo con LPS, con una reducción transitoria de la síntesis de IL-1 y TNF. Este hallazgo permitía suponer el beneficio de una respuesta inflamatoria más atenuada, lo que podrá justificar una respuesta de fase aguda de menor intensidad27, pero también permitiría sugerir una peor respuesta local a la agresión séptica. Sin embargo, el posible impacto negativo de la alteración funcional macrofágica sobre la respuesta peritoneal a la infección no ha sido confirmado. Balagué et al7 observaron que la respuesta peritoneal a la agresión séptica estaba mejor conservada durante la CL que tras la cirugía abierta, demostrada por la reducción en el número de colonias en el cultivo peritoneal tras la inoculación de E. coli, así como por una menor elevación de IL-6 peritoneal, aunque se observó una marcada diferencia en la curva de respuesta entre la situación experimental con o sin contaminación. Sin embargo, en este estudio no se ha valorado la respuesta inmediata durante las primeras horas a la infección, en las que pueden ser críticas las modificaciones inducidas por el neumoperitoneo en la respuesta peritoneal. Por otra parte, en estudios recientes se demuestra que, además del macrófago, hay otros elementos celulares (células mesoteliales) con capacidad de respuesta y producción de mediadores de la inflamación (IL-6, MCP-1, etc.)28,29. Con la hipótesis de que, a pesar de la presencia de una afección funcional del macrófago, la repuesta peritoneal a la infección está mejor preservada durante la CL que tras la cirugía abierta, se planteó este estudio experimental que intentaba evaluar la respuesta peritoneal in vivo inmediata a la contaminación peritoneal. Se evaluaron 3 parámetros representativos de la cascada inflamatoria30, como son el MCP-1, la IL-6 y la PGE-2. El MCP-1 es una chemocina ampliamente expresada en la respuesta inflamatoria tras cualquier agresión quirúrgica y que responde de forma específica a la endotoxina31. La IL-6 es una citocina proinflamatoria producida por macrófagos y células mesoteliales que se correlaciona y permite cuantificar la agresión quirúrgica y séptica5,32, y finalmente, la PGE-2 es una prostaglandina con una importante acción vasodilatadora, un metabolito de la activación enzimática de la COX y la fosfolipasa A2, vía activada por los macrófagos como respuesta inmunitaria innata33-34. A la vez, la PGE-2 es un metabolito inducido por la lesión mediada por radicales libres de oxígeno, como consecuencia de la reperfusión tras un período de isquemia.
Los resultados obtenidos demuestran una más rápida elevación de MCP-1 e IL-6 en los grupos sin contaminación, aunque con una normalización más lenta tras la laparotomía. Sin embargo, tras la contaminación peritoneal se observó una similar elevación de MCP-1, con un retraso en el pico de elevación en el grupo laparoscópico. La contaminación peritoneal permitió observar un patrón similar de repuesta en el tiempo, aunque la repuesta en el grupo laparoscópico fue significativamente menor, lo que permite suponer un impacto directo por la afección por CO2 respecto al grupo sin CO2. En el modelo de tracción, que tenía por finalidad obviar el efecto del CO2 evitando a su vez la amplia laparotomía, observamos una rápida y marcada elevación de MCP-1 e IL-6, tanto en los grupos con contaminación como sin ella. Ello se puede interpretar de varias formas: a) la presencia de CO2 reduce la producción de MCP-1, mientras que en el caso del grupo de tracción parietal, en que se evita la presencia de gas, se produce una elevación de MCP-1, y b) se puede suponer que, en este modelo en el ratón, la tracción parietal es más agresiva que el neumoperitoneo con CO2 o la laparotomía. Con las lógicas dificultades para extrapolar estos hallazgos, éstos también se han demostrado en intervenciones con tracción parietal en el humano, en las que se ha observado una mayor elevación de la epinefrina, la creatincinasa y la PCR, y permite especular que la presión no controlada, la isquemia parietal y la tracción parietal y peritoneal pueden ser las causantes de esta respuesta exagerada3,34-37.
Finalmente, en ambos grupos de laparotomía y LC-CO2 se observó una respuesta similar en cuanto a la producción de PGE-2, sin diferencias en ambos modelos, aunque los valores en el grupo de tracción fueron significativamente menores. Estos resultados permiten excluir la importancia del síndrome de isquemia-reperfusión en este modelo, aunque la utilización de una presión intraperitoneal menor que la utilizada en la clínica y, por tanto, una menor reducción de la presión venosa portal permiten entender la ausencia de este fenómeno. Sin embargo, es difícil evaluar de forma definitiva las modificaciones de la PGE-2, ya que su liberación es inmediata al contacto con LPS, lo que supone que su elevación o modificación sustancial probablemente sucede minutos después de la contaminación o la agresión, lo que no permite extraer conclusiones definitivas.
La evidencia de una menor repuesta de la MCP-1 e IL-6 a la contaminación en el grupo LP-CO2 en comparación con el grupo laparotomía y el hecho de observar una mayor modificación en el grupo con tracción respecto al grupo con gas permite suponer que durante el neumoperitoneo con CO2 in vivo realmente hay una afección funcional de la respuesta macrofágica y peritoneal al sobrestímulo que significa una contaminación por gramnegativos aunque, tal como demostraron Balagué et al7, la respuesta peritoneal final es más eficiente que tras la laparotomía. Hay diversas posibles explicaciones a este fenómeno. Se ha propuesto que el CO2 posee un efecto bacteriostático que puede afectar a la proliferación bacteriana6. Otra posible explicación es el superior efecto inmunodepresor de los diversos componentes de la agresión mediante laparotomía respecto al posible efecto de la afección macrofágica por el CO2. Está bien establecido el efecto inmunodepresor de la laparotomía sobre la capacidad fagocítica macrofágica. Iwanaka et al38 demostraron que el número y la viabilidad de los macrófagos recuperados tras una laparotomía eran significativamente menores que tras un neumoperitoneo con CO2. Otra explicación podría ser que la afección macrofágica in vivo fuera de menor intensidad que in vitro. Los estudios de West et al13 se efectuaron en condiciones in vitro, situación mucho más extrema que in vivo o en la clínica humana, donde los efectos deletéreos del neumoperitoneo (retención de CO2, acidosis) pueden ser manipulados y controlados por el anestesista39. Por otra parte, se ha demostrado que las células mesoteliales también poseen capacidad de síntesis de TNF, IL-1 e IL-628,29, y estas células que poseen un lecho capilar subperitoneal podrían no estar sometidas a una ambiente tan extremo como los macrófagos, lo que permitiría mantener un cierto grado de respuesta. Otra explicación puede corresponder al posible efecto transitorio del CO2 sobre la función macrofágica. Tras desuflar el neumoperitoneo, el macrófago recuperaría su función normal y éste, cuya función estaría mejor preservada debido a su mayor viabilidad, podría conllevar un resultado final más eficiente. Por ello efectuamos este experimento in vivo que, de forma complementaria al estudio de Balagué et al, permite concluir que, a pesar de haber observado una afección de la respuesta peritoneal inmediata por la afección funcional macrofágica inducida por el CO2, la menor agresión inducida por la CL permite un mejor control de la contaminación intraabdominal que tras la cirugía abierta.
Correspondencia: Dr. E.M. Targarona.
Servicio de Cirugía. Hospital de Sant Pau.
Mas Casanoves, 90. 08025 Barcelona. España.
Correo electrónico: etargarona@santpau.es
Manuscrito recibido el 18-5-2005 y aceptado el 18-5-2005.