Los paragangliomas de comportamiento maligno son poco frecuentes, pero pueden ocurrir especialmente en pacientes con presentación familiar de la enfermedad. Presentamos el caso de una mujer de 23 años con diagnóstico de glomus carotídeo bilateral con metástasis ganglionares locales y a distancia, asociado a historia familiar de paraganglioma y presentamos una revisión de la literatura.
Malignant paragangliomas are rare, but may occur especially in patients with familial forms of the disease. We present the case of a 23 year old woman diagnosed with bilateral carotid paraganglioma with distant and local metastases, associated to a family history of paraganglioma and we present a literature review.
Los tumores de cuerpo carotídeo (TCC) son poco comunes. Su incidencia reportada varía de uno en 30.000 a 100.000 en la población general1. Representan el 0,6% de los tumores de cabeza y cuello2 y el 50-60% de los paragangliomas (PG) del organismo3,4. Su desarrollo está relacionado con estados de hipoxia crónica5. El principal factor de riesgo reconocido en pacientes con estos tumores es habitar un área con altitud mayor a 2.000 m sobre el nivel del mar6. En el 10-30% de los casos existe una relación familiar6,7 con transmisión autosómica dominante ligada al sexo masculino3,5. La presentación maligna se reporta en el 6% de los casos, asociada fuertemente a los casos familiares8. El único criterio definitivo de malignidad es la presencia de metástasis en ganglios linfáticos regionales o metástasis a distancia9. Presentamos el caso de una mujer de 23 años de edad con diagnóstico de TCC bilateral con metástasis ganglionares asociado a historia familiar de PG.
Caso clínicoPresentamos una mujer de 23 años de edad con un tumor en el hemicuello izquierdo e historia familiar de abuela materna con TCC. Su padecimiento comenzó 10 años antes cuando fue manejada en otra institución, por un tumor de características y localización similares a las de la abuela, de aproximadamente 2cm en su eje mayor, no doloroso y de crecimiento lento, sin sintomatología asociada. En esa ocasión se realizó tomografía axial computarizada de cuello y se diagnosticó PG peritiroideo izquierdo. Se realizó escisión quirúrgica de la lesión con hemitiroidectomía ipsilateral, sin complicaciones. El diagnóstico histopatológico fue de PG de 2,3cm de eje mayor con infiltración a tejidos blandos y al lóbulo izquierdo de la glándula tiroides con positividad por inmunohistoquímica a vimentina, cromogranina, sinaptofisina y proteína S-100. La citoqueratina AE1/3 y el EMA fueron negativos. Dos años después mediante tomografía axial computarizada de control se detectó un PG yugulotimpánico izquierdo. Se manejó con radioterapia (RT) y embolización. Evolucionó de manera satisfactoria hasta que 4 años después, a los 19 años de edad, se presentó en su seguimiento con dolor en hemicuello izquierdo. Al examen físico se palpó nódulo en hemicuello izquierdo que por resonancia magnética fue reportado como PG carotídeo izquierdo con actividad tumoral cerca del seno piriforme. En una tercera intervención quirúrgica se realizó resección del tumor y se colocó una endoprótesis cubierta en la arteria carótida común izquierda. En Patología se recibió tumor de 4×1,5×1cm compuesto por nidos de células de citoplasma amplio y eosinófilo, con núcleos de cromatina granular y nucléolos ocasionales. Por inmunohistoquímica las células principales fueron positivas a cromogranina y las células sustentaculares a proteína S-100. El diagnóstico histopatológico fue de PG.
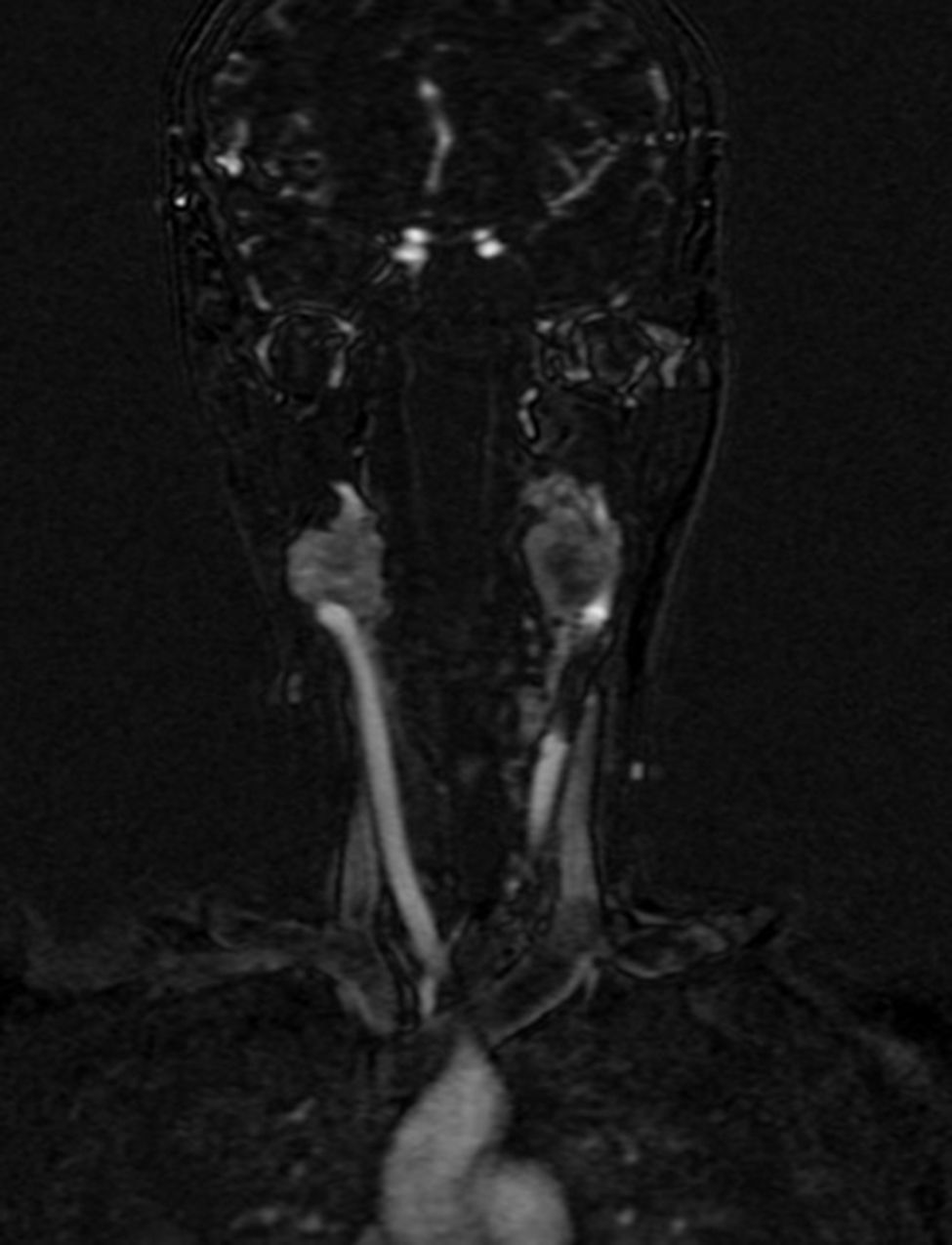
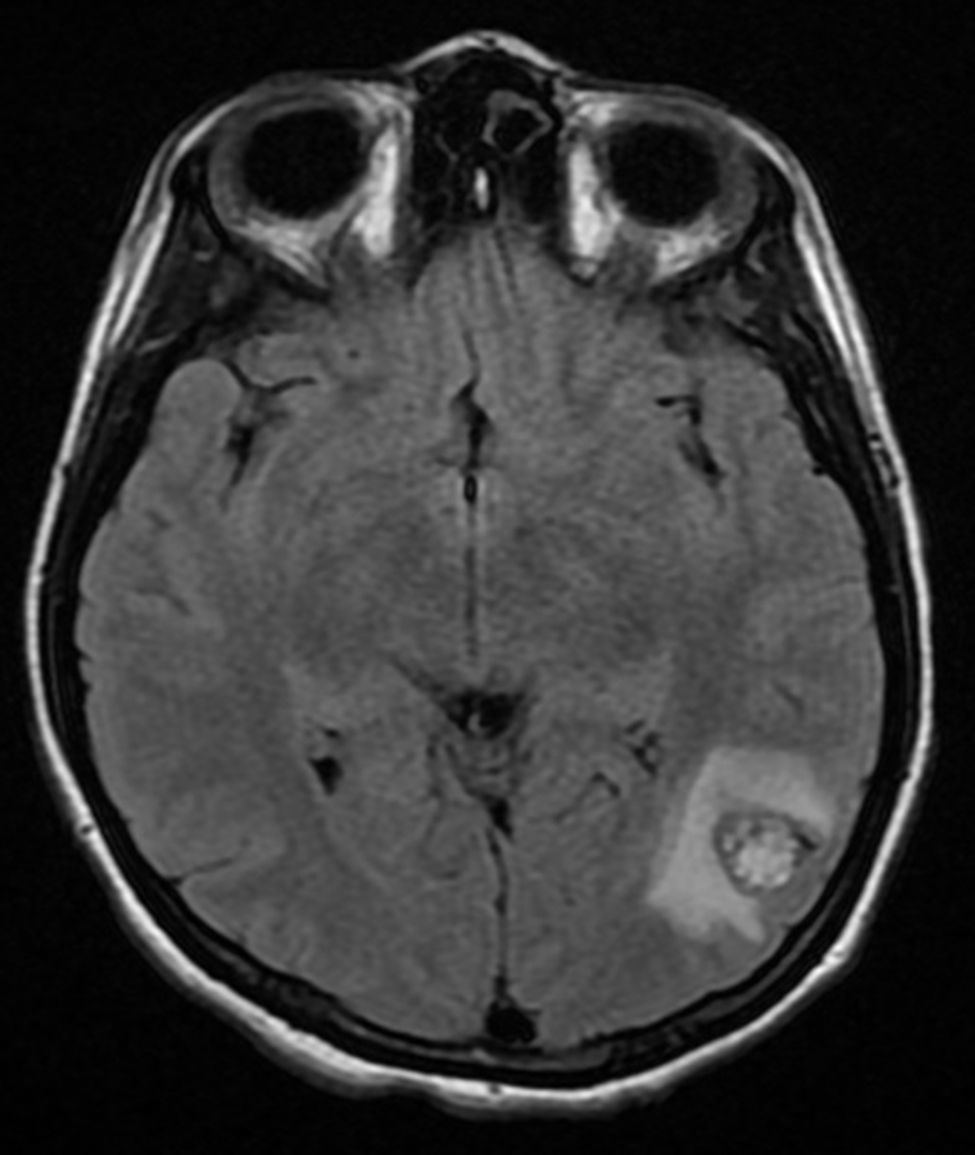
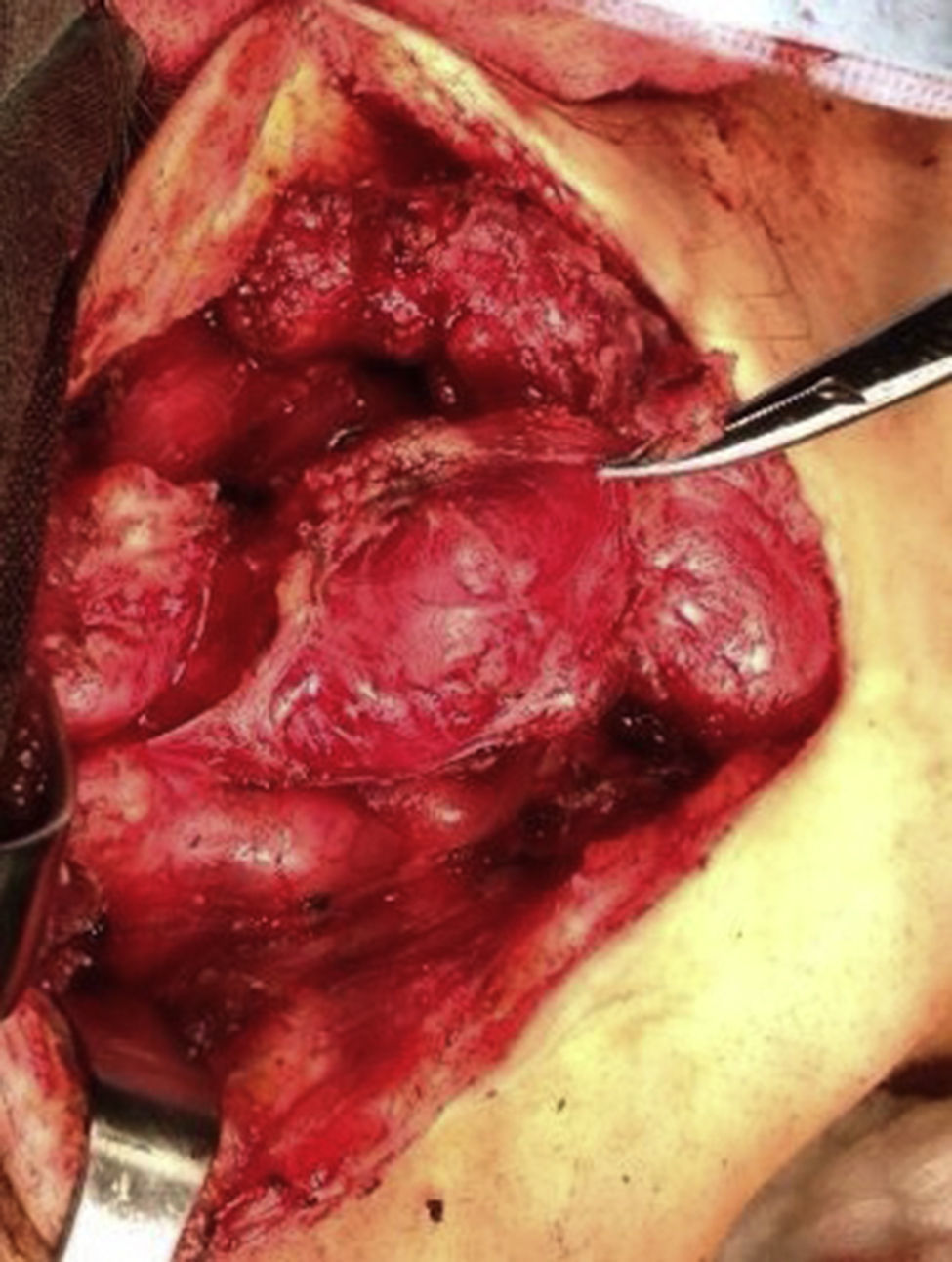
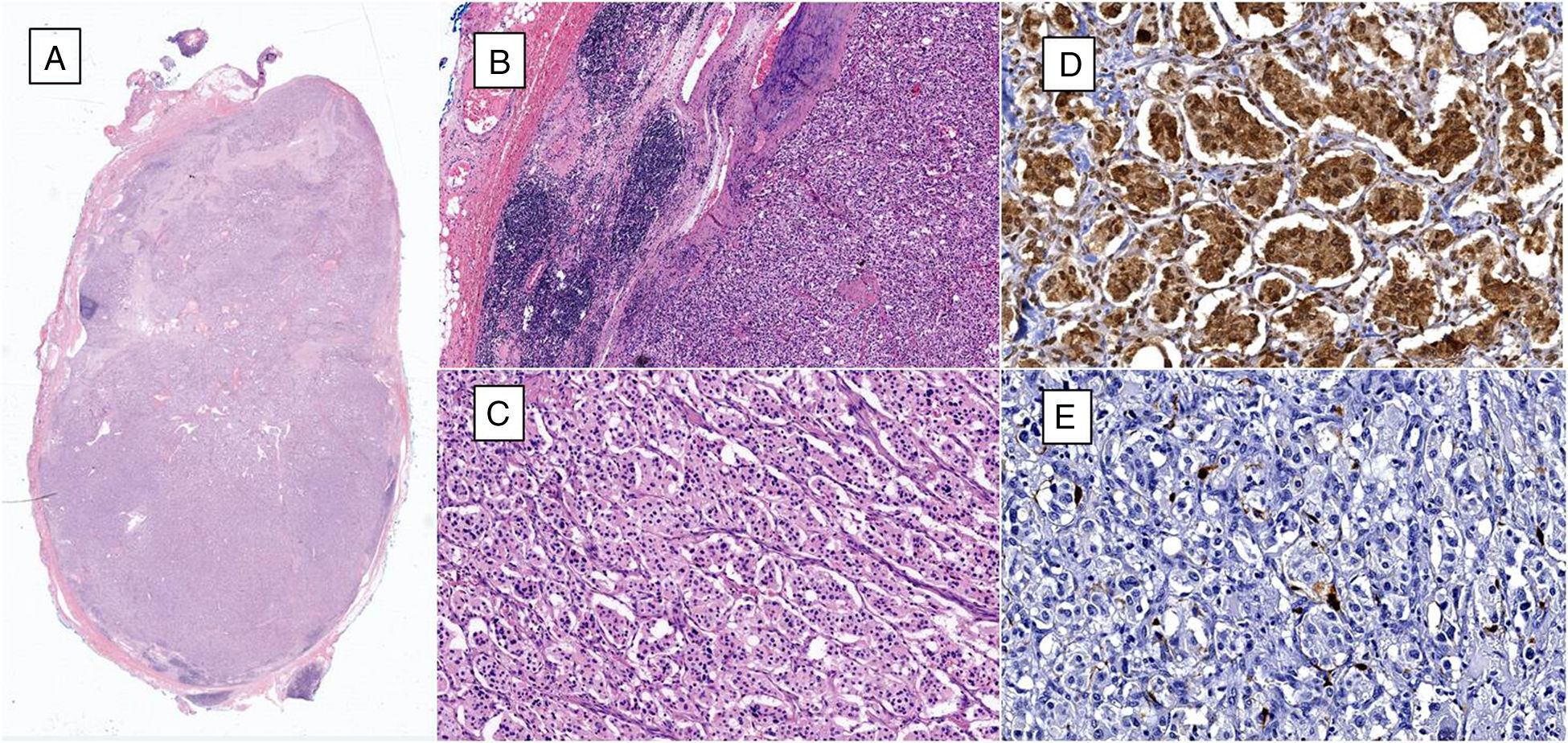
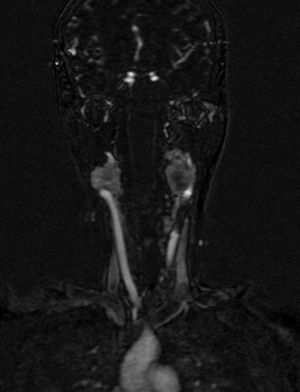
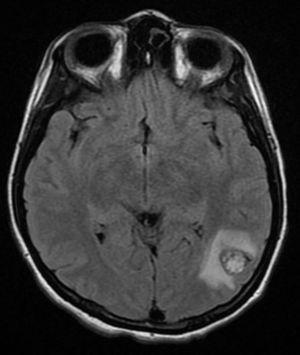
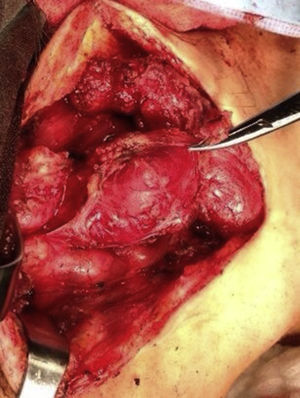
Cuatro años más tarde, a los 23 años de edad, se presentó en nuestro servicio con tumor recurrente en el hemicuello izquierdo y hemiparesia facial izquierda. Una nueva resonancia magnética demostró un PG carotídeo izquierdo de 3,5cm con extensión hacia la base del cráneo e involucro del nervio facial ipsilateral, asociado a nuevo nódulo carotídeo derecho de 1,5cm (fig. 1). Además, las imágenes cerebrales evidenciaron una lesión nodular de 14×14×13mm en la segunda y tercera circunvolución temporal izquierda asociada a una lesión infratemporal con extensión al foramen yugular que se extendía al oído medio ipsilateral (fig. 2). Nuevamente se realizó resección de tumor en región cervical II y III izquierdas. Se visualizó tumor sobre vaina carotídea (fig. 3), el cual se disecó circunferencialmente sin encontrar dependencia de estructuras vasculares. Se observó tumor adyacente a la mastoides, el cual se resecó también. En la vaina carotídea se encontraron ganglios hipertróficos que fueron disecados y enviados a estudio histopatológico. En Patología se recibieron un total de 22 ganglios linfáticos, 3 de ellos con células neoplásicas metastásicas con disposición en patrón de tipo «zellballen», con células de citoplasma amplio y eosinófilo y de núcleos ovoides. Por inmunohistoquímica las células neoplásicas expresaron cromogranina y proteína S-100 con un índice de proliferación medido con el Ki67 del 5 al 8% (fig. 4). El ganglio linfático con metástasis de mayor tamaño midió 3,5×3×1cm. La paciente evolucionó con mejoría con relación a la parálisis facial y continuó manejo con rehabilitación y prednisona oral. Se decidió no enviar a esta paciente nuevamente a RT dado que la escisión quirúrgica se consideró completa, además de que ya había recibido RT en ese sitio y se prefirió no exceder la dosis máxima recomendada. Al momento del envío de esta publicación, la paciente cumple 2 años de seguimiento libre enfermedad local recurrente en el hemicuello izquierdo.
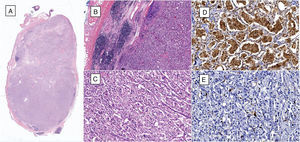
A) Microfotografía de ganglio linfático que tiene células neoplásicas metastásicas que reemplazan más del 90% de la superficie (hematoxilina y eosina, 10x). B) Al lado izquierdo se identifica ganglio linfático residual y al lado derecho se observan células neoplásicas metastásicas (hematoxilina y eosina, 40x). C) Las células neoplásicas están dispuestas en patrón «zellballen», son de citoplasma amplio y eosinófilo, de núcleos ovoides y de cromatina granular (hematoxilina y eosina, 200x). D) Por inmunohistoquímica las células principales son positivas a la cromogranina A. E) Por inmunohistoquímica, las células sustentaculares resaltan con la proteína S-100.
Los PG de cabeza y cuello son raros, pero los casos hereditarios o metastásicos lo son aún más. La correcta categorización de estos pacientes permite elegir la mejor forma de tratamiento. Indagar intencionadamente la historia familiar, especialmente ante la presencia de casos bilaterales o presentaciones con enfermedad metastásica, permitirá elegir formas de tratamiento que tiendan a evitar las recurrencias y la posibilidad de complicaciones quirúrgicas incapacitantes, especialmente de nervios craneales.
La presentación de la TCC es esporádica en el 70-90% de los casos y de tipo familiar en el 10-30%, con transmisión autosómica dominante ligada al sexo masculino1,3,5–7. El desarrollo de malignidad se reporta en un 6% de PG de cabeza y cuello y en un 2,5-5% de los TCC, principalmente relacionado con las presentaciones familiares con tendencia a la multicentricidad y se manifiesta por la invasión local del tumor2,4,8,10. El criterio definitivo de malignidad son las metástasis a ganglios linfáticos regionales u órganos a distancia9,11. A diferencia de los casos esporádicos, los casos familiares se presentan en personas jóvenes y suelen ser multicéntricos y bilaterales1,3,7,8. En estos pacientes se recomienda realizar estudio genético ya que se encuentran relacionados con la presencia de mutaciones de los genes von Hippel-Lindau (VHL), gen RET (MEN II), gen succinato deshidrogenasa (SDH) y neurofibromatosis tipo I en un 10-50% de los casos3,4. Astuti et al. y Bayle et al., en estudios separados, determinaron el rol de la deleción de SDHD, SDHC y SDHB, localizado en el cromosoma 1q23.3, como causante del desarrollo de PG familiar12,13. King et al. demostraron que la mutación en SDHB es el principal factor de riesgo para el desarrollo de enfermedad metastásica en edades tempranas, por lo que recomendaron que se realizasen de manera temprana pruebas de mutación de genes SDHD en aquellos con PG en cabeza o cuello13. En un estudio retrospectivo de 59 pacientes, Lee et al. reportaron que los TCC malignos tienen mayor tasa de metástasis regional, con sobrevida a los 5 años de 76,3%, asociándose a mejor pronóstico en aquellos tratados mediante resección del tumor asociado a RT postoperatoria. Su serie de PG malignos reportados entre 1985 y 1996 recolectó solamente 9 casos8.
Histológicamente los PG se caracterizan por presentar un patrón de crecimiento en nidos conocido como «zellballen» (del alemán «bolas celulares»)6,8,9, los cuales están compuestos principalmente por 2 tipos celulares: células principales y células sustentaculares1,3. Las células principales son productoras de catecolaminas, de medianas a grandes, de citoplasma eosinófilo granular y núcleos de tamaño variable. Por inmunohistoquímica son positivas a la cromogranina A, a la sinaptofisina y a la enolasa de neurona específica. Las células sustentaculares son células alargadas que rodean a las células principales y expresan por inmunohistoquímica proteína S-10014,15.
El manejo quirúrgico es el tratamiento de elección en casos sintomáticos, con crecimiento acelerado y presentación en pacientes jóvenes con tumores pequeños3,14. Se propone evitar la intervención en presentaciones bilaterales, yugulares y en mayores de 60 años o con problemas de ateroesclerosis (excepto en aquellos con sospecha de malignidad)3. La serie alemana de Schneider et al.16 concluyó que la escisión quirúrgica es el tratamiento de elección para PG pequeños, unilaterales, malignos o funcionales. Pero esa misma serie de 6 pacientes reportó parálisis unilateral permanente de nervios laríngeo, glosofaríngeo e hipogloso tras la resección de un tumor unilateral recurrente. Ante eventos quirúrgicos adversos de lesión de nervios craneales, especialmente en casos complicados o recurrentes, ha ganado popularidad la RT. La RT ofrece una alta probabilidad de controlar estos tumores con riesgos mínimos para los pacientes, lo que la convierte en una alternativa atractiva para los casos más complicados. El objetivo con dicho tratamiento consiste en resolver los síntomas asociados y evitar la progresión de la lesión. La radiocirugía estereotáctica (Gamma-Knife) es una técnica de RT que incluye una dosis de radiación en foco único guiada por estereotaxia17. Una serie alemana recientemente reportada18 siguió a 44 pacientes a lo largo 10 años. En 34 de estos se observó una disminución del tamaño del tumor. Las dosis de RT aplicada fue de 10 a 30Gy con media de 20Gy. Una segunda serie de RT con Gamma-Knife reportó el seguimiento de 14PG. Solo 2 de los tratados tenían cirugía previa. Se aplicaron dosis de 21,6 a 26,3Gy y se les siguió un promedio de 40,3 meses. Los 14 tumores presentaron regresión significativa después del tratamiento y se logró preservación de nervios craneales en 13 de los 14, por lo que se concluyó que la radiocirugía con Gamma-Knife es una buena alternativa como tratamiento inicial o adyuvante a cirugía en pacientes que no son candidatos a resección completa19. En una serie de 84 pacientes con PG de cabeza y cuello se demostró control local del tumor en un 73%, con seguimiento a 25 años en aquellos que recibieron RT como único tratamiento, en comparación con un 54% de control local en 15 años de seguimiento en aquellos con solo tratamiento quirúrgico15. La radiación afecta, sobre todo, a los vasos sanguíneos y al tejido conjuntivo, más que a las propias células tumorales, pero la masa vascular puede persistir aún después del tratamiento sin que esto indique falta de respuesta de la enfermedad14.
La RT externa convencional, a dosis de 45Gy en 25 fracciones, suele ser suficiente para controlar la mayoría de los PG20. Se recomienda no exceder la dosis de RT ya que una de las principales complicaciones de esta es la xerostomía. El flujo salival se reduce marcadamente a partir del 10-15Gy y con dosis mayores de 50Gy en ambas parótidas el daño es irreversible, generando la xerostomía permanente21. A la fecha, solo se ha reportado un caso de RT en población pediátrica, posiblemente porque estos pacientes cursan con tumores pequeños, los cuales son excelentes candidatos para manejo quirúrgico2.
La observación es también una decisión aceptable en algunos pacientes, si sus condiciones médicas subyacentes no les permiten acceder a un procedimiento quirúrgico o tolerar los efectos secundarios de la radiación, porque el crecimiento de los PG es lento y las molestias concomitantes pueden ser muy bien toleradas por periodos prolongados. Existen casos aislados de sobrevivencia prolongada sin tratamiento. La polémica estriba en que los que favorecen el tratamiento quirúrgico enfatizan los riesgos de la RT, que puede inducir necrosis cerebral a la par que favorecer la génesis de otras estirpes tumorales, mientras que los propulsores de la RT como modalidad primaria indican los altos riesgos de afección secundaria a pares craneales así como fístulas de líquido cefalorraquídeo y mortalidad perioperatoria asociada a cirugía17.
Desde su descripción en 1980, existe controversia en cuanto a la realización de embolización preoperatoria1,2,7,22–24. Algunos autores apoyan la embolización selectiva de los vasos que alimentan el tumor previo a la resección quirúrgica, esto con el fin de reducir el sangrado transoperatorio y mejorar la diferenciación de las estructuras comprometidas1,2,22–24. A pesar de esto, el reporte de afectación de nervios craneales varía en distintas publicaciones7,23. El abordaje por ruta transarterial tiene la desventaja de que usualmente estos tumores son irrigados por ramas demasiado pequeñas, las cuales no pueden ser cateterizadas, por lo que la tendencia actual es la embolización intralesional directa con agentes líquidos24. Sin embargo, esta técnica no está exenta de complicaciones, como el compromiso isquémico central1,22.
En los casos multicéntricos y metastásicos como el nuestro, la elección del mejor tratamiento puede ser difícil, dado el riesgo de la resección del tumor primario y el pronóstico desconocido de las metástasis25. Moskovic et al., en una revisión de 113 casos, concluyeron que el tratamiento óptimo es la resección amplia del tumor con linfadenectomía y RT postoperatoria, con mejor pronóstico en menores de 40 años de edad26. La resección de nódulos linfáticos regionales se recomienda especialmente ante la sospecha de metástasis por estudios de imagen8.
En general, la resección de la TCC se relaciona con morbilidad en un 35% y mortalidad intraoperatoria menor del 2%5,27. La sobrevida de los pacientes con PG metastásicos varía de uno a 25 años. El seguimiento en estos pacientes es importante ante el riesgo elevado de desarrollar tumores metacrónicos o sincrónicos después del tratamiento inicial, especialmente en aquellos con patrones familiares de la enfermedad2,3,7,28.
En conclusión, los PG solo pueden definirse como malignos cuando se comportan con metástasis a distancia o a ganglios linfáticos regionales especialmente en aquellos relacionados con antecedentes familiares de PG. Son aceptables como tratamientos de elección la cirugía con o sin embolización previa o la RT inicial con o sin cirugía asociada. Se recomienda seguimiento a largo plazo por el alto riesgo de recurrencia de la enfermedad.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.