Este es un análisis crítico de los ensayos prospectivos aleatorizados que comparan las técnicas de reconstrucción pancreática con el estómago y con el intestino, después de pancreaticoduodenectomía. Se utilizó un cuestionario de preguntas del Centro de Medicina Basada en Evidencias de la Universidad de Oxford (análisis PICO), y se han seguido los criterios en la evaluación de estudios prospectivos aleatorizados para intervenciones quirúrgicas de la Universidad de McMaster de Ontario. Se encontró que los estudios difieren en aspectos metodológicos, el más importante la falta de una definición uniforme de fístula pancreática. Las técnicas de realización de la pancreaticogastrostomía y pancreaticoyeyunostomía no fueron homogéneas. No existen diferencias en el porcentaje de fístula pancreática en tres de estos estudios; uno que modifica la técnica de pancreticogastrostomía presentó resultados más favorables. Los nuevos estudios comparativos deberán utilizar las nuevas definiciones de las complicaciones de la pancreaticoduodenectomía y estandarizar la técnica de reconstrucción pancreática.
This is a critical analysis of prospective randomised trials that compare pancreatic reconstruction techniques with the stomach and the intestine, after pancreaticoduodenectomy. A questionnaire with questions from the Evidence Based Medicine Centre of Oxford University (PICO analysis) was used, following the criteria for the evaluation of randomised prospective studies for surgical interventions of the McMaster University in Ontario. It was found that the studies differed in methodological aspects, the most important being the lack of a uniform definition of a pancreatic fistula. The techniques for performing pancreaticogastrostomy and pancreaticojejunostomy were not homogeneous. There were no differences in the percentage of pancreatic fistula in three of these studies; one which modified the pancreaticogastrostomy technique had more favourable results. New comparative studies should use new definitions of the complications of pancreaticoduodenectomy and standardise the pancreatic reconstruction technique.
La pancreaticoduodenectomía (PD) sigue siendo hoy una de las operaciones abdominales de mayor complejidad, que requiere un largo e intenso entrenamiento. El avance en el conocimiento de las técnicas quirúrgicas ha permitido disminuir notablemente la mortalidad a menos del 5%1–3. Sin embargo la morbilidad sigue siendo alta alcanzando cifras del 30 al 50% incluso en centros de alto volumen de casos4–7.
Por esta razón, uno de los focos de mayor atención de los cirujanos actualmente es encontrar la mejor técnica de reconstrucción pancreática8. Clásicamente la pancreaticoyeyunostomía (PY) ha sido la forma de reconstrucción más utilizada, habiéndose publicado diversas variantes, ya sea con técnica de invaginación, con un plano, con doble plano término-terminal (T-T)9–12, o la más utilizada en los hospitales de alto volumen de casos como es la ducto–mucosa término-lateral (T-L)13–18, con uso o no de stents internos o externos19–22. Dentro de esta búsqueda de una técnica que pueda disminuir sensiblemente la morbilidad de esta operación también se ha optado por la utilización del estómago para la restitución de la continuidad pancreática23–31. En la actualidad se han publicado cuatro estudios prospectivos aleatorizados (EPA) que comparan los resultados de la pancreaticogastrostomía (PG) versus la PY32–35. En tres de ellos no se ha logrado demostrar una ventaja de una técnica sobre la otra32–34, y el estudio más reciente ha demostrado un bajo porcentaje de fístula pancreática (FP) y de las complicaciones en general a favor de la PG35, utilizando una nueva técnica que incluye la creación de un segmento gástrico (partición gástrica), parcialmente separado del resto del estómago, uniéndolo al páncreas a través de una conexión ducto-mucosa y uso de stent interno.
El objetivo de este artículo es realizar un análisis crítico de los EPA que comparan las técnicas de reconstrucción pancreaticogástrica y pancreticoyeyunal después de la PD, evaluando los parámetros metodológicos, las técnicas y los resultados presentados en cada trabajo.
Material y métodosSe utilizó como herramienta para el análisis de los cuatro EPA que comparan los resultados de PG versus PY después de PD, publicados en la literatura e identificados a través de una búsqueda sistemática en MEDLINE, un cuestionario elaborado sobre la base de herramientas suministradas por el Centro de Medicina Basada en Evidencias de la Universidad de Oxford (http://www.cebm.net) diseñadas con el objetivo de determinar la validez de los EPA (análisis PICO) y la información aportada por la revisión sistemática para el análisis metodológico de los estudios prospectivos aleatorizados en la evaluación de intervenciones quirúrgicas publicado por la Universidad de McMaster de Ontario, Canadá36. Este análisis se ha realizado con preguntas relevantes para la evaluación de los diversos aspectos metodológicos y de los resultados de cada estudio (tabla 1).
Cuestionario para evaluación crítica de los estudios prospectivos aleatorizados
| Cuestionario (análisis PICOa) |
| ¿Fue el objetivo del estudio suficientemente descrito ? |
| ¿Se estableció satisfactoriamente el criterio para el ingreso de los pacientes en el estudio? |
| ¿Fueron los tratamientos bien definidos? ¿Hubo una detallada descripción de la técnica quirúrgica utilizada y del manejo postoperatorio? |
| ¿Se utilizó la asignación aleatorizada a las intervenciones en evaluación? ¿Qué tan cercano al momento de la intervención fue realizada esta aleatorización? |
| ¿Fue el estudio ciego en algún grado? |
| ¿Hubo un satisfactorio planteamiento de los criterios de medida de los resultados? ¿Se identificó la medida de objetivo primario? |
| ¿Fueron los métodos de análisis de resultados apropiados? |
| ¿Se señaló el cálculo de la muestra necesario para el estudio? |
| ¿Se estableció la duración del período de seguimiento post-tratamiento? |
| ¿Fueron los grupos de tratamiento comparables en los parámetros relevantes? |
| ¿Fue alta la proporción de pacientes que fueron seguidos? |
| ¿Fueron adecuadamente establecidos o referidos todos los procedimientos estadísticos utilizados? |
| ¿Se hicieron análisis adicionales para ver si existían factores pronósticos que influyeran en los resultados obtenidos? |
Yeo et al, y Bassi et al, no explican suficientemente en su objetivo los parámetros que utilizarán para establecer la comparación de las dos técnicas, como sí lo hacen Duffas et al, y Fernández-Cruz et al, aunque en el estudio francés se agrega un objetivo más, el determinar factores de riesgo de morbimortalidad después de PD ajeno a la comparación de las técnicas.
¿Se estableció satisfactoriamente el criterio para el ingreso de los pacientes en el estudio?Yeo y Bassi no especifican ningún criterio para la introducción de los pacientes en el estudio. Sin embargo, este último indica un criterio de selección que no se realizó en el resto de trabajos, que fue el de incluir sólo los pacientes que fueron considerados intraoperatoriamente como portadores de páncreas blandos y con un diámetro de Wirsung menor a 5mm. Duffas et al refieren que se incluyeron los pacientes con tumores pancreáticos benignos o malignos, pancreatitis crónica o tumores extrapancreáticos (ampulares, biliares o duodenales). Así también, Fernández-Cruz et al mencionan que los pacientes fueron sometidos a PD por dolencias benignas y malignas del páncreas y la región periampular.
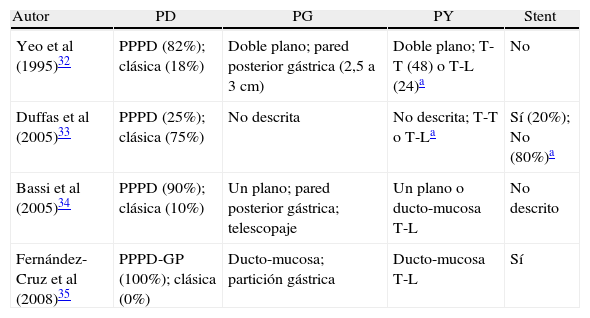
¿Fueron los tratamientos bien definidos? ¿Hubo una detallada descripción de la técnica quirúrgica utilizada y del manejo postoperatorio? (tabla 2)Yeo et al describen la técnica de anastomosis pancreática en doble plano para todos sus pacientes, no dejando claro si el plano interno es ducto-mucosa, pero se asume que por lo menos en la PG no lo fue ya que el tamaño de la gastrotomía posterior fue de 2,5 a 3cm. En el grupo de PY la técnica pierde homogeneidad ya que se dejó a elección del cirujano, siendo la T-T la realizada más frecuentemente (n=48) que la T-L (n=24). En este estudio no se utilizó una técnica estándar para la PD, en cuanto a la preservación pilórica (82%) o no (18%) para ambos grupos, siendo la localización de la PG siempre a 7cm proximal ya sea del píloro o de la línea de sutura cuando se realizó la resección gástrica. Todas las anastomosis hepaticoyeyunales fueron descomprimidas ya fuera con drenaje percutáneo preoperatorio o con tubo en T colocado durante la operación, no precisándose el número, ni las características, ni a qué grupo fue cada uno de los pacientes tratados con una u otra técnica de drenaje biliar. Se utilizaron de dos a cuatro drenajes siliconados con succión cerrada, no precisándose el tiempo en que fueron retirados. En cuanto al uso de medicamentos en el postoperatorio, se indica que el octreótide no se usó profilácticamente en ningún paciente, pero que fue usado postoperatoriamente a discreción del cirujano, no indicando en qué cantidad de pacientes de cada brazo del estudio fue utilizado finalmente. Igualmente se refiere que la «mayoría» de pacientes recibieron lactobionato de eritromicina (200mg IV cada 6h) del día postoperatorio 3 al 10, no explicando en cuántos, y a qué grupos corresponde esa mayoría. Para el control postoperatorio para el diagnóstico de fístula pancreática se tomaron muestras de líquido de los drenajes peripancreáticos entre el día 3.° y el 7.° o se obtuvieron estudios radiológicos contrastados a través del tubo en T o el catéter percutáneo, sin embargo, la definición de fístula utilizado fue de «una fuga detectada radiológicamente o más de 50ml de drenaje de líquido rico en amilasas durante o después del 10.° día postoperatorio». No queda claro si tomaron muestras todos los días postoperatorios indicados o si tomaron una sola muestra entre esos días, ni tampoco si tomaron más muestras a partir del 10.° día que sería la única forma de cumplir con su propia definición, aparte de la demostración radiológica.
Duffas et al diseñan su ensayo en una plataforma multicéntrica en el que participan catorce centros quirúrgicos (8 universitarios y 6 hospitales comunitarios) siendo 8 la mediana de pacientes incluidos por centro (rango 2-27), por lo que aquí se combinan los resultados de PD de centros de muy bajo volumen hasta hospitales de alto volumen de casos, con una variada diversidad de técnicas de reconstrucción pancreática. La PD se realizó de acuerdo a la preferencia de cada cirujano, incluyendo los casos con resecciones combinadas con otros órganos (colon, intestino delgado, confluencia porto-mesentérica, hígado, árbol biliar). La PY se realizó en forma T-T o T-L, se preservó píloro o no, con o sin vagotomía. No se especificó si se utilizó una técnica invaginante, doble o monoplano, o ducto-mucosa, tanto para la PY como para la PG. Los cirujanos fueron libres de elegir si inyectaban goma de fibrina, usaban o no stent, y si realizaban omentoplastía o no. Asimismo se dejó libertad en el criterio para usar o no octreótide. En este estudio no se indica la forma en que se hizo el seguimiento postoperatorio para la detección de las complicaciones, si hubo o no una estrategia sistemática para la detección de amilasas en el líquido por los drenajes perianastomóticos o por estudios radiológicos. Asimismo, se menciona sólo que el uso de drenajes fue recomendado pero al parecer también quedó a criterio del cirujano.
En el estudio de Bassi et al, se describe la técnica de reconstrucción en un solo plano para ambos tipos de anastomosis. En la PG se utilizó la técnica de telescopaje, no precisando a qué nivel se hizo la gastrotomía posterior. En la PY además de la técnica monoplano se realizó la ducto-mucosa, no especificándose en cuántos y en qué grupo de pacientes se llevó a cabo. No hubo tampoco homogeneidad en el uso de la preservación pilórica (tabla 2). Asimismo se indica que en la PY se usaron dos drenajes y en la PG sólo uno, no indicando la razón de ello. Octreótide se usó en forma profiláctica en todos los pacientes una hora antes del procedimiento, especificándose la dosis (0,1mg 3 veces al día por 7 días). No mencionan los métodos de control, detección y seguimiento postoperatorio de las complicaciones. Se realizaron 10 casos consecutivos con reconstrucción PG antes del inicio del estudio como serie de «aprendizaje y homogenización».
Descripción de las técnicas quirúrgicas utilizadas para la anastomosis pancreática
| Autor | PD | PG | PY | Stent |
| Yeo et al (1995)32 | PPPD (82%); clásica (18%) | Doble plano; pared posterior gástrica (2,5 a 3 cm) | Doble plano; T-T (48) o T-L (24)a | No |
| Duffas et al (2005)33 | PPPD (25%); clásica (75%) | No descrita | No descrita; T-T o T-La | Sí (20%); No (80%)a |
| Bassi et al (2005)34 | PPPD (90%); clásica (10%) | Un plano; pared posterior gástrica; telescopaje | Un plano o ducto-mucosa T-L | No descrito |
| Fernández-Cruz et al (2008)35 | PPPD-GP (100%); clásica (0%) | Ducto-mucosa; partición gástrica | Ducto-mucosa T-L | Sí |
Fernández-Cruz et al presentan una detallada descripción con figuras demostrativas de la técnica quirúrgica, no sólo de la nueva técnica que presenta para la PG (partición gástrica), sino también de la PY. Este fue el único estudio que mantuvo una completa homogeneidad en la técnica utilizada tanto para la PG como para la PY. En ambos grupos se realizó el método de conexión tipo ducto-mucosa, con la colocación de stent interno en todos los pacientes. En ambos grupos se completó la PD con preservación pilórica. Esta nueva técnica de partición gástrica se realizó en 10 casos consecutivos antes de iniciar el estudio para demostrar su seguridad y reproducibilidad. Se dejaron dos drenajes siliconados de Jackson-Pratt en todos los casos. Asimismo se detalla el seguimiento postoperatorio, indicando que no se utilizó ni somatostatina ni octreótide profilácticamente en ningún paciente, y que se midió diariamente el volumen por los drenajes y la cantidad de amilasas entre el 3.° y el 7.° día postoperatorio, en congruencia con la definición de consenso de fístula planteada por el International Study Group Pancreatic Fistula (ISGPF)37 (más de 3 veces el valor normal sérico de amilasas durante o después del día 3.° postoperatorio). Precisan el momento en que se retiraron los drenajes, así como los tiempos en que se retiró la sonda nasogástrica y se inició la vía oral. Así también especifica la conducta que se siguió de haberse presentado alguna complicación. Sin embargo, algunos pacientes fueron sometidos a PD con resección vascular venosa, sin especificar cuántos fueron ni a qué grupos pertenecieron.
¿Se utilizó la asignación aleatorizada a las intervenciones en evaluación? ¿Qué tan cercano al momento de la intervención fue realizada esta aleatorización?Yeo et al refieren que la aleatorización se realizó durante el intraoperatorio pero no especifican detalles de la técnica utilizada para ésta.
Duffas et al especifican que la aleatorización fue también intraoperatoria; en el estudio de Bassi et al, sólo se menciona que los pacientes fueron aleatorizados, pero no se especifica cómo ni el momento en que ésta se realizó.
Fernández-Cruz et al utilizaron el método de sobres sellados conteniendo números aleatorizados que asignaban a los pacientes en uno u otro grupo, asumiendo, por lo tanto, que se realizó en forma preoperatoria, ya que no lo menciona.
¿Fue el estudio, ciego en algún grado?Duffas et al indican que las complicaciones postoperatorias fueron evaluadas por un médico que no conocía la reconstrucción realizada en cada paciente.
Bassi y Fernández-Cruz no mencionan ningún intento de diseño de estudio ciego, al igual que el grupo de Baltimore.
¿Hubo un satisfactorio planteamiento de los criterios de medida de los resultados? ¿Se identificó la medida de objetivo primario?Yeo et al definen claramente su objetivo primario, que fue, el porcentaje de fístula pancreática (cuya definición se menciona anteriormente), como medida de resultado más importante para comparar cada técnica de reconstrucción pancreática. Sin embargo, las medidas de resultado secundarias que fueron las demás complicaciones postoperatorias (abdominales y extra-abdominales) así como la estancia hospitalaria postoperatoria, no fueron definidas, excepto el retardo de vaciamiento gástrico, que si fue claramente especificado al pie de la tabla 3 de resultados de este artículo.
Duffas et al establecen como objetivo primario el porcentaje de pacientes con una o más complicaciones intraabdominales (CIA) postoperatorias, diagnosticadas durante el período postoperatorio, especificando este período, como «la estancia hospitalaria total y 30 días después del alta para pacientes hospitalizados por menos de 1 mes». Define los criterios diagnósticos de cada complicación, utilizando una definición de fístula pancreática diferente a Yeo et al («líquido obtenido a través de los drenajes o por aspiración percutánea, con un contenido por lo menos cuatro veces el valor normal sérico de amilasas durante tres días, independientemente del volumen de líquido y del día de aparición, o mediante estudio radiológico») (tabla 3). Sin embargo, sus medidas de objetivos secundarios, las complicaciones extraabdominales (CEA) no las define, no siendo esta medida contemplada en sus objetivos. La definición de gravedad de las CIA sí fue adecuadamente especificada, en donde está incluida la mortalidad.
Diferencias en la definición de fístula pancreática
| Autor | Definición de fístula pancreática |
| Yeo et al | >50ml de líquido rico en amilasa vía drenaje durante o después del 10° día postoperatorio o fracaso de la anastomosis demostrada radiológicamente |
| Bassi et al | Líquido rico en amilasa con significación clínica y confirmación por fistulografía |
| Duffas et al | Bioquímica, clínica y radiográfica |
| Fernández-Cruz et al | Definición de la ISGPF (ver texto) |
Bassi et al se refieren al objetivo primario como, «comparar los 2 grupos de tratamiento sobre la base del desarrollo de complicaciones postoperatorias abdominales únicas o múltiples», sin embargo, cuando señala el análisis estadístico, es más preciso y finalmente plantea el «porcentaje de fístulas pancreáticas (con o sin complicaciones) y el impacto de las complicaciones abdominales de las 2 técnicas», como la medida de resultado primario. Asimismo, incluye una tabla donde se especifican detalladamente las definiciones usadas para cada complicación, utilizando para la de fístula pancreática una definición distinta («cualquier volumen de líquido con significación clínica, rico en amilasas, confirmado por fistulografía»). No define tampoco el concepto de mortalidad intrahospitalaria.
Fernández-Cruz et al plantean dos medidas de objetivo primario que son, el porcentaje y la gravedad de la fístula pancreática, y como medidas de objetivos secundarios, complicaciones postoperatorias en general, estancia hospitalaria y muerte. No precisa concepto de mortalidad pero sí el de estancia hospitalaria. Este es el único estudio que utiliza la definición de consenso para fístula pancreática del ISGPF37 referido previamente, aunque usa para su medida finalmente la modificación propuesta por Reid-Lombardo38 en que las fístula grado A sin significación clínica no son consideradas como complicación. Utiliza además como medida de gravedad del fracaso de la anastomosis pancreática la clasificación propuesta por Strasberg39, para establecer una comparación con la estratificación establecida por el ISGPF (grados A, B y C). Especifica además claramente las definiciones de otras complicaciones (absceso intraabdominal, neumonía, retardo de vaciamiento gástrico), pero no las de fístula biliar, hemorragia abdominal e infección de herida operatoria.
¿Fueron los métodos de análisis de resultados apropiados?Yeo et al identifican claramente este punto y utilizan el porcentaje de FP como medida primaria, y hacen el esfuerzo de relacionar esta complicación con el resto de complicaciones postoperatorias.
Duffas et al plantean a todas las CIA como objetivo primario, quizás no teniendo en cuenta que lo que se evalúa es la técnica de reconstrucción pancreática, y que las complicaciones secundarias al fracaso en la anastomosis biliar (3), colónica (2), gastroyeyunal o yeyunal (5), pudieran no estar relacionadas con el tratamiento (técnica quirúrgica PG o PY) que se están evaluando.
En el estudio de Bassi et al, la definición de fístula pancreática utilizada obliga a que se demuestre esta complicación por fistulografía cuya sensibilidad para su detección no es muy alta, y además debe ser «clínicamente significativa» no precisando claramente a qué se refiere esto.
El estudio del Hospital Clínic de Barcelona utiliza, igual que Yeo et al, el objetivo primario más importante, el porcentaje de FP utilizando una definición de consenso internacional y comparando los resultados aplicando algunas variantes de esta definición. Establece la estratificación en grados de fístula propuesta por la ISGFP.
¿Se señaló el cálculo de la muestra necesario para el estudio?Yeo et al calculan el tamaño de la muestra basados en la premisa de mejorar el porcentaje de FP de 20% a 5%. Duffas et al calculan su muestra con la premisa de disminuir el porcentaje de pacientes con uno o más CIA de 40% a 20%. Bassi et al también hacen el cálculo con la premisa de disminuir el porcentaje de complicaciones (únicas y múltiples) de 25% a 5%. Y Fernández-Cruz et al calculan el tamaño de la muestra basados en estudios previos que usaron similares definiciones de FP, para detectar una diferencia del 20% en el porcentaje de FP.
¿Se estableció la duración del período de seguimiento post-tratamiento?La duración del seguimiento no es expresado en ninguno de los estudios.
¿Fueron los grupos de tratamiento comparables en los parámetros relevantes?En todos los estudios ambos grupos de tratamiento fueron comparables, no se hallaron diferencias significativas en cuanto a características de los pacientes, ni en múltiples parámetros preoperatorios e intraoperatorios analizados.
¿Fue alta la proporción de pacientes que fueron seguidos?Llama la atención que ninguno de los ensayos mencione si hubo o no readmisiones hospitalarias, puesto que, si no las hubo deberían negarse, y especificar el tiempo en que se hizo el seguimiento el cual debe ser un tiempo prudencial en el cual ya no se esperen complicaciones de la operación, mínimo 30 días.
¿Fueron adecuadamente establecidos o referidos todos los procedimientos estadísticos utilizados?Los análisis y pruebas estadísticas fueron adecuadamente descritos y referidos en los cuatro estudios, estableciéndose los intervalos de confianza de 95% para los resultados presentados.
¿Se hicieron análisis adicionales para ver si existían factores pronósticos que influyeran en los resultados obtenidos?Los estudios de Yeo y Duffas hacen un esfuerzo adicional en analizar los factores de riesgo para el desarrollo de fístula pancreática y demás complicaciones, para tratar de explicar los resultados observados. Yeo et al encuentran en su análisis univariado el tiempo operatorio, las transfusiones, la textura blanda del páncreas, la enfermedad ampular o duodenal y el bajo volumen de pacientes por cirujano, como factores de riesgo de FP. En el análisis multivariado, el volumen quirúrgico y la enfermedad ampular o duodenal aparecieron como factores predictores de riesgo.
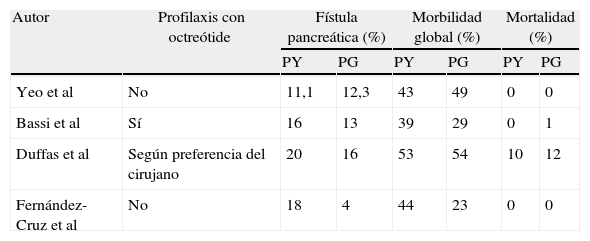
¿Se justificaron las conclusiones descritas de acuerdo al análisis estadístico?Yeo et al concluyen que «sus datos no soportan la hipótesis que la PG es más segura que la PY o que ésta se asocia a una menor incidencia de FP», lo cual es acorde con los resultados del análisis estadístico.
Bassi et al concluyen que «la PG no cambia significativamente el riesgo de complicaciones o la incidencia de FP. Sin embargo, disminuye significativamente el riesgo de complicaciones asociadas, las fístulas biliares, colecciones postoperatorias y el retardo de vaciamiento gástrico cuando se realiza PG».
Duffas et al igualmente concluyen que el tipo de anastomosis pancreatoentérica no influencia de manera estadísticamente significativa el porcentaje de pacientes con una o más CIA, el porcentaje de FP, o la gravedad de las complicaciones.
Fernández-Cruz et al concluyen que el fracaso de la anastomosis pancreática fue significativamente menor con la técnica de PG, en concordancia con su análisis estadístico.
DiscusiónLos EPA en cirugía poseen diversos problemas metodológicos, inherentes a la terapéutica quirúrgica, que ponen en riesgo su validez interna y con ello, su posibilidad de generalización y aplicabilidad (validez externa). Entre los errores más comunes están los sistemáticos o sesgos, que desvían los resultados del estudio de lo que se busca, la verdad, como son, la cuasi-aleatorización (aleatorizar en forma alternada, por día de nacimiento, por día de la semana, por número de historia clínica), la asignación no oculta de los pacientes (moneda al aire, «sobre cerrado», etc.), no utilizar el estudio ciego de los participantes en el estudio, la no aplicación del principio de intención de tratamiento, la falta de seguimiento completo de los pacientes y la exclusión de pacientes postaleatorización36,40–49. También se encuentra la dificultad en elegir y seleccionar adecuadamente las medidas para los análisis de resultado que definirán posteriormente las diferencias o no entre uno u otro tratamiento, así como también un adecuado cálculo de la muestra para finalmente obtener una diferencia clínica y estadística40–50.
En este análisis crítico hemos querido poner de manifiesto que los EPA deben ser interpretados adecuadamente basados en las herramientas disponibles actualmente para ello, puesto que los resultados de estos estudios pudieran también no ajustarse a la realidad (tablas 4 y 5). Los metaanálisis que comparan la PY con la PG51,52 lamentablemente no permiten desmenuzar los detalles metodológicos de diseño de cada estudio, cuya heterogeneidad en muchos aspectos primordiales no permite que la calidad de este tipo de análisis en algunos casos cumplan con el rigor necesario para obtener conclusiones reales50.
Resultados de morbimortalidad postoperatoria de los ensayos prospectivos aleatorizados comparando pancreatogastrostomía versus pancreatoyeyunostomía
| Autor | Profilaxis con octreótide | Fístula pancreática (%) | Morbilidad global (%) | Mortalidad (%) | |||
| PY | PG | PY | PG | PY | PG | ||
| Yeo et al | No | 11,1 | 12,3 | 43 | 49 | 0 | 0 |
| Bassi et al | Sí | 16 | 13 | 39 | 29 | 0 | 1 |
| Duffas et al | Según preferencia del cirujano | 20 | 16 | 53 | 54 | 10 | 12 |
| Fernández-Cruz et al | No | 18 | 4 | 44 | 23 | 0 | 0 |
PG: pancreatogastrostomía; PY: pancreatoyeyunostomía.
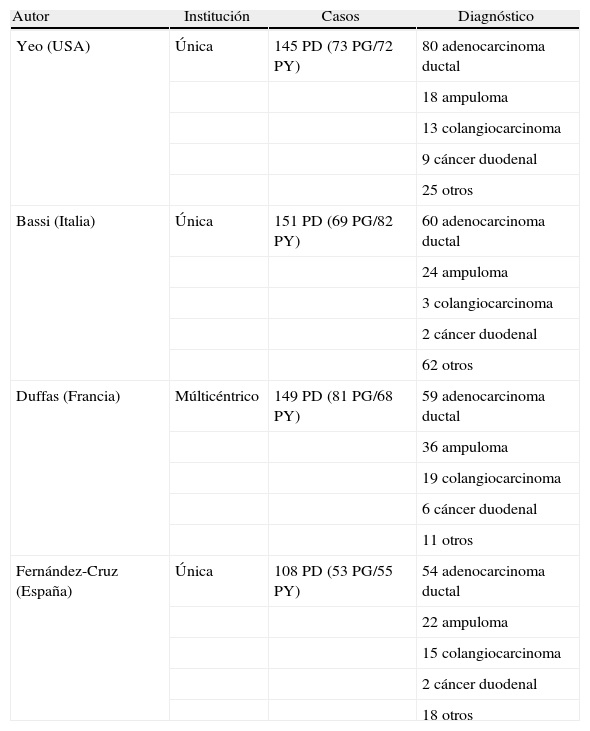
Características de la institución, casos y diagnósticos en cada ensayo
| Autor | Institución | Casos | Diagnóstico |
| Yeo (USA) | Única | 145 PD (73 PG/72 PY) | 80 adenocarcinoma ductal |
| 18 ampuloma | |||
| 13 colangiocarcinoma | |||
| 9 cáncer duodenal | |||
| 25 otros | |||
| Bassi (Italia) | Única | 151 PD (69 PG/82 PY) | 60 adenocarcinoma ductal |
| 24 ampuloma | |||
| 3 colangiocarcinoma | |||
| 2 cáncer duodenal | |||
| 62 otros | |||
| Duffas (Francia) | Múlticéntrico | 149 PD (81 PG/68 PY) | 59 adenocarcinoma ductal |
| 36 ampuloma | |||
| 19 colangiocarcinoma | |||
| 6 cáncer duodenal | |||
| 11 otros | |||
| Fernández-Cruz (España) | Única | 108 PD (53 PG/55 PY) | 54 adenocarcinoma ductal |
| 22 ampuloma | |||
| 15 colangiocarcinoma | |||
| 2 cáncer duodenal | |||
| 18 otros |
Los cuatro ensayos aquí analizados difieren en aspectos metodológicos. El más importante es el relacionado con la definición de fístula pancreática, complicación que como objetivo primario en el análisis de los resultados se relaciona directamente con las técnicas de reconstrucción pancreática. Sin una definición de FP uniforme se hace muy difícil la comparación de los diferentes estudios con objetivos similares. Es por esta razón que ya en el año 2005 el ISGPF37 publicó la definición de consenso que tan solo utilizan Fernández-Cruz et al en su estudio. Cabe apuntar, sin embargo, que los otros tres estudios publicaron sus resultados antes de la aparición de los resultados de la conferencia de consenso. A esta razón de la ausencia de definición uniforme de FP en los estudios realizados hay que sumar que el número, funcionamiento y medición del contenido de amilasa en el líquido de los drenajes no está claramente especificado en la mayoría de los trabajos. Creemos que el contenido de amilasa en los líquidos de drenaje debería hacerse de forma sistemática y de la misma forma en todos los pacientes independientemente de la presencia o no de síntomas, y por supuesto desde el 3er día del postoperatorio como mínimo. La discusión de si una FP definida bioquímicamente según el ISGFP sin repercusión clínica (grado A) deba considerarse una complicación38,39, debería ser definido claramente durante la fase del diseño del estudio. Es también importante dejar en claro que el análisis de los objetivos secundarios deberá estar estrechamente relacionado con el fracaso de la anastomosis pancreática, así como las complicaciones derivadas de ésta, como el absceso intraabdominal, la infección de la herida operatoria, la hemorragia postoperatoria, la neumonía, y posiblemente el retardo de vaciamiento gástrico. También está en relación directa la mortalidad, la estancia hospitalaria, las reintervenciones, las readmisiones hospitalarias y los costos39. Es llamativo que no se hayan incluido estas últimas medidas en el análisis de los resultados en la mayoría de los trabajos analizados. Así tampoco se definió el período de seguimiento considerado para la detección de las complicaciones relacionadas al procedimiento, y que muchas veces se detectan después del alta hospitalaria de los pacientes y que obligan a una nueva hospitalización.
No cabe la menor duda de que por más que nos esforcemos en querer homogeneizar y colocar todos los estudios en un solo «costal» para metaanalizarlos, el análisis crítico de cada uno de ellos por separado tiene una importancia capital. Como ejemplo, las técnicas quirúrgicas incluidas en los cuatro estudios difieren tanto para la PG como para la PY (tabla 2). Entre las diferencias metodológicas entre los cuatro estudios analizados también destaca que en un estudio sólo incluye pacientes con riesgo de FP, que en algunos estudios se utilizaran determinados medicamentos (octreótide, eritromicina), que se use o no stent a preferencia del cirujano, etc. Entre los estudios analizados los centros hospitalarios realizaban un volumen alto de PD, pero en el estudio francés participaron centros con menor volumen (menos de 10 pacientes por año). Las técnicas de aleatorización, en algunos estudios, no fueron tampoco claramente mencionadas. Así también, el estudio ciego, no se menciona en la mayoría de trabajos, quedando la impresión de que no se hizo el mayor esfuerzo para incluir esta importante medida y evitar el error metodológico sistemático36.
Por lo tanto, tenemos a la actualidad estos cuatro EPA que intentan demostrar si una técnica de reconstrucción pancreática, la PY o la PG, disminuye el porcentaje de FP después de PD y con esto el impacto global de esta complicación. Uno de ellos demuestra un claro beneficio, con una variante nueva de la técnica de PG, mientras que los otros tres no logran evidenciar diferencias estadísticamente significativas entre estas dos intervenciones. Quedan las preguntas ¿el problema está resuelto?, ¿deberemos hacer la PY, o la PG?, ¿debemos seguir buscando encontrar la técnica que conlleve menor morbimortalidad? Si utilizamos la PY, ¿haremos la término-lateral en un plano, dos planos o ducto-mucosa? Si es la PG la preferencia, ¿cuál será la elección?, ¿la anastomosis ducto-mucosa, el telescopaje o la partición gástrica?
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.