El linfoma mamario es una rara enfermedad que ocupa el 0,5% de los tumores malignos de mama1, puede ser primario cuando se presenta solo en esta localización (incluyendo cadenas ganglionares axilares ipsilaterales), en ausencia de enfermedad previa extramamaria o secundario cuando forma parte de una afectación variada de tejido linfoide extraganglionar, siendo la mama un sitio de aparición infrecuente que ocupa solo entre el 1,7 al 2,2% de los casos1,2. Las características clínicas y radiológicas tan poco específicas de la tumoración lo pueden confundir con un carcinoma de mama retrasándose su correcto tratamiento3. Presentamos un caso de linfoma no Hodgkin (LNH) primario de mama que deriva en necrosis extensa de la misma y grave afectación multiorgánica, describiendo las características clínicas y radiológicas especiales del mismo y revisando la literatura disponible sobre el tema.
Paciente mujer de 57 años, natural de Perú diagnosticada hace 2 años de LNH de células T, por biopsia de adenopatías axilares palpables asociado a inflamación en mama derecha, recibiendo tratamiento con ciclofosfamida, doxorrubicina, vincristina y prednisona (CHOEP). Un año después presenta empeoramiento clínico con lesiones cutáneas en piel de la mama e infiltración linfocitaria de la misma, por lo que se decide administrar 3 esquemas más de poliquimioterapia (gemcitabina-cisplatino-dexametasona, dexametasona-citarabina-cisplatino (DHAP) e hiper-CVAD-metotrexato-ARA-C) sin buena respuesta. Decide trasladarse a España donde es valorada por el servicio de hematología, observándose lesiones vesiculosas y costras melicéricas con aumento de dolor e inflamación en mama derecha que se extiende hasta brazo y abdomen, inicialmente se intenta controlar con prednisona e hidroxiurea sin mejoría, por lo que es ingresada para completar estudios.
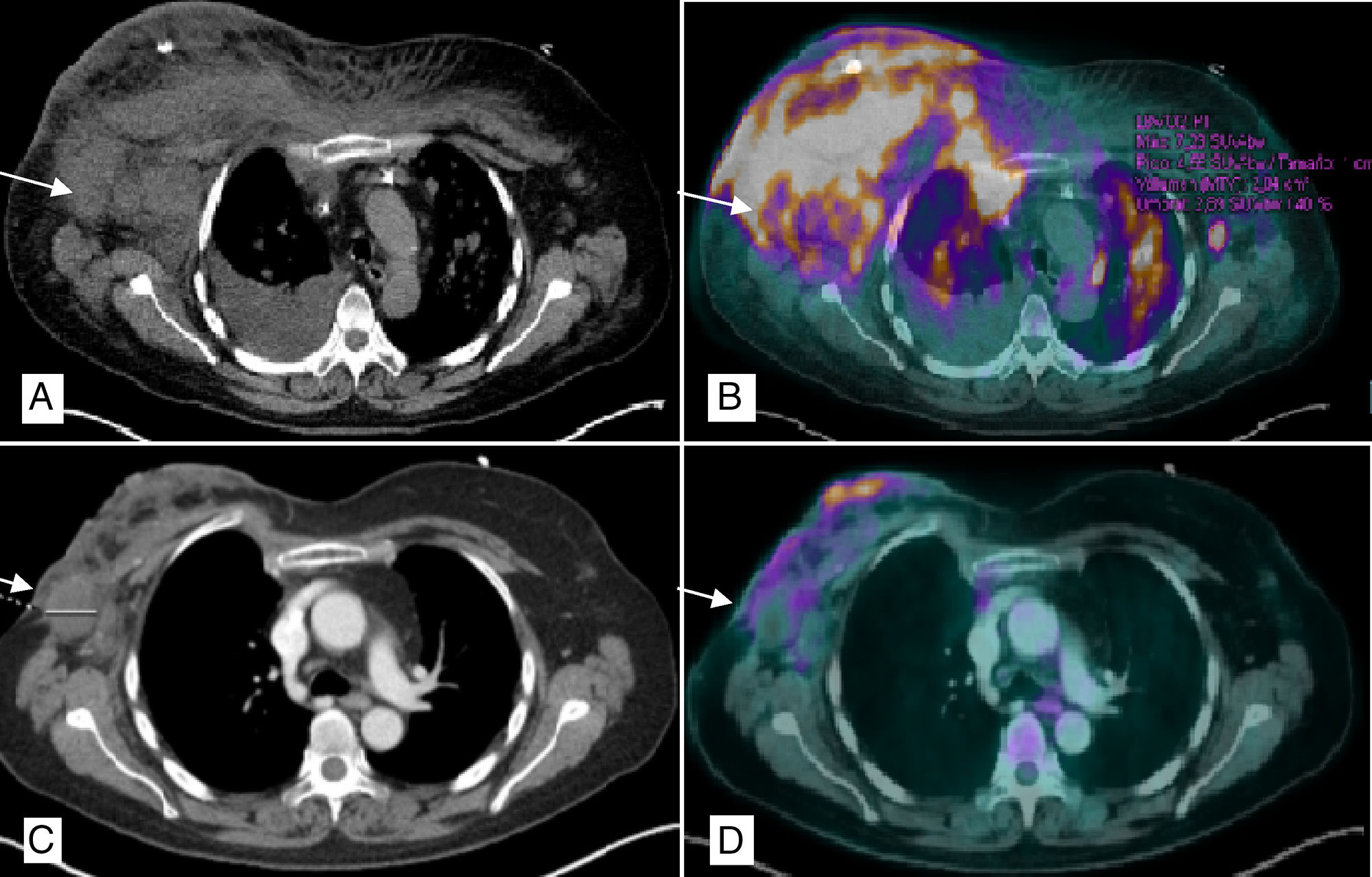
Se realiza biopsia de lesiones de mama que evidencian espongiosis epidérmica con células pequeñas de núcleos irregulares, escaso citoplasma y positividad predominantemente CD4 compatible con LNH de células T CD30+ (HTLV−). En PET/TAC (figs. 1A y B) se evidencia afectación subcutánea en ambas mamas, múltiples adenopatías supra e infradiafragmáticas, esplénicas y pulmonares en relación con el síndrome linfoproliferativo en progresión. Se decide iniciar tratamiento paliativo (metilprednisolona, ciclofosfamida, etopósido y procarbazina) con excelente respuesta, por lo que se decide alta hasta recuperación hematológica. Dos meses después suspende tratamiento por neutropenia febril y acude a urgencias con sobreinfección del tejido mamario y necrosis completa de la misma (fig. 2A).
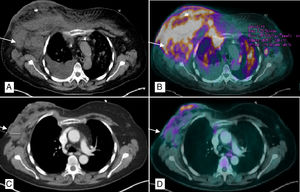
PET/TAC tórax. A) Múltiples adenopatías axilares bilaterales, la mayor derecha de 4cm (flecha), con afectación subcutánea de ambas mamas con predominio derecho y derrame pleural ipsilateral. B) Captación patológica de 18F-FDG (fluorodeoxiglucosa) en mama derecha, izquierda, cisura menor derecha y parénquima pulmonar bilateral (nódulos milimétricos) en relación con la infiltración linfomatosa. C) Disminución en el tamaño global de mama derecha con burbujas de aire en su interior en relación con la necrosis y la reducción de adenopatías axilares, la mayor derecha de 2,9cm. D) Mejoría morfo-metabólica de la afectación adenopática, pulmonar y en tejido celular subcutáneo sugerente de buena respuesta al tratamiento.
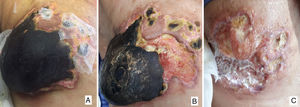
A) Necrosis mamaria derecha completa tras 2 meses de inicio del tratamiento paliativo. B) Acto quirúrgico un mes después, delimitación de la necrosis con desprendimiento casi completo de la glándula. C) Quince días del postoperatorio, buena evolución de la herida quirúrgica con tejido de granulación y ausencia de nuevas lesiones.
Se ingresa y tras recuperación hematológica, reinicia esquema presentando mejoría radiológica (figs. 1C y D) y delimitación de la necrosis decidiéndose mastectomía higiénica para mejorar el control local de los síntomas. Durante la cirugía se observa desprendimiento casi completo de la glándula, de consistencia pétrea por la necrosis y con material purulento en su interior (fig. 2B). Se realiza mastectomía simple con extirpación parcial del pectoral mayor y menor en algunas zonas más afectadas por la necrosis, eliminándose a su vez varias lesiones en región esternal y descartándose una reconstrucción inmediata debido al proceso infeccioso y al difícil control sistémico de la enfermedad.
En planta continua con curas locales de buena evolución (fig. 2C) y en anatomía patológica definitiva se observa parénquima mamario extensamente necrótico con calcificaciones, donde no se puede identificar tumor viable. Actualmente 2 meses después de la cirugía, ha reiniciado el tratamiento paliativo anterior sin nuevas complicaciones y a nivel local las heridas han cicatrizado adecuadamente por segunda intención, evidenciándose nuevas lesiones malignas en región torácica dorsal, por lo que el pronóstico sigue siendo desfavorable.
El linfoma mamario es una entidad poco frecuente que se presenta en mujeres de entre 60 a 65 años, siendo bilateral solo en un 11% de los casos4. Clínicamente se puede observar de diferentes maneras, desde un nódulo sólido, hasta un engrosamiento difuso con o sin adenopatías; lo más frecuente (60% de los casos) es que comience como una masa dolorosa de difícil distinción a un carcinoma, que en ocasiones puede estar ulcerada o presentarse como enfermedad de Paget en el pezón5. El diagnóstico radiológico es poco específico, la imagen ecográfica simula la de un carcinoma y solo en la mamografía, la ausencia de microcalcificaciones podría ser un signo distintivo con otros tumores. Además, la resonancia magnética evidencia un foco de captación único o múltiple hiperintenso en las secuencias con contraste, que tampoco sería específico para este tipo de tumores6.
El diagnóstico definitivo se obtiene mediante una biopsia con aguja gruesa o en el contexto de una resección quirúrgica conservadora, observando la presencia de células neoplásicas de predominio linfoide que varía de acuerdo con el tipo histológico, siendo el más frecuente el LNH difuso de células grandes (60-75%)5,7. El tipo de LNH periférico de células T de nuestro caso, es un tipo menos común de tumor que se asocia al virus linfotrópico de células T humanas (HTLV), sobre todo en países orientales y del Caribe. La sobreexpresión de CD30 es aun más rara, siendo un factor de mejor pronóstico en comparación a las que no lo presentan7,8. Con mayor agresividad y una supervivencia media de 4 años, en estos casos el diagnóstico precoz es fundamental para la elección de un buen tratamiento9.
Según el estadio de la enfermedad podemos optar por una biopsia escisional, asociado a radioterapia y quimioterapia (estadios iniciales de bajo grado) o un tratamiento sistémico con poliquimioterapia (estadios avanzados de alto grado), dejando la cirugía limitada a casos que requieran control local de los síntomas5,10. La mastectomía no ofrece beneficios frente a la cirugía conservadora siendo el estadio de la axila pronóstica y fundamental para la elección de radioterapia o quimioterapia posterior5,10,11. Cuando se presenta como una tumoración complicada, como en nuestro caso la mastectomía estaría indicada para disminuir el dolor, la infección y la carga tumoral, ofreciendo una técnica de reconstrucción diferida al establecerse un control sistémico de la enfermedad preferiblemente con el uso de tejidos autólogos10,12.
El esquema CHOP con o sin rituximab es la poliquimioterapia más utilizada ofreciendo los mejores resultados, asociado posteriormente a radioterapia, ambos factores disminuyen las tasas de recaídas locales1,11. En cuanto al pronóstico, existen factores conocidos que determinan el riesgo de recidiva, siendo de alto riesgo los pacientes mayores de 60 años, con peor estado general basal, que presenten enfermedad en 2 o más sitios extraganglionares y con estadios avanzados en su comienzo3.
Aunque se conocen bien las características especiales de estos tumores, su localización en la mama sigue siendo excepcional. La refractariedad en el tratamiento, el tipo histológico y las graves secuelas observadas en la glándula de nuestro caso lo hacen especial y no reportado anteriormente en la literatura. Aunque el tratamiento en el linfoma mamario es similar al que se presenta en otras localizaciones, continúa existiendo controversias sobre el papel de la cirugía y serán series más amplias las que nos determinen si su uso es necesario o se debe dejar solo para casos excepcionales.