La infección del sitio quirúrgico (ISQ) se asocia a prolongación de la estancia hospitalaria, aumento de la morbimortalidad y gasto sanitario. La adherencia a paquetes sistematizados de medidas de prevención consigue disminuir la tasa de infección. Se presenta un análisis crítico de las medidas de profilaxis de la ISQ en cirugía abdominal. Cuentan con mayor grado de evidencia: no eliminación del vello del campo quirúrgico, descontaminación de la piel con soluciones alcohólicas antisépticas, aplicación correcta de la profilaxis antibiótica sistémica (inicio 30-60 min antes de la incisión, uso preferente de cefalosporinas de 1.ª y 2.ª generación en monodosis, ajuste de la dosis con relación al peso y a la función renal, administración de dosis intraoperatoria en hemorragia > 1.500ml o duración > 2 veces la vida media del antibiótico), mantenimiento de la normotermia, control de la glucemia perioperatoria, limitación de las transfusiones sanguíneas y restricción del aporte intravenoso intraoperatorio.
Surgical site infection (SSI) is associated with prolonged hospital stay, increased morbidity, mortality and sanitary costs, and reduced patients quality of life. Many hospitals have adopted guidelines of scientifically-validated processes for prevention of surgical site and central-line catheter infections and sepsis. Most of these guidelines have resulted in an improvement in postoperative results. A review of the best available evidence on these measures in abdominal surgery is presented. The best measures are: avoidance of hair removal from the surgical field, skin decontamination with alcoholic antiseptic, correct use of antibiotic prophylaxis (administration within 30-60min before incision, use of 1st or 2nd generation cephalosporins, single preoperative dosis, dosage adjustments based on body weight and renal function, intraoperative re-dosing if the duration of the procedure exceeds 2 half-lives of the drug or there is excessive blood loss), prevention of hypothermia, control of perioperative glucose levels, avoid blood transfusion and restrict intraoperative liquid infusion.
La infección del sitio quirúrgico (ISQ) es una de las complicaciones más frecuentes en cirugía abdominal. Se asocia a prolongación de la estancia hospitalaria, disminución de la calidad de vida y aumento de la morbimortalidad y del coste1,2. La variabilidad de la incidencia de ISQ publicada depende, entre otros factores, de la definición de ISQ3,4. Los centers for disease control (CDC) definen la ISQ como la infección que ocurre en la incisión quirúrgica o cerca de ella, durante los primeros 30 días, o hasta un año, si se ha dejado un implante5. La ISQ aparece cuando el inóculo bacteriano supera la capacidad del sistema inmune de controlarlo. La contaminación en la cirugía abdominal proviene de la piel o de los órganos diana sobre los que se está actuando6,7.
Los determinantes de la infección son el cirujano, el patógeno y el paciente. El cirujano es el principal modulador de la infección quirúrgica. Su experiencia y agilidad pueden reducir el inóculo a dimensiones controlables por las defensas del organismo. Un correcto acto quirúrgico comprende un manejo cuidadoso de los tejidos, una buena hemostasia, no prolongar innecesariamente el tiempo quirúrgico y minimizar la extravasación de contenido intraluminal. Los factores dependientes del paciente incluyen las comorbilidades, la obesidad, el hábito tabáquico y la edad avanzada. Durante las últimas décadas no ha cambiado el patrón de los organismos causantes de la infección, pero sí el porcentaje de bacterias con resistencia a los antibióticos3,4,8.
El cirujano dispone de medidas farmacológicas y no farmacológicas para reducir la contaminación bacteriana del campo quirúrgico y la incidencia de ISQ. El objetivo de esta revisión es actualizar la mejor evidencia disponible sobre las medidas de prevención de la ISQ en cirugía abdominal.
Ducha preoperatoriaLa ducha preoperatoria con clorhexidina ha demostrado la mayor reducción de la contaminación bacteriana en la piel9,10. Sin embargo, varios metaanálisis no han conseguido correlacionar esta reducción en la colonización con una menor incidencia de ISQ11,12. Aunque la ducha preoperatoria es una práctica recomendable, no existen diferencias cuando se compara agua y jabón con soluciones antisépticas.
Por el contrario, en los portadores nasales de Staphylococcus aureus resistente a meticilina (SARM), se recomienda la descontaminación nasal con clorhexidina o pomada de mupirocina asociada a la ducha con clorhexidina, con lo que se consigue reducir la carga bacteriana y disminuir el riesgo de infección13,14.
Eliminación del velloHistóricamente se ha eliminado el vello de la piel periincisional por diversos medios (depilación, afeitado, rasurado). La menor tasa de infección se obtiene cuando no se corta el vello. Cuando su eliminación se crea conveniente, el corte con maquinilla eléctrica con cabezal recambiable produce menor infección que el afeitado15, debiéndose realizar pocas horas antes del inicio de la intervención y vigilando no lesionar la piel14.
Descontaminación de la piel del campo quirúrgicoLos alcoholes son los agentes microbiológicamente más activos para la desinfección, pero su efecto antimicrobiano desaparece en pocos minutos, son inflamables y están contraindicados en las mucosas, por lo que prácticamente se había abandonado su uso para preparación quirúrgica. Los antisépticos como el gluconato de clorhexidina (GC) y la povidona yodada (PY) son menos activos que el alcohol, pero tienen mayor efecto residual. Ambos se pueden encontrar en soluciones acuosas o alcohólicas, siendo las últimas más eficaces que GC y PV solos. A pesar de estudios recientes16,17, el debate sobre el antiséptico más eficaz sigue abierto. Una revisión sistemática recuerda el importante papel del alcohol asociado a antisépticos y señala que la mayoría de estudios comparan 2 agentes (alcohol y GC) contra uno (PY)18, atribuyendo la eficacia de la clorhexidina alcohólica a la clorhexidina sola. Se recomienda la desinfección solo con alcohol para la extracción de hemocultivos19 y con CG-alcohol para la inserción de catéteres venosos20. Sin embargo, para la cirugía abdominal la cuestión de CG-alcohol contra PY-alcohol no está resuelta.
Cualquier antiséptico debe actuar durante 2-3 min y debe dejarse secar antes de colocar los paños quirúrgicos. Los alcohólicos deben ser de baja concentración y se deben dejar evaporar para disminuir el riesgo de quemadura con el uso del bisturí eléctrico14,17,21.
Protectores de la heridaLos protectores de los bordes de la herida quirúrgica protegen la pared abdominal de desecación, traumatismos y contaminación. Se ha demostrado la reducción en el inóculo de la herida al final de la intervención con su uso, aunque, según el tipo utilizado, no siempre se correlaciona con menor incidencia de ISQ. Las compresas y tallas de algodón mojadas son permeables a las bacterias en pocos minutos. En cambio, un metaanálisis concluye que los protectores plásticos disminuyen la ISQ en cirugía abdominal. El efecto de la barrera plástica aumenta en paralelo al grado de contaminación de la cirugía22.
Los plásticos adhesivos sobre el campo quirúrgico intentan minimizar la contaminación de la herida con gérmenes cutáneos. Una revisión Cochrane no halla evidencia a favor de la reducción de la ISQ con su uso; al contrario, halla alguna evidencia de que la incrementa23.
Incisión de la pielLa incisión de la piel con bisturí eléctrico aumenta significativamente el riesgo de infección, por lo que debe utilizarse el bisturí frío para la incisión dérmica. En caso de sangrado de los márgenes, el electrocauterio se debe utilizar de forma selectiva sobre los puntos hemorrágicos24.
Sutura aponeuróticaLos monofilamentos son menos propensos a contaminarse que los trenzados. En los últimos, la bacterias consiguen mayor adherencia y la capacidad fagocítica de las células del huésped disminuye. Las suturas continuas se asocian a menor riesgo de infección que las interrumpidas, posiblemente por una distribución más homogénea de la tensión sobre los tejidos y por la menor cantidad de cuerpo extraño en la herida25. Los materiales de sutura impregnados con sustancias antibacterianas consiguen una reducción de la concentración bacteriana en la herida26,27. Algunos estudios sugieren que las suturas impregnadas con triclosan reducen la ISQ incisional y órgano-cavitaria27,28, aunque se precisan análisis independientes con más poder estadístico para recomendar su utilización rutinaria.
Sutura primaria diferida de la heridaLa sutura primaria diferida de la herida es válida para un grupo seleccionado de cirugía altamente contaminada14,29. Para ello se deja la herida abierta con compresas impregnadas en suero y se aproximan los márgenes cuando el aspecto del tejido es correcto30. Un estudio aleatorizado en cirugía abdominal sucia mostró una tasa de ISQ del 42,5% con cierre primario, contra un 2,7% con sutura primaria diferida30.
Drenajes intraabdominalesEn cirugía electiva, los objetivos de un drenaje son eliminar el exceso de fluidos de una cavidad y el control de una anastomosis. Ambos aspectos han sido cuestionados y existe numerosa evidencia que pone en duda su utilidad o demuestra un efecto negativo del drenaje en cirugía abdominal (cirugía de colon, colecistectomía, hepatectomía, gastrectomía) y extraabdominal (tiroides, hernioplastia). Se deben evitar los drenajes, pero en caso de utilizarlos deben ser cerrados, unidireccionales y aspirativos14,31,32.
Profilaxis tópicaAunque no concluyentes, existen evidencias a favor de la irrigación del sitio quirúrgico con soluciones antibióticas asociada a la profilaxis sistémica, sugiriendo un efecto aditivo33–35. La mayoría de estos estudios son en peritonitis experimental, mostrando reducciones de ISQ y mortalidad de hasta el 65%36. Sin embargo, los estudios clínicos no confirman estos beneficios37, debido a diferencias en el tiempo de evolución y el tamaño del inóculo entre las condiciones clínicas y experimentales. Se ha demostrado la efectividad de la irrigación profiláctica de la cavidad abdominal con gentamicina y clindamicina en cirugía colorrectal electiva, disminuyendo las tasas de ISQ38. Faltan más estudios que confirmen estos hallazgos y el agente más adecuado.
Los antibióticos tópicos de liberación retardada muestran resultados controvertidos. Modelos animales hallan reducción de la ISQ con efectos aditivos a la antibioterapia sistémica39. En cirugía colorrectal, las de esponjas subcutáneas de colágeno con gentamicina obtienen una reducción significativa de la ISQ40. Sin embargo, otros autores no han podido reproducir estos beneficios e incluso hallan un aumento de ISQ, justificándolo por la corta vida media de la gentamicina y el efecto cuerpo extraño de la esponja41.
La irrigación de la cavidad abdominal con soluciones antisépticas, como PY o clorhexidina, no ha mostrado eficacia y se asocia a la aparición de efectos adversos como mesenteritis esclerosante42,43.
La pomada de mupirocina disminuye las complicaciones asociadas a accesos venosos centrales en pacientes en hemodiálisis no portadores del SARM y podría ser válida en profilaxis de la infección en cirugía abdominal, pero esta hipótesis debe ser comprobada44.
En cirugía colorrectal, los apósitos de carboximetilcelulosa con plata podrían tener un efecto sobre la ISQ incisional superficial45, pero no en la ISQ incisional profunda o de órgano-espacio.
Preparación mecánica del colon en cirugía colorrectalLa preparación mecánica del colon (PMC) con soluciones evacuantes pretende disminuir las complicaciones infecciosas y la dehiscencia anastomótica postoperatorias46. La evidencia actual sugiere que la PMC no reduce la tasa de complicaciones, incluyendo el fallo anastomótico47–50. Algunos autores refieren un aumento de complicaciones asociadas a PMC, como trastornos hidroelectrolíticos, convulsiones o rotura espontánea de esófago51. Ante estas evidencias, muchos grupos de cirugía colorrectal han abandonado la PMC52 y con ella, lamentablemente, la profilaxis antibiótica oral.
Profilaxis antibiótica oral en cirugía colorrectalDiversos metaanálisis han demostrado que la combinación de profilaxis antibiótica intravenosa y oral reduce hasta en un 26% el riesgo de ISQ cuando se compara con la profilaxis intravenosa aislada53,54. Esta práctica podría tener poco sentido en ausencia de PMC ante el elevado inóculo bacteriano en un colon lleno de heces. No obstante, no existen trabajos que describan el efecto de la antibioterapia oral en ausencia de PMC. Las combinaciones antibióticas orales más utilizadas son: neomicina más eritromicina o metronidazol o kanamicina más eritromicina o metronidazol55.
Profilaxis antibiótica sistémicaLa profilaxis antibiótica debe conseguir niveles de antibiótico en los tejidos por encima de la concentración mínima inhibitoria de los gérmenes antes de que estos contaminen el sitio quirúrgico. Por ello se debe administrar dentro de los 30 min previos al inicio de la intervención56. En general, la profilaxis no está indicada en cirugía limpia, por un riesgo de ISQ menor del 2%14,56. No obstante, los últimos metaanálisis sobre profilaxis en herniorrafia muestran un efecto protector del antibiótico, en especial en hernioplastia57,58. En cirugía de mama también se recomienda la profilaxis antibiótica59. En cirugía colorrectal, la administración combinada de antibióticos frente a patógenos aerobios y anaerobios la reduce en un 59%14.
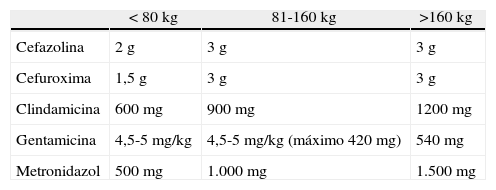
La obesidad y la insuficiencia renal obligan a modificar la dosificación de los antibióticos profilácticos. Alexander et al.14 establecieron un punto de corte de 80 kg para modificar la dosis (tabla 1). La mayoría de antibióticos se eliminan por vía renal, por lo que en insuficiencia renal se deberá ajustar la dosis según el aclaramiento de creatinina60.
Dosis preoperatorias recomendadas de antibióticos profilácticos
| < 80 kg | 81-160 kg | >160 kg | |
| Cefazolina | 2 g | 3 g | 3 g |
| Cefuroxima | 1,5 g | 3 g | 3 g |
| Clindamicina | 600 mg | 900 mg | 1200 mg |
| Gentamicina | 4,5-5 mg/kg | 4,5-5 mg/kg (máximo 420 mg) | 540 mg |
| Metronidazol | 500 mg | 1.000 mg | 1.500 mg |
Fuente: Tomada de Bibbo et al.16
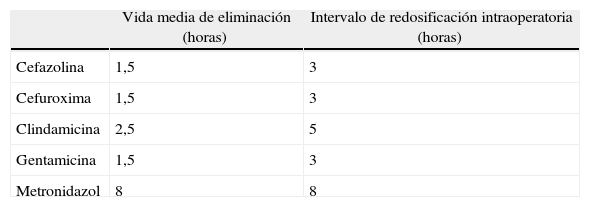
Una única dosis de antibiótico profiláctico es tan efectiva como múltiples dosis61,62. Un uso prolongado de antibioterapia, no solo no aporta beneficios, sino que aumenta el riesgo de desarrollo de resistencias63. Es más importante la redosificación intraoperatoria que la prolongación de la profilaxis tras la intervención. Las indicaciones de redosificación son la pérdida sanguínea superior a 1.500ml y la prolongación de la operación más de 2 veces la vida media del antibiótico14,55 (tabla 2). Cuando el aclaramiento de creatinina es inferior a 50ml/min, el intervalo de redosificación debe ser el doble del establecido para un paciente con función renal normal, mientras que cuando es inferior a 20ml/min, el intervalo de tiempo debe cuadruplicarse14.
Vida media de eliminación y recomendaciones de redosificación en los antibióticos más empleados en la profilaxis sistémica
| Vida media de eliminación (horas) | Intervalo de redosificación intraoperatoria (horas) | |
| Cefazolina | 1,5 | 3 |
| Cefuroxima | 1,5 | 3 |
| Clindamicina | 2,5 | 5 |
| Gentamicina | 1,5 | 3 |
| Metronidazol | 8 | 8 |
Es importante valorar los patrones locales de sensibilidad bacteriana para elegir el antibiótico apropiado. Conocemos los puntos de corte de concentración inhibitoria mínima (CMI) a partir de los cuales se considera a una bacteria resistente, pero no existe consenso sobre «el porcentaje de corte» de cepas resistentes a partir del cual consideramos un antibiótico ineficaz para profilaxis55. Los antibióticos usados en profilaxis deben ser distintos de los utilizados en tratamiento (tabla 3). Ello coloca las cefalosporinas de 1.ª y 2.ª generación como fármacos ideales14,64,65. Se han propuesto fármacos de amplio espectro en profilaxis de cirugía de alto riesgo. Itani et al.4 analizaron ertapenem en cirugía colorrectal, demostrando menor incidencia de ISQ comparado con cefotetán. Esta recomendación ha sido discutida, argumentando que el uso de fármacos de amplio espectro puede aumentar las resistencias y la colonización por Clostridium difficile66. A pesar de ello, diversas guías clínicas lo incluyen como alternativa en cirugía colorrectal electiva14,67.
Antibióticos recomendados para la profilaxis sistémica
| Tipo de intervención | Antibioterapia de elección | Alérgicos a betalactámicos |
| Cirugía general/cirugía limpia | Cefazolina o cefuroxima | Clindamicina + aminoglucósido |
| Esofago-gástrica y hepatobiliopancreática | Cefazolina o cefuroxima o amoxicilina-clavulánico | Clindamicina + aminoglucósido |
| Colorrectal | Cefazolina/cefuroxima + metronidazol o metronidazol + aminoglucósido o amoxicilina-clavulánico | Metronidazol + aminoglucósido |
Los antibióticos más recomendados en cirugía esófago-gástrica y hepatobiliar son cefalosporinas de 1.ª-2.ª generación y amoxicilina-clavulánico. En algunas regiones españolas se puede argumentar contra la profilaxis con amoxicilina-clavulánico, dadas las altas tasas de resistencia de Escherichia coli de origen no urológico, que alcanzan el 25%68. Las cefalosporinas de 3.ª y 4.ª generación también son efectivas, pero no se recomiendan debido a su coste y a su relación con la aparición de SARM y enterobacterias-BLEE. En pacientes alérgicos a betalactámicos, puede optarse por la combinación de vancomicina o clindamicina con un aminoglucósido14,55,64.
En cirugía colorrectal son recomendables las combinaciones de metronidazol con cefalosporina de 1.ª-2.ª generación (cefuroxima/cefotetán) o con gentamicina. Amoxicilina-clavulánico puede utilizarse en función del patrón local de resistencias. En pacientes alérgicos, clindamicina no es recomendable por la tasa de Bacteroides fragilis resistentes y se debe optar por metronidazol. El uso de aminoglucósidos puede ser controvertido, aunque son agentes muy eficaces frente a bacilos gramnegativos y en especial Pseudomonas aeruginosa69. Debido a la corta vida media de la gentamicina (1,5 h) se recomienda 4,5-5mg/kg en monodosis, con un riesgo de toxicidad muy bajo. Otro inconveniente es su espectro antimicrobiano, ya que la combinación de metronidazol más aminoglucósido no cubre microorganismos grampositivos, lo que puede explicar que en el 27% de las ISQ que se producen tras cirugía colorrectal electiva estén implicados Streptococcus spp.36.
Temperatura corporalLa hipotermia moderada (34-36°C) se asocia con diversos efectos adversos, como coagulopatías, que derivan en una mayor pérdida de sangre y pueden aumentar la necesidad de transfusión sanguínea70. La hipotermia también se ha asociado a una recuperación anestésica prolongada71, aumento de la estancia hospitalaria72 e ISQ73. En cirugía colorrectal se ha comprobado que la hipotermia triplica el riesgo de infección de herida74 y en cirugía limpia se multiplica hasta por 675. La explicación más aceptada es la vasoconstricción causada por la hipotermia, que reduce el flujo sanguíneo al tejido celular subcutáneo y la tensión de oxígeno72,73,76. La hipotermia afecta a la inmunidad celular y humoral, así como a su regulación mediada por citocinas77. Algunos estudios defienden que la hipertermia hasta 40°C puede ser más beneficiosa, basándose en el mecanismo de la fiebre como potenciador de los mecanismos defensivos del organismo77,78. No obstante, hacen falta estudios que confirmen estos resultados. Los mecanismos para mantener la temperatura corporal deben ser sistémicos y locales, incluyendo la administración de fluidos intravenosos calientes, uso de lámparas emisoras de calor y mantas térmicas14,79.
OxigenoterapiaSe ha especulado que la administración supranormal de oxígeno aumentaría la presión parcial de oxígeno en la herida quirúrgica, incrementando la destrucción oxidativa de las bacterias por los neutrófilos. Se han diseñado estudios comparando la administración perioperatoria de una FiO2 del 80% frente una FiO2 del 30%. Aunque no se describen efectos adversos con FiO2 del 80%, los resultados son contradictorios, con estudios que muestran menor incidencia de ISQ con la hiperoxia80,81 y otros que no muestran diferencias significativas82,83.
Control de la glucemia postoperatoriaLos diabéticos sufren mayor incidencia de complicaciones postoperatorias y mortalidad, incluyendo retraso en la cicatrización e ISQ84. En situaciones de hiperglucemia, los niveles de catecolaminas, corticosteroides y hormona del crecimiento están aumentados, inhibiendo la liberación de oxígeno en la herida85. En estudios sobre hiperglucemia e ISQ en cirugía cardíaca con esternotomía, el mantenimiento de niveles de glucemia entre 120 y 160mg/dl durante los primeros 2-3 días postoperatorios reduce el riesgo de ISQ86,87. Un estudio retrospectivo en cirugía general y vascular establece que cada aumento de 40mg/dl de glucemia por encima de 110mg/dl representa un aumento del 30% de riesgo de ISQ88. Se recomienda la monitorización de la glucemia postoperatoria en los diabéticos, manteniendo los niveles por debajo de 180mg/dl14.
Transfusiones sanguíneas perioperatoriasLas transfusiones sanguíneas perioperatorias son un factor predictivo independiente de ISQ14,89, con asociación entre la cantidad de transfusión y el riesgo de infección. En cirugía por tumores gastrointestinales, la transfusión de más de 1.000ml de concentrado de hematíes se asoció a un riesgo 6,5 veces mayor de ISQ90. Análisis multivariantes realizados con animales, confirman que las transfusiones de componentes sanguíneos son un factor de riesgo independiente para desarrollar ISQ91.
Una revisión reciente de estrategia de cuidados perioperatorios confirma que la necesidad de transfusión sanguínea se asocia a mayor incidencia de ISQ, lo que se traduce en una peor recuperación postoperatoria92. No obstante, según Hranjec et al. la reducción leucocitaria dentro de los elementos transfundidos puede ser beneficiosa93.
Infusión de líquidos intravenosos intraoperatoriosLa hiperhidratación intraoperatoria produce edemas que dificultan una correcta cicatrización, lo que conlleva un aumento de ISQ. Un ensayo multicéntrico muestra que la restricción de fluidos intraoperatorios se asocia a menor incidencia de ISQ94. Además, la restricción de líquidos se asocia a menor morbimortalidad postoperatoria, por mejoría en la función respiratoria, íleo postoperatorio y riesgo de trombosis venosa profunda95.
Los programas de rehabilitación multimodal en cirugía colorrectal incluyen la administración de soluciones glucosadas hasta 3 h antes de la intervención, con el fin de reducir la respuesta catabólica inducida por la agresión quirúrgica. La ingesta de líquidos, finalizando con la toma de 400ml de solución glucosada, ayudaría a evitar la deshidratación postoperatoria95.
Estado nutricionalLa desnutrición preoperatoria se asocia a cambios en la composición corporal y disfunción de sistemas cardiopulmonar, renal y digestivo. La inmunodepresión asociada a desnutrición facilita la ISQ y la sepsis intraabdominal. El término «inmunonutrición» hace referencia a la potencial utilidad de determinados inmunonutrientes en la evolución clínica. Los 3 más importantes son los ácidos grasos omega 3, la glutamina y la arginina. Varios estudios intentan demostrar que la ingesta perioperatoria de inmunonutrientes se asocia a una menor incidencia de infecciones. Un metaanálisis de Cerantola et al.96 muestra un descenso de complicaciones, en especial de infecciones postoperatorias, y una reducción en la estancia hospitalaria. Sin embargo, no muestra diferencias significativas en la mortalidad postoperatoria. En 2012, un metaanálisis en cáncer digestivo demostró que la inmunonutrición perioperatoria es efectiva, segura y reduce la estancia hospitalaria y las complicaciones e infecciones postoperatorias97. Sin embargo, Klek et al.98 en un ensayo clínico aleatorizado, no hallan diferencias significativas en la tasa de complicaciones, infección postoperatoria, mortalidad y estancia hospitalaria. Ante esta discordancia de resultados y el elevado precio de las formulaciones, deberán realizarse más estudios independientes antes de poder incluir o eliminar la inmunonutrición de las recomendaciones generales para la reducción de las ISQ.
Listado de verificación o checklistEn los últimos años se han diseñado varios listados de verificación para asegurar la correcta aplicación de una serie de parámetros perioperatorios. Esto facilita la interrelación entre los miembros del cuadro quirúrgico y mejora la atención global al paciente. Haynes et al. realizaron un estudio prospectivo de la cumplimentación del listado de verificación de la OMS. Comprobaron que la mortalidad perioperatoria disminuía del 1,5 al 0,8% y la tasa de complicaciones se reducía del 11 al 7%99.
BundlesDurante la última década se ha popularizado el uso de bundles o paquetes sistematizados de medidas de prevención de las complicaciones postoperatorias, aplicados en general o en situaciones de alto riesgo como la cirugía colorrectal. En 2004, los CDC iniciaron el Surgical Infection Prevention project (SIP), para asegurar el seguimiento de unas pocas medidas básicas de prevención de la ISQ basadas en la evidencia (uso apropiado de antibiótico profiláctico, administración durante la hora previa a la incisión y su retirada antes de las 24 h, buen protocolo de manejo del vello cutáneo y mantenimiento de la normotermia). Aplicando estas las medidas, Hedrick et al. reportaron en 2007 un mejor cumplimiento del protocolo de profilaxis y una reducción de ISQ del 25,6 al 15,9% en cirugía de colon en comparación con una serie previa100. Sin embargo, un estudio similar no halla diferencias en la tasa de ISQ (19%) a pesar de detectar una mejora del proceso101. En 2011, un estudio aleatorizado de 211 operaciones colorrectales comparaba su bundle «clásico» con un bundle que, entre otras modificaciones, eliminaba la preparación mecánica del colon y el antibiótico por vía oral. A pesar de que se consiguió mejorar la adherencia a las medidas basadas en la evidencia, se detectó un aumento de la ISQ del 24 al 45%102. En España, un estudio multicéntrico observacional de la incidencia de ISQ en cirugía colorrectal con aplicación de un bundle similar al del proyecto SIP, obtuvo un 23,2% de ISQ en 611 intervenciones colorrectales103.
En conclusión, la adopción de un paquete de medidas de prevención de la ISQ que gocen de buena evidencia científica (tabla 4), su protocolización y el control de su seguimiento conducen a una mejora del proceso quirúrgico. La adherencia a estos bundles mediante la confección de una lista de verificación consigue además disminuir la tasa de ISQ. Sin embargo, en la lucha por la disminución de la infección postoperatoria existen factores aún poco conocidos y sistematizables, por lo que una exquisita técnica quirúrgica individual y el buen criterio para escoger las medidas de profilaxis más apropiadas siguen siendo insustituibles.
Recomendaciones para reducir la ISQ
| 1. Ducha preoperatoria con agua y jabón |
| 2. Ante detección intranasal de SARM: descontaminación nasal con mupirocina + ducha preoperatoria con jabón de clorhexidina |
| 3. No eliminar vello del campo quirúrgico o hacerlo con maquinilla eléctrica de cabezal desechable |
| 4. Descontaminación de la piel del campo quirúrgico con solución alcohólica de clorhexidina o povidona. No secar. Dejar actuar la solución 2-3 min |
| 5. Incisión en la piel con bisturí frío. No abusar de electrocoagulación |
| 6. Cierre aponeurótico con suturas monofilamento |
| 7. Sutura primaria diferida de la herida en cirugía sucia |
| 8. Evitar drenajes intraabdominales. En caso de utilizarlos: cerrados, unidirecccionales y aspirativos |
| 9. En cirugía colorrectal no realizar preparación mecánica del colon. Asociar antibiótico oral al sistémico |
| 10. Profilaxis antibiótica sistémica:Inicio 30-60 min antes de la incisiónDosis plenas, ajustadas con relación al peso ideal y a la función renalRedosificación si pérdida de sangre > 1.500ml o duración de la cirugía > 2 veces vida media del antibióticoMonodosis preoperatoria. No prolongar la profilaxis con dosis postoperatoriasUso preferente de cefalosporinas de 1.ª y 2.ª generación |
| 11. Evitar la hipotermia |
| 12. Mantener glucemia postoperatoria por debajo de 180 mg/dl en diabéticos |
| 13. Evitar las transfusiones sanguíneas perioperatorias |
| 14. Restricción de líquidos intraoperatorios intravenosos |
Los autores no declaran conflictos de intereses relacionados con esta revisión.