Las lesiones de la vía biliar se pueden producir por múltiples causas, siendo las lesiones iatrogénicas de la vía biliar las más frecuentes. Son situaciones clínicas complejas producidas en pacientes aparentemente sanos que se asocian a una morbilidad importante y una mortalidad baja pero no despreciable. Un tratamiento correcto requiere un alto nivel de sospecha en el intraoperatorio y en el postoperatorio inmediato, y un abordaje multidisciplinario entre cirujanos, radiólogos y endoscopistas para ofrecer al paciente el mejor diagnóstico inicial, las mejores opciones terapéuticas y el mejor manejo y seguimiento de las complicaciones. Con esta revisión pretendemos describir la situación actual de la literatura con respecto a este tipo de lesiones y su manejo terapéutico, y hemos efectuado un algoritmo terapéutico.
Bile duct injuries can be caused by different reasons, with Iatrogenic Bile Duct Injuries (IBDI) being the most common factor. IBDI is a complex situation produced in apparently healthy patients and is associated with a high rate of morbidity and a low rate of mortality. A multidisciplinary approach between surgeons, radiologist and endoscopist offers the best chances for an initial diagnosis, therapeutic options, management and follow up of complications for the patient. The aim of this review is to describe the current medical literature with reference to IBDI, and discuss our therapeutic algorithm.
Las lesiones iatrogénicas de la vía biliar (LIVB) son situaciones clínicas complejas producidas generalmente por los cirujanos en pacientes habitualmente sanos, asociadas a una morbilidad importante y una mortalidad baja pero no despreciable1. Dentro de las LIVB, podemos diferenciar un grupo relacionado con la cirugía (colecistectomía, trasplante hepático y otros procedimientos) y un grupo no quirúrgico (terapias ablativas de tumores [radiofrecuencia], biopsias hepáticas, TIPS o radioterapia externa)2.
La mayoría de las LIVB se producen en el transcurso de la colecistectomía. Desde 1882 cuando Carl Langebuch realiza la primera colecistectomía abierta hasta la actualidad3,4, las LIVB han sido una complicación inherente a esta cirugía debido al error perceptivo del cirujano. La colecistectomía laparoscópica (CL) ha disminuido el dolor postoperatorio y la estancia hospitalaria, pero desgraciadamente ha incrementado algunas complicaciones como las LIVB5. En un metanálisis con más de 78.747 CL la incidencia de LIVB varió entre un 0,36-0,47%6.
Un tratamiento correcto de las LIVB requiere un alto nivel de sospecha en el intraoperatorio y en el postoperatorio inmediato7, y un abordaje multidisciplinario entre cirujanos, radiólogos y endoscopistas para ofrecer al paciente el mejor diagnóstico inicial, las mejores opciones terapéuticas, y el mejor manejo de las complicaciones y su seguimiento8.
Con esta revisión pretendemos describir la situación actual de la literatura con respecto a este tipo de lesiones y su manejo terapéutico.
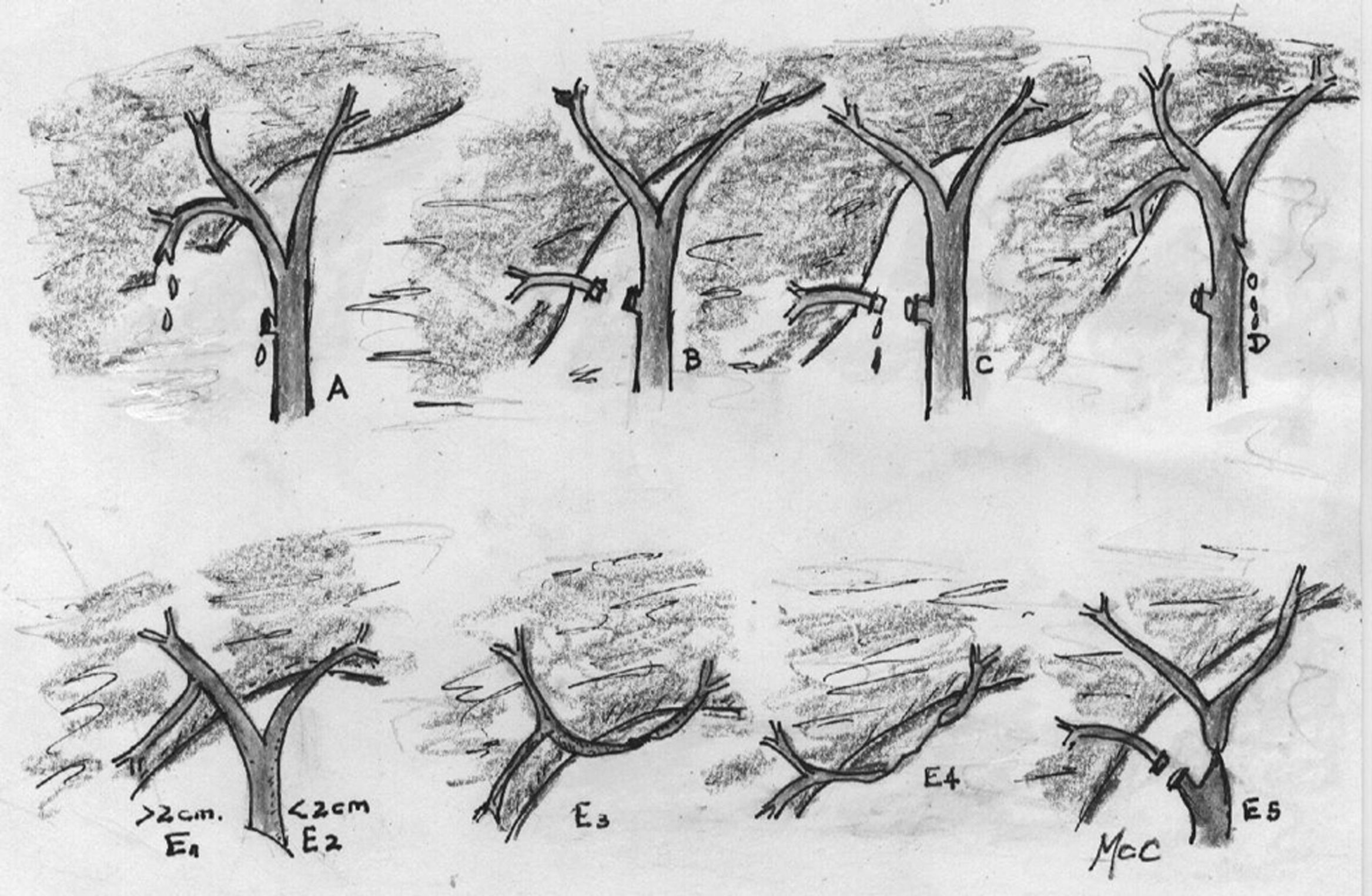
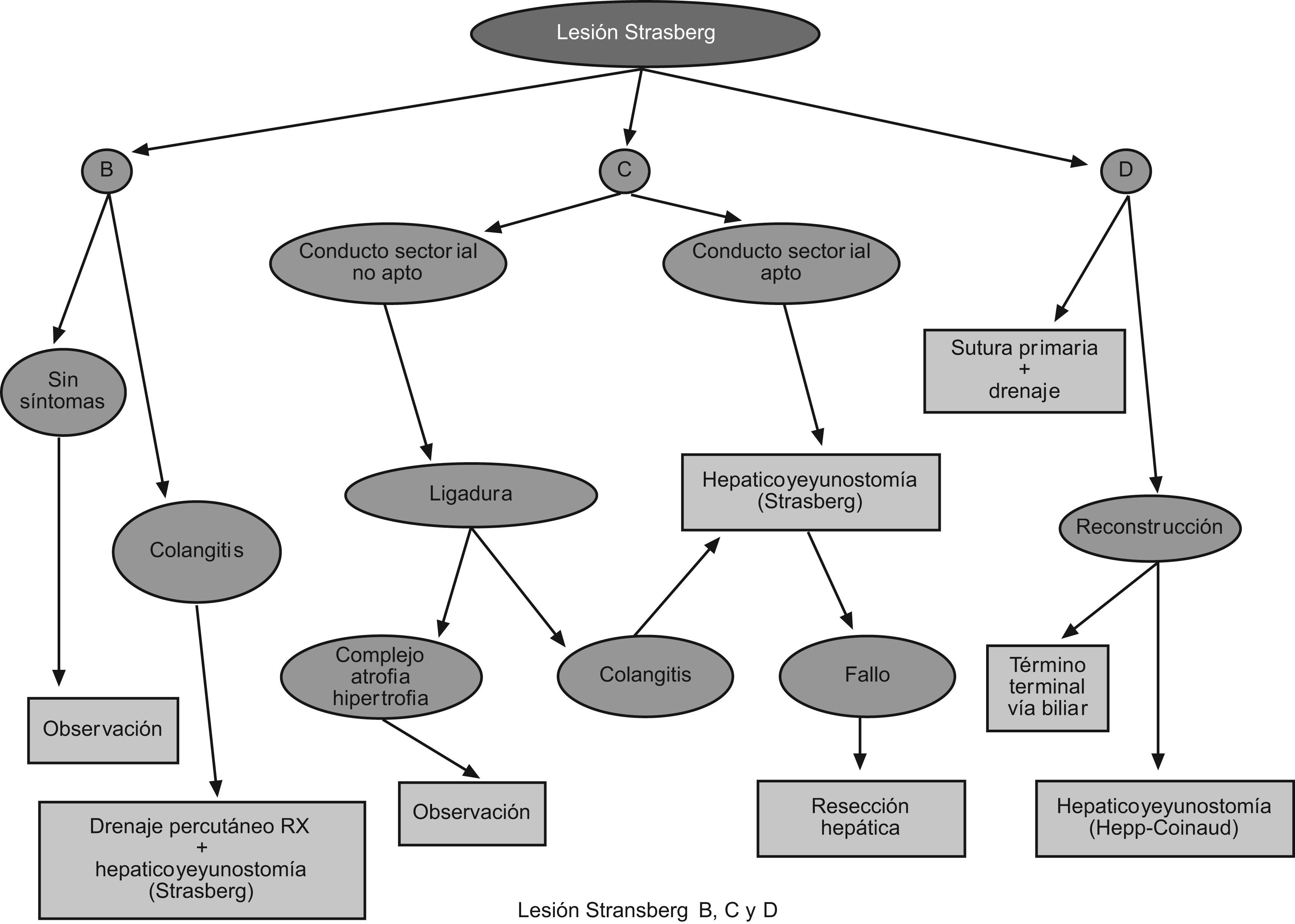
ClasificaciónDiferentes clasificaciones de LIVB han sido propuestas basándose en el nivel anatómico de la lesión o el mecanismo de acción, pero llamativamente ninguna ha valorado factores como la sepsis, el estado hemodinámico del paciente o las comorbilidades asociadas. La presencia de lesiones vasculares asociadas generalmente en LIVB más proximales al hilio hepático y su influencia clínica es considerado en las Clasificaciones de Hannover9, Lau10, Kapoor11 y Stewart-Way12, pero no en las clasificaciones de Strasberg13, Bismuth14, Neuhaus15, Csendes16, McMahon17, Siewert18, Frattaroli19 y Ámsterdam20. En general, ninguna de estas clasificaciones es aceptada como un estándar universal lo que reduce su utilidad clínica. Las más utilizadas son las clasificaciones de Strasberg (fig. 1) y Bismuth.
Clasificación Strasberg LIVB. A) Fuga del muñón del c.cístico o fuga de un canalículo en el lecho hepático. B) Oclusión de una parte del árbol biliar, casi invariablemente un conducto hepático derecho aberrante. C) Transección sin ligadura del conducto hepático derecho aberrante. D) Daño lateral a un conducto hepático mayor. E) Subdivida por la clasificación de Bismuth en E1–E5.
Edad/sexo: los pacientes de edad avanzada y sexo varón tienen un riesgo incrementado de LIVB21.
Malformaciones congénitas: la agenesia parcial hepática ha sido descrita como factor de riesgo22.
Colecistitis aguda: las LIVB son 3 veces más frecuentes en las CL por colecistitis aguda, con una incidencia entre el 0,77-5,0% y es el mayor factor predisponente de LIVB23–28.
Síndrome del conducto cístico oculto: cuando se diseca el infundíbulo para la identificación del conducto cístico (CC) en la técnica infundibular, es posible que confundamos el hepato-colédoco con un cístico erróneamente identificado y lo seccionemos. Este hecho se favorece por la presencia de inflamación aguda o crónica, piedras grandes impactadas en el infundíbulo, adherencias entre la vesícula y el colédoco y vesículas intrahepáticas29–32.
Anomalías anatómicas de la vía biliar (VB). El CC anómalamente puede unirse al colédoco muy cerca de la localización de los conductos sectoriales segmentarios, puede drenar en un conducto sectorial, así como en la convergencia de los conductos sectoriales anterior y posterior33. La confluencia entre el CC y la VB principal puede ser angular (75%), paralela (20%) y espiral (5%).Con una implantación paralela, es posible dañar el exterior del colédoco con una quemadura térmica al disecar el CC por la proximidad34.
Error percepción en CL y reconvertidas a abiertas: aunque la técnica de fondo a infundíbulo es un buen recurso para colecistits agudas por vía abierta,cuando sospechas una fístula colecisto-coledocal, esta técnica en la cirugía laparoscópica puede llevar a lesionar el colédoco34.
Tipo de abordaje. Las LIVB de CL son más graves y complejas por su localización más proximal, por su frecuente asociación con lesión vascular y por el mecanismo térmico asociado35–37.
Experiencia del cirujano: aunque la experiencia es esencial para evitar altas cifras de morbilidad en cualquier cirugía, en las CL la curva de aprendizaje no parece ser el factor más importante a la hora de minimizar las cifras de las LIVB38–40.
Medidas preventivasExisten múltiples técnicas para la prevención de las LIVB: utilización de una cámara de 30 grados, evitar el uso de la termocoagulación cerca de la VB principal, una disección meticulosa y la conversión a cirugía abierta cuando la anatomía sea incierta41,42.
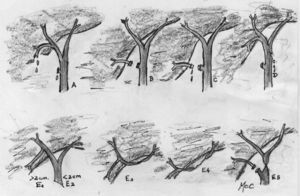
Se han copiado principios de navegación para disminuir las LIVB. En el caso de las colecistectomías abiertas se habla de un «fundus first technique». En las CL, el punto de referencia es el Surco de Rouviêre43 (fig. 2). Dado que la causa principal de LIVB es la identificación errónea de la VB principal o un conducto aberrante como CC, el cirujano debe usar un método de identificación de la arteria y CC44.
Entre los métodos empleados destacamos:
- 1.
Método triestructura: debemos identificar durante la CL: CC, conducto hepático común y colédoco45.
- 2.
Método de Fischer: consiste en separar la vesícula completamente del lecho vesicular desde el fondo hacia el infundíbulo como en cirugía abierta, hasta que cuelgue de la arteria y el CC. Esto es especialmente difícil en caso de vesículas intrahepáticas o muy inflamadas46. La separación de la vesícula del lecho hepático, también suele sangrar más, al no haberse ligado previamente al arteria cística.
- 3.
Técnica infundibular: consiste en la identificación del CC al unirse al infundíbulo vesicular. Es la técnica más empleada actualmente en la mayoría de los centros. Presenta el inconveniente de no prevenir la LIVB en los pacientes con síndrome del conducto cístico oculto. Por ello, distintos grupos sistemáticamente recomiendan el uso de la colangiografía intraoperatoria (CIO) con este tipo de técnica34.
- 4.
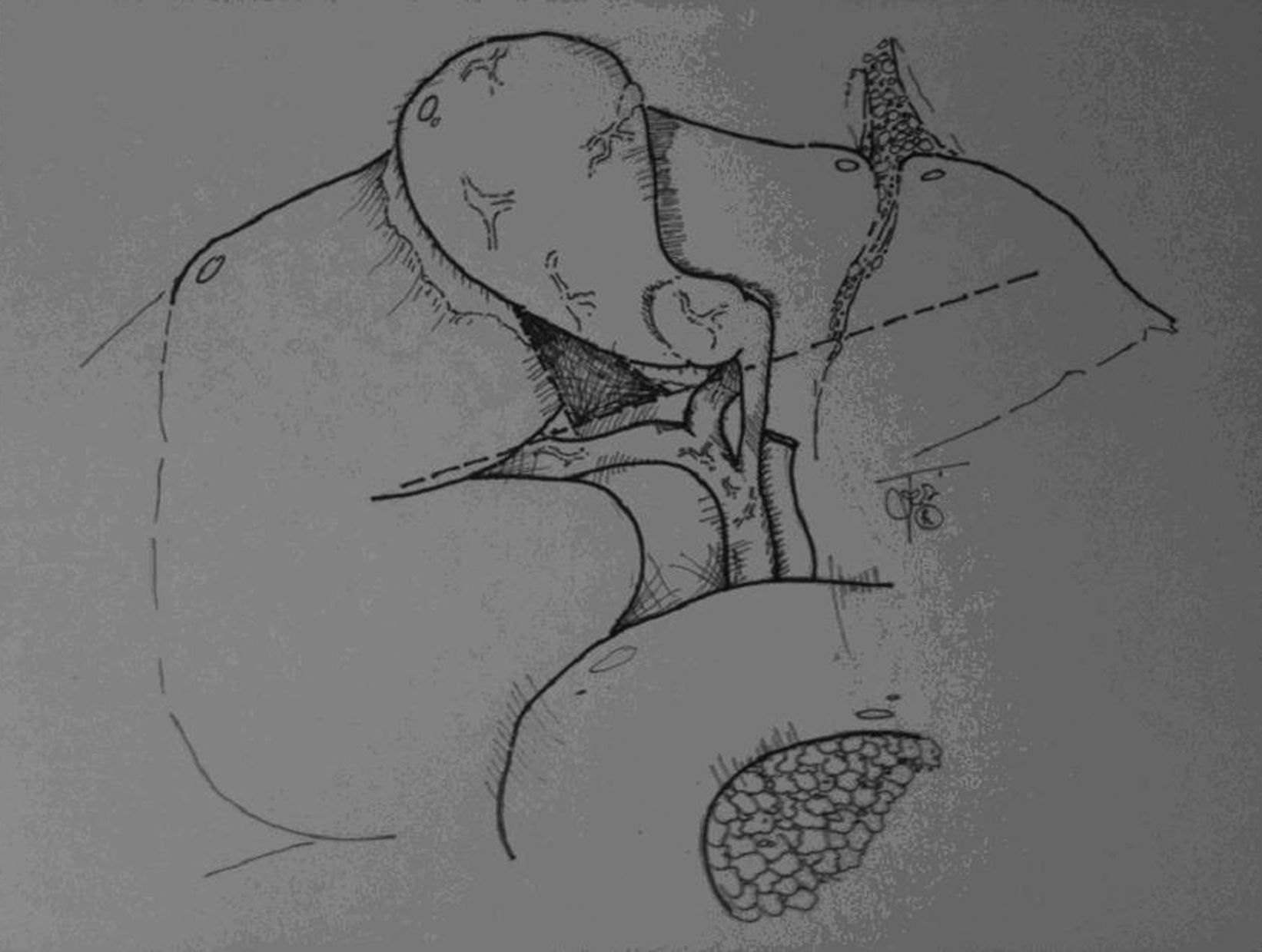
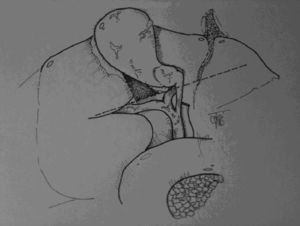
Técnica de la Vista Crítica de Strasberg: consiste en la disección y liberación del triángulo de Calot hasta exponer la arteria y el CC y exponer la base del hígado. Una vez se alcance esta vista, estas estructuras solo pueden corresponder al conducto y a la arteria cística (fig. 3)26. En casos de conductos aberrantes o en casos de vesículas muy inflamadas, se sugiere la exposición de la capa interna de la subserosa, optimizando la vista crítica47.
- 5.
Colangiografía: desde que en 1932 el argentino Pablo Mirizzi introdujese la primera colangiografía intraoperatoria hasta la actualidad48, su beneficio para prevenir la LIVB es debatido. La CIO puede ayudar a evitar las LIVB al menos por 3 causas49:
- 1.
Muestra la diversidad del árbol biliar y sus anormalidades.
- 2.
Ayuda al cirujano a identificar pacientes con riesgo de LIVB por anatomías anómalas.
- 3.
Si la LIVB ha ocurrido, permite su identificación y reparación.
La CIO ha demostrado ser coste beneficio especialmente cuando es utilizado por cirujanos con menos experiencia y si hay factores de riesgo50. Otros estudios no aceptan que la CIO prevenga la incidencia de LIVB y remarcan el incremento del tiempo total de cirugía51,52. Actualmente no existen ensayos clínicos aleatorizados que justifiquen el uso de CIO53.
- 1.
- 6.
Ecografía laparoscópica intraoperatoria: en un estudio multicéntrico reciente, se destacan sus ventajas para la prevención de LIVB aunque se trata de otro método muy caro y a veces no disponible en todos los hospitales, que no reemplaza completamente a la CIO pero que abre un futuro esperanzador54.
Hay que mantener un alto nivel de sospecha para diagnosticar las LIVB55. Podemos hablar de 3 escenarios posibles56:
- 1.
Diagnóstico intraoperatorio (<50%).
- 2.
Postoperatorio inmediato: pacientes que no estén clínicamente bien en las primeras 48h de la cirugía, o con bilis en un drenaje abdominal. Se puede acompañar de colestasis57,58.
- 3.
Pacientes diagnosticados de un modo tardío con síntomas de colangitis e ictericia obstructiva.
La ecografía permite visualizar las colecciones líquidas y la dilatación de la VB, pero no informa del recorrido completo de la VB y de otros daños asociados. Por ello, se recomienda como estudio diagnóstico inicial la TAC con contraste, ya que además de la información del ultrasonido, permite diferenciar el nivel de la lesión, el daño vascular asociado y la atrofia-hipertrofia hepática59. El scanner con ácido iminodiacético (HIDA scan) ayuda al diagnóstico de las fugas biliares, pero no delimita el nivel de la lesión y la anatomía biliar60. La colangiografía por RM nos permitirá identificar la necesidad de realizar o no una CPRE por fugas de pequeños radicales biliares o fugas del muñón cístico, y nos informará de la presencia o no de coledocolitiasis61,62. La RM colangiografía con manganeso es un método no invasivo, eficiente en el diagnóstico de las LIVB pero que requiere mayores series para su valoración63.
El nivel de la LIVB en el árbol biliar puede visualizarse por colangiografía a través de la CPRE o CTPH. En casos de lesiones proximales al hilio, con transección, o con presencia de un conducto aberrante, la CPRE no logra dibujar el árbol biliar de un modo correcto, necesitándose la colangiografía anterógrada por CTPH64.
Actitud terapéuticaEl tratamiento de las LIVB es complejo, y multidisciplinario. Se requiere conocer: el tipo de lesión, la situación clínica del paciente, lesiones vasculares asociadas, factores locales hospitalarios…
Describimos brevemente unas generalidades sobre el tratamiento no quirúrgico y quirúrgico, resaltando la hepaticoyeyunostomía (H-Y). Posteriormente definimos un tratamiento según los tipos de Strasberg. El tratamiento endoscópico será ampliado en lesiones Strasberg tipo A.
- 1.
Tratamiento no quirúrgico (endoscópico y radiológico intervencionista).
El tratamiento multimodal de la LIVB incluye el tratamiento endoscópico y radiológico intervencionista. Las técnicas de radiologías intervencionistas percutáneas van a requerir una continuidad bilioentérica, son menos invasivas y pueden ser más adecuadas en pacientes no candidatos a la cirugía, o aquellos cuya anatomía hace la instrumentación endoscópica técnicamente muy difícil65. El desarrollo de «stent» autoexpandibles cubiertos, específicamente diseñados para ser retirados posteriormente, puede cambiar próximamente el manejo de las estenosis benignas66.
- 2.
Tratamiento quirúrgico
Hay 3 parámetros pronósticos independientes del tratamiento quirúrgico de una LIVB que implican una pobre evolución postoperatoria y una tasa superior de complicaciones 67:
- 1.
LIVB proximal: técnicamente mucho más complejas de reparar y habitualmente asociadas a lesión vascular68.
- 2.
Reparación en fase aguda: en LIVB agudas, la reparación inmediata es la mejor opción si el estado hemodinámico del paciente y las condiciones sépticas lo permiten69. No existe evidencia para apoyar una reparación precoz o diferida cuando la LIVB es identificada días después de la lesión70.
- 3.
Derivación tardía a un centro terciario: la reconstrucción biliar en un centro de referencia por un cirujano experto en LIVB, presentan mejor tasa de éxito, menor estancia hospitalaria, morbilidad y mortalidad. El momento en que se deriva a un centro terciario puede afectar drásticamente a la cirugía de reconstrucción biliar cuando se lleve a cabo67.
- 1.
La anastomosis bilioentérica que ofrece los mejores resultados es la H-Y en Y de Roux. El asa desfuncionalizada garantiza la ausencia de reflujo intestinal dentro de la VB, y evita la colangitis ascendente. La anastomosis hepatoduodenal presenta una mayor tensión anastomótica, el reflujo de comida macroscópico a nivel del árbol biliar y la posibilidad de desarrollar una fístula biliar de alto débito71. Los errores más comunes en relación con el fallo de la reparación y anastomosis bilioentérica son la falta de aposición mucosa completa entre la VB y el intestino y el uso de material de sutura no absorbible72.
El uso de «stents» transanastomóticos no se encuentra universalizado. Se ha sugerido colocarlo de modo proximal sin atravesar la reparación73,74. También se ha postulado emplear un asa proximal redundante y fijada a la pared, que permite una manipulación percutánea radiológica más sencilla75–77.
Existen estudios experimentales en animales con LIVB utilizando prótesis anilladas de «Gore-Tex» vasculares78, «stents» magnéticos79, pegamentos de fibrina80 y «flap» vesiculares para la reconstrucción biliar81.
Existen 2 complicaciones que requerirían el trasplante hepático (TH): LIVB asociadas a episodios de colangitis de repetición y colestasis crónica con cirrosis biliar secundaria y lesiones de los vasos del hilio hepático, especialmente la arteria hepática, que conlleven un fallo hepático fulminante82. Existen pocas publicaciones acerca del TH secundario a LIVB83–88. En general el trasplante en estos pacientes es técnicamente más complejo por: adherencias intraabdominales, esclerosis del pedículo hepático, hipertensión portal severa y coagulopatía asociada89. La mayor incidencia de LIVB por CL hace pensar en un incremento en esta indicación de TH en próximos años90.
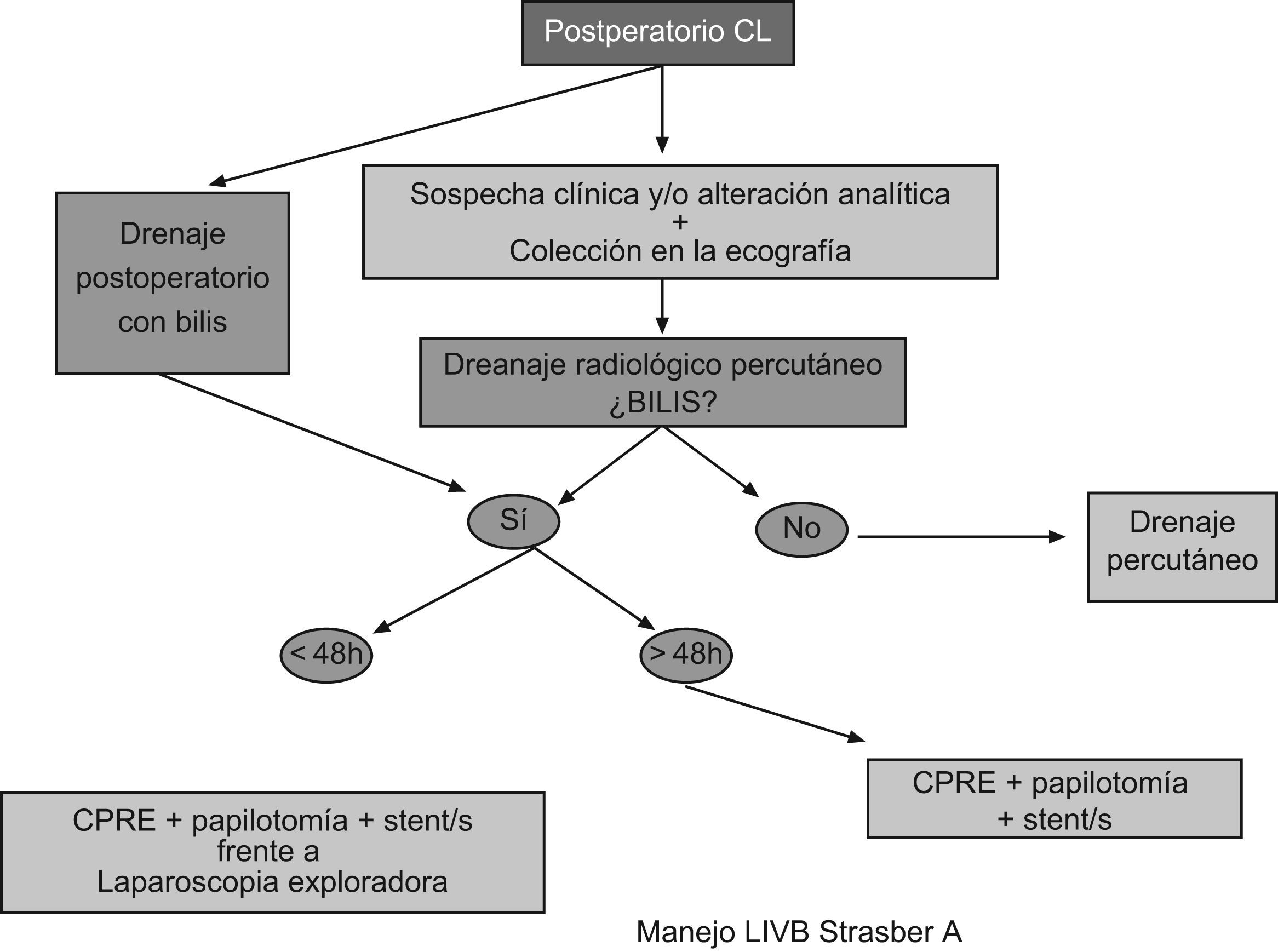
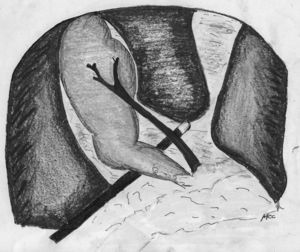
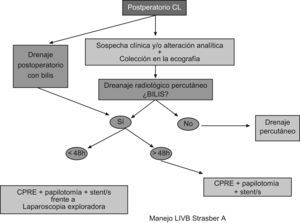
Técnica a realizar según la clasificación LIVB StrasbergTipo A: el tratamiento endoscópico (papilotomía+prótesis) en las fugas biliares del CC es muy eficiente, en cambio, si las fugas son más proximales el porcentaje de resolución del cuadro es inferior91. Las diferencia de presión basal o intraductales, la longitud del CC y el diámetro de la VB posiblemente expliquen las diferencias en los resultados92. No existen datos comparativos que definan el número óptimo de «stents», tamaño, configuración (recto o «pigtail»), longitud y tiempo de retirada93. No hay diferencias entre el uso de «stents» que atraviesen la fuga («leak- bridging») o cortos que solo descompriman y disminuyan el gradiente de presión transpapilar94. Aunque en algunos centros, estas lesiones en el postoperatorio inmediato sean abordadas mediante laparoscopia exploradora y recolocación de clips o sutura del conducto de Luschka, no existe actualmente ningún estudio comparativo que compare el abordaje endoscópico y el abordaje laparoscópico en este escenario (fig. 4).
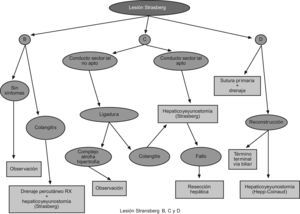
Tipo B: (fig. 5).
Tipo C: (fig. 5) no existe continuidad con la VB principal por lo que el uso de prótesis no será efectiva. Si el conducto es pequeño, se puede ligar, evolucionando hacia una atrofia95, o bien dando episodios de colangitis. Si es un conducto de mayor calibre (2 o más segmentos) se debería reconstruir mediante H-Y. La reconstrucción biliar en un sectorial derecho aberrante con respecto a la VB principal presenta mayores cifras de estenosis y colangitis a largo plazo96. Con respecto a las resecciones hepáticas, hay que reservarla para el fallo de la H-Y previa o si hay sintomatología persistente97.
Tipo D: (fig. 5) pueden abordarse por:
- •
Cierre primario con sutura absorbible y un drenaje subhepático. La colocación de un tubo en T se ha asociado con una mayor cifra de estenosis tardías en pacientes trasplantados98. Por lo tanto parece prudente evitar un cuerpo extraño en una VB no dilatada53.
- •
Anastomosis término-terminal: su realización va a depender de una serie de factores como la presencia de los extremos proximales y distales intactos, similitud de diámetro entre los extremos, lesión menor de 1cm longitud y ausencia de tensión excesiva, signos de infección o inflamación. Las ventajas son la simplicidad y la preservación de la longitud de la VB, pero aproximadamente un 50% se estenosa durante el seguimiento. Se describe un refuerzo mediante un parche de la vena umbilical y del tejido adiposo del ligamento redondo99–101.
- •
Hepaticoyeyunostomía: es el método más utilizado y más seguro. La anastomosis bilioentérica con la anastomosis latero-lateral es superior al preservar mejor la vascularización, minimizar la disección detrás de los conductos102. Se recomienda realizar la H-Y en la porción extrahepática del conducto hepático izquierdo (CHI) en la base del segmento iv, realizándose una anastomosis latero-lateral entre el CHI y el yeyuno tipo «Y» de Roux. Esta técnica fue descrita por Hepp y se denomina técnica de Hepp-Coinaud en referencia a la descripción anatómica extrahepática del CHI descrita por Coinaud103.
Tipo E: la H-Y descrita para las lesiones tipo D es la técnica ideal para lesiones E1, E2 y E3. Aquellas lesiones situadas por encima de la bifurcación (E4) o que puedan afectar a ramas sectoriales del lado derecho (E5, B y C) no las puede solucionar ya que sólo permite drenar el sistema hepático ductal izquierdo.
- •
E1 y E2: otra técnica aplicable en estos pacientes fue descrita hace 23 años y rebautizada por Mercado y cols como «bile duct growing factor»104,105, en honor al término acuñado por Starzl en anastomosis vasculares106, y consiste en la anastomosis de la cara anterior del CHC y del CHI a un asa de yeyuno. Es una alternativa técnica para la reconstrucción de un CHC fino, menor de 4mm, siempre que exista preservación de la confluencia hepática.
- •
E4 y E5: en estos casos, la anastomosis es técnicamente más demandante, especialmente cuando existe una interrupción amplia entre CHD y CHI y se extiende longitudinalmente la estenosis a un conducto sectorial. Generalmente se asocia a daño vascular, atrofia hepática, colangitis de repetición e intentos previos de reparación. En este contexto, se recomienda considerar la hepatectomía antes del trasplante107. Strasberg et al describieron el abordaje «extraglissoniano» para estas lesiones basándose en la disección intrahepatica de la confluencia del pedículo derecho e izquierdo, el descenso de la llamada «placa hiliar»108. El cirujano debe puncionar con una aguja fina ambos pediculos hasta localizar la VB, realizar una apertura lo más amplia de los mismos y una doble anastomosis latero-lateral. La exposición de una adecuada longitud del conducto sectorial posterior puede estar limitada por la posición de la vena portal sectorial anterior derecha. También es importante no producir desvascularización de la arteria hepatica derecha anterior102,109. También se ha descrito la resección parcial del segmento iv y v permitiendo una mejor anastomosis en el CHD110, aunque otros grupos creen que con una movilización de la placa hiliar es suficiente para la reparación106,111.
- 1.
Estenosis biliares:
Las estenosis tempranas suelen estar relacionadas con aspectos del procedimiento quirúrgico. Las estenosis tardías, se relacionan con fenómenos inflamatorios y fibrosis por las fugas biliares o bien, secundarias a la isquemia por lesión vascular asociada (LVA). Habitualmente el tratamiento se inicia mediante CTPH y drenaje transhepático para solucionar la colangitis. La técnica «rendez-vous» puede facilitar el manejo terapéutico en este tipo de pacientes116–118. Si hay fracaso intervencionista, la realización de una nueva H-Y es la solución. El 61% de los fallos de las reparaciones primarias bilioentéricas hay asociada una lesión vascular, más frecuente cuanto más alta es la estenosis112.
La estenosis tras anastomosis H-Y oscila entre un 9–25%113,114. El tratamiento radiológico intervencionista presenta resultados similares a los de la cirugía, pero con menor morbilidad y mortalidad115.
- 2.
Hipertensión portal:
La incidencia de estenosis biliar e hipertensión portal en pacientes con LIVB oscila entre un 15–20%119,120. La cifra de mortalidad quirúrgica en estos casos alcanza un 23–46%121. La hipertensión portal en las LIVB puede deberse a: obstrucción biliar prolongada, daño portal durante la colecistectomía, trombosis portal inflamatoria o coexistencia con patología hepática previa (Cirrosis)122. El tratamiento más aceptado es la dilatación con balón y «stent»37. En caso de fallo, se realiza un by pass veno-venoso y una nueva H-Y123 . El TH será la mejor opción en caso de cirrosis.
- 3.
Cirrosis biliar secundaria (CBS):
La incidencia de hipertensión portal y CBS en las LIVB es aproximadamente del 8%124. La presencia de cirrosis durante la reparación predice un incremento en la morbilidad y mortalidad125. Se necesita para desarrollar una CBS en estenosis benignas 7,1 años, en coledocolitiasis 4,6 años y en estenosis malignas 0,8 años126.
- 4.
Lesión vascular asociada /Lesión vasculo-biliares:
Debemos diferenciar entre lesiones vasculo-biliares y las lesiónes vasculares asociadas. Las lesiones vasculo-biliares son aquellas que dañan el pedículo portal principal o sus ramificaciones, produciendo un infarto de todo o parte del hígado y/o VB, necesitando una resección parcial o total del hígado34. La lesión vascular asociada implica estar asociada a las LIVB, generalmente más proximal al hilio hepático. Puede ser silente y permanecer clínicamente asintomática, al ser el flujo portal suficiente para la recuperación del parénquima hepático sin aporte vascular arterial o con aporte limitado.
Análisis univariantes y multivariantes han mostrado que lesión vascular asociada es un factor de riesgo para el desarrollo de complicaciones biliares postoperatorias127–130. La VB extrahepática y la VB principal intrahepática poseen un flujo únicamente arterial. Existen 2 plexos en la vascularización de la VB, uno en la superficie del colédoco-hepático, conectando la arteria hepática derecha con la pancreatoduodenal postero-superior y otro en la placa hiliar entre ramas de la arteria hepática derecha e izquierda131,132.
En las lesiones tipo E, existe una deprivación de la circulación arterial desde la arteria gastroduodenal y pancreatodudoenal, dependiendo el flujo solo de la arteria hepática133.
Si el diagnóstico es intraoperatorio, podemos realizar una recostrucción vascular mediante una anastomosis termino-terminal o bien mediante una plastia de arteria mesentérica inferior37. En el postoperatorio, habría que estudiar el flujo portal y el flujo retrógrado a la lesión mediante angiografía.
Hasta ahora solo existen 4 estudios en la literatura sobre calidad de vida tras LIVB con resultados no homogéneos134–137. El más reciente afirma que la calidad de vida no se afecta en pacientes que sobreviven a una LIVB138.
Responsabilidad judicalEn el contexto de la LIVB, la piedra angular que determinará la negligencia médica, será el descifrar si los estándares de cuidado han sido cumplidos. Si el cirujano dentro de este contexto, no utiliza o utiliza mal los métodos de identificación aceptados, legalmente estará más desprotegido44.
Las Sociedades Quirúrgicas Nacionales deberían planificar conferencias de consenso para definir los estándares de la CL. En noviembre de 2006, la Sociedad Holandesa Laparoscópica elaboró y puso en práctica, un protocolo que recomendaba la grabación analógica o digital de la vista crítica de seguridad previamente a la transección del conducto y de la arteria cística. Estas imágenes son de gran interés en el postoperatorio y para el tratamiento de posibles complicaciones139. Sería interesante que los cirujanos y la Asociación Española de Cirujanos pudiéramos desarrollar un proyecto similar.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a la Sra. María Cristina Claude y al Dr. José Quiñones Sampedro la realización de las ilustraciones que aparecen en este artículo.