El desequilibrio entre el número de candidatos a trasplante hepático y el número de injertos hepáticos disponibles conduce a la mortalidad en lista de espera para trasplante. Dos posibles fuentes de aumentar el número de injertos hepáticos son la bipartición hepática y los donantes en asistolia. Ambas fueron estudiadas en una reunión de consenso de la Sociedad Española de Trasplante Hepático en octubre de 2012. Este artículo recoge las conclusiones de esta reunión.
The disbalance between the number of candidates to liver transplant and the number of liver grafts leads to waiting list mortality. Two potential ways of increasing the number of liver grafts are split liver transplantation and the transplantation of grafts from non-heart beating donors. Both of them were discussed in a consensus meeting of the Spanish Society of Liver Transplantation in October 2012. This paper outlines the conclusions of that meeting.
El notable desequilibrio entre un creciente número de candidatos a trasplante hepático en lista de espera y un limitado número de injertos disponibles para la realización de dicho procedimiento, resulta en una mortalidad en absoluto desdeñable. Una vez establecido el trasplante de hígado como terapia consolidada, y con la intención de paliar esta mortalidad, se han explorado fuentes de obtención de injertos consideradas no convencionales, como la bipartición hepática, el trasplante de órganos procedentes de donantes en asistolia (DA), el trasplante de donante vivo y el trasplante dominó. El trasplante hepático (TH) a partir de un donante vivo ya se revisó en los documentos de consenso de la Sociedad Española de Trasplante Hepático (SETH) publicados en 20111,2.
Trasplante hepático procedente de bipartición hepática (split)España destaca, además de por una elevada tasa de donación y TH (los más elevados del panorama mundial en 2011), por una muy escasa utilización de injertos procedentes de bipartición3. En este documento se tratará principalmente la bipartición de un injerto hepático cadavérico para un receptor infantil, que recibirá los segmentos II y III, y para un receptor adulto, que recibirá el resto del hígado.
Es de reseñar que, en la conferencia de consenso de la SETH que tuvo lugar en el año 20084,5, se recomendaban unas pautas claras para paliar la mortalidad entre los candidatos infantiles a TH en lista de espera, proponiendo estrategias de distribución de órganos que favorecieran el desarrollo de la bipartición hepática y que, sin embargo, estas recomendaciones no se han materializado a nivel nacional.
NecesidadLa mortalidad en lista de espera para TH afecta a candidatos adultos e infantiles, sin embargo, este problema es especialmente grave en un subgrupo de la población infantil. Así lo describe el grupo de trasplante del Hospital Universitario La Paz de Madrid6, observando un riesgo crítico en los niños de edad inferior a un año, candidatos con pocas opciones para un trasplante con órgano completo cadavérico. Esta mortalidad nunca ha sido completamente erradicada desde el inicio de la actividad de trasplante en el territorio nacional y, año tras año, un número variable de candidatos infantiles a TH fallecen en lista de espera.
En los últimos 10 años (2002-2011), el promedio anual de niños fallecidos en lista de espera ha sido de 7,1, con un rango de 4-10 según se aprecia en las memorias de actividad de trasplante elaboradas por la Organización Nacional de Trasplante (ONT)7. Esto implica que, si a la actividad regular de TH infantil se sumaran los trasplantes realizados con un número muy pequeño de biparticiones, la mortalidad infantil en lista de espera quedaría definitivamente eliminada.
La mayoría de los candidatos infantiles en los últimos años fueron trasplantados mediante injertos completos cadavéricos, mientras que la segunda fuente de obtención de injertos para los candidatos infantiles por orden de utilización, y dentro del ámbito nacional, la constituyen los injertos parciales de donante vivo. Los trasplantes realizados mediante esta técnica ofrecen excelentes resultados con supervivencias superiores a los injertos cadavéricos completos o procedentes de bipartición8. Mientras que la tasa de trasplante con injerto parcial de vivo ha sido de un 23% en España entre los años 2004 y 2011, la tasa de utilización de injertos procedentes de bipartición, tan solo es del 14%7. Aun contando con los citados buenos resultados en el caso de utilización de injerto procedente de donante vivo para receptor infantil, no debemos olvidar el riesgo de morbimortalidad para el donante. En dicho sentido, en un estudio reciente, que registra la mortalidad de donante vivo en Estados Unidos, demuestra una frecuencia de muerte de donante de 1,7/1.000 donaciones, con 2 casos de exitus tras donación de segmentos laterales izquierdos, aun siendo este tipo de donación la teóricamente menos comprometida para el donante. Este análisis concluye que la mortalidad observada para la donación de vivo en TH es independiente del tipo de injerto donado9.
Por tanto, se concluye que existe una necesidad de expansión de la donación para los receptores infantiles a través de la técnica de bipartición con el objetivo de eliminar la mortalidad infantil en lista de espera para TH.
PotencialEspaña es un estado con una elevada tasa de donación por millón de habitantes, ocupando el primer lugar a nivel mundial. Sin embargo, el perfil de los donantes de órgano sólido ha experimentado un notable cambio respecto a periodos previos de actividad de trasplante3. Una población donante más años a, con causas de muerte relacionadas con enfermedad vascular, dificulta la expansión del trasplante a través de la bipartición, ya que los donantes considerados para bipartición han de cumplir unos estándares exigentes en relación con su edad, peso, tiempo de ingreso en cuidados intensivos, ausencia de parada cardiorrespiratoria (PCR), soporte vasoactivo, ausencia de obesidad o esteatosis relevante, ausencia de hipernatremia grave y mínima alteración de bioquímica hepática10–12.
Diferentes estudios han evaluado el potencial de donación, estimándose proporciones variables de donantes susceptibles de bipartición hepática de un 23 a un 43% para donantes con pesos superiores a 70 kg13.
Para realizar un cálculo aproximado del potencial de este recurso en nuestro territorio, se podría analizar la tasa de trasplante pancreático14, dado que el nivel de exigencia para evaluar una potencial donación hepática para bipartición es asimilable al propio de una donación pancreática. En España en los últimos 10 años, se han realizado un promedio de 89,5 trasplantes pancreáticos anuales (y 8,5 biparticiones hepáticas), por lo que el número de donantes óptimos que podrían someterse a bipartición es mayor de 80 al año.
La ONT ha analizado el número de donantes con edad inferior a 55 años, peso superior a 70 kg, estancia en UCI inferior a 5 días y valores de transaminasas inferiores a 70 a lo largo del año 2009 sobre un total de 1.431 donantes15. Ese año se contabilizaron 84 donantes de estas características y, paralelamente, 7 niños fallecieron en lista de espera.
En conclusión, existe un potencial suficiente para desarrollar la actividad necesaria de trasplante realizado con injerto hepático procedente de bipartición para erradicar la mortalidad infantil.
JustificaciónLa bipartición permite el TH de 2 pacientes simultáneamente. Su beneficio es sencillamente cuantificable a través de la estimación de la suma de los años de sobrevida obtenidos con ambos injertos16.
Por otro lado, diferentes estudios demuestran que la supervivencia de los injertos procedentes de bipartición son equiparables a la obtenida con el TH realizado con injerto completo cadavérico, a pesar de observarse mayores tasas de complicaciones vasculobiliares10,17–29.
La actual política de asignación de donantes establecida a nivel nacional no favorece la realización de TH con injerto procedente de bipartición, situando a España como un país con muy baja tasa de este tipo de trasplante (de 0,3 a 2,4% de los TH realizados en los últimos 10 años)7, de modo contrario a lo que acontece en otros países con tasas más bajas de donación y trasplante30–32.
No obstante, tanto en la comunidad andaluza33 como en Cataluña34 se han establecido con éxito sistemas de priorización que claramente favorecen la bipartición. En ambos casos se estipula la evaluación obligatoria de donantes adultos o infantiles óptimos para permitir la bipartición siempre que exista un posible candidato infantil que se pueda beneficiar de este procedimiento.
Los centros nacionales de mayor actividad infantil realizan trasplante a candidatos que en una elevada proporción proceden de áreas geográficas distantes del territorio nacional, mientras que la asignación de injertos para realizar dichos trasplantes ha sido vehiculizada a través de los algoritmos de distribución más restrictivos locales, zonales o regionales, circunstancia que disminuye notablemente la posibilidad de realizar bipartición hepática. La carga del trasplante infantil nacional ha de ser distribuida a través de la red de donación también nacional. Acuerdos como los tomados en Andalucía y Cataluña han de ser extendidos al global del territorio nacional.
Los acuerdos mencionados, establecidos en Cataluña y Andalucía, detallan los algoritmos de coordinación entre los equipos de TH infantil y de adulto que también serían fácilmente reproducibles en el ámbito nacional (división de elementos vasculobiliares, técnica ex situ o in situ, etc.).
La expansión de esta fuente de donación se acompañaría de un mínimo impacto sobre el trasplante de los receptores adultos (durante el año 2011 habría bastado con 4 biparticiones para que no hubiera habido mortalidad infantil en lista de espera).
RecomendacionesSe ha de considerar todo donante, con edad superior a 15 años con características favorables, como divisible para trasplante split independientemente del centro donde se presente, si cumple unos requisitos consensuados.
Es aconsejable establecer políticas similares a las emprendidas en Andalucía y Cataluña que favorezcan la bipartición hepática en aquellos donantes que reúnan tales requisitos. Tales políticas se llevarán a nivel autonómico (cuando el área de referencia de receptores del hospital pediátrico sea la autonomía) o interterritorial (cuando el área de referencia de receptores pediátricos abarque más de una autonomía). Una vez desarrolladas dichas políticas, se considerará una prioridad autonómica y posteriormente nacional para la asignación de estos donantes.
Se ha de establecer un registro de potenciales receptores adultos de lóbulo hepático derecho ampliado, seleccionados por los diferentes equipos de trasplante, y que acepten el procedimiento a través de consentimiento informado.
Se debe realizar un esfuerzo máximo con el fin de homogeneizar en lo posible los criterios (asignación de donante, división de pedículos, selección de receptor) para TH con órgano procedente de bipartición.
No es aconsejable asignar un injerto procedente de bipartición hepática a un receptor adulto muy grave (ej. MELD > 24).
Trasplante hepático con donante en asistoliaIntroducciónSituación de la donación en asistolia en EspañaEn el año 2012 hubo en España 161 DA, lo que ha llegado a representar el 10% del número total de donantes. En comunidades como la de Madrid esta cifra se eleva hasta el 40%. Este hecho ha generado un gran interés por parte de los programas de trasplante, y en el momento actual ya hay 17 programas en 9 comunidades autónomas que han puesto en marcha programas de DA35.
Sin embargo, a pesar de su elevado potencial para aumentar el número de trasplantes, durante el año 2012, únicamente se realizaron 17 TH procedentes de DA en España, de un total de 1.084. Doce de los DA fueron no controlados (DA-nc) y 5 controlados (DA-c)35.
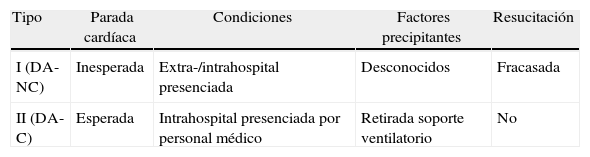
Clasificación de los donantes en asistoliaA efectos prácticos, los DA se pueden clasificar en 2 grupos fundamentales como queda reflejado en la tabla 1. En los DA-nc se produce una parada cardíaca presenciada, irrecuperable a pesar de las maniobras de reanimación cardiopulmonar (RCP), y se corresponden con el tipo 2 de DA de la clasificación de Maastricht. En los DA-c se produce una interrupción del soporte ventilatorio que determinará la posterior parada cardíaca y se corresponden con el tipo 3 de DA de la clasificación de Maastricht36.
Propuesta de clasificación de los donantes en asistolia (SETH)
| Tipo | Parada cardíaca | Condiciones | Factores precipitantes | Resucitación |
| I (DA-NC) | Inesperada | Extra-/intrahospital presenciada | Desconocidos | Fracasada |
| II (DA-C) | Esperada | Intrahospital presenciada por personal médico | Retirada soporte ventilatorio | No |
DA-c: donante en asistolia controlado; DA-nc: donante en asistolia no controlado.
Si bien la valoración de la donación de órganos para trasplante después de la llamada muerte cardiocirculatoria controlada (donantes tipo 3, según la categorización de Maastricht36 o la modificación de Madrid 201137) mereció una moratoria, según se refleja en el Documento de Consenso Español38 elaborado por los grupos españoles de trasplante y la ONT en el año 1995, por reservas de tipo ético, varios factores nos obligan a su reconsideración actualmente. España es el país con máxima actividad en trasplante de órganos procedentes de donantes fallecidos después de muerte cardiocirculatoria no controlada tipo 2 de Maastricht39–41, sin embargo, la actividad de TH realizada con la utilización de donantes tipo 3 de Maastricht o asistolia controlada no ha comenzado su desarrollo hasta muy recientemente42,43.
AplicabilidadEste tipo de trasplante, cada vez más frecuente en determinados países del ámbito europeo, ha ofrecido resultados equiparables a los obtenidos con la utilización de donantes por muerte encefálica (DME)44,45.
Los recientes cambios en el marco legal, en la línea del proyecto de ley 121/000132 Proyecto de ley reguladora de los derechos de la persona ante el proceso final de la vida46, podrían favorecer en un futuro el desarrollo de este tipo de donación.
Dentro de esta coyuntura, la ONT ha elaborado un Documento Nacional de Consenso2, en directa colaboración con los grupos de trasplante del ámbito nacional, con la intención de establecer las bases de este tipo de donación e impulsar su desarrollo, realizando un exhaustivo análisis de todos los aspectos de este tipo de actividad, incluyendo los ético-legales que, en un principio, resultaban uno de los puntos de debate más importantes.
Estos cambios han favorecido que algunos centros españoles hayan realizado con éxito sus primeros casos de TH con donante procedente de muerte cardiocirculatoria controlada.
Las complicaciones asociadas tradicionalmente a este tipo de donación, como son el fallo primario del injerto y la colangiopatía isquémica, dependientes del estrés hipóxico, parecen haber reducido notablemente su prevalencia, así como su impacto sobre la supervivencia de injertos y de pacientes. En las series más recientes, la supervivencia es mayor del 80%47–49 en el primer año del trasplante y la tasa de colangiopatía isquémica (complicación que frecuentemente obliga al retrasplante) baja45, incluso inferior a un 3%.
La decisión de retirada de medidas de soporte vital en un paciente crítico ha de ser previa e independiente del proceso de solicitud de donación y los criterios de los especialistas en cuidados intensivos responsables de los pacientes serán determinantes para que este tipo de donación se desarrolle37. No obstante, es preocupación de todos los profesionales de trasplante el fenómeno de una posible sustitución indiscriminada de la DME por este tipo de donación, evidenciada en otros países, y que es considerada una circunstancia negativa, dado que la citada sustitución podría conducir a una restricción cuantitativa y cualitativa en el TH44,50.
En cualquiera de los casos, es recomendable que los centros que asuman este tipo de actividad elaboren protocolos consensuados por los profesionales de los distintos ámbitos implicados en el trasplante, con la supervisión del comité ético correspondiente37.
En cuanto a los protocolos tácticos de actuación, se ha de destacar que el Documento Nacional de Consenso37 constituye una referencia que describe detalladamente todos los puntos relevantes una vez decidida la donación, tales como posibles actuaciones previas a la retirada de medidas (heparinización, canulación) o tiempos máximos de isquemia caliente en el donante. En dicho documento también se describen las pautas referentes a extracción de órganos y preservación de los mismos según los diferentes métodos, bien mediante extracción rápida y preservación fría51 bien con utilización de recirculación normotérmica52 previa a la preservación fría. Ambas alternativas son igualmente válidas, por lo que se elegirán dependiendo de la disponibilidad y preferencia de cada centro.
RecomendacionesLa donación después de muerte cardiocirculatoria controlada puede ser considerada una fuente útil y aplicable de injertos hepáticos dentro del ámbito nacional.
Esta fuente de donantes debe expandir la donación de órganos y nunca entrar en competencia con la DME.
Es aconsejable que se promuevan protocolos intrahospitalarios consensuados entre los diferentes profesionales implicados en la actividad de trasplante, con la participación de los comités éticos de los centros, en los que se detallen los procedimientos concretos a seguir para desarrollar en esta modalidad de donación.
Asistolia no controladaLos DA-nc tienen una serie de ventajas potenciales como donantes, determinadas por el hecho 1) de que la PCR se produce generalmente de forma extrahospitalaria y no después de una estancia más o menos prolongada en UCI; 2) porque nunca pueden evolucionar a DME, como algunos casos de DA-c y, por tanto, nunca van a disminuir el número de estos y 3) porque fallecen por causas naturales y no debido a la interrupción del soporte vital53. Además, prestigiosas organizaciones sanitarias como el Institute of Medicine de Estados Unidos han puesto de manifiesto el enorme potencial que el aprovechamiento de la DA-nc tendría para incrementar el número de trasplantes. Durante el año 2006, se estimó que al menos 22.000 personas que fallecían por una parada cardíaca fuera del hospital podrían ser donantes potenciales54.
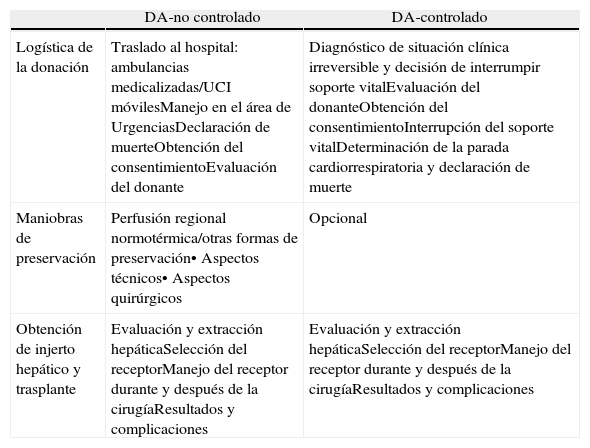
LogísticaLa logística del proceso de DA es específica de este contexto y difiere de forma importante en el caso de que los DA sean controlados o no controlados55,56 (tabla 2).
Logística del proceso de donación y trasplante en el caso de donación en asistolia
| DA-no controlado | DA-controlado | |
| Logística de la donación | Traslado al hospital: ambulancias medicalizadas/UCI móvilesManejo en el área de UrgenciasDeclaración de muerteObtención del consentimientoEvaluación del donante | Diagnóstico de situación clínica irreversible y decisión de interrumpir soporte vitalEvaluación del donanteObtención del consentimientoInterrupción del soporte vitalDeterminación de la parada cardiorrespiratoria y declaración de muerte |
| Maniobras de preservación | Perfusión regional normotérmica/otras formas de preservación• Aspectos técnicos• Aspectos quirúrgicos | Opcional |
| Obtención de injerto hepático y trasplante | Evaluación y extracción hepáticaSelección del receptorManejo del receptor durante y después de la cirugíaResultados y complicaciones | Evaluación y extracción hepáticaSelección del receptorManejo del receptor durante y después de la cirugíaResultados y complicaciones |
El desarrollo de protocolos específicos de actuación en esta primera fase de la DA no es competencia directa de los profesionales que participan en esta reunión de consenso y han sido ampliamente discutidos en otros foros37. Los coordinadores de trasplante, médicos intensivistas y de atención extrahospitalaria tienen un rol fundamental en el desarrollo de protocolos intra- y extrahospitalarios que puedan permitir la posterior donación. Los aspectos éticos y legales también han de ser conocidos y respetados, con una gran variabilidad de leyes en todo el mundo, incluyendo los países de nuestro entorno, que impide, en ocasiones, la implementación de programas de este tipo57. Las bases legales para la donación de DA-nc en España se encuentran recogidas en la ley general 30/1979 y en el reciente real decreto 1723/2012 donde se establecen de forma clara los criterios cardiorrespiratorios y las condiciones para el diagnóstico de la muerte en los que se han de basar los protocolos de DA-c y DA-nc.
Logística de la donación en asistolia no controlada y recursos necesarios para su implementaciónEn los DA-nc, tras la PCR, se han practicado maniobras de soporte vital avanzado siguiendo recomendaciones de autoridades sanitarias competentes como el European Resuscitation Council58. Una vez realizadas dichas maniobras, el paciente puede volver a la circulación espontánea y completar su recuperación en el hospital, o no, siendo en este último caso posible la activación del proceso de donación. El proceso de muerte en los DA-nc conlleva, por tanto, el cese inicial de la función circulatoria y respiratoria espontáneos, tras lo que se inician maniobras de RCP avanzadas por personal sanitario antes y durante el traslado del paciente al hospital. Una vez en el hospital, se continúan dichas maniobras hasta que se considera que existe un cese de funciones irreversible y se procede a realizar un periodo de observación de 5 min durante el cual debe existir una ausencia de actividad electrocardiográfica espontánea. Tras dicho proceso se realiza el diagnóstico de la muerte del paciente.
La implementación de programas de DA-nc en nuestro país debe realizarse en áreas de población con un potencial suficiente para garantizar su viabilidad. Idealmente debe establecerse en áreas metropolitanas con adecuada infraestructura en cuanto a unidades de soporte vital avanzado, soporte vital intermedio y unidades de asistencia médica rápida. Experiencias como la de Granada, con una población mínima de 600.000 habitantes, muestran la posibilidad de obtener 8 donantes hepáticos potenciales al año. La experiencia en Cataluña demuestra que el desarrollo de programas específicos de donación en asistolia producen un incremento significativo del número de donantes potenciales a lo largo de los años. En el Hospital Clínic de Barcelona se pasó de 5 potenciales donantes en el año 2002 a 83 en el año 201041.
Activación del protocolo de donación en asistolia no controladaSiempre tras el diagnóstico de la muerte por el profesional competente para ello, se podría proceder a la activación del procedimiento de donación en asistolia. Dicho procedimiento se iniciará con la toma de muestras para la realización de serologías y microbiología, bioquímica e inmunología. En este momento, también se puede proceder a la heparinización del donante, a dosis de 3mg/kg.
Características de los donantes potenciales de hígado en la donación en asistolia no controladaLas características iniciales que han de presentar los DA-nc para activar el protocolo de preservación y evaluación se resumen a continuación:
- -
Edad: 14 (40kg)-65 años
- -
Parada cardiorrespiratoria (PCR): presenciada, < 15 min hasta la instauración de maniobras de RCP. Se excluyen los casos de muerte violenta o con indicios de criminalidad.
- -
RCP: duración total < 150 min hasta la instauración de la recirculación abdominal.
- -
Traslado al hospital: siempre con intubación orotraqueal y RCP continuada, manual o mecánica. El uso de compresores mecánicos tipo LUCAS es altamente recomendable durante los traslados, ya que ha demostrado una mayor eficacia frente a la RCP manual a la hora de garantizar una adecuada perfusión tisular59–61.
- -
Contraindicaciones: aspecto externo indicativo de adicción a drogas por vía parenteral, presencia de hemorragia activa por lesiones en tórax o abdomen, historia de infecciones sistémicas o enfermedades neoplásicas que contraindiquen la donación.
Hasta el momento, se han desarrollado 4 técnicas de mantenimiento del DA con el fin de garantizar una adecuada preservación del injerto hepático para trasplante, antes de su extracción:
- -
La perfusión in situ, mediante la cual se inicia la perfusión con una solución de preservación fría a través de los vasos inguinales. Es una técnica fácil y rápida, pero ha mostrado resultados inferiores en trasplante renal.
- -
Las compresiones simultáneas torácicas (mecánicas) y abdominales (manuales) con el fin de mantener una PAM ≥ 70mmHg y una PaO2 ≥ 100mmHg39,62.
- -
La recirculación hipotérmica, que ha sido utilizada principalmente para mantener DA-c, obteniendo resultados variables, con altas tasas de función retardada del injerto en algunas series renales, con poca experiencia en DA-nc63–68.
- -
La recirculación normotérmica, también denominada actualmente perfusión regional normotérmica (PRN), que parece garantizar una mejor función inmediata de los órganos tras el trasplante y se ha constituido como la técnica de elección en la preservación de órganos abdominales52,55.
Durante la realización de las maniobras de PRN es recomendable la colocación de un catéter de Fogarty® antes del inicio de las mismas con el fin de ocluir la aorta supracelíaca. De este modo se consigue mejorar el flujo sanguíneo a los órganos abdominales de interés, en especial al hígado. Por otro lado, se evita la reinstauración de la circulación cardíaca o cerebral.
La imposibilidad de realización de la PRN debido a una falta de retorno venoso al circuito constituye la mayor contraindicación para la donación en DA-nc41. Dependiendo de la causa de muerte, hay distintos factores que pueden condicionar este hecho, como la presencia de hemorragias internas, o problemas vasculares, como una ateromatosis severa o aneurismas de aorta abdominal. A su vez, hay factores técnicos que pueden determinar el fracaso de la PRN. En este sentido, la utilización de cánulas multiperforadas, colocadas en posición retrohepática, de bombas centrífugas o la eliminación del reservorio en el circuito son alternativas que podrían mejorar la aplicabilidad de la técnica. La existencia de un personal entrenado en este tipo de técnicas de perfusión con una rápida capacidad de respuesta cuando se activa el protocolo de DA-nc es fundamental si se contempla instaurar un programa de este tipo.
Evaluación del donante en asistolia no controlado durante la perfusión regional normotérmicaLas características que ha de presentar la PRN y que van a condicionar la aceptación del injerto hepático para trasplante se resumen a continuación:
- -
Temperatura del circuito: 37°C
- -
pH: 7,35-7,45
- -
PaO2: 100-150mmHg
- -
Hematocrito: superior al 20%
- -
AST, ALT iniciales:<3 veces el límite superior de la normalidad
- -
AST, ALT finales:<4 veces el límite superior de la normalidad
- -
Flujo de bomba de recirculación: > 1,7 l/min con Fogarty® en la aorta supracelíaca
- -
Heparinización: 1,5mg/kg cada 90min
- -
Duración recomendable: inferior a 4 h
En la experiencia del Hospital Clínic de Barcelona, utilizando criterios similares a los anteriores, en el periodo desde abril del 2002 hasta diciembre del 2010, se instauró PRN en 290 DA-nc y, de estos, 145 fueron excluidos durante el periodo de PRN, lo que indica que la evaluación del donante durante dicho periodo es fundamental a la hora de seleccionar su idoneidad41.
Evaluación final del donante en asistolia durante el proceso de extracciónLa evaluación final intraoperatoria del injerto es muy importante y especialmente relevante en este tipo de donantes. Para su aceptación, será necesario que tanto el hígado como el colédoco y la vesicular biliar tengan un aspecto adecuado antes y después de la perfusión fría.
La realización de una biopsia hepática para evaluación microscópica del hígado no es recomendable, ya que está sujeta a un amplio margen de error en este contexto y difícilmente facilitará la toma de decisiones69–71.
Durante el proceso de extracción se recomienda una técnica rápida, así como el mantenimiento de la PRN hasta la introducción de la solución de preservación en los casos de DA-nc. La utilización de soluciones de preservación que no contienen coloide ha sido controvertida. Aunque dichas soluciones pueden mejorar el lavado del árbol arterial peribiliar, en algunos estudios se ha demostrado que su uso incrementa significativamente el riesgo de pérdida del injerto hepático procedente de DA72–74.
Manejo intraoperatorio del receptor durante el trasplante hepático de un donante en asistoliaEl manejo hemodinámico intraoperatorio del receptor de un TH procedente de un DA ha de ser especialmente cuidadoso. No ha de diferir del que se realiza en los receptores de un órgano de un DME, pero puede requerir una mayor intensidad en su aplicación, ante la posibilidad de aparición de inestabilidad hemodinámica tras la reperfusión del injerto. Será especialmente relevante el manejo de fluidos, siendo recomendable el mantenimiento de una presión venosa central de alrededor de 5mmHg, así como iniciar un soporte vasopresor precoz, antes de la reperfusión del injerto, y realizar medidas de protección renal (mantenimiento de una presión arterial media superior a 70mmHg y una diuresis superior a 0,5ml/kg/h).
Ante el mayor riesgo de aparición de coagulopatía severa tras la reperfusión de injertos procedentes de DA-nc, las siguientes medidas se recomiendan, de acuerdo al protocolo de actuación del Hospital Clínic de Barcelona: mantener una hemoglobina superior a 8g/l y un hematocrito superior a 24%, administrar ácido tranexámico (10mg/kg bolus en la inducción y 10mg/kg/h hasta la anastomosis biliar), mantener un nivel de plaquetas superior a 50.000 y fibrinógeno superior a 2g/l antes de la reperfusión y en el momento del cierre, administrar plasma fresco congelado 15mg/kg si el INR es superior a 1,7 o el tiempo de protrombina es inferior al 40%, administrar factor VIIa en caso de hemorragias no controlables, y realización de packing durante 48h para hemorragias en sábana.
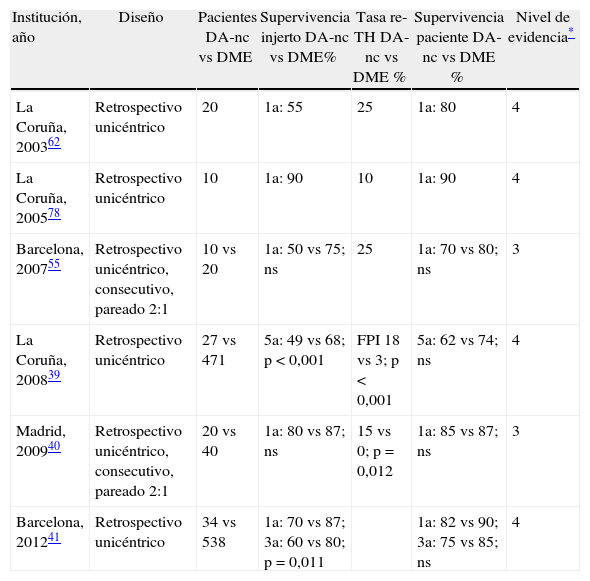
Resultados y complicaciones del trasplante hepático con injertos procedentes de donantes en asistoliaSupervivencia en el trasplante hepático procedente de donantes en asistolia no controladoAlgunos trabajos publicados de nuestro país han comparado los resultados postrasplante al utilizar injertos procedentes de DA-nc y de DME (tabla 3). En un estudio del Hospital 12 de Octubre de Madrid, en el que se incluyeron 20 DA-nc en los que se utilizó un sistema de PRN, la supervivencia del injerto y del paciente no fue diferente de la obtenida en 40 pacientes trasplantados con injertos procedentes de DME40. En otro estudio del Hospital Clínic de Barcelona, en el que se incluyó a 34 pacientes trasplantados con DA-nc con una mediana de seguimiento de 24 meses (rango 0-111), la supervivencia del injerto al año fue del 70%, significativamente inferior a la obtenida con injertos procedentes de DME que fue del 87% (p=0,011). Sin embargo, el número de injertos que sobrevivieron más de 6 meses tras el TH fue significativamente mayor en la segunda mitad de la serie, 15 (88%) frente a los de la primera mitad, 9 (53%) (p=0,024), lo que sugiere un efecto de aprendizaje con el proceso de DA y una mejora significativa en la supervivencia del injerto con el tiempo. Además, la supervivencia del paciente al año y a los 5 años después del trasplante fue similar entre los DA-nc y los DME.
Supervivencia del injerto y del paciente en el trasplante hepático procedente de DA-nc frente al procedente de DME
| Institución, año | Diseño | Pacientes DA-nc vs DME | Supervivencia injerto DA-nc vs DME% | Tasa re-TH DA-nc vs DME % | Supervivencia paciente DA-nc vs DME % | Nivel de evidencia* |
| La Coruña, 200362 | Retrospectivo unicéntrico | 20 | 1a: 55 | 25 | 1a: 80 | 4 |
| La Coruña, 200578 | Retrospectivo unicéntrico | 10 | 1a: 90 | 10 | 1a: 90 | 4 |
| Barcelona, 200755 | Retrospectivo unicéntrico, consecutivo, pareado 2:1 | 10 vs 20 | 1a: 50 vs 75; ns | 25 | 1a: 70 vs 80; ns | 3 |
| La Coruña, 200839 | Retrospectivo unicéntrico | 27 vs 471 | 5a: 49 vs 68; p < 0,001 | FPI 18 vs 3; p<0,001 | 5a: 62 vs 74; ns | 4 |
| Madrid, 200940 | Retrospectivo unicéntrico, consecutivo, pareado 2:1 | 20 vs 40 | 1a: 80 vs 87; ns | 15 vs 0; p=0,012 | 1a: 85 vs 87; ns | 3 |
| Barcelona, 201241 | Retrospectivo unicéntrico | 34 vs 538 | 1a: 70 vs 87; 3a: 60 vs 80; p=0,011 | 1a: 82 vs 90; 3a: 75 vs 85; ns | 4 |
DA-nc: donante en asistolia no controlado; DME: donante muerte encefálica; FPI: fallo primario del injerto; re-TH: retrasplante.
Nivel de evidencia basado en clasificación del Centro para la Medicina Basada en la Evidencia de Oxford (www.cebm.net).
En la actualidad, la aparición de colangiopatía isquémica tras el TH procedente de DA tiene un gran impacto en la necesidad de retrasplante, habiendo disminuido la necesidad de retrasplante por otras causas, como la aparición de un fallo primario del injerto o complicaciones vasculares agudas. En una serie de Tianjin (China), donde se analizaron 80 casos de re-TH tras un primer TH procedente de DA-nc, en el 45% de los mismos la indicación de retrasplante fue debida a la aparición de complicaciones biliares75.
El manejo de la colangiopatía isquémica tras el TH es complejo y está asociado a un incremento importante de los costes después del mismo, ya que requiere de la realización de procedimientos de radiología intervencionista que, en la mayor parte de los casos, son paliativos, y de reingresos hospitalarios prolongados76.
Siguiendo un protocolo estricto de selección de DA-nc como el recomendado en este artículo, la aparición de colangiopatía isquémica puede reducirse de forma significativa. En la experiencia del Hospital Clínic de Barcelona la aparición de la misma se redujo hasta un 8% (3 casos), cifra inferior a las tasas referidas en centros en los que se había practicado el TH con DA-c41. Los 3 pacientes que la desarrollaron fueron retrasplantados a los 5, 8 y 13 meses postrasplante.
Con respecto a la técnica quirúrgica, no existe evidencia alguna que aconseje la utilización de un tubo en T en la reconstrucción de la vía biliar en el receptor, aunque podría facilitar la realización de colangiografías seriadas postoperatorias para el diagnóstico. En la actualidad, la colangio-RMN puede sustituir a la colangiografía a través del tubo en T. La realización de biopsias y colangio-RMN depende de la evolución clínica en la experiencia de los grupos de Barcelona y La Coruña. Sin embargo, en el Hospital 12 de Octubre de Madrid se practica una biopsia obligatoria al año del trasplante y una colangio-RMN a los 6 meses del mismo.
Selección del receptorDebido a la limitada experiencia con este tipo de DA, hasta el momento no hay trabajos publicados basados en análisis multivariados de factores asociados con características del receptor que puedan afectar a los resultados postrasplante.
Por ello, únicamente podemos analizar las características de los pacientes trasplantados con DA-nc en los centros españoles con experiencia. En la experiencia reportada del Hospital 12 de Octubre de Madrid, la edad del receptor fue de 59±6 años (rango 48-67), la mediana de puntuación de Child-Pugh 10±2 (rango 6-13) y la de MELD de 19±6 (rango 10-34), respectivamente. La principal indicación de trasplante fue cirrosis alcohólica en un 60% y cirrosis VHC en 30%40.
En la serie del Hospital Clínic de Barcelona, la mediana de edad fue de 55 años (rango 49-60) y la mediana de MELD 19 puntos (rango 14-21). Los receptores se clasificaron como Child-Pugh A y B en el 47% de los casos y Child C en el 53%. Las principales indicaciones fueron cirrosis alcohólica (24%), CHC (32%) y cirrosis VHC, estando un 74% de los receptores infectados por el VHC. Es destacable el hecho de que las características cambiaron a lo largo del tiempo con la mayor experiencia acumulada, siendo, en la primera mitad de la serie, un 71% de los pacientes Child-Pugh C, frente a un 35% de los pacientes en la segunda mitad de la serie (p = 0,039). Además, la puntuación de MELD pretrasplante tendía a ser más alta en la primera mitad de la serie frente a la segunda mitad: 20 (rango 18-23) frente a 1614–19 (p=0,112). Por otro lado, el 53% de los receptores en la primera mitad de la serie y el 18% de los de la segunda mitad fueron admitidos en el hospital antes del trasplante por descompensaciones (p = 0,031)41.
Por otro lado, el tiempo de isquemia fría del injerto parece tener un impacto negativo en los resultados del TH con DA, ya que es mucho más deletérea en los injertos que han sufrido un periodo inicial de isquemia caliente antes de la preservación76,77. Ante este hecho, hay factores relacionados con el receptor que podrían hacer incrementar el tiempo de isquemia fría y que, a priori, deberían ser evitados.
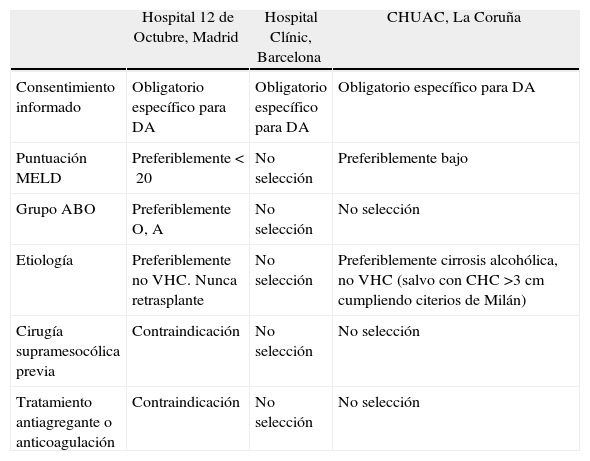
Ante esta baja evidencia, en España, la modificación en los criterios de selección de los receptores es variable, y dependerá de las políticas aplicadas en la lista de espera en cada hospital y región. En la tabla 4, se muestran los criterios de selección del receptor en los 3 hospitales españoles, hasta el momento, más activos con este tipo de donación.
Selección del receptor para trasplante con injertos de donante en asistolia
| Hospital 12 de Octubre, Madrid | Hospital Clínic, Barcelona | CHUAC, La Coruña | |
| Consentimiento informado | Obligatorio específico para DA | Obligatorio específico para DA | Obligatorio específico para DA |
| Puntuación MELD | Preferiblemente<20 | No selección | Preferiblemente bajo |
| Grupo ABO | Preferiblemente O, A | No selección | No selección |
| Etiología | Preferiblemente no VHC. Nunca retrasplante | No selección | Preferiblemente cirrosis alcohólica, no VHC (salvo con CHC >3cm cumpliendo citerios de Milán) |
| Cirugía supramesocólica previa | Contraindicación | No selección | No selección |
| Tratamiento antiagregante o anticoagulación | Contraindicación | No selección | No selección |
CHC: carcinoma hepatocelular; CHUAC: Complejo Hospitalario Universitario de A Coruña; DA: donante en asistolia; VHC: virus de la hepatitis C.
Hasta la fecha, no se han evaluado específicamente los resultados del TH con DA-nc en receptores VHC positivos, por lo que no se puede establecer ninguna conclusión al respecto. Sin embargo, la serie del Hospital Clínic de Barcelona muestra unos resultados satisfactorios a pesar del hecho de que un 74% de los receptores son VHC positivos, lo que sugiere que quizás no sea un factor que afecte específicamente a los resultados. Obviamente, se necesitan estudios a mayor escala para establecer alguna conclusión al respecto.
RecomendacionesPor la baja aplicabilidad actual del TH de DA-nc, su mayor complejidad organizativa y, teniendo en cuenta las listas de espera de cada centro de forma individualizada, no se puede recomendar la implementación de esta modalidad de donación en todos los centros de trasplante.
En los centros en los que se active un programa de donación de este tipo, es recomendable la asignación de un lugar específico para la realización de las maniobras de preservación y para la permanencia del donante durante el proceso de evaluación, antes del traslado al quirófano para la extracción de los órganos. El procedimiento de preservación de los órganos incluye el inicio de cardiocompresión y ventilación mecánica hasta la realización de la canulación para el inicio de recirculación sanguínea del territorio abdominal.
La duración de las distintas fases del donante es un parámetro fundamental que afectará en gran medida a la viabilidad de los órganos para trasplante. Una vez instauradas las maniobras de RCP y, hasta el inicio de la PRN, no deben trascurrir más de 150 min, periodo que incluye el tiempo de canulación de los vasos femorales. La duración del periodo de PRN no debe ser superior a los 240 min.
La PRN antes de la extracción, mediante un sistema similar al ECMO, es esencial en los DA-nc para mantener y seleccionar la idoneidad de los injertos hepáticos para el trasplante. El uso de PRN permite rechazar injertos hepáticos basados en parámetros de viabilidad. Si las transaminasas iniciales son elevadas o continúan aumentando durante el periodo de preservación, esto refleja la existencia de un daño hepático irreparable.
La evaluación hepática en DA es más compleja que en DME debido al periodo de isquemia adicional. Dicha evaluación es un proceso dinámico y no basado en un único parámetro. La evaluación macroscópica ha de ponderar 2 aspectos principales. En primer lugar, cuando exista algún parámetro adicional de mal pronóstico, como la existencia de esteatosis hepática, es recomendable la no utilización de dichos injertos. Por otro lado, siendo conocida la mayor sensibilidad del árbol biliar a la isquemia caliente, su evaluación cuidadosa durante la extracción es fundamental. La presencia de áreas de isquemia intestinal durante la extracción puede ser un indicador indirecto que ayude en la toma de decisiones de aceptación o no del injerto hepático.
En el TH procedente de DA-nc, puede existir una severa inestabilidad hemodinámica y coagulopatía después de la reperfusión por lo que es recomendable el inicio precoz de soporte vasopresor y el uso de profilaxis con antifibrinolíticos, así como recuperar un mínimo de plaquetas y fibrinógeno antes de la reperfusión, al final de la cirugía y durante la estancia en UCI. La transfusión de plasma fresco debe basarse en la evidencia clínica de hemorragia más que en los test de laboratorio.
Para disminuir la incidencia de complicaciones biliares y optimizar el uso de DA, se recomienda aplicar estrictos criterios de selección. Limitando la selección de DA de acuerdo a los parámetros expresados con anterioridad en este documento, el riesgo de complicaciones biliares puede ser minimizado. La duración del periodo de inadecuada perfusión tisular y oxigenación de los órganos durante la parada cardíaca y maniobras de RCP es clave para la aparición de complicaciones biliares y debe conocerse con exactitud. Asímismo, es fundamental la administración de heparina al donante antes del inicio de las maniobras de preservación hepática.
Ante la aparición de colangiopatía isquémica en los receptores de DA, en aquellos centros donde la lista de espera se organice de acuerdo al MELD, es recomendable que se permita priorizar a aquellos receptores de injertos de DA en los que el MELD puede no reflejar la morbimortalidad asociada a esta situación clínica.
La mejor selección de los receptores puede haber contribuido a la mejora en los resultados del TH con DA-nc a lo largo del tiempo, por lo que puede ser recomendable que se ofrezca este tipo de trasplante a aquellos receptores de menor riesgo.
La existencia de cirugía previa abdominal, trombosis de la vena porta o la realización de un retrasplante, aunque no han sido evaluados claramente en los estudios clínicos, podrían ser considerados contraindicaciones relativas para el TH con DA.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Manuel Abradelo (coordinador). Hospital Doce de Octubre (Madrid)
Constantino Fondevila (coordinador). Hospital Clinic (Barcelona)
Patricia Ruiz Ordorica. Hospital de Cruces (Bilbao)
Gerardo Blanco. Hospital Infanta Cristina (Badajoz)
Javier Briceño. Hospital Reina Sofía (Córdoba)
Ramón Charco. Hospital Vall d’Hebrón (Barcelona)
Daniel Garrote. Hospital Virgen de las Nieves (Granada)
Miguel Ángel Gómez Bravo. Hospital Virgen del Rocío (Sevilla)
Rafael López Andújar. Hospital La Fe (Valencia)
Manuel López Santamaría. Hospital La Paz (Madrid)
Alejandra Otero. Complejo Hospitalario Universitario de A Coruña (La Coruña)
Baltasar Pérez Saborido. Hospital Río Hortega (Valladolid)
Víctor Sánchez Turrión. Hospital Puerta de Hierro (Majadahonda, Madrid).
Autor para correspondencia.
Correo electrónico: iherrero@unav.es (J.I. Herrero).