El objetivo de nuestro estudio consistió en identificar aquellas pacientes con diagnóstico preoperatorio de carcinoma ductal in situ (CDIS) y alto riesgo de presentar un carcinoma infiltrante en la lesión, en las que se debería considerar realizar una biopsia selectiva de ganglio centinela (BSGC).
MétodosSe estudiaron 105 pacientes con CDIS tratadas mediante cirugía conservadora o mastectomía. Se analizaron las características preoperatorias de los tumores para investigar su asociación con la infraestimación de carcinoma infiltrante.
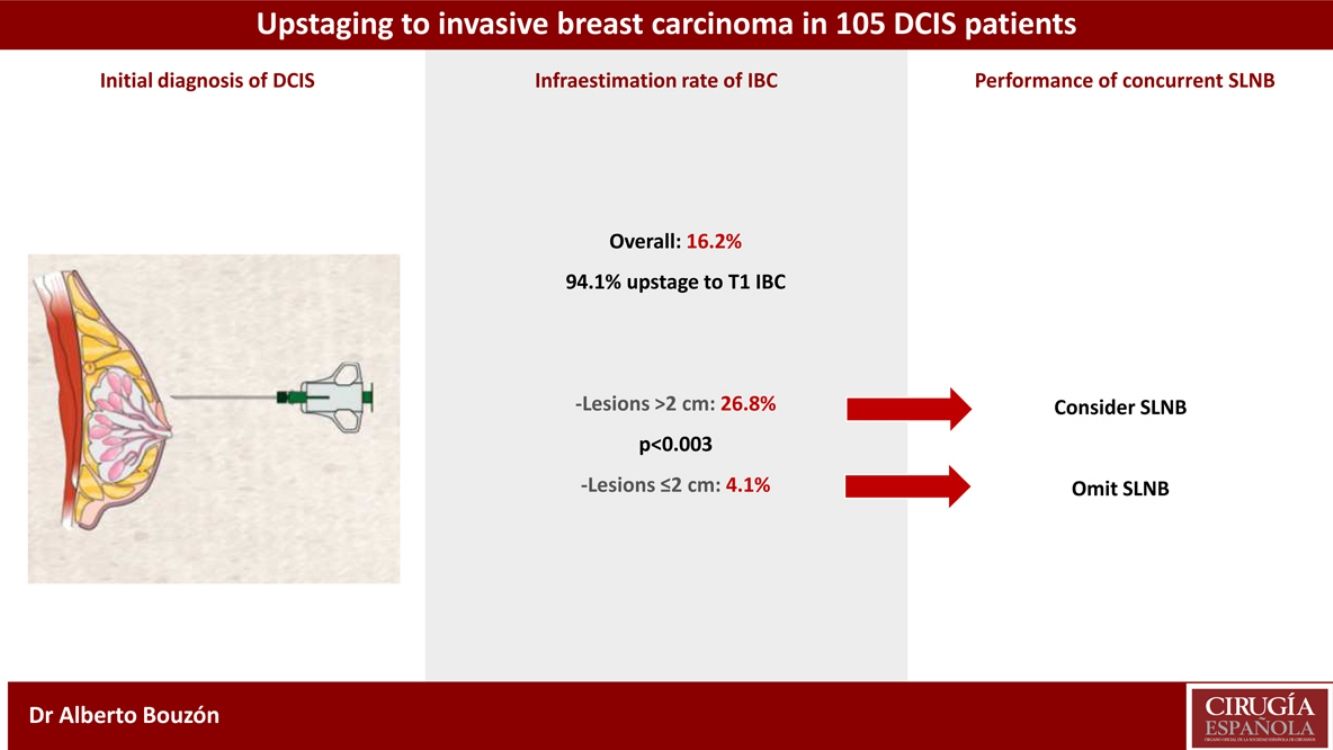
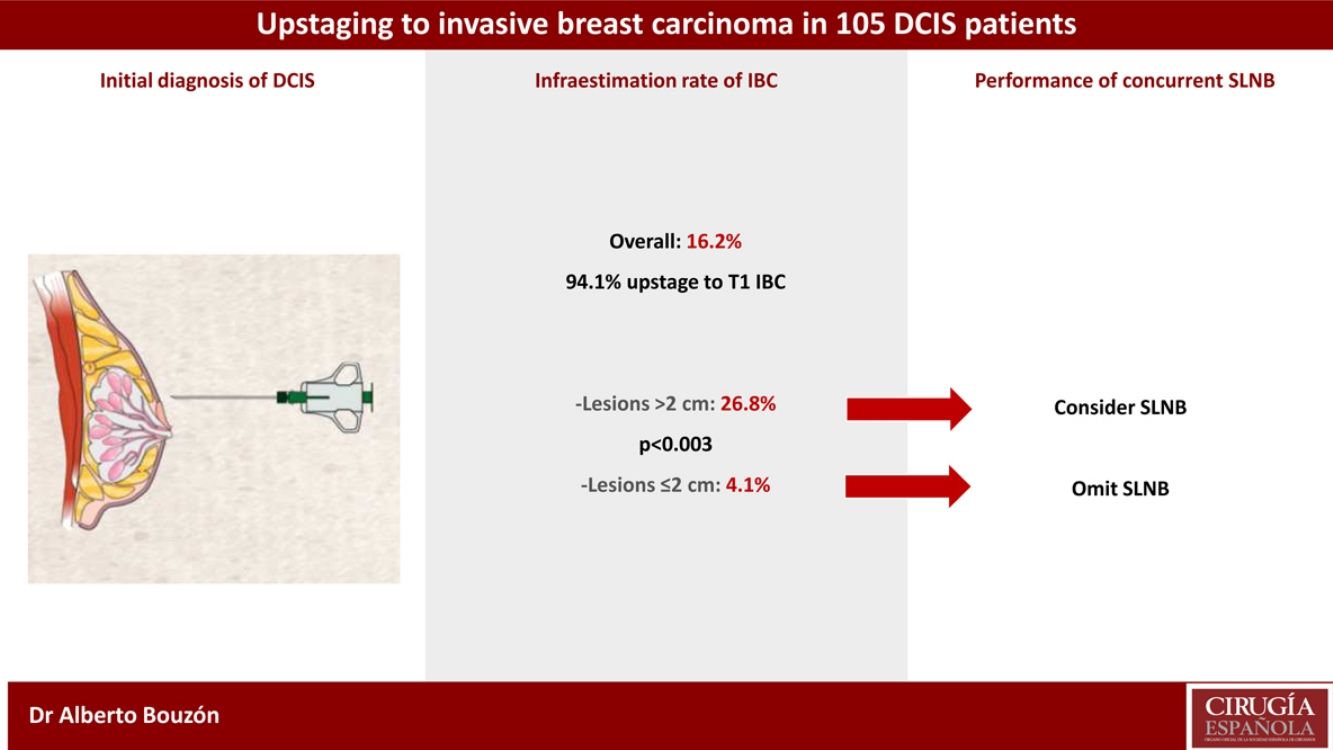
ResultadosEl porcentaje global de infraestimación de carcinoma infiltrante fue del 16,2%. El porcentaje de infraestimación fue mayor en las lesiones con un tamaño inicial superior a 2 cm en comparación con las lesiones con un tamaño igual o menor a 2 cm (26,8% vs. 4,1%, respectivamente; p < 0,003). Se realizó la BSGC en 88 pacientes (83,8%), encontrándose afectación ganglionar en un solo caso (1,1%).
ConclusionesEn pacientes con diagnóstico inicial de CDIS tratadas mediante cirugía conservadora, se debería considerar realizar una BSGC cuando el tamaño de la lesión es superior a 2 cm, ya que uno de cada cuatro casos albergará la presencia de un carcinoma infiltrante.
The aim of our study was to identify those patients with preoperative diagnosis of ductal carcinoma in situ (DCIS) and high risk of upstaging to invasive breast carcinoma (IBC), in whom sentinel lymph node biopsy (SLNB) should be considered.
MethodsOne-hundred and five DCIS patients treated with breast-conserving surgery (BCS) or mastectomy were studied. Preoperative features of the tumors were analyzed to investigate its association with underestimation of IBC on final pathology.
ResultsOverall, the underestimation rate of IBC was 16.2%. The underestimation rate was highest in lesions with initial size >2 cm compared with those with size ≤2 cm (26.8% vs. 4.1%, respectively; p < 0.003). Eighty-eight patients (83.8%) underwent concurrent SLNB and only one case had lymph node involvement (1.1%).
ConclusionsSLNB should be considered in DCIS patients receiving BCS with lesions greater than 2 cm since approximately one in four will harbor an IBC.
El carcinoma ductal in situ (CDIS) se considera una lesión precursora no obligatoria del cáncer de mama infiltrante. La proporción de diagnósticos de CDIS ha aumentado desde la implementación del programa de cribado mamario, lo que representa aproximadamente el 20% de todos los nuevos carcinomas de mama en mujeres1. Hasta el 90% de los casos presentan microcalcificaciones sospechosas en la mamografía2.
El tratamiento local del CDIS incluye la cirugía conservadora de mama, generalmente seguida de radioterapia, y la mastectomía, en función de la relación entre el tamaño tumoral y mamario, y de las preferencias de la paciente. La mayoría de las lesiones de CDIS detectadas durante el cribado podrían tratarse mediante cirugía conservadora. En las pacientes con CDIS tratadas mediante cirugía conservadora, la radioterapia reduce el riesgo de recaída mamaria ipsilateral en un 15,2%3.
La biopsia selectiva de ganglio centinela (BSGC) es la técnica de elección para la estadificación axilar en pacientes con carcinoma infiltrante de mama en estadio precoz, aunque no se recomienda de forma rutinaria en las pacientes con diagnóstico preoperatorio de CDIS tratadas mediante cirugía conservadora. Sin embargo, se ha sugerido realizar una BSGC de forma concomitante en las pacientes con CDIS y alto riesgo de reestadificación a carcinoma infiltrante4.
El objetivo del estudio consistió en investigar la incidencia de reestadificación a carcinoma infiltrante de mama en nuestra serie de pacientes diagnosticadas de CDIS mediante biopsia radioguiada, además de identificar aquellos casos con mayor probabilidad de infraestimar la presencia de un carcinoma infiltrante y, por tanto, en los que se debería considerar la realización de una BSGC.
MétodosSe trataron 105 pacientes con diagnóstico inicial de CDIS de mama desde enero de 2014 hasta octubre de 2019. Se excluyeron las pacientes con CDIS asociado a enfermedad de Paget, CDIS con microinvasión, antecedentes de cáncer de mama previo, biopsia quirúrgica de mama previa o contraindicación para radioterapia. Este estudio retrospectivo fue aprobado por el Comité de Ética de la Investigación de nuestra Área Sanitaria (No 2019/446).
Las pacientes fueron diagnosticadas mediante biopsia con aguja gruesa (aguja de calibre 11) en caso de masa, nódulo o distorsión arquitectural, o mediante biopsia asistida por vacío (aguja de calibre 10) en caso de presencia de calcificaciones. En las muestras obtenidas mediante biopsia asistida por vacío se realizó un examen radiológico para confirmar la presencia de calcificaciones. En las lesiones de pequeño tamaño se colocó un clip marcador después de realizar la biopsia.
Las muestras de biopsia se fijaron en formalina tamponada al 10%, se incluyeron en parafina y se tiñeron con hematoxilina-eosina estándar para su estudio histológico. En la mayoría de los casos se describió el grado nuclear, el patrón arquitectural, la presencia de necrosis y el estado del receptor de estrógeno (RE).
Todas las pacientes fueron tratadas mediante cirugía mamaria. Se realizaron cortes de 5 mm en las muestras quirúrgicas y se procesaron de forma rutinaria. La presencia de carcinoma infiltrante y la extensión de la enfermedad se reflejaron en el informe histopatológico definitivo. La microinvasión se definió como un foco tumoral ≤ 1 mm. Un margen de 2 mm se aceptó como negativo para las pacientes con CDIS.
El ganglio centinela (GC) se identificó utilizando sulfuro coloidal marcado con tecnecio 99m o colorante azul de isosulfán. Se realizaron secciones de los GC a intervalos de 2 mm y se enviaron para su procesamiento rutinario.
La afectación de los ganglios linfáticos se categorizó como macrometástasis (> 2 mm), micrometástasis (> 0,2 y ≤ 2 mm) o células tumorales aisladas (≤ 0,2 mm).
Análisis estadísticoSe calculó la incidencia de reestadificación a carcinoma infiltrante. Se realizó un análisis univariante para examinar la asociación entre las características iniciales del tumor y la presencia de carcinoma infiltrante en el estudio histopatológico definitivo, mediante el test de X2 o el test exacto de Fisher para variables categóricas. Un valor de p < 0,05 se consideró estadísticamente significativo. Todos los análisis estadísticos se realizaron con el software SPSS (versión 23).
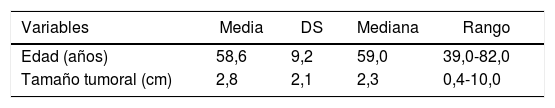
ResultadosLa mayoría de las lesiones de CDIS se detectaron durante el cribado (74,3%). Las características clínico-patológicas de las pacientes se resumen en la tabla 1. La edad media de las pacientes fue de 58,6 años y el promedio del tamaño tumoral preoperatorio fue de 2,8 cm. Las microcalcificaciones fueron la presentación inicial de la lesión en la mamografía en 90 pacientes (85,7%). El diagnóstico preoperatorio de CDIS se realizó mediante biopsia asistida por vacío en 80 pacientes (76,2%).
Características clínicas y tumorales (n = 105)
| Variables | Media | DS | Mediana | Rango |
|---|---|---|---|---|
| Edad (años) | 58,6 | 9,2 | 59,0 | 39,0-82,0 |
| Tamaño tumoral (cm) | 2,8 | 2,1 | 2,3 | 0,4-10,0 |
| n | % | IC 95% | ||
|---|---|---|---|---|
| Tipo de biopsia | BAG | 25 | 23,8 | 16,5-33,0 |
| BAV | 80 | 76,2 | 66,9-83,5 | |
| Microcalcificaciones | No | 15 | 14,3 | 8,7-22,5 |
| Sí | 90 | 85,7 | 77,5-91,3 | |
| Grado histológico | Bajo-Medio | 37 | 35,2 | 26,6-44,9 |
| Alto | 68 | 64,8 | 55,0-73,4 | |
| Comedonecrosis | No | 38 | 36,2 | 27,4-45,9 |
| Sí | 63 | 60,0 | 52,2-69,0 | |
| Desconocido | 4 | 3,8 | 1,4-9,9 | |
| Estado del RE | Positivo | 66 | 62,9 | 53,1-71,7 |
| Negativo | 18 | 17,1 | 10,9-25,7 | |
| Desconocido | 21 | 20,0 | 13,3-28,9 |
DS: desviación estándar; IC: intervalo de confianza; BAG: biopsia con aguja gruesa; BAV: biopsia asistida por vacío; RE: receptor de estrógeno
De forma global, la tasa de reestadificación a carcinoma infiltrante fue del 16,2% (17/105). La mayoría de estas pacientes progresaron a un estadio T1 (94,1%). El tamaño medio del carcinoma infiltrante fue de 0,7 cm (rango 0,1-3,6 cm). En nueve pacientes (8,6%) no se detectó CDIS o carcinoma infiltrante residual en la pieza quirúrgica.
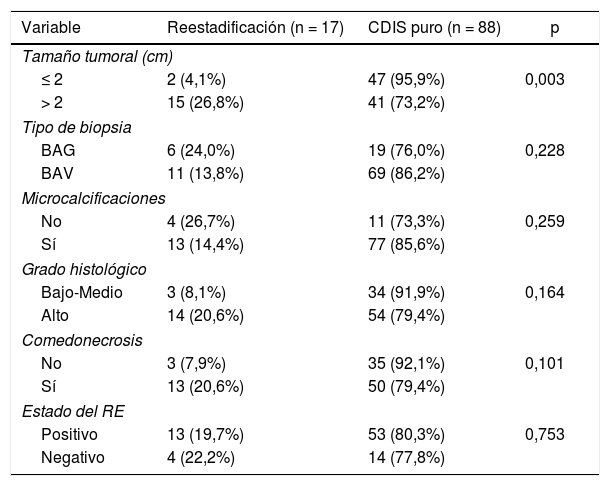
El análisis univariante de los factores clínico-patológicos predictivos de la infraestimación de carcinoma infiltrante en las pacientes con CDIS se resumen en la tabla 2. Entre todas las características tumorales examinadas, el único factor asociado a la reestadificación a carcinoma infiltrante fue el tamaño inicial del tumor. Se observó una diferencia estadísticamente significativa en la tasa de infraestimación de carcinoma infiltrante entre las pacientes con una extensión inicial de la lesión > 2 cm o ≤2 cm (26,8% vs. 4,1%; p < 0,003). El tipo de biopsia, la presencia de microcalcificaciones, el grado nuclear, la presencia de comedonecrosis y el estado de los RE no se asociaron con la reestadificación a enfermedad invasiva.
Factores predictivos de la infraestimación del carcinoma infiltrante de mama. Análisis univariante
| Variable | Reestadificación (n = 17) | CDIS puro (n = 88) | p |
|---|---|---|---|
| Tamaño tumoral (cm) | |||
| ≤ 2 | 2 (4,1%) | 47 (95,9%) | 0,003 |
| > 2 | 15 (26,8%) | 41 (73,2%) | |
| Tipo de biopsia | |||
| BAG | 6 (24,0%) | 19 (76,0%) | 0,228 |
| BAV | 11 (13,8%) | 69 (86,2%) | |
| Microcalcificaciones | |||
| No | 4 (26,7%) | 11 (73,3%) | 0,259 |
| Sí | 13 (14,4%) | 77 (85,6%) | |
| Grado histológico | |||
| Bajo-Medio | 3 (8,1%) | 34 (91,9%) | 0,164 |
| Alto | 14 (20,6%) | 54 (79,4%) | |
| Comedonecrosis | |||
| No | 3 (7,9%) | 35 (92,1%) | 0,101 |
| Sí | 13 (20,6%) | 50 (79,4%) | |
| Estado del RE | |||
| Positivo | 13 (19,7%) | 53 (80,3%) | 0,753 |
| Negativo | 4 (22,2%) | 14 (77,8%) | |
CDIS: carcinoma ductal in situ; BAG: biopsia con aguja gruesa; BAV: biopsia asistida por vacío; RE: receptor de estrógeno
Ochenta y tres pacientes se trataron mediante cirugía conservadora (79%) y 22 mediante mastectomía (21%). Catorce pacientes necesitaron una cirugía adicional debido a la afectación de márgenes tras cirugía conservadora (en el 92,9% fue suficiente con una ampliación de márgenes). Todas las pacientes, excepto una (un CDIS pequeño de bajo grado), recibieron radioterapia adyuvante tras la cirugía conservadora.
En 88 de las 105 pacientes del estudio (83,8%) se realizó una BSGC de forma concomitante. La media de GC extirpados fue de 2. Entre las pacientes tratadas mediante cirugía conservadora, se realizó la estadificación axilar mediante BSGC en el 79,5% de los casos. Del total de casos, solo una paciente (1,1%) presentó una BSGC positiva (un ganglio linfático afectado con micrometástasis). Se realizó una estadificación axilar en un segundo tiempo quirúrgico en una paciente que presentó una reestadificación a carcinoma infiltrante, en la que no se había realizado BSGC concomitante.
DiscusiónLa Sociedad Americana de Oncología Clínica (ASCO) recomienda realizar una BSGC de forma rutinaria en pacientes con CDIS tratadas mediante mastectomía, pero no en las pacientes tratadas con cirugía conservadora5,6. Sin embargo, aproximadamente el 25% de las pacientes diagnosticadas inicialmente con CDIS progresarán a carcinoma infiltrante en el estudio histopatológico definitivo7. En el contexto de una cirugía conservadora y tras una cuidadosa discusión interdisciplinar, se debe considerar la BSGC en pacientes con CDIS y alto riesgo de reestadificación, con el objetivo de evitar una reintervención para la evaluación axilar.
Hemos observado una tasa de reestadificación a carcinoma infiltrante del 16,2%, similar a la de otros estudios8–10. Gumus et al.10 observaron una tasa de infraestimación del 17,8%, sin embargo, solo incluyeron en su estudio lesiones con microcalcificaciones diagnosticadas mediante biopsia asistida por vacío.
Se identificó el tamaño inicial del tumor como un factor predictivo para la reestadificación a carcinoma infiltrante. Estos resultados son compatibles con el estudio de Kurniawan et al.11, que observaron una tasa de infraestimación del 12,5% en lesiones ≤ 2 cm frente al 26,7% detectado en lesiones > 2 cm (p = 0,001). En el estudio de Marques et al.12, el tamaño del tumor no se asoció con la infraestimación, lo que se explicaba por la alta tasa de casos con CDIS diagnosticados durante el cribado.
En nuestra serie, la tasa de infraestimación fue mayor tras una biopsia con aguja gruesa, en las lesiones sin calcificaciones, en el CDIS de alto grado y en presencia de comedonecrosis, aunque estas diferencias no alcanzaron una significación estadística debido al pequeño tamaño muestral. Sin embargo, varios estudios han demostrado que estos factores predicen una infraestimación de carcinoma infiltrante en el estudio histopatológico definitivo. Se ha demostrado que el CDIS diagnosticado mediante biopsia con aguja gruesa tiene un mayor riesgo de infraestimación frente a la biopsia asistida por vacío, debido a la menor cantidad de tejido extirpado12–14. Schulz et al.8 y Kurniawan et al.11 señalaron que las lesiones sospechosas sin calcificaciones en la mamografía se asociaron significativamente con la reestadificación a carcinoma infiltrante. Lee et al.15 observaron que el grado nuclear era un factor de riesgo significativo para la reestadificación. Son et al.16 y Marques et al.12 observaron que la presencia de comedonecrosis era un factor predictivo independiente de infraestimación de carcinoma infiltrante.
El porcentaje de metástasis en los ganglios linfáticos en pacientes con CDIS puro es bajo, generalmente menor al 2%9,16–19. En este estudio, casi el 99% de las BSGC fueron negativas. Solo una paciente tratada con cirugía conservadora presentó una micrometástasis en los ganglios linfáticos, sin evidencia de tumor residual en la muestra quirúrgica mamaria. La paciente no recibió cirugía axilar adicional. En este caso, se sospechó la presencia de un pequeño foco de invasión no detectado tras la biopsia asistida por vacío.
Nuestros datos apoyan la recomendación actual de omitir la cirugía axilar en pacientes con diagnóstico preoperatorio de CDIS. La BSGC es un procedimiento mínimamente invasivo en comparación con el vaciamiento ganglionar axilar convencional. Sin embargo, una BSGC innecesaria implica un aumento en la morbilidad, los costes económicos y el tiempo quirúrgico. Un estudio prospectivo realizado por Goldberg et al.20 en pacientes con cáncer de mama y axila clínicamente negativa, describió una incidencia de linfedema del 5% con un seguimiento medio de cinco años. Otras complicaciones como seromas, dolor, parestesias y reducción del rango de movimiento pueden disminuir la calidad de vida en estas pacientes.
Según Lara et al.21, las micrometástasis en los ganglios linfáticos no tienen un significado clínico aparente en las pacientes con CDIS. Recientemente, se ha sugerido no realizar una BSGC de forma concomitante en aquellas pacientes con CDIS y sospecha de microinvasión22. Además, Magnoni et al.23 encontraron una buena supervivencia libre de enfermedad y supervivencia global en mujeres con BSGC positiva y CDIS con microinvasión, lo que sugiere que la BSGC no sería útil en estas pacientes.
En nuestro estudio, el 94,1% de las pacientes con reestadificación presentaban carcinoma infiltrante en estadio T1, en el que la imagen radiológica podría reemplazar la estadificación axilar quirúrgica en los próximos años. Actualmente, hay tres ensayos clínicos prospectivos en curso diseñados para evaluar la seguridad de omitir la BSGC en pacientes con cáncer de mama precoz y axila clínicamente negativa tratadas mediante cirugía conservadora24–26. El estudio SOUND (Sentinel node vs. Observation after axillary Ultra-SouND)24 incluye pacientes con enfermedad T1, mientras que los estudios BOOG 2013-0825 e Intergroup-Sentinel-Mamma (INSEMA)26 incluyen pacientes con enfermedad T1-T2. Mientras no se disponga de los resultados de estos estudios, la BSGC sigue siendo la técnica de referencia para la estadificación ganglionar en pacientes con cáncer de mama precoz y axila clínicamente negativa y, por tanto, este procedimiento puede contemplarse en pacientes seleccionadas con CDIS y alto riesgo de reestadificación a carcinoma infiltrante.
Las principales limitaciones de este análisis son el diseño retrospectivo de este estudio unicéntrico y el número limitado de pacientes.
En conclusión, la tasa de reestadificación en nuestra serie fue del 16,2%. En pacientes con CDIS tratadas mediante cirugía conservadora, se puede considerar realizar una BSGC de forma concomitante si la lesión mamaria mide más de 2 cm, ya que una de cada cuatro albergará un carcinoma infiltrante.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Los autores agradecen a Jorge Suances, miembro del Departamento de Bioestadística del Complejo Hospitalario A Coruña, su contribución en el análisis estadístico. Los autores agradecen también la contribución de Carmen Cereijo y Manuel Juaneda, miembros de la Unidad de Mama del Complejo Hospitalario A Coruña.