la infección de la prótesis es una complicación infrecuente pero importante en la cirugía de la pared abdominal. El objetivo de este estudio es valorar la incidencia y los factores de riesgo influyentes en la infección de la prótesis tras la reparación herniaria, así como el tratamiento a aplicar.
Material y métodoentre enero de 2002 y diciembre de 2006, se realizaron en total 1.055 reparaciones protésicas herniarias: 761 hernias inguinocrurales (72,1%), 74 hernias umbilicales (7%) y 220 eventroplastias (20,9%). Se analizaron de forma prospectiva variables preoperatorias, intraoperatorias y postoperatorias, así como la incidencia de infección de herida quirúrgica y de prótesis. Se utilizó la clasificación ASA para la valoración preoperatoria anestésica.
Resultadosel porcentaje de infección del biomaterial en general fue del 1,3%. Observamos infección en 11 reparaciones con prótesis de polipropileno (PPL), en 4 con PTFE-e y 1 caso en prótesis combinada. Fueron factores de riesgo en la infección del biomaterial: la obesidad (p=0,002), la diabetes mellitus (p=0,020), el tipo de reparación (p=0,047), la intervención de urgencia (p=0,001), el tipo y el tamaño de la prótesis (p=0,003 y p=0,007) y el tiempo quirúrgico >180min (p<0,001). De 11 pacientes con infección de prótesis de PPL, 7 respondieron al tratamiento con curas, mientras que todos los casos con infección de PTFE-e o prótesis mixta necesitaron de su extirpación para resolver el problema.
Conclusionesexisten numerosos factores de riesgo influyentes en la tasa de infección del biomaterial. Mientras que la terapia antibiótica adecuada y el drenaje quirúrgico de la infección pueden ser suficientes en la mayoría de las infecciones de prótesis de PPL, las de PTFE-e requieren extirpación precoz para acabar con el proceso infectivo.
Prosthesis infection is an infrequent but important complication in abdominal wall surgery. The aim of this study is to evaluate the incidence and risk factors for the infection of the prosthesis after hernia repair, as well as the treatment to apply.
Material and methodBetween January 2002 and December 2006, we performed 1055 prosthetic hernia repairs: 761 inguinal hernias (72.1%), 74 umbilical hernias (7%) and 220 ventral hernias (20.9%). We prospectively analysed preoperative, intraoperative and postoperative variables, as well as the incidence of infection of surgical wound and of prosthesis. We used ASA classification for preoperative anaesthetic evaluation.
ResultsThe overall percentage of infection of the prosthesis was 1.3%. Infection was observed in 11 repairs with polypropylene mesh (PPL), in 4 with PTFE mesh, and one case in combined mesh. Risk factors of mesh infection were: obesity (p=0.002), diabetes (p=0.020), the type of repair (p=0.047), emergency surgery (p=0.001), the type and size of mesh (p=0.003; p=0.007) and time of surgery >180min (p<0.001). Seven of the 11 patients with infection of PPL prosthesis were resolved with conservative treatment, whereas all the cases with PTFE infection or mixed mesh needed removal to solve the problem.
ConclusionsSeveral factors are involved in producing a prosthesis infection. Whereas antibiotic treatment and surgical drainage of the infection can be sufficient in most PPL mesh infection, PTFE prostheses need to be removed prematurely in order to halt the infection process.
Uno de los principales problemas que han surgido tras la instauración de la reparación herniaria mediante métodos protésicos es la posibilidad de la infección del biomaterial sintético, que se puede observar hasta en un 8%1–3. Aunque afortunadamente la mayoría de las infecciones de herida observadas tras hernioplastia son superficiales y suelen responder bien al tratamiento antibiótico, combinado o no con drenaje quirúrgico, la infección profunda del tejido con material protésico afectado es una complicación seria que requiere la retirada del biomaterial en numerosos casos para permitir su resolución. Incluso, la posibilidad de recidiva herniaria es la lógica consecuencia de dicha retirada, que ocurre en un porcentaje de casos nada despreciable4.
Este estudio tiene como objetivo analizar la incidencia, los factores de riesgo y la actitud a seguir en la infección de la prótesis tras la reparación herniaria, exponiendo nuestra experiencia al respecto durante estos últimos 5 años.
Material y métodoEntre enero de 2002 y diciembre de 2006, hemos realizado 1.055 reparaciones protésicas de la pared abdominal en la Unidad de Cirugía de Urgencias y Pared abdominal del Hospital La Fe. Hubo 761 hernias inguinocrurales (72,1%), 74 hernias umbilicales (7%) y 220 eventroplastias (20,9%). El 17,5% de las reparaciones se intervinieron en ámbito de urgencia, mientras que el resto (82,5%) se operó de manera programada, y en un 26,9% de estos casos, vía ambulatoria mediante UCSI. Las prótesis utilizadas en la intervención fueron PPL (98%), PTFE-e (1,7%) y combinadas tipo Dualmesh®(0,3%).
Se realizó una revisión de los historiales clínicos de todos los pacientes intervenidos, de los que se obtuvieron de forma prospectiva variables epidemiológicas preoperatorias como antecedentes y presentación clínica, hallazgos intraoperatorios y tasa de complicaciones infecciosas. Se analizaron específicamente los casos de infección local y profunda, y sus factores de riesgo, la necesidad de retirada de la malla, la posibilidad de recidiva y los gérmenes aislados. Excluimos de la revisión a los pacientes con herniorrafia no protésica o que no acudieron a las revisiones postoperatorias programadas tras la cirugía. El periodo de observación postoperatoria aplicado en el estudio se cumplió hasta los 9 meses tras la cirugía.
Se realizó estudio preoperatorio básico completo (radiología simple de tórax, electrocardiograma y analítica de sangre) en el 100% de los pacientes. Se obtuvo el consentimiento informado quirúrgico de cada paciente. Se aplicó la clasificación anestésica ASA (valoración del estado físico según la American Society of Anesthesiology) para valorar el riesgo anestésico.
La reparación protésica se realizó con raquianestesia en el 39%, anestesia general en el 26%, mascarilla laríngea en el 25%, y anestesia local y sedación en el 11%. En todos los pacientes se realizó profilaxis antibiótica con una dosis preoperatoria de 2g de amoxicilina-clavulánico. En caso de alergia a penicilina y/o cefalosporinas se administró quinolona de segunda generación.
La técnica quirúrgica consistió, en el caso de las reparaciones inguinocrurales, en hernioplastia tipo Lichtenstein en un 81,1% y del tipo Rutkow-Robbins en un 18,9% de los casos. En las eventraciones, se procedió a reparaciones con colocación del biomaterial en el espacio supraaponeurótico (87%), en el preperitoneal/infraaponeurótico (8,3%) y en el intraperitoneal (3,7%).
Se utilizó la prueba de la χ2 o la de la t de Student, según las variables en análisis, y se consideró significación estadística valoresde p<0,05.
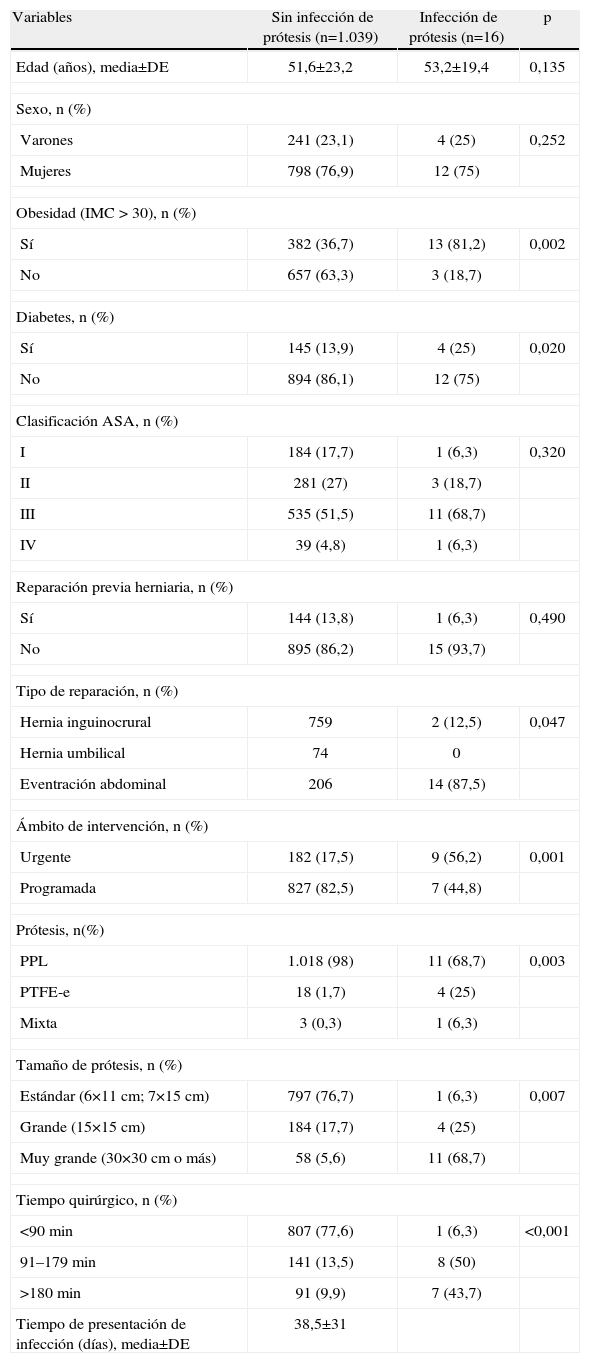
ResultadosLas características demográficas de los pacientes, los tipos de reparación y los factores de riesgo analizados se exponen en la tabla 1. El porcentaje de infección superficial de herida en general fue del 6,1%: el 2,2% en hernias inguinocrurales (17 reparaciones) y el 16,3% en eventraciones abdominales (48 reparaciones).
Características demográficas, antecedentes y factores de riesgo analizados en la serie
| Variables | Sin infección de prótesis (n=1.039) | Infección de prótesis (n=16) | p |
| Edad (años), media±DE | 51,6±23,2 | 53,2±19,4 | 0,135 |
| Sexo, n (%) | |||
| Varones | 241 (23,1) | 4 (25) | 0,252 |
| Mujeres | 798 (76,9) | 12 (75) | |
| Obesidad (IMC > 30), n (%) | |||
| Sí | 382 (36,7) | 13 (81,2) | 0,002 |
| No | 657 (63,3) | 3 (18,7) | |
| Diabetes, n (%) | |||
| Sí | 145 (13,9) | 4 (25) | 0,020 |
| No | 894 (86,1) | 12 (75) | |
| Clasificación ASA, n (%) | |||
| I | 184 (17,7) | 1 (6,3) | 0,320 |
| II | 281 (27) | 3 (18,7) | |
| III | 535 (51,5) | 11 (68,7) | |
| IV | 39 (4,8) | 1 (6,3) | |
| Reparación previa herniaria, n (%) | |||
| Sí | 144 (13,8) | 1 (6,3) | 0,490 |
| No | 895 (86,2) | 15 (93,7) | |
| Tipo de reparación, n (%) | |||
| Hernia inguinocrural | 759 | 2 (12,5) | 0,047 |
| Hernia umbilical | 74 | 0 | |
| Eventración abdominal | 206 | 14 (87,5) | |
| Ámbito de intervención, n (%) | |||
| Urgente | 182 (17,5) | 9 (56,2) | 0,001 |
| Programada | 827 (82,5) | 7 (44,8) | |
| Prótesis, n(%) | |||
| PPL | 1.018 (98) | 11 (68,7) | 0,003 |
| PTFE-e | 18 (1,7) | 4 (25) | |
| Mixta | 3 (0,3) | 1 (6,3) | |
| Tamaño de prótesis, n (%) | |||
| Estándar (6×11cm; 7×15cm) | 797 (76,7) | 1 (6,3) | 0,007 |
| Grande (15×15cm) | 184 (17,7) | 4 (25) | |
| Muy grande (30×30cm o más) | 58 (5,6) | 11 (68,7) | |
| Tiempo quirúrgico, n (%) | |||
| <90min | 807 (77,6) | 1 (6,3) | <0,001 |
| 91–179min | 141 (13,5) | 8 (50) | |
| >180min | 91 (9,9) | 7 (43,7) | |
| Tiempo de presentación de infección (días), media±DE | 38,5±31 | ||
DE: desviación estándar; IMC: índice de masa corporal.
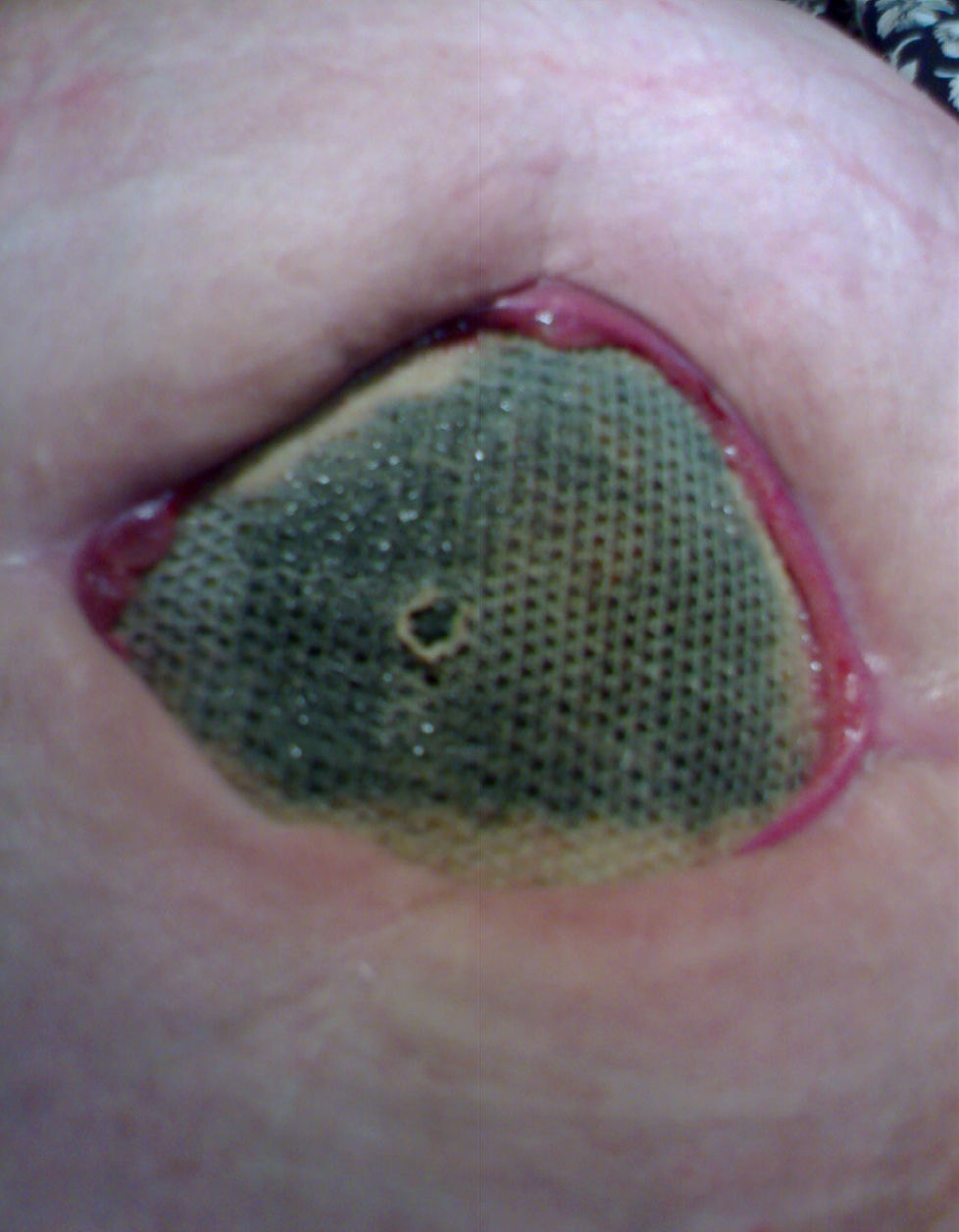
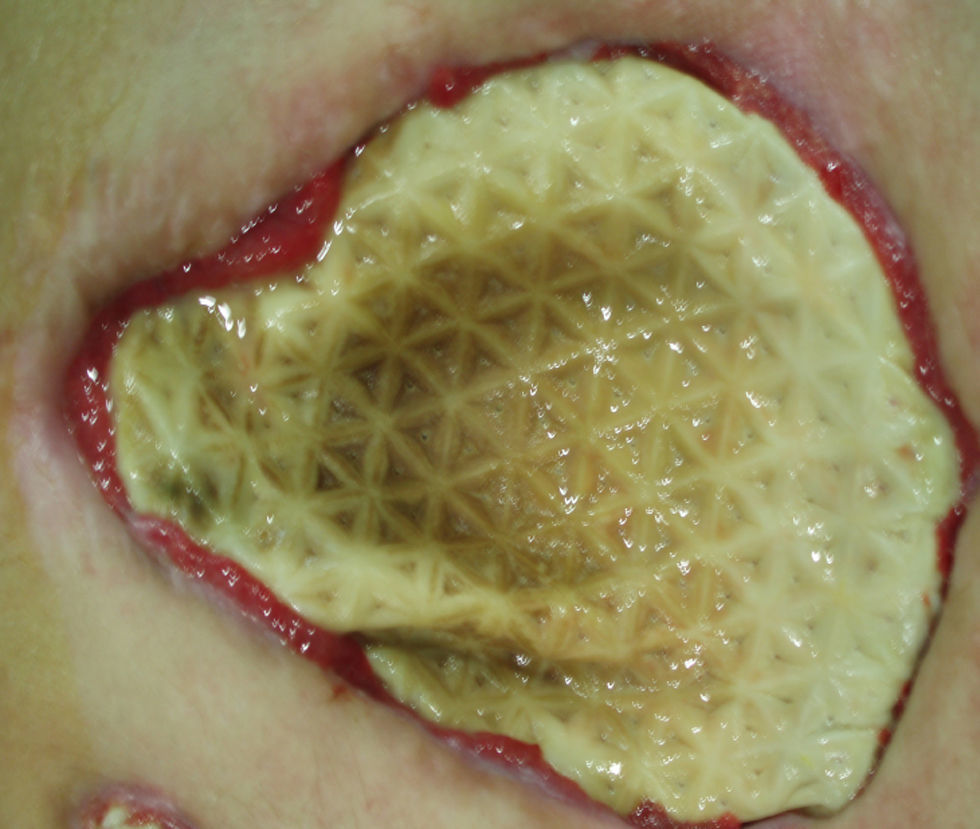
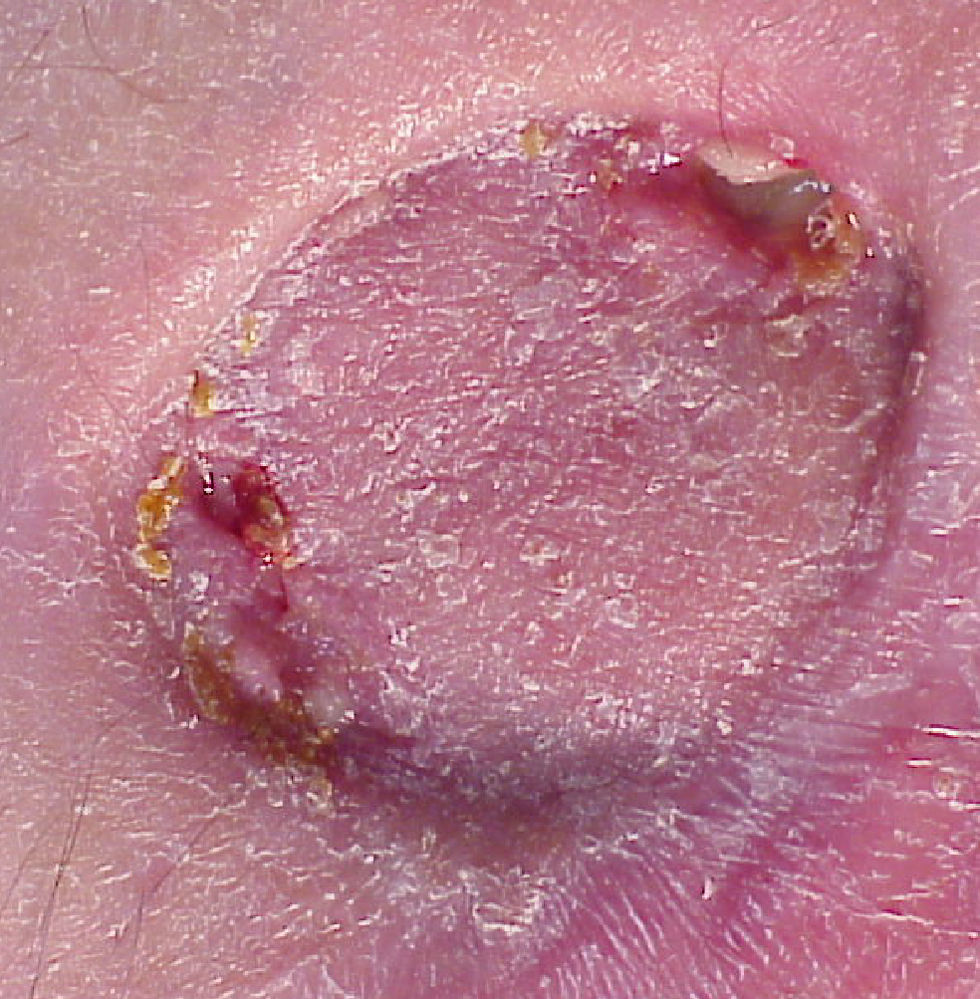
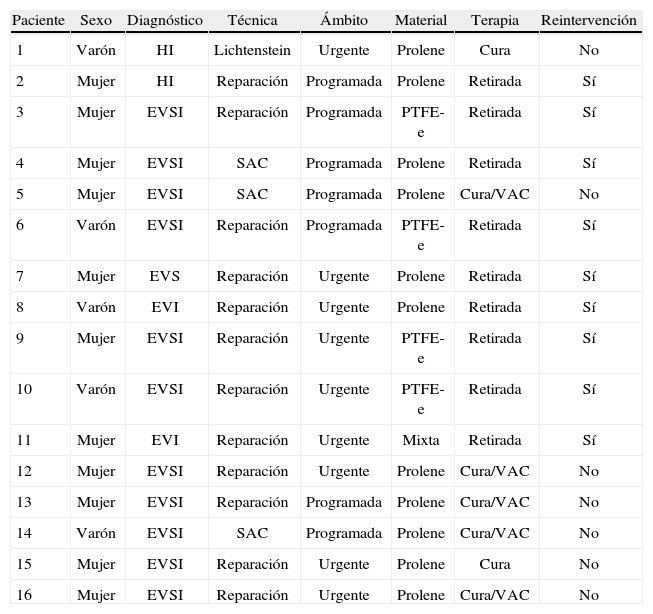
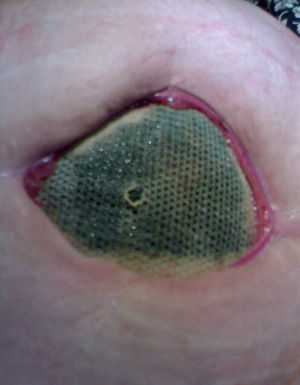
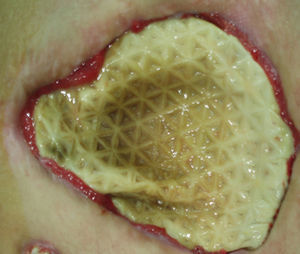
La infección de la prótesis ocurrió en el 1,3%: 2 casos en hernias inguinocrurales y 14 casos en eventraciones. De ellas, observamos infección en 11 reparaciones con prótesis de PPL (el 1,1% del total de reparaciones con dicho biomaterial; fig. 1), en 4 con prótesis de PTFE-e (el 22,1%; fig. 2) y 1 caso en prótesis combinada. La infección del biomaterial se presentó con mayor frecuencia en casos intervenidos de urgencia (9 casos) frente al ámbito programado (7 pacientes). El tiempo medio de presentación de la infección fue de 38,5±31 días (fig. 3).
Los factores de riesgo relacionados con la infección del biomaterial fueron: la obesidad (p=0,002), la diabetes (p=0,020), el tipo de reparación (p=0,047), la intervención de urgencia (p=0,001), el tipo y el tamaño de la prótesis (p=0,003 y p=0,007) y el tiempo quirúrgico >180min (p<0,001) (tabla 1).
El espectro microbiológico de los gérmenes aislados fue: Staphilococcus aureus (9 casos), enterobacterias (3 casos), Pseudomonas (1 paciente) y flora mixta (3 pacientes). La terapia antibiótica utilizada con mayor frecuencia tras el hallazgo de infección de herida fue la cobertura de amplio espectro con amoxixilina-clavulánico o fluoroquinolona, recurriendo de antibióticos específicos contra grampositivos (vancomicina intravenosa) una vez establecida la infección de la malla en el 96% de los casos. En 2 pacientes se utilizó el linezolid intravenoso durante 15 días, con buenos resultados.
Fue necesario extraer la prótesis en 9 casos, y en 2 de ellos se precisó más de una intervención porque la primera había sido incompleta. Mientras que 7 de 11 pacientes con infección de prótesis de PPL respondieron al tratamiento con curas locales, todos los casos con infección de PTFE-e o material mixto necesitaron de su extirpación para resolver el problema infectivo (tabla 2). Para agilizar la cicatrización del defecto en pacientes con infección de la prótesis de PPL, utilizamos en 5 pacientes la terapia de vacío (VAC). Observamos recidiva herniaria durante el periodo de seguimiento en 5 de los 9 pacientes de los que se retiró la prótesis, y necesitaron reintervención una vez solucionado definitivamente el proceso infeccioso.
Características de los pacientes que presentaron infección de prótesis tras la reparación herniaria
| Paciente | Sexo | Diagnóstico | Técnica | Ámbito | Material | Terapia | Reintervención |
| 1 | Varón | HI | Lichtenstein | Urgente | Prolene | Cura | No |
| 2 | Mujer | HI | Reparación | Programada | Prolene | Retirada | Sí |
| 3 | Mujer | EVSI | Reparación | Programada | PTFE-e | Retirada | Sí |
| 4 | Mujer | EVSI | SAC | Programada | Prolene | Retirada | Sí |
| 5 | Mujer | EVSI | SAC | Programada | Prolene | Cura/VAC | No |
| 6 | Varón | EVSI | Reparación | Programada | PTFE-e | Retirada | Sí |
| 7 | Mujer | EVS | Reparación | Urgente | Prolene | Retirada | Sí |
| 8 | Varón | EVI | Reparación | Urgente | Prolene | Retirada | Sí |
| 9 | Mujer | EVSI | Reparación | Urgente | PTFE-e | Retirada | Sí |
| 10 | Varón | EVSI | Reparación | Urgente | PTFE-e | Retirada | Sí |
| 11 | Mujer | EVI | Reparación | Urgente | Mixta | Retirada | Sí |
| 12 | Mujer | EVSI | Reparación | Urgente | Prolene | Cura/VAC | No |
| 13 | Mujer | EVSI | Reparación | Programada | Prolene | Cura/VAC | No |
| 14 | Varón | EVSI | SAC | Programada | Prolene | Cura/VAC | No |
| 15 | Mujer | EVSI | Reparación | Urgente | Prolene | Cura | No |
| 16 | Mujer | EVSI | Reparación | Urgente | Prolene | Cura/VAC | No |
EVI: eventración infraumbilical; EVSI: eventración supraumbilical; HID: hernia inguinal; SAC: técnica de separación anatómica de componentes.
La intensidad de la reacción fibroblástica y la incidencia de infección están en relación con la porosidad del material protésico. Así, cuando los poros de la malla son<10μm, los granulocitos y macrófagos que superan tal dimensión no pueden neutralizar y destruir las bacterias, mientras que los poros más anchos (>10μm) previenen su crecimiento y permiten una rápida fibrosis y angiogénesis. Prototipo de las mallas microporosas o >10μm es el PTFE-e, mientras que la referencia de las prótesis macroporosas es el PPL (poro >75μm).
Se ha estudiado la influencia de determinados factores en la aparición y el comportamiento de la infección de la prótesis, mediante la alteración del proceso de integración tisular del biomaterial1,5–8. La comorbilidad del paciente con afecciones como la diabetes, la enfermedad obstructiva crónica pulmonar y la inmunodeficiencia influyen en la posibilidad de infección profunda postoperatoria. Algunos autores han especulado que la reparación preperitoneal, por la localización de la malla y la existencia de una «barrera» de tejido graso y muscular, puede presentar un efecto protector contra la infección9,10. Esto explicaría por que la tasa de infección en la reparación mediante la técnica de Stoppa es menor que con la reparación por vía anterior supraaponeurótica11,12. Sin embargo, no hay acuerdo entre el teórico efecto defensivo que pudiera otorgar la obesidad del paciente, pues algunas series han observado dicha protección y otras, un efecto perjudicial1,13. En nuestro caso, hemos observado mayor riesgo de infección de malla en pacientes obesos y diabéticos, aunque no hemos encontrado diferencias con relación al grado de clasificación ASA preoperatorio.
Tampoco se han descrito diferencias en relación con la utilización de determinadas suturas para anclar la malla, ya sea el caso de grapas, suturas absorbibles o no absorbibles14. Asimismo, aunque varias series han demostrado el menor riesgo de complicaciones infecciosas en la reparación laparoscópica, no permanece clara la influencia de dicha técnica en la posibilidad de infección de la prótesis en comparación con la técnica abierta15–17. Tampoco hay unanimidad en relación a qué tipo de biomaterial presenta mayor predisposición a la infección. Algunas series determinan mayor probabilidad en el caso de la prótesis de PTFE-e, como en nuestro caso, aunque no existen series amplias comparativas que concluyan tal aseveración7.
A finales de los años noventa, Costerton definió el concepto de biofilm como el grupo de bacterias con una elevada capacidad adherente que se unen con fuerza a un soporte sólido que les proporciona estabilidad, nutrientes y protección, lo que posibilita la formación de microcolonias18. Ese autor explica la elevada resistencia del biofilm al tratamiento antimicrobiano por tres razones: su pobre difusión a través de la matriz polimérica que lo rodea; por la heterogeneidad bacteriana presente en el biofilm, debido a bacterias de crecimiento lento y alta variabilidad metabólica, que asegura su supervivencia en estado semilatente, y por mecanismos reducidos de susceptibilidad, conferidos por fenotipos adoptados por las bacterias dentro del biofilm. Todo ello conllevaría a un intercambio de ADN extracromosómico mediante transferencia de plásmidos que explicaría la resistencia a la terapia convencional antimicrobiana. La existencia de dichas «bacterias persistentes» haría que en situaciones de inmunodeficiencia del huésped lleven a cronificar la infección, y se produzca una infección tardía del biomaterial. Esto explicaría el hallazgo de sinus o fístulas cutáneas con secreción seropurulenta tras un tiempo prolongado tras la intervención.
Es importante hacer énfasis en la prevención de la infección. Se han analizado como medidas efectivas, en mayor o menor grado, el uso adecuado de los antimicrobianos preoperatorios y postoperatorios, la disminución de los tiempos quirúrgicos, la eliminación del tejido desvitalizado, la minimización del contacto del biomaterial con la piel, el uso de drenajes eficientes para prevenir la formación de hematomas y la sutura de pared con técnica aséptica6,19. En nuestro caso, hemos constatado la existencia de mayor número de casos de infección en el ámbito de la reparación urgente y en las intervenciones donde se utilizaron prótesis grandes o que superaron los 180min. Estos parámetros están en relación con factores intraoperatorios difíciles de prevenir, sobre todo por el aumento de la morbilidad existente en la cirugía de urgencias relacionado con la falta de preparación del paciente, necesidad de amplias disecciones y aumento de la posibilidad de infección que conlleva este tipo de cirugía.
Algunos estudios sobre modelos animales indican que la aplicación de soluciones de antibióticos durante la intervención ofrece ventajas contra la posibilidad de infección del biomaterial, pues producen una teórica inhibición de la adhesión bacteriana en su superficie20. Algunos autores irrigan una solución de gentamicina sulfato o cubren los tejidos con gasas impregnadas en este antibiótico en las que se mantiene la prótesis antes de insertarla21. Sin embargo, la efectividad del lavado o la aplicación de estas soluciones es controvertida, por la escasa duración del contacto del antibiótico con el patógeno. Tópicos antisépticos como la povidona yodada aplicadas dentro de la herida están recomendados en algunas series, aunque la evidencia experimental indica que su uso confiere adicional beneficio con la profilaxis antibiótica sólo en el caso de inoculación bacteriana masiva1.
La utilización de la profilaxis antibiótica en la cirugía herniaria sigue siendo un punto de controversia en diversos estudios prospectivos, tanto nacionales como internacionales22–25. Una reciente revisión Cochrane concluye que no existen criterios para recomendar de forma sistemática la profilaxis en la reparación primaria de la hernia inguinal26. Concluye que en general podría ser útil, pero no implicaría una administración indiscriminada, si no que su uso debería basarse en la tasa local de infección de herida y en el análisis de los factores de riesgo del paciente. En nuestra serie, hemos aplicado dicha profilaxis protocolizada en todos los casos.
Los microorganismos asociados con casos de infección de prótesis son Staphylococcus spp. (hasta un 75%), especialmente S. aureus, Streptococcus spp., incluido el grupo B, las bacterias gramnegativas (principalmente la enterobacteria) y anaerobios27.
Ante la sospecha de infección superficial de la herida quirúrgica, un antibiótico de amplio espectro debería usarse y si no existe mejora, explorarse la herida y drenar las colecciones purulentas. Es mandatorio asimismo, el cultivo microbiológico del exudado para la antibioterapia adecuada. Esta terapia es efectiva en la mayoría de los casos, obteniendo buenos resultados. Si durante la evolución tórpida de la infección se necesitan antimicrobianos de uso intravenoso, se recomiendan antibióticos en acorde al antibiograma, sobre todo los efectivos contra grampositivos, como la vancomicina o teicoplanina.
Algunos grupos de trabajo han obtenido excelentes resultados aplicando novedosas terapias antimicrobianas contra cepas resistentes a meticilina, como el linezolid (Zyvoxid€R). Se trata de un bacteriostático contra grampositivos, aunque en algunos centros hospitalarios su uso está restringido. En nuestra experiencia, este antimicrobiano nos fue de gran utilidad en dos casos de infección de prótesis tras eventroplastia con malla de PPL, que respondieron bien a la terapia local con curas locales y sin necesidad de retirar el biomaterial.
Como hemos referido anteriormente, existen diferencias en cuanto al comportamiento de la prótesis ante la infección. En términos generales, cuando se infecta la prótesis macroporosa, a veces solamente se afecta una pequeña parte del biomaterial, por lo que la posibilidad de exéresis parcial y la cicatrización por segunda intención representan una opción de tratamiento eficaz. Sin embargo, en la prótesis microporosa, los gérmenes pueden quedar acantonados dentro del biomaterial, por lo que la retirada de la prótesis se antoja necesaria para la completa resolución del cuadro. Nuestra experiencia coincide con estas aseveraciones, pues nos hemos visto obligados a retirar el 100% de las mallas PTFE-e utilizadas, mientras que en 7 pacientes de 11 casos de reparación con PPL (63,6%) no fue necesario extirparla.
Con la retirada de prótesis, el paciente queda expuesto a una recidiva de la hernia, que con frecuencia es mayor que la lesión inicial. No es infrecuente que, tras la extirpación inicial de material, en alguna porción residual queden restos de prótesis que pueden perpetuar o recidivar la supuración, en forma de sinus crónico recidivante, y que obligue a la extirpación total para la curación definitiva4. Por lo tanto, es obligado esperar a que la herida esté bien curada y libre de infección antes de nueva reparación, por lo que se recomienda dilatar la reparación definitiva hasta que la herida haya cicatrizado.
En conclusión, según nuestra experiencia, existen numerosos factores de riesgo, algunos ciertamente prevenibles, que inciden directamente en la tasa de infección protésica. Una vez que se verifica la infección, las medidas conservadoras y el drenaje adecuado de la colección podrían ser suficientes en el caso de mallas de PPL, mientras que las prótesis de PTFE-e o mixtas deberían ser extirpadas precozmente para acabar con el proceso infectivo.
A otros compañeros que han participado de uno u otro modo en la realización del trabajo: Dres. José Luis Ibáñez, José Iserte, José Miguel Martínez, Raquel Blasco, Soledad Carceller y Gemma Bellver.