La resección completa con márgenes libres en los tumores viscerales pélvicos localmente avanzados, primarios o recurrentes, requiere ocasionalmente de una exenteración pélvica total (EPT).
MétodosRevisamos los resultados obtenidos con la EPT en 34 pacientes consecutivos operados entre junio de 2006 y diciembre de 2013.
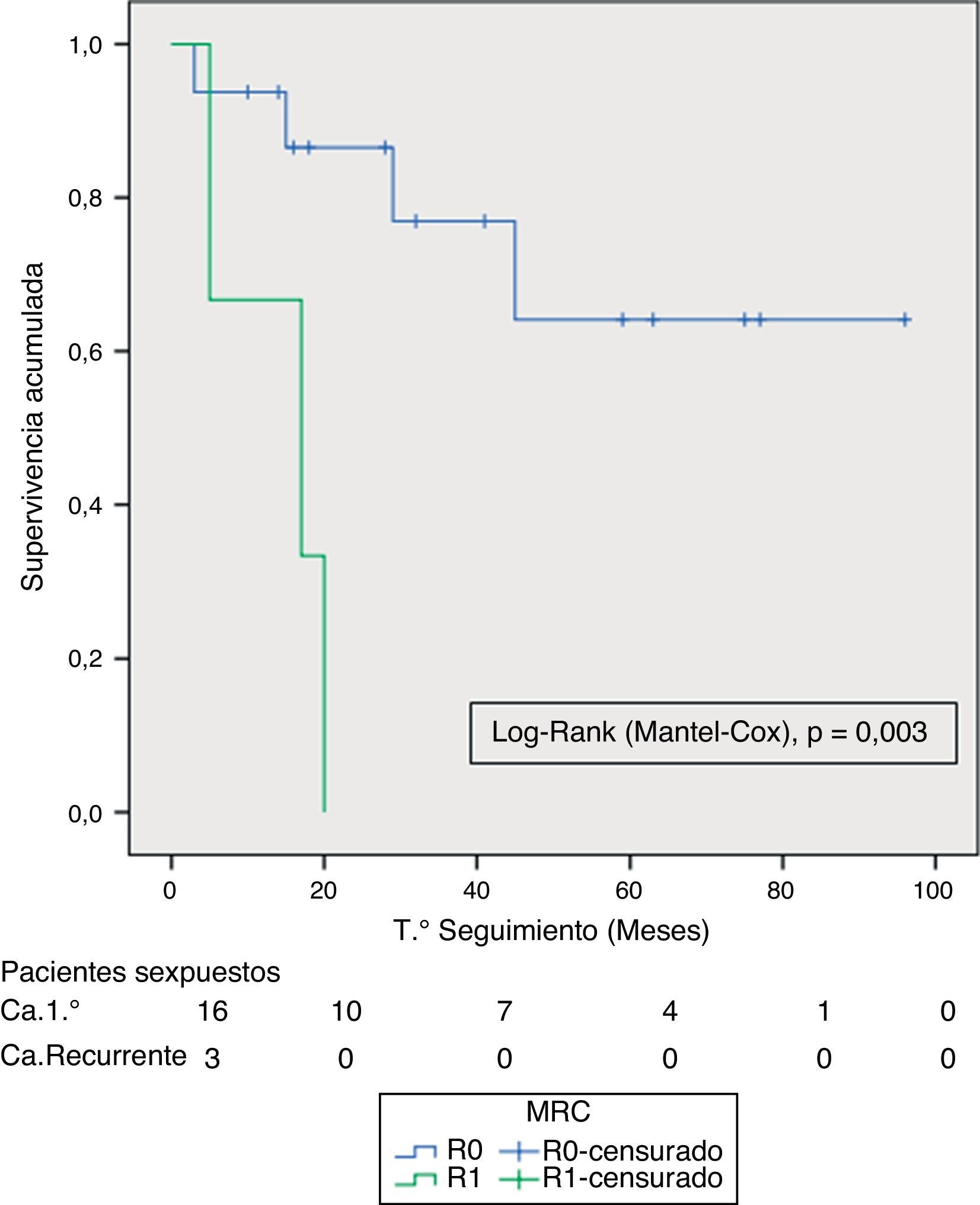
ResultadosLa mediana de edad fue de 62 (40-82) años; 24 (70%) eran varones. El origen tumoral más frecuente fue el avanzado y primitivo de recto (TAPR), con 19 casos (55,9%) y el tipo de exenteración, la supraelevadora (61,8%). Se logró una resección R0 en 24 (70,6%) pacientes y en 16 (85%) de los TAPR. Quince (79%) pacientes con TAPR tenían pT4, y 4 (20%) pN+. La continuidad intestinal y urinaria se realizó con 2 estomas en 17 casos (50%), Bricker y anastomosis colorrectal en 11 (32,3%) y colostomía húmeda double barreled en 6 (17,6%). No hubo mortalidad postoperatoria; 23 (67,5%) pacientes tuvieron complicaciones y 5 (14,6%) requirieron una reoperación en el postoperatorio. La mediana de seguimiento fue de 23 (13-45) meses. La supervivencia global (SG) y libre de enfermedad (SLE) a los 2 años fueron del 67% y 58% respectivamente, y la mediana de SG y SLE fue de 59 meses (IC 95%: 26 a 110) y de 39 meses (IC 95%: 14 a 64), respectivamente. La SLE de las R0 fue significativamente mejor (p=0,003) que las R1.
ConclusionesLa EPT es un procedimiento potencialmente curativo para las neoplasias viscerales avanzadas de la pelvis, con una morbimortalidad similar a otras cirugías exeréticas mayores.
Complete resection with clear margins in locally advanced pelvic visceral tumors, primary or recurrent, occasionally requires total pelvic exenteration (TPE).
MethodsWe reviewed the results of EFA in 34 consecutive patients operated on between June 2006 and December 2013.
ResultsMedian age was 62 (40-82) years; 24 (70%) were male. The tumor origin most frequent was advanced primary rectal tumor (APRT), with 19 cases (55.9%) and most common type of exenteration was supraelevator (61.8%). R0 resection was achieved in 24 (70.6%) patients and in 16 (85%) of the APRT. Fifteen (79%) patients had pT4 APRT, and 4 (20%) pN +. Reconstruction of the bowel and bladder was performed with two stomas in 17 cases (50%), colorectal anastomosis and Bricker in 11 (32.3%) and wet double barreled colostomy in 6 (17.6%). There was no postoperative mortality; 23 (67,5%) patients had complications, and 5 (14.6%) required a postoperative reoperation to solve them. Median follow-up was 23 (13-45) months. Overall survival (OS) and disease free survival (DFS) at 2 years were 67% and 58% respectively, and the median OS and DFS was 59 months (95% CI 26-110) and 39 months (95% CI 14-64), respectively. The DFS of R0 was significantly better (p=0.003) than R1.
ConclusionsTPE is a potentially curative procedure for advanced pelvic visceral malignancies with similar morbi-mortality than other extended excisional surgery.
El término exenteración o evisceración pélvica se refiere a la resección completa, en bloque, de al menos 2 estructuras orgánicas contiguas de la pelvis, necesaria para obtener márgenes quirúrgicos negativos en casos de neoplasias avanzadas de los órganos pélvicos. En la exenteración pélvica total (EPT) se extirpan todos los órganos de la pelvis menor en el hombre y en la mujer. En la mujer la exenteración puede ser también anterior (preservación del recto) o posterior (preservación de la vejiga). La EPT y la posterior pueden ser supra o infraelevadora, es decir con o sin preservación de los elevadores del ano y muñón anorrectal1. Las exenteraciones pueden ampliarse a estructuras vasculares, linfáticas, musculares e incluso óseas (exenteración/resección pélvica compuesta)2.
La EPT fue descrita por Brunschwig en 1948 como procedimiento paliativo en el tratamiento del cáncer de cérvix avanzado3. Una mejora para dicho procedimiento consistió en la utilización de parte del ileon como derivación urinaria, descrito por Bricker en 1950. Posteriormente se describió la EPT como tratamiento de cáncer de recto avanzado y en 1981 se realizó la primera publicación en la que se aplicó en la recurrencia locorregional del cáncer de recto4.
Los tumores avanzados primitivos del recto (TAPR) suponen entre el 5 y 20% de los cánceres de recto, y sin tratamiento la supervivencia mediana es menor de un año, con solo un 5% de supervivencia a los 5 años5. Incluso tras una resección potencialmente curativa un 2-30% de los pacientes con cánceres de recto sufren una recurrencia locorregional (CRR), que en ausencia de re-resección tienen una supervivencia media de 7-8 meses. Aunque la quimio y radioterapia (QRT) pueden controlar o paliar los síntomas locales durante un tiempo y prolongar la supervivencia en 10-17 meses, la resección radical es la única opción curativa5.
El tratamiento del cáncer cérvix y endometrio avanzado se realiza mediante QRT, no obstante un 25% de las pacientes sufrirá una recurrencia local sin metástasis. La supervivencia a 5 años de las pacientes con carcinoma recurrente de cérvix tratado mediante EPT es del 45% (25-55%), lo que justifica este abordaje en casos bien seleccionados6. Los resultados a largo plazo de la EPT para otros tumores pélvicos (sarcomas, indiferenciados urológicos, etc.) son más difíciles de sistematizar por escasa frecuencia.
La EPT se ha asociado históricamente a una elevada morbimortalidad postoperatoria. Sin embargo, los resultados en publicaciones más recientes señalan que la EPT es un procedimiento cada vez más seguro gracias a los avances en las pruebas de imagen, una cuidadosa selección de los pacientes, la participación multidisciplinaria y la mejoría en la técnica quirúrgica y cuidados postoperatorios4. Sin embargo, existen pocas referencias actuales relativas a la EPT en nuestro país.
El objetivo de este trabajo fue analizar la morbimortalidad y la supervivencia global y libre de enfermedad de nuestros pacientes tratados con una EPT.
Material y métodosRealizamos una revisión retrospectiva de los pacientes a quienes se practicó una EPT entre junio de 2006 y diciembre de 2013, tras realizar una búsqueda de los códigos de la evisceración pelviana femenina (CIE-9 68.8) y masculina (CIE-9 57.71) en el archivo y base de datos del hospital.
Se revisan las historias clínicas de los pacientes con EPT, registrando en una base de datos las variables relativas a la demografía, fecha intervención, días de estancia postoperatoria, diagnóstico o tipo de tumor (colorrectal, genitourinario u otro, primario o recurrente), tipo de EPT (supra o infraelevadora, ampliada o no a otros órganos o estructuras), tipo de resección de la UICC (R0, R1, R2), forma de reconstrucción (urostomía y colostomía, colostomía húmeda o urostomía y anastomosis colorrectal/anal), manejo de la cavidad pélvica residual, hallazgos y estadificación anatomopatológica, administración de radio-quimioterapia pre o postoperatoria, complicaciones postoperatorias (Clavien-Dindo7) y tardías (más de 30 días) y estado de los pacientes en mayo 2014 (libre de enfermedad, fecha de recurrencia y/o fallecimiento).
Todos estos pacientes fueron valorados en los comités de tumores multidisciplinarios correspondientes, y si bien la mayor parte de las intervenciones fueron compartidas, todos los pacientes sometidos a EPT estuvieron a cargo de la sección de cirugía colorrectal.
Analizamos los datos con el programa SPSS 21.0 (SPSS, Chicago, Illinois, EE. UU.). La supervivencia global (SG) y la supervivencia libre de enfermedad (SLE) se calcularon desde la fecha de resección hasta la fecha de fallecimiento o pérdida de seguimiento y la aparición de la primera recurrencia, respectivamente. El análisis de supervivencia se realizó mediante el método de Kaplan-Meier. La prueba de «log-rank» fue utilizada para el análisis univariado de curvas de supervivencia. Consideramos diferencias estadísticamente significativas valores de p<0,05.
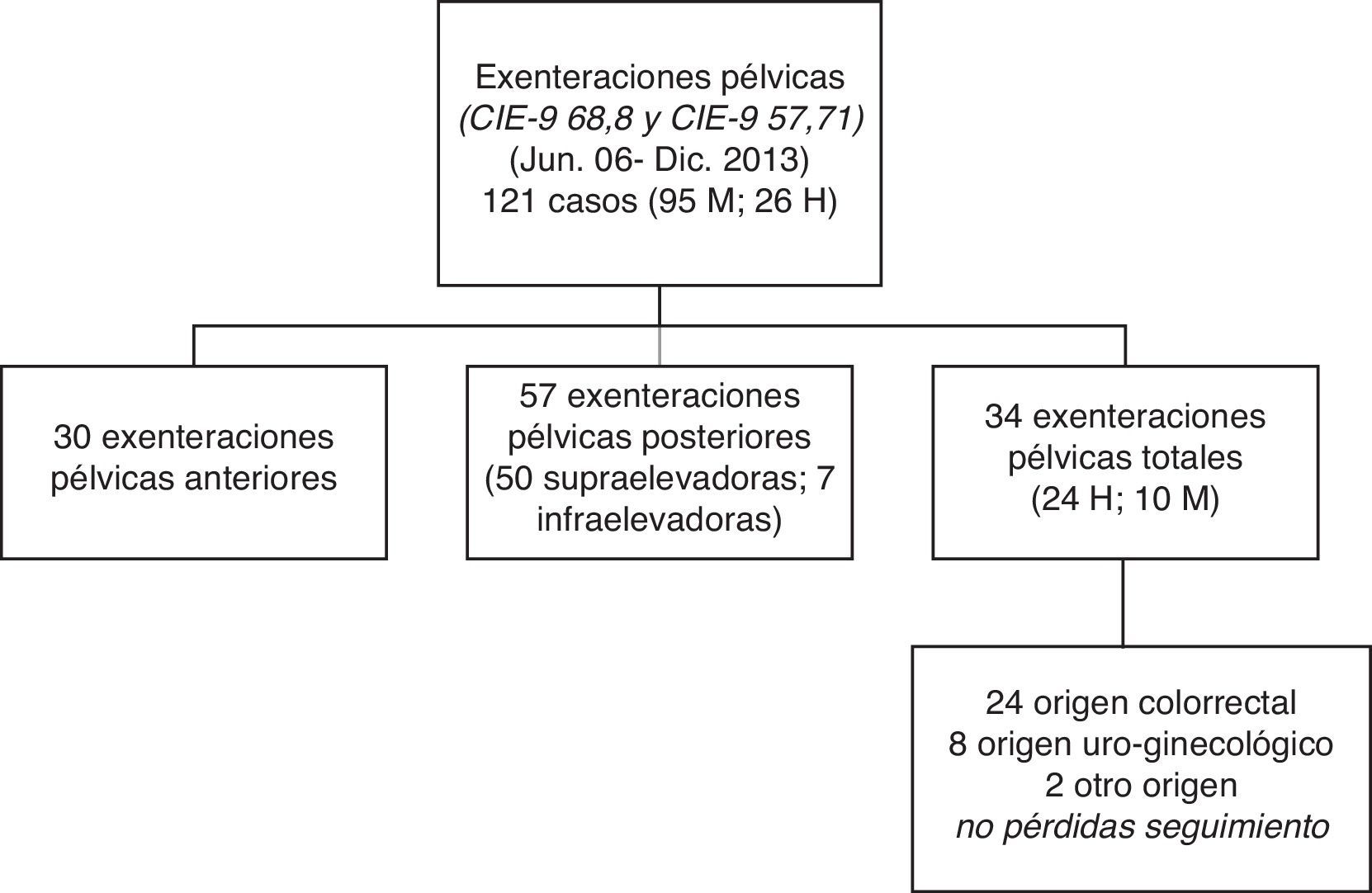
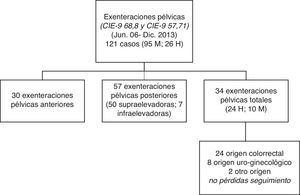
ResultadosEntre las fechas indicadas se realizaron un total de 121 exenteraciones o evisceraciones pélvicas, de las cuales 30 eran exenteraciones anteriores, por enfermedad uroginecológica, 57 fueron exenteraciones posteriores, por tumores de recto o de la unión rectosigmoidea con afectación de útero o vagina o viceversa, y 34 fueron EPT y que constituyen el grupo de pacientes que analizamos en este trabajo. En la figura 1 se presenta la población y la localización de los tumores sometidos a EPT con seguimiento completo.
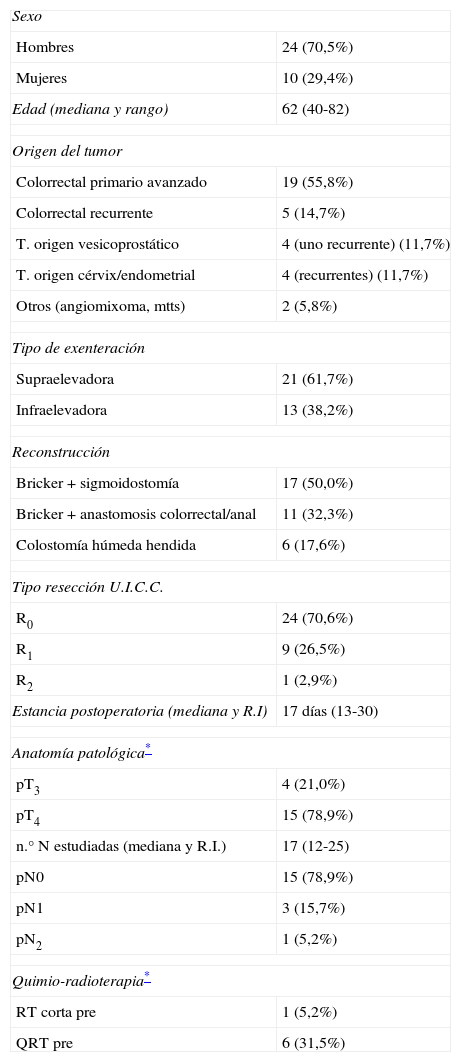
Los datos demográficos y parte de los clínicos analizados en nuestros pacientes se muestran en la tabla 1. Como puede observarse la mayor parte de la serie la componen hombres, la mediana de edad fue de 62 años (rango: 40-82) y el origen del tumor que con más frecuencia requirió una EPT fue el TAPR. Todos los cánceres de origen ginecológico fueron tumores recurrentes, de cérvix o endometrio.
Datos demográficos y clínicos de los pacientes con exenteración pélvica total
| Sexo | |
| Hombres | 24 (70,5%) |
| Mujeres | 10 (29,4%) |
| Edad (mediana y rango) | 62 (40-82) |
| Origen del tumor | |
| Colorrectal primario avanzado | 19 (55,8%) |
| Colorrectal recurrente | 5 (14,7%) |
| T. origen vesicoprostático | 4 (uno recurrente) (11,7%) |
| T. origen cérvix/endometrial | 4 (recurrentes) (11,7%) |
| Otros (angiomixoma, mtts) | 2 (5,8%) |
| Tipo de exenteración | |
| Supraelevadora | 21 (61,7%) |
| Infraelevadora | 13 (38,2%) |
| Reconstrucción | |
| Bricker+sigmoidostomía | 17 (50,0%) |
| Bricker+anastomosis colorrectal/anal | 11 (32,3%) |
| Colostomía húmeda hendida | 6 (17,6%) |
| Tipo resección U.I.C.C. | |
| R0 | 24 (70,6%) |
| R1 | 9 (26,5%) |
| R2 | 1 (2,9%) |
| Estancia postoperatoria (mediana y R.I) | 17 días (13-30) |
| Anatomía patológica* | |
| pT3 | 4 (21,0%) |
| pT4 | 15 (78,9%) |
| n.° N estudiadas (mediana y R.I.) | 17 (12-25) |
| pN0 | 15 (78,9%) |
| pN1 | 3 (15,7%) |
| pN2 | 1 (5,2%) |
| Quimio-radioterapia* | |
| RT corta pre | 1 (5,2%) |
| QRT pre | 6 (31,5%) |
La EPT fue más frecuentemente supraelevadora. Se consiguió obtener una resección tipo R0 en el 70% de la serie (85% en los TAPR), precisando para ello ampliar la resección monobloque e incluir asas de ileon, el ciego, en 3 ocasiones, el cóccix en una y una vulvectomía y vaginectomía completa en otras 2.
La reconstrucción del tracto urinario y digestivo más frecuente fue mediante doble estoma (Bricker-Wallance II y sigmoidostomía) seguida de Bricker-Wallance II y anastomosis colorrectal (con estoma de protección en 3 ocasiones y sin estoma derivativo en 8 casos) y la menos frecuente la colostomía húmeda hendida o double-barreled.
El manejo o tratamiento de la cavidad pélvica resultante tras la EPT no fue homogéneo. Se empleó un colgajo pediculado de epiplón siempre que fue posible para rellenar la pelvis, bien de manera aislada o en combinación con mallas, biológicas o absorbibles, y en 3 ocasiones decidimos dejar una prótesis de mama rellenando la pelvis denudada. Se realizó un colgajo miocutáneo pediculado de recto anterior del abdomen en 5 ocasiones para la reconstrucción vaginal o de la herida pelviperineal resultante de la EPT infraelevadora.
En la tabla 1 se señalan los hallazgos anatomopatológicos más relevantes referidos a los TAPR. De los 19 casos 15 (79%) tenían pT4, infiltración neoplásica de las estructuras incluidas en el espécimen, y en 4 (21%) la fijación a las estructuras era inflamatoria o fibrosa, sin invasión neoplásica real. Los adenocarcinomas fueron del tipo mucinoso de la WHO en 6 ocasiones y en uno de células en anillo de sello (paciente con colitis ulcerosa de larga evolución). Se obtuvieron una mediana de 17 adenopatías (R.I. 12-25) en las piezas estudiadas; la mayor parte no presentaba invasión tumoral ganglionar. En el estudio histológico de las piezas se encontraron de manera incidental 3 carcinomas síncronos de próstata y otro vesical, no diagnosticados previamente.
El empleo de la QRT, aun en los casos de TAPR, fue poco uniforme. En solo 7 casos (36%) de los tumores de origen colorrectal se empleó preoperatoriamente radioterapia, de ciclo largo (con quimioterapia) o corto debido a la presencia de tumores mucinosos extensos, con fistulización genitourinaria o al periné o vulva, o tratarse de pacientes muy debilitados. El 26% de estos casos recibió radio o quimioterapia adyuvante postoperatoria.
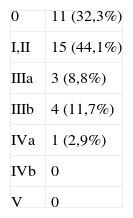
En la tabla 2 se muestra la morbilidad postoperatoria de la serie, agrupada con la clasificación de Clavien-Dindo7. La mortalidad fue nula y un 67,5% de los pacientes tuvo alguna complicación, lo que conllevó una mediana de estancia hospitalaria de 17 días (R.I. 13-30). La complicación más frecuente fue el íleo prolongado. Cinco pacientes (14,6%) requirieron reintervención durante el postoperatorio por diversos motivos (dehiscencia de la anastomosis colorrectal, urinoma por fístula uretero-ileal, bypass fémoro-femoral por oclusión y hernia inguinal incarcerada). Otros 5 pacientes (14,6%) tuvieron que ser intervenidos por complicaciones surgidas durante el seguimiento (nefrectomía tras nefrostomía complicada, retirada de prótesis de mama por infección persistente, y por complicaciones relacionadas con la preservación de muñones anorrectales en la EPT supraelevadora).
Morbimortalidad de la serie de exenteración pélvica total, agrupada según la clasificación de Clavien-Dindo7, así como el número de reintervenciones tardías
| 0 | 11 (32,3%) | |
| I,II | 15 (44,1%) | |
| IIIa | 3 (8,8%) | |
| IIIb | 4 (11,7%) | |
| IVa | 1 (2,9%) | |
| IVb | 0 | |
| V | 0 |
Reintervenciones tardías: 5 (14,6%).
Con una mediana de seguimiento de 23 meses (R.I: 13-45) tras la EPT, 21 (62%) pacientes están vivos sin evidencia de enfermedad, 12 (35%) han fallecido por progresión de la enfermedad o enfermedad intercurrente (un caso) y una (3%) paciente está viva con enfermedad recurrente.
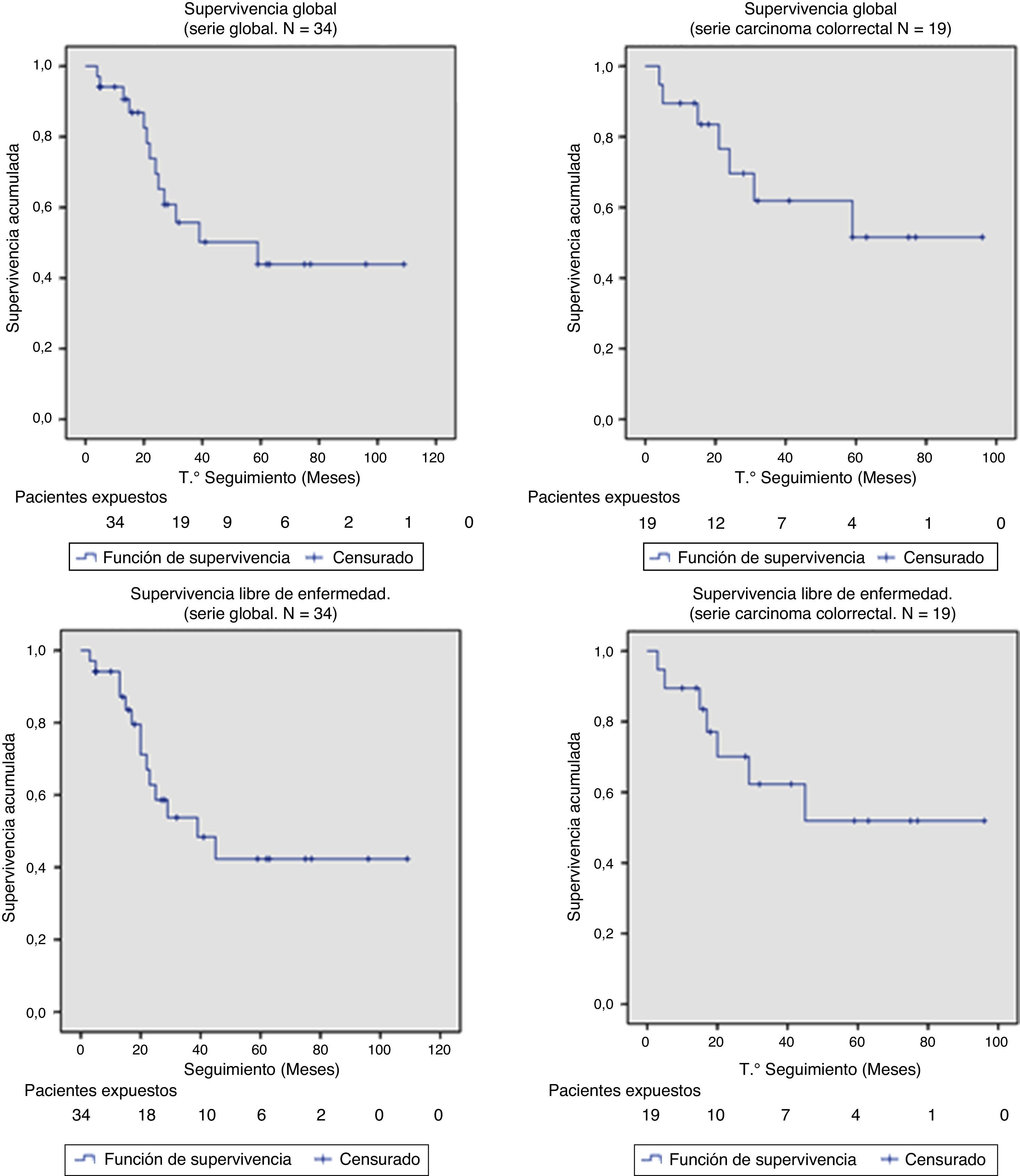
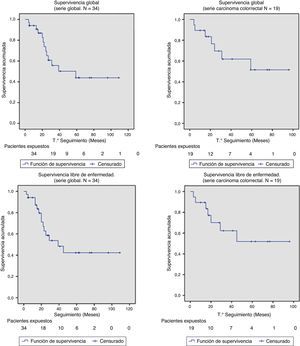
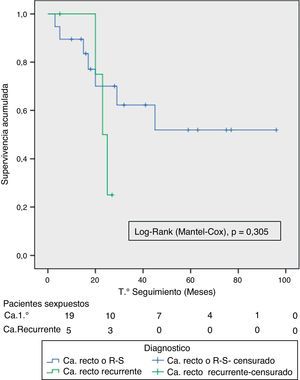
La SG y la SLE a los 2 años del total de la serie fueron del 67% y 58% respectivamente. La mediana de SG y SLE de la serie fue de 59 meses (IC 95%: 26 a 110) y de 39 meses (IC 95%: 14 a 64), respectivamente. Dado que el evento (recidiva o muerte por enfermedad) no se ha producido en el 50% de los pacientes con TAPR, las medianas de SG y SLE no se pueden calcular para este grupo (en la figura 2 se puede observar que más del 50% se encontraban vivos y libres de enfermedad al final del estudio); en su defecto la SG y la SLE a los 2 años para este grupo de pacientes fue del 69,6% y 62,3%, respectivamente (fig. 2).
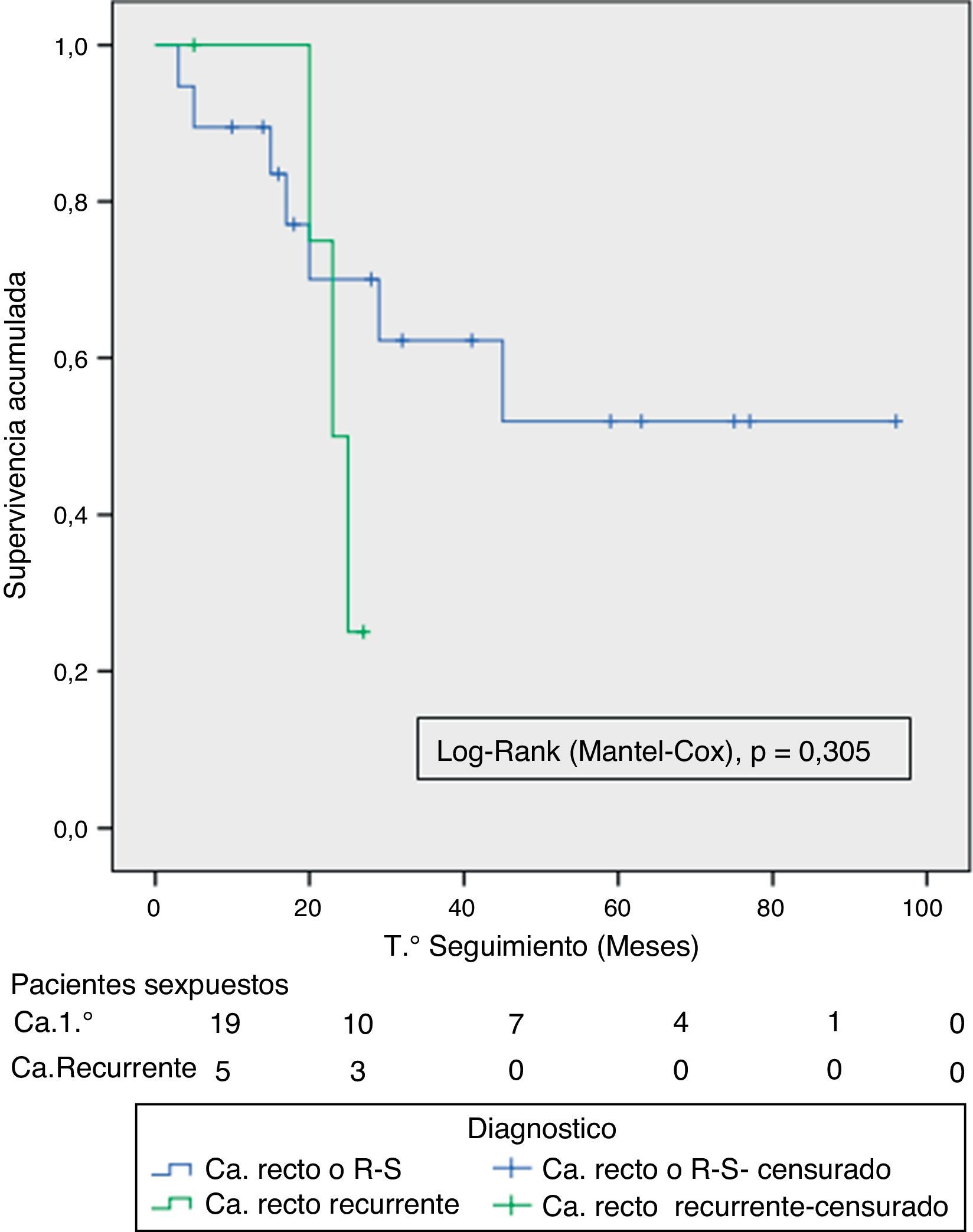
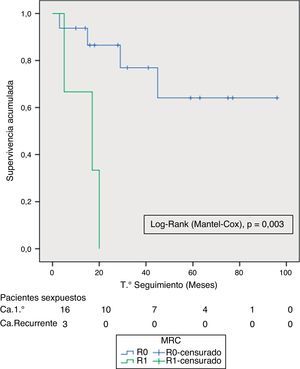
Se compararon las curvas de SG y SLE entre los TAPR y CRR y entre las resecciones R0/R1 mediante la prueba de long-rank. Solo encontramos diferencia significativa en la SLE entre resecciones R0 y R1. El pequeño número de pacientes con tumores recurrentes y resecciones R1 podría explicar estos resultados (figs. 3 y 4).
Como en otras series contemporáneas4,8–10 realizamos una EPT principalmente para tratar los TAPR. En una revisión sistemática sobre la EPT en los TAPR4 se señala una supervivencia a 5 años del 52% (rango de 31-77%) y una mediana de supervivencia de 35,5 meses (rango 14-93 meses). Estas cifras son inferiores para las EPT por cáncer de recto recurrente, con una supervivencia a 5 años del 18% (rango: 0-37%) y una mediana de supervivencia de 18 meses (rango: 8-38 meses), lo que indica el peor pronóstico para este subgrupo de pacientes.
Las pruebas de imagen preoperatorias y la elección de casos nos permitió realizar un 70% de resecciones R0 en el global de la serie, y del 85% en los casos de TAPR, porcentajes similares a otras publicaciones recientes4,8–10, evidenciando las diferencias entre realizar una EPT para los TAPR respecto a los CRR, en lo relativo a una resección con márgenes libres, potencialmente curativa. Esto se traduce en la diferencia significativa relativa a la SLE entre las resecciones R0 y R1 que encontramos.
Por otra parte el 21% de los casos con cáncer rectal avanzado se estadificaron como pT3, lo que implica que la fijación a las estructuras genitourinarias eran inflamatorias o fibrosas, no por infiltración tumoral. Hay que señalar que 3 de los 4 pacientes con pT3 habían recibido QRT preoperatoria. Incluso intraoperatoriamente persiste la incertidumbre entre el riesgo de provocar una siembra tumoral y la necesidad de realizar una resección ampliada. Estos hallazgos son consistentes con otras publicaciones, que cifran en un 20-56% los especímenes de EPT que no infiltran los órganos genitourinarios4,6,11. En los casos recurrentes las principales causas de incertidumbre vienen dadas por la ausencia de un plano claro en las paredes laterales de la pelvis y la dificultad de diferenciar la infiltración de la fijación fibrosa a cóccix y sacro. En estos casos la resección ampliada a estructuras óseas, vasculares y nerviosas, bien detalladas anatómicamente, obtiene un incremento de resecciones R011,12. Por otra parte, la presencia de tumores en pelvis previamente radiadas, de tumores mucinosos extensos, la existencia de fístulas recto-genitourinarias o externas al periné o la vulva, o de pacientes muy debilitados, hace que la QRT no sea una opción real o válida en esos casos, como se desprende del dato de que solo el 62% de nuestros pacientes con TAPR la recibiera, dato algo inferior al de otras series, si bien estas incluyen tanto TAPR como CRR4,8–11.
Solo un 20% de los tumores primitivos de recto fueron pN1-2, lo que indica que estos tumores avanzados son comparativamente poco linfotropos. La alta presencia de tumores mucinosos (más expansivos que infiltrativos) en esta serie puede producir un sesgo en este sentido. La afectación ganglionar se ha señalado, junto a la obesidad y a la enfermedad recurrente, como los principales factores de mal pronóstico en relación con la EPT para los TAPR8,9. Los carcinomas de cérvix o endometrio tienen una alta frecuencia de afectación ganglionar, lo que justifica la realización sistemática al menos de una linfadenectomía obturatriz bilateral, cuya implicación pronóstica es diferente a la del cáncer colorrectal6.
La mortalidad postoperatoria histórica al inicio de la EPT, en el siglo pasado, era del 23%3,4. Obviamente, los avances en muchos campos de la medicina y la cirugía han contribuido a disminuir la morbimortalidad. En la revisión sistemática de Yang et al., sobre series de EPT entre los años 2000 y 2012, se señala una mediana de mortalidad del 2,2% (rango: 0-25%), y una morbilidad del 57% (rango: 37-100%)4. El 67,5% de nuestros pacientes sufrieron alguna complicación postoperatoria, un 14,6% requirió una reintervención quirúrgica durante su ingreso, y un 14,6% más una reintervención por complicaciones tardías. La nula mortalidad y la morbilidad obtenida se asemeja a otras series actuales, con similar estancia hospitalaria como dato sustituto de morbilidad global6,8–10.
La principal fuente de morbilidad postoperatoria se origina por la derivación o reconstrucción urinaria, vaginal e intestinal y por el manejo de la cavidad pélvica vacía resultante.
Aunque en algunos pacientes es posible realizar la reconstrucción intestinal y genitourinaria tras una EPT, sin la necesidad de estomas13, la mayoría de los pacientes no tienen esta posibilidad (por resección de la uretra membranosa o exenteración infraelevadora) o presentan una pelvis muy fibrosa o rádica, y requieren una doble derivación. Típicamente esta se realiza mediante 2 estomas por separado. El conducto ileal de Bricker es el procedimiento más efectuado como diversión urinaria, pero no está exenta de problemas. La incidencia de estenosis ureteroileal, hidronefrosis, pielonefritis recurrente o el deterioro silente de la función renal ocurre hasta en un 20% de los casos4,6,13, lo que requiere seguimiento de por vida. Una alternativa es la derivación urinaria y fecal utilizando un solo estoma mediante una colostomía húmeda hendida o double-barrelled colostomy, procedimiento que difiere técnicamente de la nada recomendable colostomía húmeda clásica. Con este procedimiento el grupo de Belvitge ha publicado una de las serie más largas de la literatura, con resultados satisfactorios y comparables, en términos de morbilidad urinaria, al doble estoma, Bricker y colostomía, por separado14. Nuestra experiencia con 6 casos es muy limitada para sacar conclusiones. La intervención es más rápida, evita una anastomosis ileo-ileal y requiere un solo estoma, lo que facilita el empleo de un colgajo miocutáneo de recto anterior en caso de precisarlo, y puede ser más aceptable para los enfermos, sin embargo el manejo de los dispositivos de estomaterapia no son tan sencillos; por otra parte requiere vigilancia respecto a la posibilidad de infecciones urinarias ascendentes.
La pelvis denudada de órganos, y frecuentemente radiada, está asociada a complicaciones como abscesos, obstrucción intestinal, fístula intestinal o dehiscencia de heridas perineales. El aporte de tejido vascularizado, como la epiplonplastia o los colgajos miocutáneos, ayudan la rellenar la cavidad vacía y a disminuir la morbilidad15. La epiplonplastia, por lo general, es pequeña para rellenar toda la pelvis, por lo que simultánea o alternativamente se pueden utilizar mallas biológicas o de otro tipo para reparar el suelo pélvico15. En 3 ocasiones empleamos una prótesis de mama para rellenar la pelvis, y puede ser una buena opción cuando se requiera dar radioterapia postoperatoria16 o reconstruir el tránsito intestinal mediante una anastomosis colorrectal, al impedir la entrada del intestino delgado en la pelvis17.
Aunque un 62% de las EPT que realizamos fueron supraelevadoras, solo reconstruimos el tránsito intestinal en la mitad de ellas, dejando un muñón anorrectal abandonado y grapado en el resto. Este ha sido la principal causa de reoperaciones tardías en la serie, por problemas de dehiscencia, supuración mantenida y fistulización, por lo que completar la excisión anorrectal en caso de no reconstrucción parece más aconsejable, como por otra parte han señalado otros autores18.
El patrón de la morbimortalidad de la EPT es similar hoy al de otras cirugías mayores, sin embargo la naturaleza desfigurativa de la intervención y la necesidad de un prolongado proceso de rehabilitación hacen que cobre mayor importancia la valoración de la calidad de vida resultante. A este respecto 2 estudios19,20 señalan que la calidad de vida de los pacientes con una supervivencia prolongada libre de enfermedad sometidos a EPT por TAPR no difiere de los pacientes tratados con una resección rectal estándar o que no han requerido derivación urinaria.
En conclusión, la EPT es un procedimiento potencialmente curativo para las neoplasias viscerales avanzadas de la pelvis con una morbimortalidad hoy aceptable. La adecuada selección de pacientes y el abordaje multidisciplinario son claves para mejorar los resultados.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.