Introducción
El pie diabético es una complicación devastadora de la diabetes mellitus que se acompaña con úlceras de evolución tórpida, que a menudo desembocan en amputación. Estudios realizados en Estados Unidos demuestran que entre el 4,4 y el 10,5% de los diabéticos desarrollan una úlcera en el pie, lo que motiva 82.000 amputaciones anuales1. En España no hay datos concluyentes de la incidencia y la prevalencia de esta complicación, aunque se estima que afecta al 15% de los diabéticos.
Se ha comprobado que el retraso en la cicatrización de las úlceras de pie diabético se relaciona con infección en el hueso o las partes blandas y esto complica el pronóstico y el tratamiento de la lesión2.
El control de la isquemia, la ausencia de infección, una descarga adecuada y un correcto manejo local de la úlcera son los pilares del tratamiento en las lesiones de pie diabético3. Sin embargo, a menudo, pese a seguir estas premisas, las úlceras no evolucionan y se dilata el tiempo de cicatrización; de hecho, se estima que las lesiones que no avanzan en un período aproximado de 4 semanas deben ser reevaluadas4.
Varios estudios han demostrado que las úlceras crónicas en general y las de pie diabético en particular presentan alteraciones en la proliferación de fibroblastos, el equilibrio entre factores de crecimiento y metaloproteinasas (MMP) y la remodelación de la matriz extracelular5,6.
Estudios posteriores han investigado el entorno biomolecular del exudado de las úlceras crónicas de pie diabético. El análisis comparativo del entorno de heridas crónicas y agudas reveló una elevada cantidad de MMP en úlceras crónicas impidiendo la acción proliferativa de los factores de crecimiento y promoviendo el recambio de la matriz extracelular7.
La elevada cantidad de MMP en úlceras de pie diabético tiene efectos deletéreos en la formación de nuevo tejido y degrada el tejido de granulación neoformado. A esto se suma la destrucción de los factores de crecimiento y citocinas que incrementa los efectos nocivos en el entorno ulceroso8-11.
Varios estudios han demostrado la eficacia y la efectividad de la utilización de factores de crecimiento exógenos como tratamiento de las úlceras neuropáticas de pie diabético12. Sin embargo, las últimas tendencias en el campo de investigación del medio de la herida parecen apuntar a que el control de las condiciones hostiles y la restauración del equilibrio proteolítico modulando la cantidad de proteasas pueden favorecer la curación de la úlcera y acelerar la cicatrización. Éste es el principio del mecanismo de acción del apósito de celulosa oxidada regenerada y colágeno (CRO+C)13.
El apósito de CRO+C actúa principalmente uniéndose e inactivando las MMP, lo que favorece la protección de los factores de crecimiento endógenos, que se liberan en el lecho de la herida de forma gradual una vez que se han reducido las proteasas. De forma añadida la CRO+C modula la función quimiotáctica y la proliferación celular de fibroblastos13.
La evidencia aportada por esos estudios nos condujo a la realización de un estudio comparativo con el objetivo de evaluar la eficacia de un apósito CRO+C modulador de proteasas en el tratamiento de úlceras neuropáticas de pie diabético, comparándolo con el tratamiento estandarizado mediante apósitos convencionales.
Material y método
Se realiza un estudio prospectivo, aleatorizado, longitudinal y controlado en el que se incluye a 40 pacientes que acudieron a la Unidad de Pie Diabético de la Clínica Universitaria de Podología de la Universidad Complutense de Madrid. Los pacientes fueron asignados a 2 grupos: un grupo de pacientes que recibieron tratamiento con apósito de CRO+C (G1; n = 20) y otro grupo que recibió el tratamiento estandarizado en la unidad de acuerdo con el protocolo (G2; n = 20). Los pacientes fueron asignados aleatoriamente a cada uno de los grupos mediante asignación por códigos de números aleatorios.
Los criterios de inclusión en el estudio fueron: pacientes mayores de 18 años con diagnóstico de diabetes mellitus que tuvieran lesiones en el pie (no se incluyeron lesiones por encima de los maléolos) de origen neuropático, con un estado vascular compatible con la cicatrización (presión transcutánea de oxígeno [TcpO2] > 30 mmHg), con lesiones en cuyo lecho hubiera tejido de granulación en el 100% de su superficie.
Los pacientes con úlceras infectadas fueron tratados hasta controlar el proceso séptico antes de incluirlos en el estudio. A los pacientes que requirieron amputación previa o desbridamiento quirúrgico se los incluyó una vez que el lecho de amputación presentara tejido de granulación en el 100% de su superficie, y después de 15 días tratados con un apósito biocida de carbón activo y plata.
De los pacientes con varias lesiones, sólo se incluyó una úlcera, y siempre se eligió la más representativa o aquella por la que se inició el tratamiento en el centro.
También se incluyó a pacientes con fracasos de tratamientos previos de la lesión.
Se excluyó del estudio a los pacientes con un estado vascular pobre y diagnóstico de enfermedad vascular periférica (TcpO2 < 30 mmHg), los pacientes con expectativa de vida inferior a 6 meses, con hipersensibilidad conocida a los apósitos utilizados o algunos de sus componentes, con úlceras con infecciones activas o con osteomielitis no tratada y cualquier otro criterio que a opinión del investigador se debiera manejar previamente a la inclusión del paciente en el estudio.
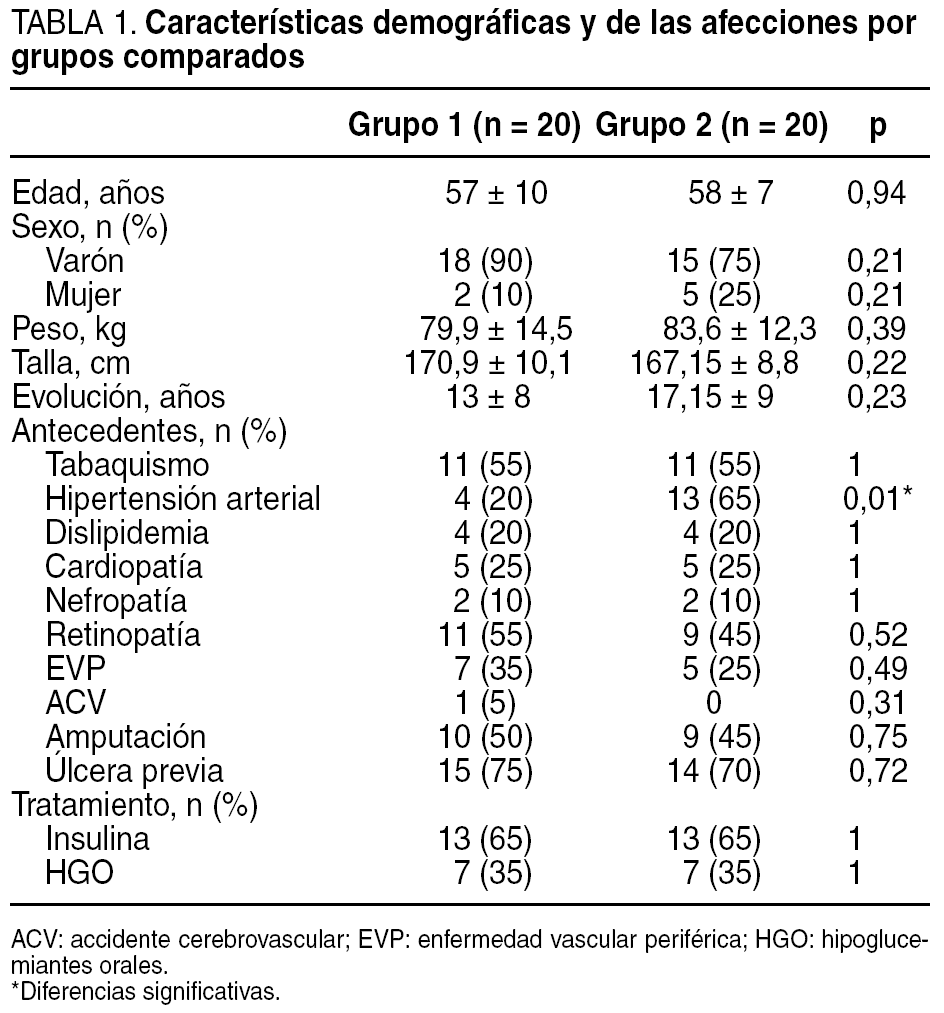
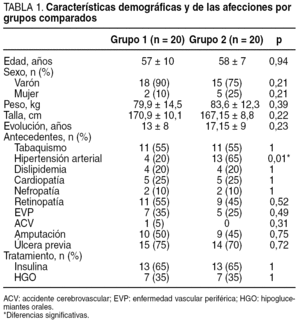
Las características descriptivas de la muestra (n = 40) se describen en la tabla 1. A todos ellos se les realizó una exploración vascular y neurológica para investigar la base etiopatogénica de la lesión y su pronóstico.
La sensibilidad vibratoria fue explorada mediante el uso del biotensiómetro y mediante el monofilamento de Semmes-Weinstein 5.07 10g. Todos los pacientes de ambos grupos tenían afección neurológica.
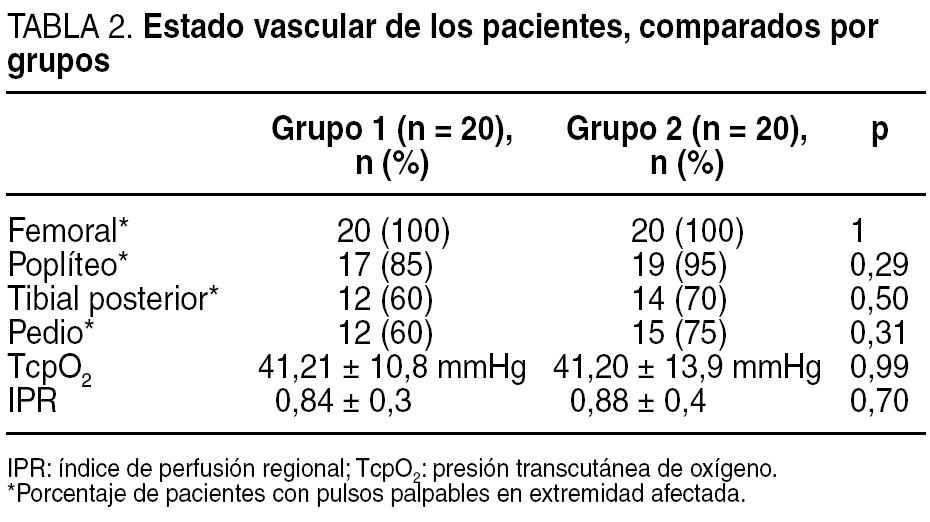
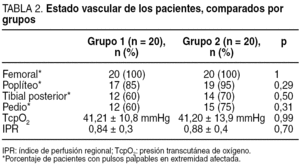
El examen vascular se realizó mediante la toma de pulsos femoral, poplíteo, tibial posterior y pedio así como mediante la determinación de la TcpO2. El índice tobillo/brazo se realizó a todos los pacientes como protocolo de exploración del centro; sin embargo, la dificultad de realizar esta prueba a los pacientes con calcificación arterial de la capa media (enfermedad de Mönckeberg) hizo que se tomara como medidas objetivas de referencia la TcpO2. Los valores de normalidad son los > 30 mmHg. De forma añadida se halló la tasa que relaciona la oxigenación central y la periférica medida en el pie, denominada índice de perfusión regional (IPR)14. Los resultados del examen vascular en ambos grupos son similares (tabla 2), si cabe, ligeramente peores en el grupo de pacientes que recibió el tratamiento con CRO+C, aunque sin significación estadística al comparar ambos grupos (p > 0,05).
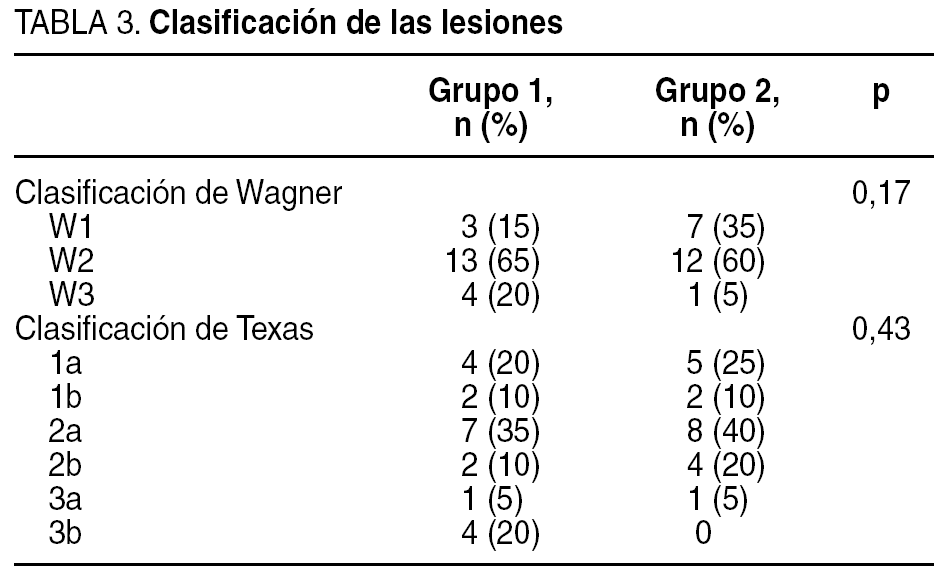
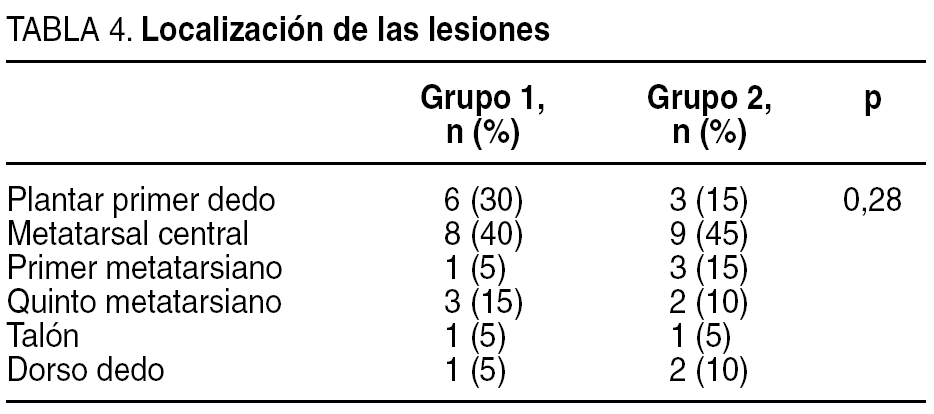
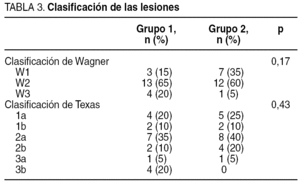
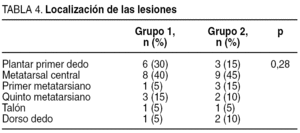
Las lesiones se clasificaron utilizando la escala de Wagner y Texas (tabla 3, donde aparece la situación previa de la úlcera del paciente antes de iniciar el estudio, es decir, en el estado en que acudieron a la unidad en la primera consulta). Respecto a la localización de las lesiones, la mayoría de ellas se localizaron en zonas de roce o presión (tabla 4). La antigüedad requerida para incluirla en el estudio fue mayor de 6 semanas.
El tiempo medio de evolución de la lesión fue mayor para el grupo de pacientes que no recibieron tratamiento con matriz moduladora (37,9 ± 34 semanas y 12 ± 13,5 semanas; p = 0,04).
Para el tratamiento local de las úlceras incluidas en el estudio, se aplicó el protocolo de curación establecido en la unidad de pie diabético, que consiste en el lavado con suero fisiológico de la lesión y secado posterior con gasa estéril mediante leve presión. Posteriormente todos los pacientes recibieron durante 15 días tratamiento de descontaminación mediante un apósito biocida de carbón activo y plata y la colocación de un apósito secundario hidropolimérico adhesivo. La secuencia de cambio de apósitos se realizó cada 48 h los lunes, los miércoles y los viernes.
Un vez superadas las 2 semanas de tratamiento con la malla biocida, los pacientes fueron aleatorizados para elegir la aplicación del tratamiento. Los pacientes asignados al grupo 1 recibieron terapia con la matriz moduladora de proteasas (CRO+C) cubierta con un apósito secundario hidroactivo. Los pacientes asignados al grupo 2 continuaron el tratamiento con apósito hidroactivo. En este grupo de pacientes se aplicó en ocasiones un gel humectante amorfo en úlceras de bajo exudado.
La duración de las observaciones para cada paciente se estableció en un período máximo de 6 semanas (42 días) o hasta la completa cicatrización de la herida. Todos los pacientes fueron sometidos a terapias de descarga de la úlcera adecuadas a su localización. No obstante, se recomendó a los pacientes reposo relativo durante el proceso de cicatrización de la lesión y reducir el apoyo del pie ulcerado y la bipedestación prolongada.
Las valoraciones se realizaron durante las 6 semanas en el día de inclusión del paciente en el estudio (valoración 0), el día 21 y el día 42. Durante estos registros se realizó fotografía digital de la lesión y medición de superficie y volumen de la úlcera. Los pacientes que cicatrizaron antes de los 42 días fueron registrados el día de la cicatrización.
Durante la realización del estudio se produjeron 2 exclusiones, 1 por cada grupo de estudio, debido a la complicación del proceso con infección. Se excluyó del estudio a ambos pacientes y se trató la complicación, que en ambos casos tuvo buena evolución y se consiguió la cicatrización de la lesión, aunque se los excluyó del seguimiento del estudio.
Los datos recogidos en los formularios de los pacientes fueron introducidos en el programa de análisis SPSS versión 13.0 para Windows, para su manejo estadístico. Se aceptó significación estadística cuando p < 0,05 con un intervalo de confianza (IC) del 95%.
Resultados
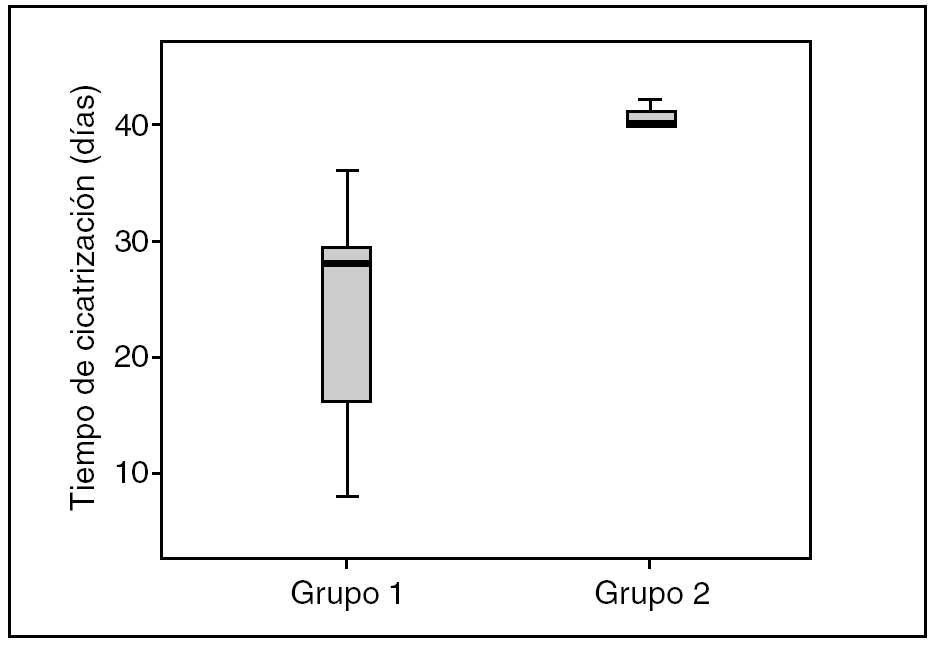
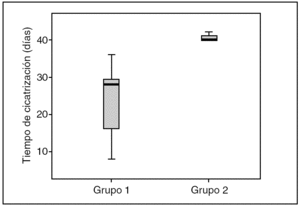
Al finalizar las 6 semanas de seguimiento, había cicatrizado un total de 12 (63%) de 19 pacientes en el grupo 1 de tratamiento con la matriz moduladora, frente a 3 (15%) de 19 pacientes en el grupo 2 de control; la diferencia tuvo significación estadística (p < 0,03; fig. 1). El tiempo medio de cicatrización fue de 23,3 ± 9,9 días en el grupo 1 y de 40,6 ± 1,15 días, también con diferencias significativas entre ambos grupos (p < 0,01).
Fig. 1. Gráfico de cajas que representa el tiempo de cicatrización en días de los grupos en estudio durante las 6 semanas de seguimiento.
Los porcentajes de reducción en volumen, superficie y profundidad fueron mejores en el grupo 1 de CRO+C que en el grupo 2 de control (tabla 5).
Todos los pacientes que no cicatrizaron al finalizar el tiempo del estudio tuvieron una mejoría de sus lesiones y progresaron a úlceras superficiales, tanto el grupo 1 como en el grupo 2.
Los pacientes que recibieron la terapia moduladora de proteasas tuvieron una ventaja hacia la cicatrización, en comparación con el grupo con tratamiento estándar (odds ratio [OR] = 8,5; p = 0,03).
Discusión
El análisis de los resultados obtenidos contrasta la hipótesis de que la utilización de apósitos de CRO+C en pacientes con úlceras de pie diabético de origen neuropático induce una mejor regeneración tisular que un buen tratamiento local.
La comparación de las medias del número de pacientes cicatrizados en ambos grupos (G1 y G2) y del tiempo medio de curación demostró diferencias significativas (p < 0,05), lo que demuestra una mejor respuesta a la cicatrización del grupo de pacientes que recibieron el tratamiento con CRO+C.
Un dato interesante que se desprende de este estudio es el tiempo de observación. La mayoría de las experiencias previas con este tratamiento habían estudiado en tiempos más largos con un seguimiento de 12 semanas, no se había encontrado diferencias significativas entre el grupo de pacientes que recibió tratamiento con CRO+C y el grupo control (p = 0,12) y se había hallado una notable mejoría sobre todo en las úlceras con un tiempo de evolución < 6 meses (p = 0,56)15. En el presente estudio los pacientes cicatrizaron en tiempos cortos, con un tiempo medio de 23,3 ± 9,9 días en el G1 a CRO+C, es decir que el 60% de los pacientes se curaron en un período de aproximadamente 3 semanas.
La mayoría de los pacientes que se incluyó en ambos grupos no recibían un tratamiento adecuado de la úlcera (45%; 18 estaban tratados con povidona yodada y suero) y se trataban con antisépticos y otros productos que en ocasiones son perjudiciales para la regeneración tisular. Un 2,5% se trataba con PDGF y otro 2,5%, con apósito estéril de colágeno en polvo. El resto recibía tratamientos variados, y un grupo destacado recibía tratamiento con apósito de plata (32,5%; n = 13).
Acelerar la cicatrización de una úlcera en el pie diabético es un aspecto fundamental para prevenir complicaciones como la infección o la amputación. Existe un factor añadido al problema sanitario cuando se trata úlceras y heridas crónicas: la relación coste/beneficio. Un obstáculo importante en la implantación de nuevas terapias en el manejo de las úlceras de pie diabético es el prejuicio sobre el incremento de costes que se asocia a la utilización de nuevas tecnologías. Los gestores de salud temen incrementar los costes de los tratamientos establecidos sin el aval de evidencias contrastadas. Esta cautela, pese a ser lógica, no debe ser una barrera al análisis de nuevas terapias que sin duda benefician al paciente y a la balanza eficacia/eficiencia. Existen datos que avalan una reducción en los tiempos de tratamiento y curación en pacientes tratados con CRO+C, estudios que se han realizado en países como Francia, Alemania, Suiza y Reino Unido. Aparte de indicar que este tratamiento tiene un beneficio en el ahorro del coste del paciente, se destaca su especial beneficio en la terapia de úlceras de pie diabético de origen neuropático16. Nuestros resultados respaldan estos criterios, ya que se ha conseguido resultados notables en alrededor de 6 semanas.
Otros estudios han cuantificado la reducción de las MMP, además de los resultados de cicatrización. La aplicación de CRO+C en úlceras neuropáticas de pie diabético ha demostrado diferencias en la relación cuantitativa de la MMP-9/TIMP-2, favorables a los pacientes que se tratan con un apósito de COR+C, en comparación con un grupo control, que se empiezan a hacer notables a los 8 días de tratamiento (p = 0,01)17.
Durante la realización del estudio observamos una respuesta regenerativa excelente en los pacientes con desbridamiento quirúrgico previo. Se trataba de pacientes con úlceras de larga evolución que, por su localización, se habían complicado con osteomielitis del hueso adyacente. Dichos pacientes fueron sometidos al desbridamiento quirúrgico del hueso afecto, sumado a terapia antibiótica guiada por cultivo y antibiograma. Tras la cirugía los pacientes fueron tratados con apósito biocida durante 2 semanas, momento en el que se les incluía en el estudio. Los pacientes que llegados a este punto recibieron CRO+C mostraban resultados espectaculares, con superficies óseas cubiertas y cavidades articulares rellenas en apenas 1 semana. Esta circunstancia despertó un especial interés en el grupo investigador, ya que presumíamos que se definía una indicación muy adecuada de la utilización del apósito de CRO+C. Un estudio publicado en 2005 nos relata el efecto del apósito de CRO+C en heridas agudas5 y desvela el efecto protector de este apósito en la concentración de factor de crecimiento derivado de las plaquetas (PDGF), el factor de crecimiento epidérmico (EGF) y el factor de crecimiento insulínico 1 (IGF-1), en comparación con los pacientes que no recibieron el tratamiento (p < 0,05). Estos hallazgos revelan que el apósito de CRO+C tiene un beneficio en el manejo de heridas tras el desbridamiento, ya que incrementa la concentración de factores de crecimiento endógenos del paciente, que se encuentran alterados en los pacientes diabéticos5,18.
La fisiopatología de la úlcera neuropática de pie diabético ha demostrado diferencias respecto a otras úlceras crónicas de etiología distinta, incluso que la respuesta regenerativa en el paciente diabético es diferente de la de estos casos. Esto explicaría que determinadas terapias consistentes en la aplicación de factores de crecimiento exógenos no sean igual de eficaces en pacientes diabéticos que en aquellos que no lo son5,18.
Los resultados ofrecidos por nuestro estudio y la evidencia aportada hasta el momento por otros autores revelan la importancia de conocer la fisiopatología y el entorno de la úlcera de pie diabético, ya que esta y otras terapias que modulan el medio de la herida se definen como opciones terapéuticas beneficiosas que tener en cuenta.
Correspondencia: Prof. J.L. Lázaro Martínez.
Unidad de Pie Diabético. Clínica Universitaria de Podología.
Facultad de Medicina. Pabellón I.
Avda. Complutense, s/n. 28040 Madrid. España.
Correo electrónico: diabetes@enf.ucm.es
Manuscrito recibido el 28-2-2007 y aceptado el 28-3-2007.