No existe consenso internacional en la definición del tipo de resección oncológica que corresponde a cada una de las colectomías existentes en la bibliografía actual.
El objetivo es definir para cada colectomía descrita en la literatura: plano de disección embriológico, pedículos vasculares en los que realizar ligadura central, la extensión de la colectomía y la necesidad de resección del epiplón mayor.
Se realiza un consenso de expertos a través de la metodología Delphi mediante 2 rondas desde la Sección Coloproctología de la Asociación Española de Cirujanos. Período de estudio: noviembre 2021/enero 2023. Fueron encuestados 120 expertos.
Grados de consenso: Muy fuerte: >90%, fuerte: 80-90%, moderado: 50-80%, no consenso: <50%.
La definición para cada colectomía oncológica quedó establecida mediante recomendaciones muy fuertes y fuertes.
Colectomías definidas: hemicolectomía derecha (HCD), HCD con linfadenectomía D3, HCD-ampliada, colectomía segmentaria de colon transverso, resección segmentaria ángulo esplénico, colectomía subtotal, total, hemicolectomía izquierda (HCI), HCI-ampliada y sigmoidectomía.
There is no international consensus on the definition of the type of oncological resection that corresponds to each of the colectomies existing in the current literature.
The objective is to define for each colectomy described in the literature: embryological dissection plane, vascular pedicles in which to perform central ligation, the extent of the colectomy and the need for resection of the greater omentum.
A consensus of experts is carried out through the Delphi methodology through two rounds from the Coloproctology Section of the Spanish Association of Surgeons. Study period: November 2021-January 2023. 120 experts were surveyed.
Degrees of consensus: Very strong: >90%, strong: 80-90%, moderate: 50-80%, non-consensus: <50%.
The definition for each oncological colectomy was established by very strong and strong recommendations.
Each oncological colectomy was established by right hemicolectomy (RHC), RHC with D3 lymphadenectomy, extended-RHC, transverse colon segmentary colectomy, splenic flexure segmentary colectomy, subtotal colectomy, total, left hemicolectomy (LHC), extended-LHC, sigmoidectomy.
Los estándares ampliamente reconocidos para las resecciones oncológicas en el cáncer de colon fueron definidos por Hohenberguer et al. en el año 2008, quienes detallaron la técnica de escisión completa del mesocolon (ECM)1. Estos se basan en una disección por el plano embriológico para mantener intacto el mesocolon, la ligadura alta o central de los vasos nutrientes tumorales, un margen de seguridad intestinal de 10cm y la incorporación de epiplón mayor en la resección.
La linfadenectomía-D3 (LD3) se basa en los mismos principios que la ECM, pero añade la necesidad de incorporar en la pieza quirúrgica los territorios de drenaje venoso del mesocolon que no van acompañados de la arteria2.
Sin embargo, no existe consenso internacional a la hora de definir exactamente el tipo de resección oncológica que corresponde a cada una de las colectomías existentes en la bibliografía actual3. Como consecuencia, la metodología de los estudios retrospectivos y prospectivos puede verse alterada.
Incluso, se pueden observar algunas diferencias de definición entre las guías europeas y americanas, resultado de la herencia quirúrgica de las diferentes escuelas.
El objetivo del presente estudio es estandarizar mediante consenso de expertos la definición de cada una de las colectomías oncológicas existentes.
Material y métodosEstudio diseñado y realizado por la Junta de Coloproctología de la Asociación Española de Cirujanos (AEC-CP).
Se empleó consenso de expertos a través de la metodología Delphi, que implica la aplicación de una secuencia de cuestionarios, complementada con resúmenes y revisiones basados en respuestas anteriores4. Período de estudio: noviembre 2021 a enero 2023.
Primera faseSelección de expertos que participarán en el estudioCriterio de selección de expertos: Cirujanos miembros de la sección AEC-CP con Certificado de Especialización Europeo en Coloproctología (EBSQ) y/o autores de publicación T-1 relacionados con cáncer de colon los últimos 5 años.
Selección de colectomías a definirHemicolectomía derecha (HCD), HCD con linfadenectomía D3 (HCD-LD3), HCD-ampliada, colectomía segmentaria de colon transverso (CSCT), colectomía segmentaria ángulo esplénico (CSAE), colectomía subtotal (CSUBT) y total (CTOT), hemicolectomía izquierda (HCI), HCI-ampliada y sigmoidectomía (SIG).
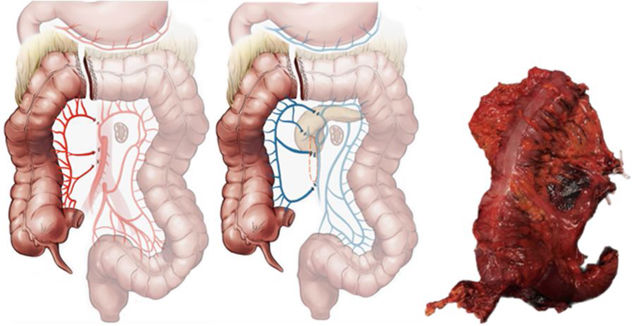
Iconografía anatomía vascular quirúrgica arterial y venosa mostrada en la figura 1A y B.
Segunda faseElaboración de cuestionario de primera rondaPreguntas de respuesta múltiple sobre cada uno de los puntos técnicos de las colectomías oncológicas.
Para colectomías que impliquen colon derecho y transverso incluyendo ambas flexuras, también se cuestionó sobre la inclusión o no de epiplón mayor con o sin inclusión de arteria gastroepiploica.
Además, en la HCD-LD3 y en la CSAE se cuestiona sobre la vascularización venosa que debe de ser incluida en la pieza quirúrgica. La razón de esta excepción es que son las 2 únicas zonas del mesocolon donde existe retorno venoso sin vascularización arterial satélite.
Para la elaboración de las cuestiones múltiples se asignó de forma voluntaria a un miembro de la AEC-CP para cada colectomía, el cual, realizó una revisión bibliográfica para mostrar las diferentes opciones descritas en la literatura.
Las pautas recomendadas para realizar esta revisión bibliográfica fueron las siguientes:
- -
Bases de datos: PubMed, Medline, Google Scholar y Cochrane.
Los criterios de inclusión en la búsqueda literaria:
- -
Artículos publicados desde el año 2000.
- -
Lecturas de texto completo.
- -
Metaanálisis, revisiones, libros y revistas.
- -
En la base de datos Google Scholar se ha filtrado también por idioma, incluyendo aquellos artículos que estuvieran solo en español y en inglés.
Grados de consenso:
Muy fuerte: más del 90% de acuerdo, fuerte: 80-90%, moderado: 50-80%, no consenso: menos del 50%.
Las respuestas con consenso muy fuerte, fuerte o moderado quedaron establecidas como respuestas finales.
Aquellas respuestas con consenso moderado o no consenso se preguntaron de nuevo en la ronda 2, pero con distinto formato con el objetivo de conseguir un grado de consenso mayor.
Cuarta faseElaboración de cuestionario de segunda rondaPara elaborar el cuestionario de la segunda ronda se propusieron 2 nuevos formatos de preguntas: mediante iconografía esquemática y/o datos estadísticamente significativos según la bibliografía.
Los miembros de la AEC-CP escogieron el nuevo formato por votación mediante reunión telemática.
Quinta faseDistribución de cuestionario de segunda ronda: vía email oficial desde la cuenta del secretario de la AEC-CPAlmacenamiento de las respuestas de segunda ronda. Mediante la aplicación TypeformAnálisis de los resultados de las respuestas de la primera rondaCada colectomía quedó definida con recomendaciones por encima del 50% de consenso (muy fuertes, fuertes o moderadas).
ResultadosSe extendieron invitaciones para responder los cuestionarios a 120 expertos. De los cuales, 86 (71,6%) realizaron participación completa (contestación de las 2 rondas al completo).
El tipo de disección embriológica, los pedículos vasculares arteriales y venosos que deben ser ligados en su origen, la extensión de la colectomía, la necesidad y la extensión de epiplón mayor a resecar y la necesidad de inclusión de la arteria gastroepiploica fueron definidos para cada una de las colectomías.
En las tablas 1-4 se muestran las preguntas realizadas para cada una de las colectomías, se detallan los resultados de la primera ronda (PR) y de la segunda ronda (SR) respecto a la cuestión más votada y el grado de consenso obtenido.
En la tabla 5 se muestra la definición definitiva para cada una de las colectomías a partir de las respuestas con un grado mayor del 50% (moderado, fuerte o muy fuerte).
En forma de material suplementario se aportan 2 documentos con todas las respuestas de PR y SG de forma detallada (material suplementario).
A continuación, se realiza un resumen de resultados de PR y SR para cada una de las colectomías.
La HCD, la HCD-LD3 y la HCD-ampliada presentan un grado de consenso fuerte o muy fuerte respecto al plano de disección por la fascia de Toldt y de Fredet, y la ligadura central de los vasos arteriales ileocólicos, cólica derecha cuando está presente y rama derecha de cólicos medios en la HCD y HCD-LD3 o vasos cólicos medios en su origen en la HCD-ampliada.
Además, existe consenso del 88,5% respecto a la incorporación en la HCD-LD3 del tejido linfograso localizado sobre la vena mesentérica superior (VMS) y en el en el tronco gastrocólico de Henle (TGCH). Además, el 80% de los expertos considera que la vena cólica derecha superior (VCDS) es la vena del TGCH que debe ser incorporada en la pieza quirúrgica (tabla 1).
Cuestiones realizadas respecto a hemicolectomía derecha, hemicolectomía derecha con linfadenectomía D3 y hemicolectomía derecha ampliada
| Resección | Cuestión | Resultado | Ronda 1 (%) | Ronda 2 (%) | Consenso |
|---|---|---|---|---|---|
| Hemicolectomía derecha | Disección embriológica | Acceso Toldt+Fredet | 81,6 | Fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Ileocólica+cólica derechaa+rama derecha cólica media | 77 | 80,2 | Fuerte | |
| Epiplón mayor y gastroepiploica | Inclusión derecha del epiplón mayor sin gastroepiploica | 72,4 | 77,9 | Moderado | |
| Hemicolectomía derecha con linfadenectomía D3 | Disección embriológica | Acceso Toldt+Fredet | 92 | Muy fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Ileocólica+cólica derechaa+rama derecha cólica media | 57,5 | 73,3 | Moderado | |
| Epiplón mayor y gastroepiploica | Inclusión derecha del epiplón mayor sin gastroepiploica | 52,9 | 62,8 | Moderado | |
| Territorios venosos | Tejido linfograso sobre la vena mesentérica superior y el tronco gastrocólico de Henle | 88,5 | Fuerte | ||
| ¿Qué vena del tronco gastrocólico de Henle debe ser incorporada? | Vena cólica derecha superior en su desembocadura en el tronco gastrocólico de Henle | 80,05 | Fuerte | ||
| Hemicolectomía derecha ampliada | Disección embriológica | Acceso Toldt+Fredet | 85,1 | Fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Ileocólica+cólica derechaa+cólica media | 81,6 | Fuerte | ||
| Epiplón mayor y gastroepiploica | Inclusión hasta ángulo esplénico del epiplón mayor sin gastroepiploica | 50,6 | 38,4 | No | |
| Extensión | Extensión de la colectomía transversa sin incluir el ángulo esplénico | 64,4 | 65,1 | Moderado |
Se muestran las respuestas que han obtenido más votos en la segunda ronda. Además, se muestran los porcentajes de votos tanto en la primera como segunda ronda y el grado de consenso.
El consenso respecto a incluir la porción derecha de epiplón mayor en la pieza quirúrgica es moderado.
En la CSCT, el 92% de los encuestados considera que la ligadura central debe de ser de los cólicos medios y el consenso es moderado respecto resecar ambas flexuras e incluir todo el epiplón mayor en la pieza quirúrgica.
Respecto a la CSAE, en la PR se obtiene consenso muy fuerte o fuerte de plano de disección por fascia de Toldt en colon descendente y transcavidad de epiplones en transverso, de extensión de colectomía de porción distal de colon transverso y colon descendente y de ligadura arterial central de la rama izquierda de la cólica media y de la arteria cólica izquierda. Por otro lado, tras las 2 rondas el consenso es moderado respecto a la inclusión del epiplón mayor del ángulo esplénico sin incluir la arcada gastroepiploica (72%), y respecto a la inclusión de la porción de la vena mesentérica inferior entre origen de arteria mesentérica inferior y borde inferior del páncreas (78%) (tabla 2).
Cuestiones realizadas respecto a colectomía segmentaria de colon transverso y colectomía segmentaria de ángulo esplénico
| Resección | Cuestión | Resultado | Ronda 1 (%) | Ronda 2 (%) | Consenso |
|---|---|---|---|---|---|
| Colectomía segmentaria colon transverso | Disección embriológica | Acceso a la transcavidad de los epiplones. No existe fascia de coalescencia | 73.6 | 72.1 | Moderado |
| Pedículos vasculares arteriales (y venas satélite) | Cólica media | 92 | Muy fuerte | ||
| Epiplón mayor y gastroepiploica | Todo el epiplón mayor, incluidas flexuras sin gastroepiploica | 35.6 | 54.7 | Moderado | |
| Extensión | Colon transverso incluyendo flexuras | 23 | 66.3 | Moderado | |
| Colectomía segmentaria ángulo esplénico | Disección embriológica | Acceso Toldt en colon descendente+transcavidad en transverso | 100 | Muy fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Rama izquierda cólica media+cólica izquierda | 89.7 | Fuerte | ||
| Epiplón mayor y gastroepiploica | Epiplón mayor del ángulo esplénico sin gastroepiploica | 70.1 | 72.1 | Moderado | |
| Territorios venosos | Porción de vena mesentérica inferior entre origen de arteria mesentérica inferior y borde inferior del páncreas | 72.4 | 77.9 | Moderado | |
| Extensión | Porción distal de colon transverso+colon descendente | 95.3 | Muy fuerte |
Se muestran las respuestas que han obtenido más votos en la segunda ronda. Además, se muestran los porcentajes de votos tanto en la primera como segunda ronda y el grado de consenso.
La CSUBT y CTOT muestran ya en la primera ronda un grado de consenso muy fuerte o fuerte (85-94%) para el plano de disección, la extensión de resección de colon y la ligadura central de los pedículos vasculares. El plano de disección de ambas técnicas será la fascia de Toldt y Fredet en colon derecho, Toldt en izquierdo y el acceso a la transcavidad de los epiplones para colon transverso. La extensión de resección será colon derecho, transverso y descendente para la CSUBT y CTOT, pero además la CTOT añadirá el colon sigmoide. La ligadura central de ambas técnicas coinciden en los vasos ileocólicos, cólicos derechos si están presentes y medios, pero se diferencian en que en la CSBUT se realiza ligadura central de la arteria cólica izquierda y en la CTOT de la mesentérica inferior. Tanto en la CSUBT como en la CTOT se muestra un consenso moderado (60-62%) de incluir la resección de todo el epiplón mayor sin la arcada gastroepiploica (tabla 3).
Cuestiones realizadas respecto a colectomía subtotal y colectomía total
| Resección | Cuestión | Resultado | Ronda 1 (%) | Ronda 2 (%) | Consenso |
|---|---|---|---|---|---|
| Colectomía subtotal | Disección embriológica | Acceso Toldt+Fredet en el lado derecho+Toldt en izquierdo+transcavidad en transverso | 93,1 | Muy fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Ileocólica+cólica derechaa+cólica media+cólica izquierda | 85,1 | Fuerte | ||
| Epiplón mayor y gastroepiploica | Todo el epiplón mayor sin gastroepiploica | 62,1 | 62,8 | Moderado | |
| Extensión | Colon derecho+transverso+descendente | 86,2 | Fuerte | ||
| Colectomía total | Disección embriológica | Toldt+Fredet en el lado derecho+Toldt en izquierdo+transcavidad en transverso | 94,3 | Muy fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Ileocólica+cólica derechaa+cólica media+mesentérica inferior | 85,1 | Fuerte | ||
| Epiplón mayor y gastroepiploica | Todo el epiplón mayor sin gastroepiploica | 60,9 | 60,5 | Moderado | |
| Extensión | Todo el colon hasta su unión con el recto | 94,3 | Muy fuerte |
Se muestran las respuestas que han obtenido más votos en la segunda ronda. Además, se muestran los porcentajes de votos tanto en la primera como segunda ronda y el grado de consenso.
Las colectomías centradas en tumores de colon izquierdo han mostrado en primera ronda alto grado de consenso respecto al plano de disección por la fascia de Toldt tanto en la HCI, HCI-ampliada y la SIG (84-100%). Sin embargo, en esta primera ronda, la HCI y la HCI-ampliada no alcanzaron consenso para la extensión de resección (21-39%) ni para el tipo de ligadura central vascular (28-51%). Sin embargo, tras la elaboración del nuevo cuestionario de segunda ronda sí que se alcanzó consenso muy fuerte (94-95%) para ambos puntos. En la HCI se debe de realizar ligadura vascular central de la arteria mesentérica inferior (AMI) y extensión de resección de colon descendente y sigma. En la HCI ligadura vascular central de arteria mesentérica inferior y rama izquierda de vasos cólicos medios con una extensión de resección de tercio distal de colon transverso, colon descendente y sigma.
Por último, la SIG muestra un consenso moderado de ligadura alta de arteria mesentérica inferior (65%) y extensión de resección proximal en la unión de colon descendente y sigma (69%) y un consenso muy fuerte (92%) de extensión de resección distal hasta recto superior incluyendo la unión rectosigmoidea (tabla 4).
Cuestiones realizadas respecto a hemicolectomía izquierda, hemicolectomía izquierda ampliada y sigmoidectomía
| Resección | Cuestión | Resultado | Ronda 1 (%) | Ronda 2 (%) | Consenso |
|---|---|---|---|---|---|
| Hemicolectomía izquierda | Disección embriológica | Acceso Toldt | 100 | Muy fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Mesentérica inferior | 28,7 | 95,3 | Muy fuerte | |
| Extensión | Colon descendente+sigma | 21,8 | 95,3 | Muy fuerte | |
| Hemicolectomía izquierda ampliada | Disección embriológica | Acceso Toldt | 100 | Muy fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Mesentérica inferior+rama izquierda cólica media | 51,7 | 94,2 | Muy fuerte | |
| Extensión | Tercio distal del colon transverso+colon descendente+sigma | 39,1 | 94,2 | Muy fuerte | |
| Sigmoidectomía | Disección embriológica | Acceso Toldt | 83,9 | Fuerte | |
| Pedículos vasculares arteriales (y venas satélite) | Mesentérica inferior en origen | 63,2 | 65,1 | Moderado | |
| Extensión proximal | Unión de colon descendente y sigma | 41,4 | 68,6 | Moderado | |
| Extensión distal | Recto superior incluyendo unión rectosigmoidea | 92 | Muy fuerte |
Se muestran las respuestas que han obtenido más votos en la segunda ronda. Además, se muestran los porcentajes de votos tanto en la primera como segunda ronda y el grado de consenso.
La tabla 5 muestra la definición definitiva obtenida tras las 2 rondas para cada una de las colectomías oncológicas.
Muestra la definición definitiva obtenida tras las 2 rondas para cada una de las colectomías oncológicas
| Tipo de resección | Definición definitiva | Figura |
|---|---|---|
| Hemicolectomía derecha | • Plano disección: Acceso Toldt+Fredet.• Ligadura central arterial: Ileocólica+cólica derecha+rama derecha cólica media.• Inclusión epiplón mayor: Inclusión derecha del epiplón mayor sin gastroepiploica. | |
| Hemicolectomía derecha con linfadenectomía D3 | • Plano disección: Acceso Toldt+Fredet.• Ligadura central arterial: Ileocólica+cólica derecha+rama derecha cólica media.• Ligadura central venosa: Tejido linfograso sobre la vena mesentérica superior+vena cólica derecha superior en su desembocadura en el tronco gastrocólico de Henle.• Inclusión epiplón mayor: Inclusión derecha del epiplón mayor sin gastroepiploica. | |
| Hemicolectomía derecha ampliada | • Plano disección: Acceso Toldt+Fredet.• Ligadura central arterial: Ileocólica+cólica derecha+cólica media.• Extensión colectomía: Colon transversa sin incluir el ángulo esplénico.• Inclusión epiplón mayor: No consenso. Respuesta más votada: Inclusión hasta ángulo esplénico del epiplón mayor sin gastroepiploicaa. | |
| Colectomía segmentaria colon transverso | • Plano disección: Acceso a la transcavidad de los epiplones. No existe fascia de coalescencia.• Ligadura central arterial: Cólica media.• Extensión colectomía: Colon transverso incluyendo flexuras.• Inclusión epiplón mayor: Todo el epiplón mayor, incluidas flexuras sin gastroepiploica. | |
| Colectomía segmentaria ángulo esplénico | • Plano disección: Acceso Toldt en colon descendente+transcavidad en transverso.• Ligadura central arterial: Rama izquierda cólica media+cólica izquierda.• Ligadura central venosa: Porción de vena mesentérica inferior entre origen de arteria mesentérica inferior y borde inferior del páncreas.• Extensión colectomía: Porción distal de colon transverso colon descendente.• Inclusión epiplón mayor: Epiplón mayor del ángulo esplénico sin gastroepiploica. | |
| Colectomía subtotal | • Plano disección: Acceso Toldt+Fredet en el lado derecho+Toldt en izquierdo+transcavidad en transverso.• Ligadura central arterial: Ileocólica+cólica derechaa+cólica media+cólica izquierda.• Extensión colectomía: Colon derecho+transverso+descendente.• Inclusión epiplón mayor: Todo el epiplón mayor sin gastroepiploica. | |
| Colectomía total | • Plano disección: Toldt+Fredet en el lado derecho+Toldt en izquierdo+transcavidad en transverso.• Ligadura central arterial: Ileocólica+cólica derechaa+cólica media+mesentérica inferior.• Extensión colectomía: Todo el colon hasta su unión con el recto.• Inclusión epiplón mayor: Todo el epiplón mayor sin gastroepiploica. | |
| Hemicolectomía izquierda | • Plano disección: Acceso Toldt.• Ligadura central arterial: Mesentérica inferior.• Extensión colectomía: Colon descendente+sigma. | |
| Hemicolectomía izquierda ampliada | • Plano disección: Acceso Toldt.• Ligadura central arterial: Mesentérica inferior+rama izquierda cólica media.• Extensión colectomía: Tercio distal del colon transverso+colon descendente+sigma. | |
| Sigmoidectomía | • Plano disección: Acceso Toldt.• Ligadura central arterial: Mesentérica inferior en origen.• Extensión colectomía: Desde unión del colon descendente y sigma hasta el recto superior incluyendo unión rectosigmoidea |
Esta definición es el resultado de las respuestas con consenso mayor del 50%.
Según la localización tumoral, se describen diferentes tipos de colectomías en la literatura actual.
Sin embargo, la definición de cada una de ellas puede variar según la bibliografía consultada5. Este hecho puede suponer un sesgo metodológico en aquellos estudios que valoran los resultados tanto de morbimortalidad como oncológicos a corto y largo plazo.
El presente trabajo no tiene como objetivo indicar el tipo de colectomía a realizar según la localización tumoral, sino estandarizar la definición de cada colectomía para unificar criterios.
La primera ronda de preguntas del presente estudio mostró esta falta de consenso ya que ninguna de las colectomías pudo quedar definidas completamente.
Tras el estudio publicado en el año 2009 por Hohemberger et al., se aceptaron como estándares de calidad en la técnica quirúrgica la disección por el plano embriológico, la ligadura alta de los vasos arteriales nutrientes y un margen de seguridad intestinal de 10cm proximal y distal a la lesión1.
Sin embargo, 2 puntos son más controvertidos y no quedan completamente establecidos en la bibliografía: la inclusión o no del epiplón mayor6 con o sin la arcada gastroepiploica7 y la extensión de la colectomía según la localización tumoral8.
Además, la creciente adaptación de la linfadenectomía D3 en occidente promulgada por oriente añade nuevas áreas anatomoquirúrgicas de confusión9.
En el presente estudio, el plano embriológico de disección según la colectomía parece no presentar dudas ya que en todas se llegó a un consenso fuerte o muy fuerte en la primera ronda.
En el colon ascendente dicho plano son la fascia de Toldt y de Fredet10, en el descendente la de Toldt11. La fascia de Fredet no está nombrada como tal en el artículo de Hohemberger et al., sin embargo desde la publicación en 201910 que mostraba su utilidad para disecar el mesocolon derecho de la segunda porción duodenal y la cabeza pancreática, esta fascia ha cobrado importancia hasta el punto de quedar incluida en la definición definitiva de HCD, HCD-LD3 y HC-ampliada.
Llama la atención la selección de los expertos de la fascia de Toldt en el sigma ya que por la rotación embriológica el sigma no presenta fascia de coalescencia12. La razón de esta elección podría ser que los expertos consideraron que en la SIG el colon descendente también debe liberarse del retroperitoneo.
Estas fascias de coalescencia son resultado de las rotaciones embriológicos del intestino primitivo y no solo repercuten en la técnica quirúrgica del cáncer de colon, sino que también lo hacen en el estudio anatomopatológico de las piezas quirúrgicas. De hecho, si la disección se ha realizado por el plano quirúrgico embriológico la superficie mesocólica será lisa y la pieza será clasificada como plano mesocólico correcto, en cambio si la superficie es rugosa será clasificada como plano mesocólico incorrecto. Sin embargo, encontramos un punto de discusión de este sistema de clasificación de calidad quirúrgica ya que tanto el colon transverso13 como el colon sigmoide no presentan fascia de coalescencia con el retroperitoneo por lo que todas las piezas presentarán superficie lisa.
Respecto a la ligadura alta de los vasos arteriales nutrientes tumorales, se observa un claro consenso de definición en la HCD, HCD-ampliada y CSCT. Los tumores del ángulo hepático y transverso proximal muestran dificultad a la hora de seleccionar que colectomía realizar ya que no existe un punto claro anatómico que nos marque cuando el drenaje linfático se realizará a través de los cólicos medios y por tanto cuando deben de ser ligados en su origen como en la HCD-ampliada y la CSCT. Por otro lado, la literatura nos muestra que la CSCT es poco utilizada, aunque su definición debía de ser incluida en el presente trabajo ya que es empleada en algunos estudios retrospectivos de cáncer de localizado en colon transverso.
La ligadura alta de tumores localizados en colon izquierdo mostró en la primera ronda una clara falta de consenso. Este hecho se refleja en las diferentes formas que existen actualmente para definir una ligadura alta de la arteria cólica izquierda más una ligadura alta de la rama izquierda de la cólica media. Para Mike et al.14 se denominaría HCI, mientras que para los expertos del presente estudio equivaldría a una colectomía segmentaria del ángulo esplénico.
El metaanálisis publicado por Wang et al.15 es un claro ejemplo de que esta falta de consenso definitorio provoca que las conclusiones de los diferentes estudios puedan ser rebatidas. En este metaanálisis se concluye que no existen diferencias de supervivencia oncológica en neoplasia localizada en ángulo esplénico para diferentes técnicas quirúrgicas: CSUBT, HCD-ampliada, HCI y colectomía segmentaria. Sin embargo, según los resultados del presente trabajo ni la HCD-ampliada ni la HCI incluirían al tumor localizado en ángulo esplénico en su resección por lo que no deberían ser valoradas en este estudio.
Un ejemplo de la necesidad de realizar el presente trabajo es el tipo de ligadura central en la HCI. En la primera ronda, los expertos seleccionaron la AMI en un 28%, mientras en tras incluir ilustraciones en el segundo cuestionario el porcentaje ascendió al 95%, considerándose consenso muy fuerte.
La HCI-ampliada, tras las 2 rondas, alcanzó un consenso del 94% de ligadura central de la AMI y de la rama izquierda de los vasos cólicos medios. En este caso, destacar que en algunos casos el cirujano decidirá la sección de los vasos cólicos medios, no por razones oncológicas, sino para posteriormente poder realizar una anastomosis colorrectal libre de tensión mediante el procedimiento denominado de Deloyers o el procedimiento de la de rotación completa intestinal16.
La SIG oncológica plantea tres tipos de ligadura central en la bibliografía, sin que ninguno de los 3 haya mostrado mejores resultados oncológicos hasta el momento. La primera sería ligadura central de vasos sigmoideos sin incluir la AMI, lo cual equivaldría a linfadenectomía D2 en oriente17. La segunda sería ligadura central de AMI, que equivaldría a linfadenectomía D3. Pero, esta última se divide a su vez en 2: ligadura alta y baja18,19. En la baja, la ligadura de la AMI se realiza posterior al origen de la ACI, mientras que en la alta se realiza en el origen de la AMI desde la aorta. En el presente trabajo se observa un consenso moderado (65%) de ligadura alta e inclusión de todo el recorrido de la AMI en la pieza quirúrgica. Mientras que un 32% votaron ligadura baja de la AMI y tan solo un 3% ligadura central de los vasos sigmoideos.
El hecho de que la bibliografía actual no haya demostrado inferioridad en términos de supervivencia de la ligadura central de los vasos sigmoideos podría ser resultado de otro problema que presenta el sistema de clasificación anatomopatológico de las piezas quirúrgicas. Ya que por ahora no es posible saber a través de la visión macroscópica del espécimen quirúrgicos que tipo de ligadura ha realizado el cirujano y la mayoría de publicaciones clasifican las piezas según la hoja operatoria.
El drenaje venoso que debe de ser incluido en la pieza quirúrgica es satélite de la arterial, a excepción de 2 áreas del mesocolon: en el colon derecho la VCDS20 y en el colon izquierdo el fragmento de vena mesentérica inferior entre origen de arteria mesentérica inferior y borde inferior del páncreas21. Estas zonas cobran mayor importancia dentro del concepto de LD3, debido al origen embriológico venoso de los conductos linfáticos.
En la HCD-LD3 se recomienda con consenso fuerte la inclusión del tejido linfograso localizado sobre la VMS y sobre el TGCH. Independientemente de la confección del TGCH, se recomienda también de forma fuerte que la vena que debe de ser ligada de forma apical es la VCDS. Este consenso está en consonancia con las últimas publicaciones que remarcan la importancia de esta vena que drena del ángulo hepático al TGCH22 y está presente en el 95% de los pacientes23.
En la CSAE, existen diferentes posturas respecto a la necesidad o no de incluir la vena mesentérica inferior en la pieza quirúrgica por posibilidad de adenopatías24. En el presente trabajo el 78% de los expertos recomiendan que la porción de vena mesentérica inferior entre origen de arteria mesentérica inferior y borde inferior del páncreas debe ser incluida en la resección.
Recientemente Planellas et al.25 demuestran en un estudio multicéntrico randomizado que en la SIG oncológica no es necesario incluir este fragmento de vena mesentérica inferior, sin embargo, todavía existe la duda en los tumores localizados en ángulo esplénico y colon descendente.
Otro motivo de duda quirúrgica es la extensión de las diferentes colectomías. Respecto a la HCI, en la Guía de Cirugía Colorrectal de la Asociación Española de Cirujanos26 incluye el colon transverso izquierdo, descendente y sigmoideo, sin embargo, en el presente estudio con un consenso muy fuerte incluye solo el descendente y sigmoideo. El colon transverso distal formaría parte de la HCI-ampliada.
La diferencia definitoria entre CTOT y CSUBT respecto a la extensión en la colectomía ha sido siempre motivo de confusión. Algunos autores27 definen que la CSUBT la forman colon derecho, transverso, descendente y sigma hasta la unión rectosigmoidea. Sin embargo, los resultados del presente estudio muestran que esta extensión equivaldría a la CTOT con consenso muy fuerte y no a la subtotal. Por tanto, si no se realiza ligadura alta de la AMI y resección del colon sigmoide, la colectomía será CSUBT.
Respecto a la inclusión o no del epiplón mayor en tumores localizados en ángulo hepático, colon transverso y ángulo esplénico, diferentes estudios muestran la necesidad de incluir el epiplón mayor por riesgo de implantes tumorales en el mismo28, y otros insisten en la necesidad de incluir la arcada gastroepiploica por la posibilidad de adenopatías29, especialmente en ambas flexuras colónicas. Sin embargo, recientes estudios apoyan la no inclusión del epiplón mayor ya que su origen embriológico se distinto al del mesocolon y por tanto el riesgo de micrometástasis es muy bajo30. Esta discusión queda reflejada en el presente estudio a pesar de las dos rondas de preguntas ya que se puede apreciar una falta de consenso o consenso moderado para la HCD, HCD-LD3, HCD-ampliada, CSCT, CSAE, CSUBT y CTOT.
En conclusión, mediante un estudio prospectivo con metodología tipo Delphi desde la Sección AEC-CP quedan establecidas las definiciones quirúrgicas para cada una de las colectomías oncológicas nombradas en la bibliografía.
Con ello, se podrán unificar criterios y realizar estudios prospectivos de mayor calidad metodológica y así obtener conclusiones de supervivencia más exactas tras la resección quirúrgica por cáncer de colon. Además, será de utilidad a la hora de estandarizar la técnica quirúrgica en el cáncer de colon.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Ilustradora: María Martín-Martí (mmartmararte@gmail.com).
J. Die-Trill, Unidad de Cirugía Colorrectal, Hospital Universitario Ramón y Cajal, Madrid; P. Pascual Damieta, Unidad de Cirugía Colorrectal, Hospital del Mar, Barcelona; E. Peña Ros, Unidad de Cirugía Colorrectal, Hospital General Universitario Reina Sofía, Murcia; R. Jimenez Rodríguez, Unidad de Cirugía Colorrectal, Hospital Universitario Virgen del Rocío, Sevilla; M. Hidalgo Pujol, Unidad de Cirugía Colorrectal, Hospital Universitario de Bellvitge, Barcelona; L.M. Jiménez Gómez, Unidad de Cirugía Colorrectal, Hospital Universitario Gregorio Marañón, Madrid; B. Arencibia Pérez, Unidad de Cirugía Colorrectal, Hospital Universitario de Gran Canaria Doctor Negrín, Las Palmas de Gran Canaria, Las Palmas; V. Vigorita, Unidad de Cirugía Colorrectal, Hospital Universitario Álvaro Cunqueiro, Vigo, Pontevedra; R. Colombari, Unidad de Cirugía Colorrectal, Hospital General Universitario Gregorio Marañón, Madrid y T. Pérez Pérez, Unidad de Cirugía Colorrectal, Servicio de Cirugía General, Hospital Lluis Alcanyis de Xativa, Valencia.
M.T. García Martínez, Unidad de Cirugía Colorrectal, Hospital Universitario de A Coruña (CHUAC); J. Bauxali, Unidad de Cirugía Colorrectal, Clínica Universitaria de Navarra, Madrid; J. Cerdán, Unidad de Cirugía Colorrectal, Hospital Clinico Universitario de San Carlos, Madrid; J.C. García-Pérez, Unidad de Cirugía Colorrectal, Hospital Universitario Ramón y Cajal, Madrid; B. Martin-Perez, Unidad de Cirugía Colorrectal, Servicio Extremeño de Salud; N. Uribe Quintana, Unidad de Cirugía Colorrectal, Hospital Arnau de Vilanova, Valencia, España; R. Farrés Coll, Unidad de Cirugía Colorrectal, Departamento de Cirugía General y Digestiva, Hospital Universitario de Girona; F.J. González-Argenté, Unidad de Cirugía Colorrectal, Hospital Universitario Son Espases Islas Baleares, Palma de Mallorca, España; J.C. Bernal Sprekelsen, Unidad de Cirugía Colorrectal, Hospital Dr. Peset de Valencia, Valencia, España; D. Fraccalvieri, Unidad de Cirugía Colorrectal, Hospital Universitario de Bellvitge, Departamento de Cirugía General y Digestiva, Barcelona, España; E. Garcia Granero, Unidad de Cirugía Colorrectal, Hospital Universitario y Politécnico de La Fe Valencia, España; M. Gómez Ruiz, Unidad de Cirugía Colorrectal, Hospital Universitario Marqués de Vadecilla, Santander; A.M. García Cabrera, Unidad de Cirugía Colorrectal, Hospital Universitario Virgen del Rocio, Sevilla; P. Palma, Unidad de Cirugía Colorrectal, Hospital Universitario Virgen de las Nieves, Granada; V. Pla-Martí, Unidad de Cirugía Colorrectal, Hospital Clínico Universitario de Valencia; S. Mera Velasco, Unidad de Coloproctología, Hospital Regional Universitario Carlos Haya, Málaga; F. Blanco-Antona, Unidad de Cirugía Colorrectal, Hospital Clínico Universitario de Salamanca; A. Parajó, Unidad de Cirugía Colorrectal, Hospital Univeristario de Pontevedra; G. Salgado, Unidad de Cirugía Colorrectal, Hospital Santa Helena, Los Álamos, Málaga; J.M. Vázquez Monchul, Unidad de Cirugía Colorrectal, Hospital Universitario Virgen del Rocío, Sevilla; J. Ocaña Jiménez, Unidad de Cirugía Colorrectal, Hospital Universitario Ramón y Cajal, Madrid; F. Jiménez-Escobar, Unidad de Cirugía Colorrectal, Hospital Universitario Galdakao- Usansolo, Vizcaya; M. Martí-Gallostra, Unidad de Cirugía Colorrectal, Hospital Universitario Vall d´Hebrón, Barcelona; J.M. Díaz Pavón, Unidad de Cirugía Colorrectal, Hospital Universitario Virgen del Rocío, Sevilla, España; C. Salvador-Morales, Unidad de Cirugía Colorrectal, Hospital Universitario Virgen Macarena, Sevilla; S. Biondo, Unidad de Cirugía Colorrectal, Hospital Universitario de Bellvitge, Barcelona; A. Espí, Unidad de Cirugía Colorrectal, Hospital Clínico Universitario de Valencia; A. Solana-Bueno, Unidad de Cirugía Colorrectal, Hospital de Sagunto; G. Marín, Unidad de Cirugía Colorrectal, Hospital Universitario Virgen del Rocío, Sevilla; C. Pastor Idoate, Unidad de Cirugía Colorrectal, Clínica Universitaria de Navarra, Madrid; E.D. Valle-Hernández, Unidad de Cirugía Colorrectal, Hospital Universitario Gregorio Marañón, Madrid; P. Tejedor, Unidad de Cirugía Colorrectal, Hospital Universitario Gregorio Marañón, Madrid; R. Alós Company, Unidad de Cirugía Colorrectal, Hospital Universitario y Politécnico La Fe, Valencia; T. Elosua, Unidad de Cirugía Colorrectal, Hospital Universitario de León; J.A. Rueda Orgaz, Unidad de Cirugía Colorrectal, Hospital Universitario Fundación de Alcorcón; J. García Septiem, Unidad de Cirugía Colorrectal, Hospital Universitario de La Princesa, Madrid; C. Ballester Ibánez, Unidad de Cirugía Colorrectal, Hospital Universitario y Politécnico La Fe, Valencia; M. Frasson, Unidad de Cirugía Colorrectal, Hospital Universitario y Politécnico La Fe, Valencia; J.V. Hernandis Villalba, Unidad de Cirugía Colorrectal, Hospital General Universitario de Elda, Alicante; I. Pascual Miguelañez, Unidad de Cirugía Colorrectal, Hospital Universitario de La Paz, Madrid; J.M. García-González, Unidad de Cirugía Colorrectal, Hospital Universitario de Cruces, Vizcaya; M. Jimenez-Toscano, Unidad de Cirugía Colorrectal, Hospital del Mar, Barcelona; J.A. Benavides Buleje, Unidad de Cirugía Colorrectal, Hospital Universitario Reina Sofía, Murcia; J.M. Enríquez-Navascués, Unidad de Cirugía Colorrectal, Hospital Universitario de Donostia; M.L. Reyes Díaz, Unidad de Cirugía Colorrectal, Hospital Universitario Virgen del Rocío, Sevilla; M. Millan, Unidad de Cirugía Colorrectal, Hospital Universitario y Politécnico La Fe, Valencia; L. Sánchez-Guillén, Unidad de Cirugía Colorrectal, Hospital Universitario de Elche; J.V. Roig Vila, Unidad de Cirugía Colorrectal, Hospital Nisa 9 de Octubre, Valencia; P.A. Parra-Baños, Unidad de Cirugía Colorrectal, Hospital Universitario Reina Sofía de Murcia; C. Fernánde, Unidad de Cirugía Colorrectal, Hospital Universitario Marqués de Valdecilla, Santander; R. Cantero-Cid, Unidad de Cirugía Colorrectal, Hospital Universitario de La Paz, Madrid; N. Truán Alonso, Unidad de Cirugía Colorrectal, Hospital Universitario Central de Asturias, Oviedo; E.M. Nogués-Ramia, Unidad de Cirugía Colorrectal, Hospital Universitario de Gran Canaria Dr. Negrín, Universidad de Las Palmas de Gran Canaria, Las Palmas de Gran Canaria; S. Serra Pla, Unidad de Cirugía Colorrectal, Hospital Universitario Parc Taulí, Sabadell, Barcelona; M. Climent-Agustín, Unidad de Cirugía Colorrectal, Hospital del Mar, Barcelona; F. Marinello, Unidad de Cirugía Colorrectal Hospital Universitario Vall d´Hebron, Barcelona; D. Moro-Valdezate, Unidad de Cirugía Colorrectal, Hospital Clínico Universitario de Valencia; R. Frago, Unidad de Cirugía Colorrectal, Hospital Universotario de Bellvitge, Barcelona; E. Espin, Unidad de Cirugía Colorrectal Hospital Universitario Vall d´Hebron, Barcelona; M. Pera-Román, Unidad de Cirugía Colorrectal, Hospital del Mar, Barcelona; C.J. Álvarez Laso, Unidad de Cirugía Colorrectal, Hospital Universitario de Cabueñes, Gijón; C. Placer-Galan, Unidad de Cirugía Colorrectal, Hospital Universitario de Donosti; M. Labalde Martínez, Unidad de Cirugía Colorrectal, Hospital Universitario 12 de Octubre. Madrid; J.J. García-Armengol, Unidad de Cirugía Colorrectal, Hospital Vithas- Nisa 9 de Octubre, Valencia; A. Codina, Unidad de Cirugía Colorrectal, Hospital Universitario de Girona; L.C. Capitan-Morales, Unidad de Cirugía Colorrectgal, Hospital Universitario Virgen Macarena, Sevilla; J. Garcia-Aguilar, Unidad de Cirugía Colorrectal, Memorial Sloan Kettering Cancer Center, New York; J.M. Fernández-Cebrián, Unida de Cirugía Colorrectal, Hospital Universitario Ramón y Cajal. Madrid; M. Fernández-Hevia, Unidad de Cirugía Colorrectal, Hospital Universitario Central de Asturias; L.J. García-Flórez, Unidad de Cirugía Colorrectal, Hospital Universitario Central de Asturias; G. Pellino, Unidad de Cirugía Colorrectal, Hospital Universitario Vall d´Hebrón, Barcelona; C. Martínez-Pérez, Unidad de Cirugía Colorrectal, Hospital General Universitario de Valencia; F. Fernández-López, Unidad de Cirugía Colorrectal; Complejo Hospital Universitario de Santiago de Compostela.