La mejoría de los resultados en el trasplante de islotes pancreáticos se debe en gran parte a la introducción de nuevos protocolos de inmunosupresión que incluyen, entre otros, tacrolimus a bajas dosis. Este fármaco tiene efectos antioxidantes y antiapoptóticos que podrían ser de utilidad en la prevención del rechazo primario.
ObjetivosEvaluar la respuesta in vitro a tacrolimus a bajas dosis en islotes de rata estimulados con citocinas proinflamatorias implicadas en el rechazo primario de islotes.
Material y métodoSe cultivaron islotes de rata en medio RPMI determinándose producción de lipoperóxido (LPO) y óxido nítrico (NO) y marcadores de apoptosis (nucleosomas y Bcl-2) en presencia de IL-1 (50UI/ml) e IF-γ (1000UI/ml) y adición de tacrolimus (FK-506; 5ng/ml).
ResultadosTras la estimulación se apreció un aumento muy significativo (p<0,01) de los marcadores de estrés oxidativo (LPO 10,1±1,16pmol/islote x 24; NO 19,1±3,28pmol/islote x 24h) y apoptosis (nucleosomas 0,24±0,04; Bcl-2 0,69±0,212). Dichos efectos fueron contrarrestados de manera significativa tras añadir tacrolimus, siendo la reversión completa (p NS frente a controles) en el caso de la producción de lipoperóxidos (1,58pmol/islote x 24h) y óxido nítrico (9,81pmol/islote x 24h) así como en el descenso de Bcl-2 (1,37±0,23Ui/islote).
ConclusionesEl efecto citoprotector in vitro del tacrolimus a bajas dosis sobre islotes estimulados con citocinas proinflamatorias consigue aminorar la generación de estrés oxidativo y la activación de la apoptosis, habitualmente implicados en el rechazo en las primeras 48h postimplante.
The improvement in pancreatic islet transplantation results is due to immunosuppression protocols that include, among others, low-dose tacrolimus. Both anti-inflammatory and anti-oxidant effects of tacrolimus could be useful in preventing primary rejection.
AimTo evaluate in vitro islet low-dose tacrolimus response after pro-inflammatory stimulation.
Material and methodsIsolated rat islets were cultured in RPMI medium in the presence of IL-1 (50UI/mL) plus IF-γ (1000UI/mL) and tacrolimus (5ng/mL). The 24h production of lipoperoxide (LPO) and nitric oxide (NO) were measured as oxidative stress markers. Determination of apoptosis markers (nucleosome content and Bcl-2) was also performed.
ResultsOxidative stress (LPO 10.1±1.16pmol/islet x 24; NO 19.1±3.28pmol/islet x 24h) and apoptosis (nucleosome 0.24±0.04UI/islet; Bcl-2 0.69±0.212UI/islet) markers showed a very significant increase after cytokine stimulation (p<0.01). Both effects improved by adding tacrolimus to the medium. Protective effect was complete when lipoperoxide (1.58pmol/islet x 24h), nitric oxide (9.81pmol/islet x 24h) and Bcl-2 (1.37±0.23UI/islet) were determined.
ConclusionIn vitro cytoprotective effect of low-dose tacrolimus on isolated rat islets decreases both oxidative stress and apoptosis markers after stimulation of pro-inflammatory mediators.
Actualmente el trasplante de islotes pancreáticos (TIP) es una alternativa válida de cara al tratamiento de la diabetes tipo 1. La mejoría en sus resultados en cuanto a insulnoindependencia y mejor control metabólico se deben en gran parte a las mejorías introducidas en la selección de donantes y receptores, aislamiento, preservación e inmunosupresión1. Junto con la escasez de donantes, los problemas inmunológicos siguen siendo el principal obstáculo para la generalización del trasplante de islotes2. En ese sentido, la persistencia de la autoinmunidad y el rechazo son los principales aspectos a tener en cuenta3. Sin embargo, la supervivencia de los islotes trasplantados se ve amenazada además por una serie de fenómenos que generan una respuesta inflamatoria inespecífica. Además la presencia de la respuesta inmunitaria innata origina la pérdida de una parte importante de los islotes durante las primeras 48h postimplante de modo que este fracasa sin que la mayoría de los islotes hayan llegado a funcionar en algún momento4. Este fenómeno es conocido como rechazo/disfunción primario. Dicho fenómeno se observa también en trasplantes singénicos y autotrasplante sin que se observe la participación de la inmunidad adaptativa5 y sí una liberación masiva de mediadores proinflamatorios como TNF-α, IL-1 o IL-66. La activación de señales proapoptóticas y generación de estrés oxidativo está desencadenada tanto por macrófagos intraislote como células ductales, endoteliales e incluso las propias células beta4,7. Por otra parte, el estrés mecánico, químico e isquémico originado durante la obtención y el aislamiento de los islotes contribuye notablemente a la pérdida de islotes4. Asimismo, la introducción de tratamientos capaces de disminuir los fenómenos proinflamatorios y proapoptóticos observados en el rechazo primario tras TIP han mejorado tanto la viabilidad como la supervivencia de los islotes trasplantados8.
La mayoría de los protocolos actualmente empleados en el TIP incluyen tacrolimus a bajas dosis9. Independientemente de sus efectos negativos sobre las células beta a largo plazo, en determinadas circunstancias posee un efecto citoprotector actuando tanto como antiinflamatorio inespecífico como bloqueador de fenómenos apoptóticos10,11. Así, tales acciones podrían ser de utilidad TIP al aminorar o contrarrestar los fenómenos fisiopatológicos asociados al rechazo primario12.
El objetivo de nuestro trabajo fue evaluar el posible efecto citoprotector del tacrolimus a bajas dosis en islotes de rata sometidos a estímulos similares a los que participan en el rechazo primario tras su trasplante.
Material y métodosSe emplearon ratas Wistar macho de 250–350 gramos conservadas en régimen de estabulación convencional, alimentadas con pienso estándar (Panlab; Barcelona) sometidas a ciclos automáticos de luz/oscuridad de 12h y una temperatura de 22±2°C.
Todos los experimentos se realizaron observando la Ley 32/2007 para el cuidado de los animales, en su explotación, transporte, experimentación y sacrificio, en cumplimiento con las normativas para el bienestar animal vigentes en la Unión Europea.
Aislamiento de islotesLos islotes fueron obtenidos tras disección y canulación selectiva del ducto pancreático en las ratas utilizando un catéter Abbocath de 16Fr. Posteriormente y previo clampaje duodenal proximal y distal, se infundió una disolución de colagenasa P 2mg/ml (1213865; Roche Diagnostics; Laval, Canadá) hasta conseguir una distensión completa de la cápsula pancreática. Posteriormente se llevó a cabo el proceso de digestión enzimática en cámara cerrada a 37°C (Bio-Rep; Miami, EE.UU.), que se detuvo mediante adición de solución de Hank a 4°C (PAA Laboratories GmbH; Linz, Austria) durante 4 ciclos consecutivos hasta obtener al menos 100.000 equivalentes de islote (EI). Posteriormente se añade al medio una disolución de ditizona 20mg/ml (Sigma-Aldrich; St.Louis, EE.UU.) para conseguir una visualización por tinción a rojo de los islotes, comprobándose su viabilidad cada 2min. A continuación se realizó un gradiente de Ficoll (Sigma Chemical Co; St. Louis, EE.UU.) mediante un procesador celular COBE (Denver, EE.UU.). El remanente de islotes se recogió manualmente bajo visión directa hasta almacenar a los islotes en grupos de 300EI.
Cultivo de islotes y adición de estímulos proinflamatoriosDurante 24h los islotes fueron cultivados en medio RPMI-1640 (PAA Laboratories GmbH; Linz, Austria) a 37°C en una microatmósfera de 95%O2/5% CO2. Se añadieron al medio tanto glucosa 11,11mm como albúmina sérica bovina (Sigma Chemical Co; St. Louis, EE.UU.) (0,1%). Los islotes pancreáticos fueron estimulados añadiendo al medio de cultivo 50IU/ml de interleucina-1 (IL-1), (Boehringer Mannheim GmbH; Germany) y 1000IU/ml de interferón-gamma (γ-IF), (Boehringer Mannheim GmbH; Germany). Como tratamiento, se empleó tacrolimus (FK-506) a bajas dosis (5ng/ml) (Fujisawa; Osaka, Japan) en el mismo medio de cultivo.
Grupos experimentalesSe realizaron experimentos en grupos de 5 ratas diferentes obteniéndose de cada una de ellas muestras de 300 EI recogidos manualmente bajo visión microscópica. Los grupos experimentales fueron: controles, islotes únicamente tratados, islotes únicamente estimulados e islotes estimulados y tratados.
DeterminacionesLas muestras de 300 EI fueron homogeneizadas mediante centrifugación secuencial (600g x2; 5.500 x2; 2.400g; 10.000g) separándose material citosólico y microsomal por separado. Con el objetivo de evaluar la aparición de fenómenos apoptóticos, se determinaron los valores de nucleosomas (contenido intraislote; UI/islote) y proteína Bcl-2 (UI/islote) mediante kits comerciales para ELISA/ espectrofotometría (Calbiochem ; La Jolla, USA & Canadá). De cara a evaluar la repercusión sobre la generación de estrés oxidativo de novo, se determinaron los valores de óxido nítrico (NO) y lipoperóxidos (LPO). La determinación de NO (fmol/ ml x 24h) se realizó mediante la reacción de Griess (absorbancia a 550nm). La medición de niveles de LPO (fmol/islote) se llevó acabo mediante kits espectrofotométricos ad hoc (absorbancia a 533nm; Calbiochem; La Jolla, EE.UU y Canadá).
Análisis estadísticoEl análisis estadístico de los resultados se llevó a cabo mediante el paquete informático Statgraphics Plus 5.1 package (Statpoint Inc., EE.UU.) para Microsoft Windows NT. La comparación de las medias de los grupos se llevó a cabo mediante el análisis factorial de la varianza (ANOVA) y test de Scheffé's post-hoc. Los resultados se expresan como medias ±ESM. Se consideraron como significativos valores de p<0,05 y muy significativos <0,01.
ResultadosLa adición de tacrolimus a bajas dosis al medio de cultivo de islotes de rata estimulados con Il-1 e IF-γ consiguió aminorar de modo significativo el aumento de marcadores de daño celular observados tras la exposición a citocinas.
- A.
Generación de estrés oxidativo
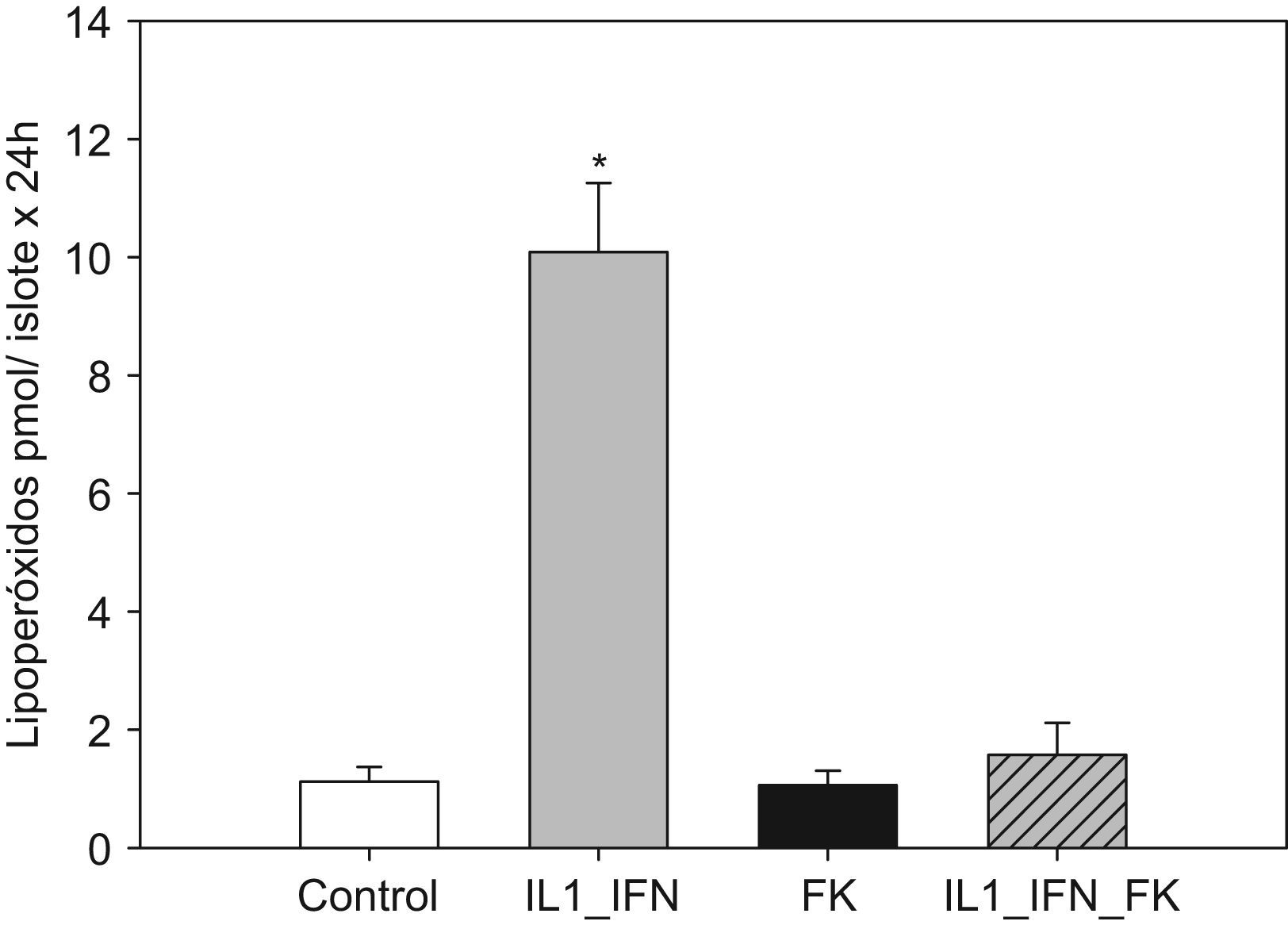
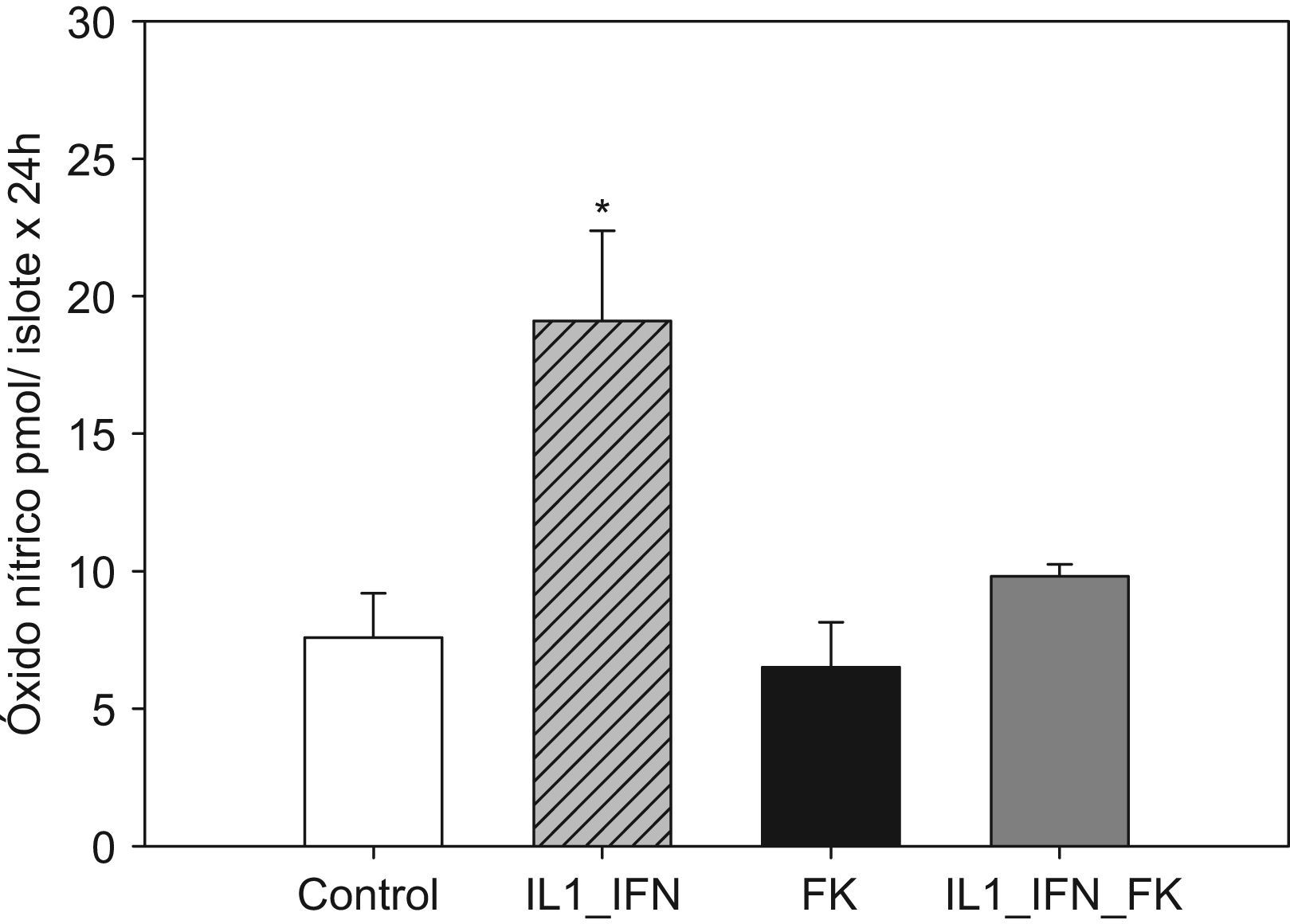
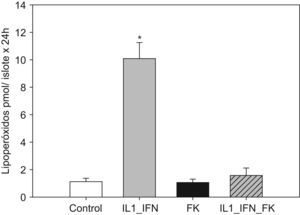
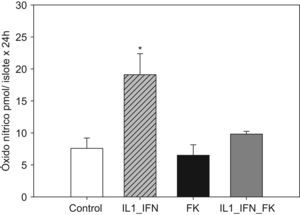
La estimulación con IL-1/IF-γ se correlacionó con un aumento muy significativo (p<0,01) de las concentraciones de marcadores de estrés oxidativo (LPO y NO). En ambos experimentos, la adición de tacrolimus revirtió completamente tal efecto de tal manera que los valores de dichos marcadores disminuyeron hasta ser equiparables a los de los controles. No hubo variaciones significativas en la concentración de LPO o NO en islotes tratados únicamente con fármaco (figs. 1 y 2).
Figura 1.El incremento de la producción de lipoperóxido en islotes expuestos a citocinas proinflamatorias es contrarrestado por la adición de tacrolimus a bajas dosis. El gráfico muestra la producción de lipoperóxido (media+ESM; pmol/islote x 24h) en islotes de rata cultivados en medio RPMI y estimulados con IL-1 (50UI/ml) e IF-γ (1000UI/ml) en presencia de tacrolimus a bajas dosis (5ng/ml). La adición de citocinas induce un aumento muy significativo en la producción de lipoperóxido, hecho que se contrarresta al añadir el fármaco (*p<0,01 frente a todos los grupos restantes).
Figura 2.La estimulación de islotes pancreáticos con L-1+IF induce un incremento en la producción de óxido nítrico que es neutralizada en presencia de tacrolmus a bajas dosis. El gráfico de barras refleja el incremento significativo en la producción de óxido nítrico (media+ESM; pmol/islote x 24h) en islotes de rata cultivados en medio RPMI expuestos a IL-1 (50UI/ml) e IF-γ (1000UI/ml). Al añadir tacrolimus (5ng/ml) al medio, este fenómeno es neutralizado reestableciéndose valores equiparables al grupo control (*p<0,01 frente a todos los grupos restantes).
- B.
Activación de la apoptosis
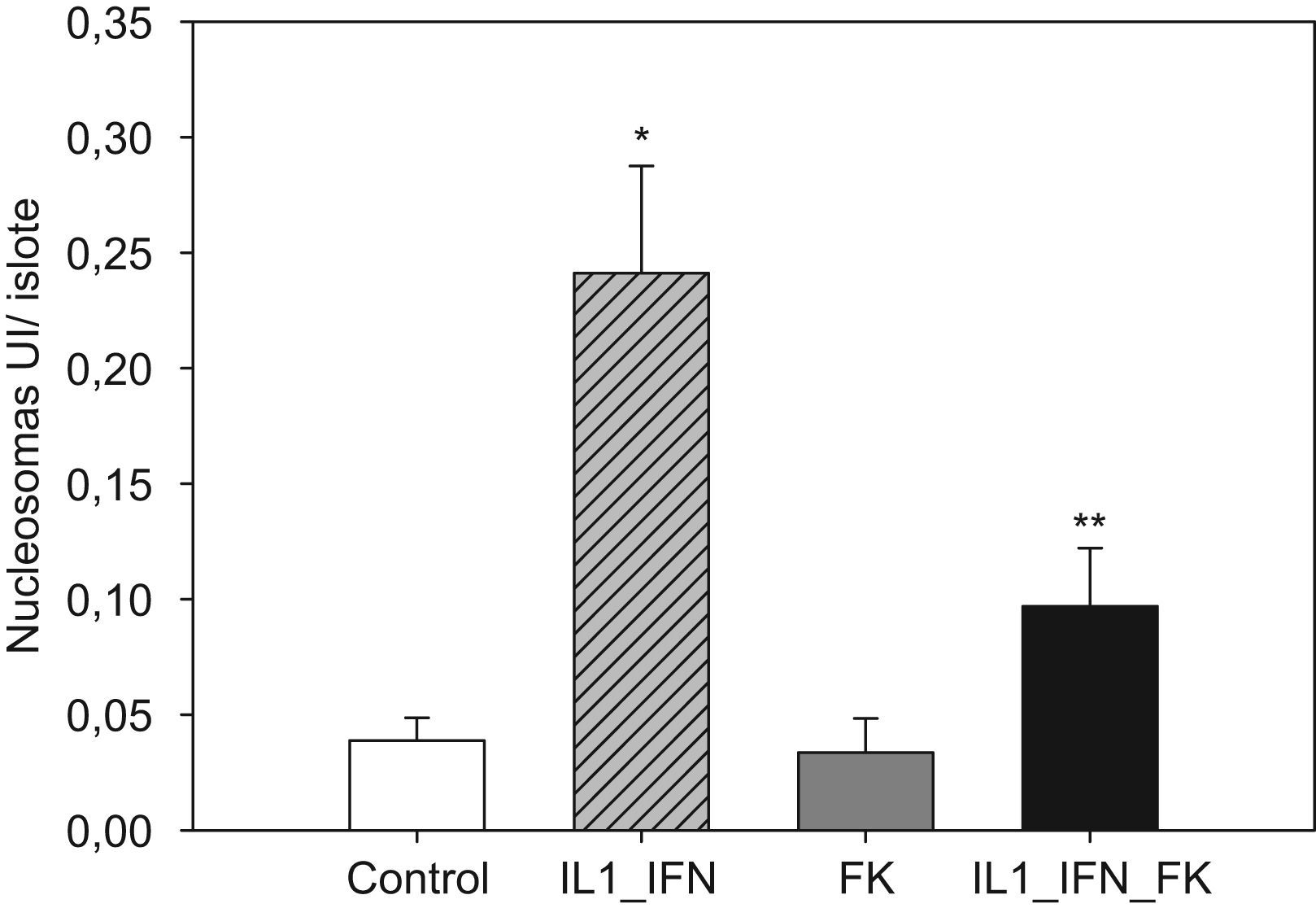
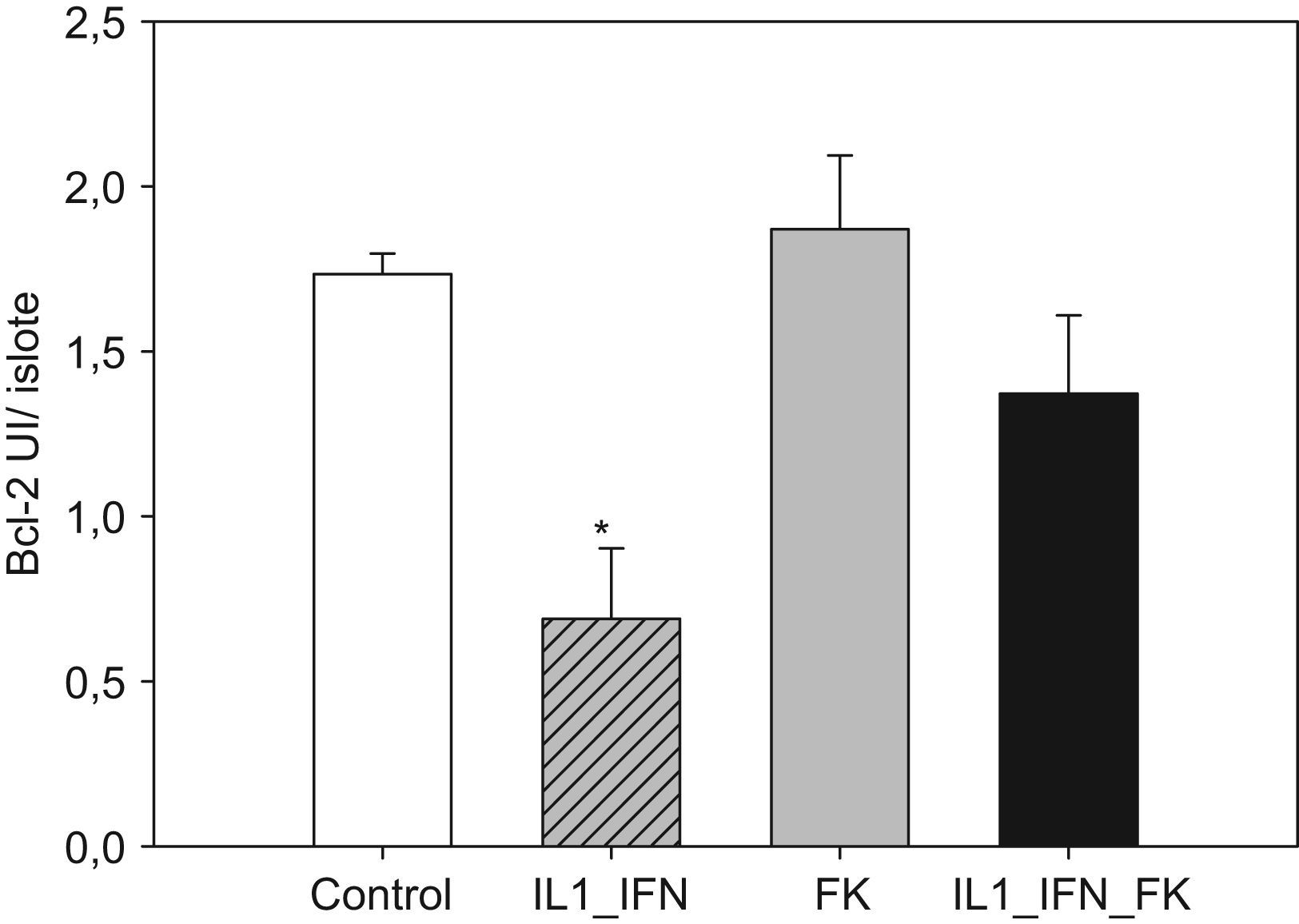
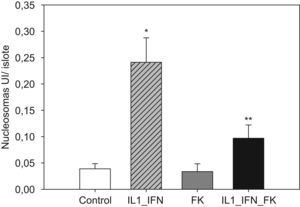
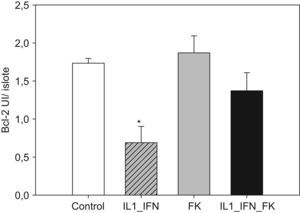
La estimulación con mediadores proinflamatorios se tradujo en un aumento de los marcadores de apoptosis, de tal manera que aumentó muy significativamente las presencia de nucleosomas y disminuyó la concentración de Bcl-2 (p<0,01). En ambos casos la adición de tarcólimus al medio de cultivo aminoró tal efecto. En el caso de los nucleosomas la disminución fue muy significativa frente al grupo de islotes estimulados (p<0,01) pero no alcanzó niveles equiparables a los de los controles (p<0,05). Cuando se determinaron los niveles de Bcl-2, el fármaco revirtió completamente el descenso observado tras la adición de citocinas proinflamatorias de tal manera que los valores fueron equiparables a los de los controles. Al igual que en el caso de los marcadores de estrés oxidativo, no hubo variaciones significativas en los niveles de nucleosomas ni Bcl-2 en islotes tratados únicamente con fármaco (figs. 3 y 4).
Figura 3.El incremento de nucleosomas en islotes estimulados con mediadores proinflamatorios es contrarrestado parcialmente por la adicón de tacrolimus al medio. En islotes de rata cultivados en medio RPMI la adición de IL-1 (50UI/ml) e IF-γ (1000UI/ml) se traduce en un incremento significativo en los niveles de nucleosomas (media+ESM; UI/islote) que disminuye de manera significativa en presencia de tacrolimus a bajas dosis (5ng/ml). El efecto antiapoptótico del fármaco es parcial ya que los valores no descienden hasta ser equiparables a los del grupo control (*p<0,01 frente a todos los grupos restantes; **p<0,05 frente a controles).
Figura 4.Tacrolimus revierte el descenso de Bcl-2 en islotes de rata tras la estimulación con de IL-1 e IF-γ. Los niveles de la proteína antiapoptótica Bcl-2 (media+ESM; UI/islote) en islotes de rata cultivados en medio RPMI experimentan un descenso muy significativo en presencia de IL-1 (50UI/ml) e IF-γ (1.000UI/ml). Este efecto se ve neutralizado en presencia de tacrolimus a bajas dosis (5ng/ml) de forma completa (*p<0,01 frente a todos los grupos restantes).
El TIP es una alternativa terapéutica válida en algunos casos de DM11. Dentro de los diferentes eventos adversos que han dificultado resultados clínicos favorables de modo habitual, el rechazo primario sigue constituyendo una fuente de disfunción y pérdida de islotes muy importante13. Este hecho hace que sean necesarias nuevas estrategias de cara a su prevención empleando principalmente agentes citoprotectores capaces de neutralizar los eventos fisopatológicos asociados. La utilización del tacrolimus en el TIP siempre ha suscitado dudas por sus propiedades diabetogénicas y proapoptóticas previamente conocidas. Sin embargo, su inclusión a bajas dosis en la gran mayoría de protocolos de inmunosupresión a partir de la experiencia del grupo de Edmonton en el año 200014 sugiere un efecto beneficioso sobre alguno de los tipos de rechazo implicados en el TIP. Sus efectos citoprotectores (antiinflamatorio, antioxidante y antiapoptótico) en diversos modelos experimentales15,16 podrían justificar su efecto beneficioso al interferir en la secuencia de acontecimientos implicados en el rechazo primario.
El presente trabajo muestra un efecto protector in vitro del tacrolimus a bajas dosis sobre islotes de rata estimulados con citocinas proinflamatorias habitualmente implicadas en el rechazo primario tras TIP. Tanto la generación de estrés oxidativo como la puesta en marcha de la apoptosis fueron neutralizadas de modo efectivo en presencia del fármaco. En ese sentido, nuestro grupo ha obtenido resultados equiparables empleando islotes humanos estimulados tanto con IL-1 e IF-γ como con otros mediadores inflamatorios como el LPS17. Estos resultados in vitro han de ser interpretados con cautela ya que se trata de islotes murinos y su extrapolación con los efectos sobre el rechazo primario tras TIP real podrían no ser los mismos. Del mismo modo, la valoración in vivo del efecto del tacrólimus mediante el trasplante insular permitiría el estudio del efecto global del fármaco en el rechazo tras TIP.
La contribución del estrés oxidativo al desarrollo del rechazo primario tras TIP es un fenómeno bien conocido que tiene como origen muy diversos estímulos que implican al propio proceso de obtención del donante, aislamiento y la repuesta inflamatoria del endotelio del receptor4. En el presente trabajo, el tacrolimus ejerció un efecto claramente antioxidante sobre los islotes expuestos a citocinas proinflamatorias. El papel como antioxidante en islotes del tacrolimus es poco conocido, sin embargo ha mostrado efectos beneficiosos en modelos de isquemia reperfusión o daño cerebral18,19. La supervivencia en modelos de isquemia reperfusión en roedores mejora tras el uso de tacrolimus al disminuir la respuesta inflamatoria ya que se frena la producción de especies reactivas de oxígeno, la infiltración por neutrófilos y la producción in situ de IL-1 y TNF-α20. En este caso tanto la producción de NO como de LPO fue neutralizada eficazmente. Estos resultados suponen un bloqueo de fenómenos secundarios a la respuesta inflamatoria tanto precoces como tardíos así como su amplificación. La liberación de NO es un fenómeno de segunda generación que además tiene un potencial efecto mediador, la peroxidación lipídica y la apoptosis se sitúan al final de la secuencia fisiopatológica de la disfunción celular en la respuesta inmune inespecífica. En relación a este hecho, la utilización de agentes bloqueantes de la producción de NO como la NG-Metil-L-arginina (L-NMA) podría contribuir a aminorar el estrés oxidativo asociado al rechazo primario tras TIP.
En nuestros experimentos el tacrolimus consiguió aminorar la respuesta propapotótica en condiciones similares a las del rechazo primario. El fármaco revirtió el efecto negativo de la exposición a mediadores de modo significativo pero parcial al valorar los valores de nucleosomas y total en lo que al descenso del factora antiapoptótico Bcl-2 se refiere. La presencia de nucleosomas es un marcador de apoptosis tardío que refleja alteraciones morfológicas. La expresión de la proteína Bcl-2 señala el estado de bloqueo de la cascada apoptótica en la célula. Constitutivamente se expresa en equilibrio con la otra subfamilia proapoptótica (Bax, Bad…)21 de tal manera que el descenso de los niveles a consecuencia de los mediadores inflamatorios indica una clara correlación con la pérdida de islotes durante la respuesta inflamatoria inespecífica asociada al rechazo primario del TIP22. Las alteraciones en las proteínas del grupo Bcl-2 son fenómenos relacionados con la activación de la vía mitocondrial de la apoptosis generalmente en respuesta a la llegada de «señales de muerte celular», es decir, es un fenómeno precoz en la muerte celular programada. De este modo se podría deducir que el tacrolimus actúa preferentemente sobre los fenómenos apoptóticos en los que la vía mitocondrial es la principal ya que el efecto sobre un marcador morfológico tardío (y resultado de la activación de todas las vías apoptóticas) como son los nucleosomas, es parcial. Este efecto diferencial no se ha observado en islotes humanos expuestos a estímulos similares17. Los efectos del tacrolimus sobre fenómenos apoptóticos son variables y sido poco estudiados en islotes pancreáticos. Son en ocasiones dosis y tejido dependientes, sin que afecte a patrones de apoptosis fisiológicos en modelos animales, pudiendo incluso estimular la regeneración celular23,24. Si bien parte de su acción inmunosupresora se debe a un efecto proapoptótico sobre las células T25, se han descrito efectos antiapoptóticos en presencia de estímulos proinflamatorios10. Otros autores han comunicado resultados diferentes a los nuestros en islotes humanos no estimulados empleando dosis mucho mayores del fármaco al disminuir los niveles de marcadores antiapoptóticos Bcl-2, Bcl-XL o la transducción del gen XIAP26. El efecto antiapoptótico del tacrolimus podría tener una justificación ultraestructural dado que las proteínas implicadas en su mecanismo de acción (FK-BP) interaccionan con la proteína Bcl-2 reubicándola yuxtamitocondrialmente donde ejerce su efecto antiapoptótico27,28.
Dadas las diversas acciones sobre la apoptosis que el fármaco genera, es posible que tales efectos sean no solo dosis y tejido dependiente sino estímulo dependiente de tal modo que la presencia de la respuesta inmune inmediata favorece el efecto citoprotector y antiapoptótico en células no inmunes si se emplea a dosis bajas.
La prevención del rechazo en el TIP requiere la consideración de fenómenos fisiopatológicos que habitualmente no son tan importantes en otro tipo de trasplantes y frente a los que estrategias de citoprotección son necesarias En ese sentido el efecto in vitro antioxidante y antiaopotótico del tacrolimus a bajas dosis constituye un hallazgo útil que podría tener influencia de cara a diseñar protocolos de inmunosupresión eficaces en el TIP clínico.
FinanciaciónEstudio financiado a través del Programa de Creación y Consolidación de Grupos de Investigación Universidad Complutense/Comunidad de Madrid; Grupos de Investigación de la Universidad Complutense de Madrid (920210); Grupo «Investigaciones Quirúrgicas Básicas y Clínicas».
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Comunicaciones previas: Resultados preliminares presentados en la IX Reunión Nacional de Residentes de Médicos Residentes de Cirugía, Madrid, 2005.