El tratamiento de los quistes hepáticos requiere del diagnóstico diferencial de quiste simple hepático (QSH) de la neoplasia mucinosa quística (NMQ) hepática. Las características radiológicas no son patognomónicas. Algunos estudios han sugerido la utilidad de los marcadores tumorales (MKT) intraquísticos.
MétodosAnálisis retrospectivo de base de datos prospectiva incluyendo pacientes diagnosticados de QSH sintomático desde el 2003 hasta el 2021. El objetivo del estudio es evaluar los resultados del tratamiento de los QSH sintomáticos y analizar la utilidad de la determinación de «carcinoembryonic antigen» (CEA) y «carbohydrate antigen» CA 19.9 intraquísticos.
ResultadosSe incluyeron 50 pacientes tratados por quiste sintomático. En 15 pacientes el primer tratamiento fue el drenaje percutáneo. En 35 pacientes se realizó fenestración laparoscópica. Cuatro pacientes se diagnosticaron de lesiones premalignas/malignas (NMQ, NPIB, linfoma B); tres de ellos requirieron una segunda cirugía tras la fenestración y el diagnóstico anatomopatológico.
La mediana de los valores de CEA y CA- 19.9 fue de 196μg/L y 227.321U/mL respectivamente. Los pacientes con lesiones premalignas no tuvieron valores elevados de MKT. El valor predictivo positivo fue del 0% en ambos MKT, y el valor predictivo negativo fue de 89% y 91% respectivamente.
ConclusionesLos valores de CEA y CA 19.9 intraquísticos no permiten distinguir los QSH de las NMH. El tratamiento más resolutivo de los QSH sintomáticos es la fenestración quirúrgica. El análisis anatomopatológico de la pared del quiste posibilita su correcto diagnóstico, permitiendo indicar una reintervención quirúrgica en los casos de NMQ.
To decide treatment of hepatic cysts diagnosis between simple hepatic cyst (SHC) and cystic mucinous neoplasm (CMN). Radiological features are not pathognomonic. Some studies have suggested the utility of intracystic tumor markers.
MethodsRetrospective analysis of our prospective database including patients treated due to symptomatic SHC from 2003 to 2021. The aim of the study was to evaluate the results of treatment of symptomatic SHC and the usefulness of the determination of intracystic “carcinoembryonic antigen” (CEA) and “carbohydrate antigen” CA 19.9.
ResultsFifty patients diagnosed and treated for symptomatic SHC were included. In 15 patients the first treatment was percutaneous drainage. In 35 patients the first treatment was laparoscopic fenestration. Four patients were diagnosed of premalignant or malignant liver cystic lesions (MCN, IPMN, and lymphoma B); three of them required surgery after initial fenestration and pathological diagnosis.
Median CEA and CA 19.9 were 196μg/L and 227.321U/mL, respectively. Patients with malignant or premalignant pathology did not have higher levels of intracystic tumor markers. Positive predictive value was 0% for both markers, and negative predictive value was 89% and 91%, respectively.
ConclusionValues of intracystic tumor markers CEA and CA 19.9 do not allow distinguishing simple cysts from cystic liver neoplasms. The most effective treatment for symptomatic simple liver cysts is surgical fenestration. The pathological analysis of the wall of the cysts enables the correct diagnosis, allowing to indicate a surgical reintervention in cases of hepatic cyst neoplasia.
Los quistes simples hepáticos (QSH) se originan de exclusiones congénitas de restos de conducto biliar hiperplásico sin comunicación con la vía biliar. Habitualmente son asintomáticos y se diagnostican de forma incidental, aunque en algunas ocasiones pueden provocar síntomas como dolor o distensión abdominal, plenitud pospandrial, disnea y otros menos frecuentes como son los síntomas secundarios a infección, perforación o sangrado intraquístico1.
Con el incremento en la realización de pruebas de imagen en los últimos años se ha visto un aumento en el diagnóstico incidental de lesiones quísticas hepáticas.
La incidencia de los QSH en la población general oscila entre un 15-20%. En referencia a los pacientes con QSH sintomáticos la incidencia de lesiones premalignas o neoplásicas puede llegar hasta un 5%2,3.
El diagnóstico diferencial de las lesiones quísticas hepáticas es complejo; en ocasiones puede llegar a ser muy difícil diferenciar un quiste simple de lesiones hepáticas premalignas como pueden ser la neoplasia mucinosa quística (NMQ) y la neoplasia papilar intraductal biliar (NPIB)2–4. El diagnóstico diferencial de las lesiones quísticas se realiza mediante pruebas de imagen como la ecografía (US), tomografía computarizada (TC) y la resonancia magnética nuclear. En ocasiones puede ser difícil distinguir el tipo de lesión únicamente con pruebas de imagen ya que este tipo de lesiones no tienen características patognomónicas5. La falta de correlación radiológica puede llevar a indicar cirugía de forma innecesaria6. Es por ello que sería interesante disponer de otros datos que permitan realizar correctamente el diagnóstico diferencial.
En los últimos años se ha demostrado la utilidad de los valores de marcadores tumorales (MKT) obtenidos del líquido de lesiones quísticas pancreáticas para diferenciar lesiones pancreáticas benignas de premalignas o malignas7. Por este motivo, extrapolando esta hipótesis a las lesiones quísticas hepáticas, recientemente se ha intentado correlacionar los valores de MKT intraquísticos con la posibilidad de diferenciar lesiones hepáticas quísticas benignas de lesiones premalignas8–10. Algunos estudios sugieren que las lesiones quísticas con «carcinoembryonic antigen» (CEA) y «carbohydrate antigen» (CA) 19.9 intraquísticos elevados pueden ser lesiones premalignas mientras que, por lo contrario, refieren que las lesiones quísticas simples suelen tener valores de MKT normales9.
El objetivo de este estudio es analizar nuestra experiencia en el manejo diagnóstico y terapéutico de los quistes simples sintomáticos. Dentro del diagnóstico se analiza específicamente la utilidad de la determinación de CEA y CA 19.9 intraquísticos para el diagnóstico diferencial entre quiste simple hepático y lesiones quísticas hepáticas premalignas o malignas.
MétodosSe realizó un análisis retrospectivo de nuestra base de datos prospectiva de los pacientes tratados en nuestro centro por QSH sintomático desde enero 2003 hasta diciembre de 2021. Los pacientes con QSH no sintomáticos en los que no se indicó tratamiento no están incluidos en el estudio, pues no fueron recogidos prospectivamente. Se excluyeron los pacientes con sospecha o confirmación preoperatoria de neoplasias quísticas hepáticas (NQ), dado que su manejo ya sería diferente.
De forma somera, en los casos de QSH que consultan por síntomas, se indica fenestración quirúrgica como tratamiento de primera elección. En aquellos casos de síntomas poco específicos, o casos de edad avanzada y/o comorbilidad se indica como primera acción terapéutica el drenaje percutáneo con esclerosis con alcohol. En los pacientes con recidiva clínica y radiológica posdrenaje, se revalora la opción quirúrgica, si la edad y comorbilidad lo permiten.
El diagnóstico se basó en el estudio radiológico realizado con ecografía y/o tomografía computarizada o resonancia magnética. Se realizó determinación intraoperatoria o del contendido obtenido durante la punción percutánea de niveles de marcadores tumorales intraquísticos (CEA y CA 19.9). Se consideraron los puntos de corte de CEA >30μg/L y CA 19,9 15000 U/mL, descritos previamente9, como criterio de riesgo de NMQ.
Las variables estudiadas fueron las características demográficas, síntomas, pruebas de imagen realizadas, tratamiento y la evolución durante el seguimiento.
Análisis estadísticoLos datos se recogieron en una base de datos de Microsoft Office Access y fueron procesados mediante el SPSS. Se realizó un análisis estadístico descriptivo de los resultados.
ResultadosSe incluyeron 50 pacientes con diagnóstico inicial de QSH que requirieron tratamiento específico por síntomas. La mayor parte de las pacientes fueron mujeres (70%), con una mediana de edad de 64 años, y con una mediana de índice de Charlson de 5.
El síntoma más habitual fue el dolor abdominal (35/50;70%), seguido de intolerancia oral y plenitud pospandrial (2/50; 4%), otros síntomas menos frecuentes como infección e ictericia se presentaron únicamente en un paciente respectivamente. En el 18% de los pacientes los síntomas fueron inespecíficos.
Con respecto a las características de los quistes, lo más frecuente fue el quiste único en un 46%, un 24% de los pacientes tenían menos de 5 quistes, mientras que un 30% tenían más de 5 quistes. El tamaño mediano fue de 13cm [2-22] y el tipo de quiste más habitual fue el quiste simple en un 60%, complejo en un 24% (12/50). La mediana de seguimiento fue de 36 meses [11-144].
Las pruebas diagnósticas realizadas fueron ecografía (83%), TC (88%), resonancia magnética nuclear (55%) y citología para anatomía patológica (81%). La determinación de marcadores tumorales intraquísticos se obtuvo en 41 pacientes (77%).
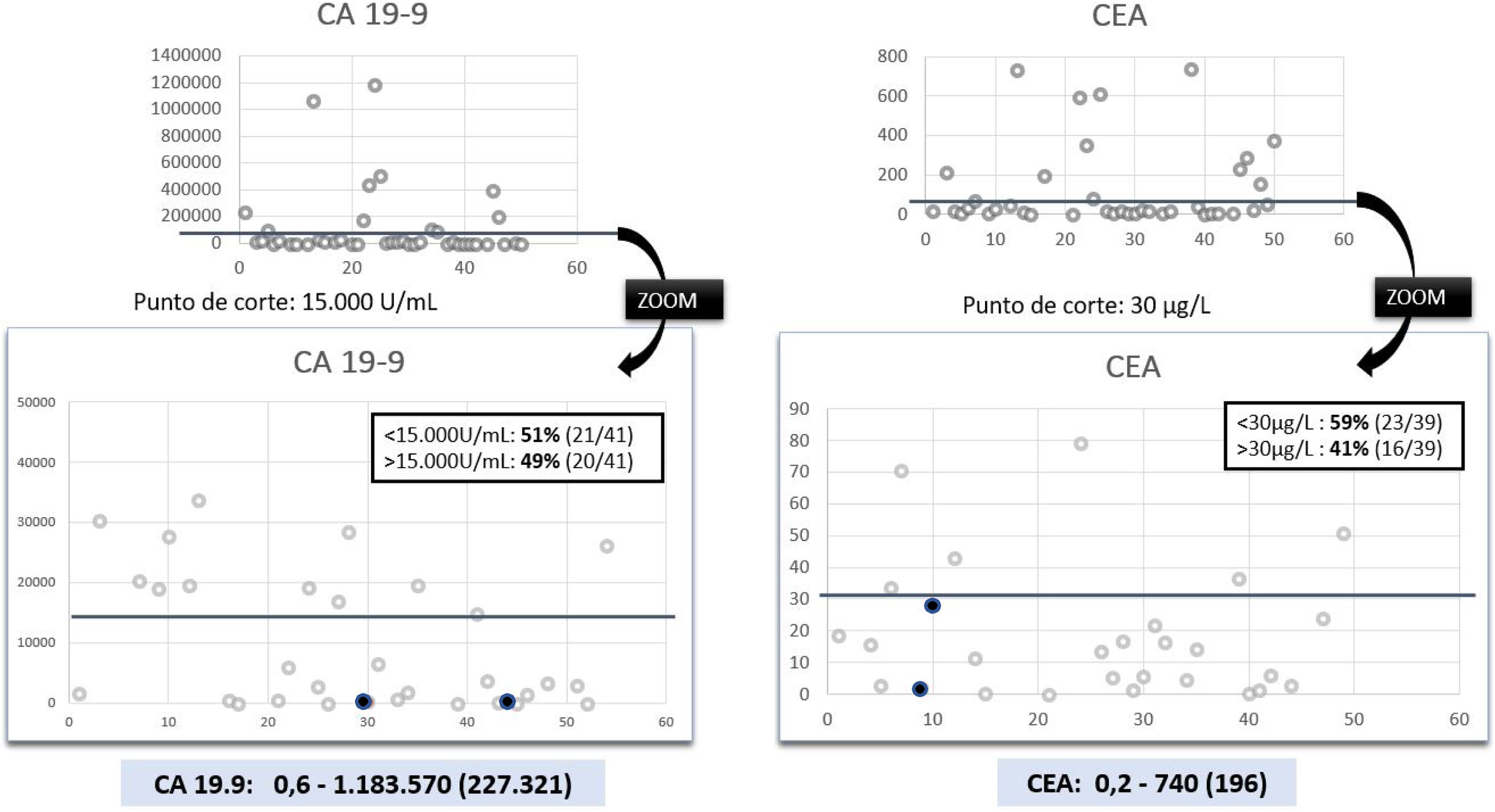
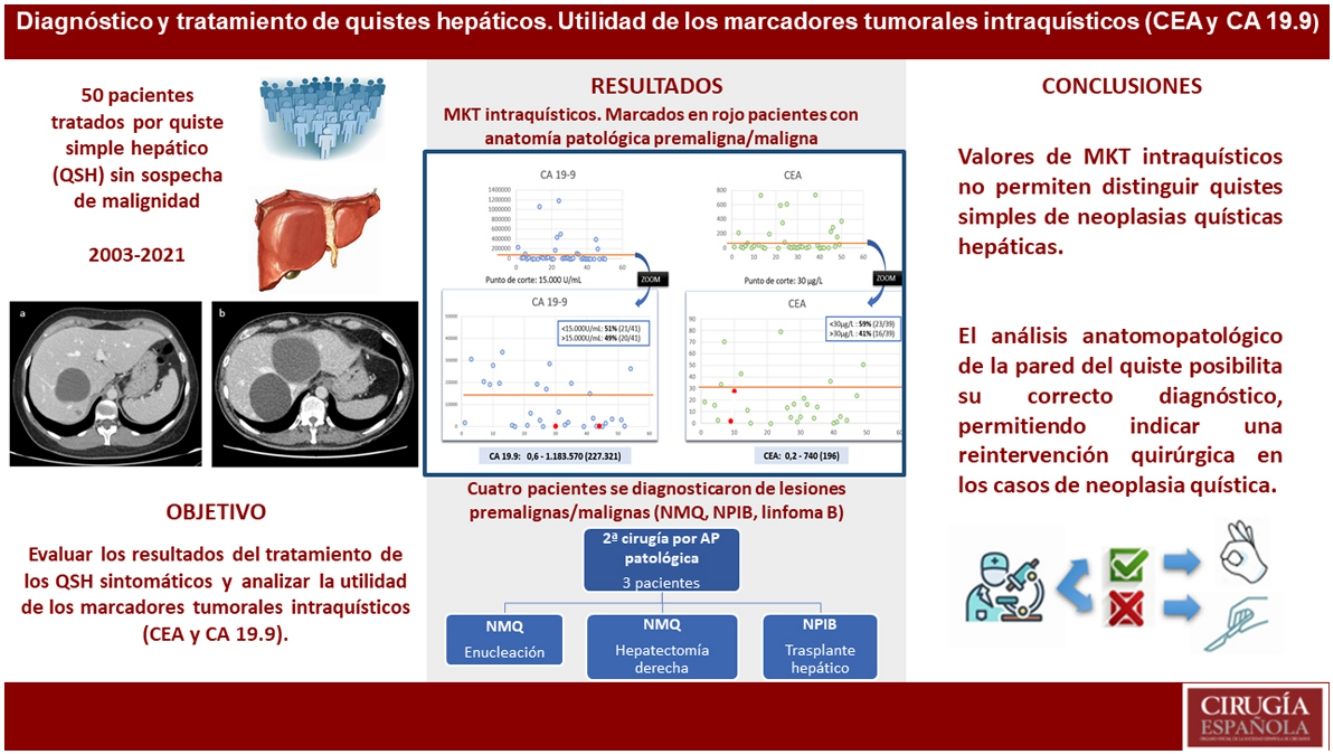
Los valores de MKT intraquísticos mostraron gran variabilidad (fig. 1). La mediana de CA 19.9 fue de 227.321 U/mL [0,6-1183570], mientras que la mediana del CEA fue de 196μg/L [0,2-740]. Los valores de MKT de los pacientes con anatomía patológica diferente a quiste simple, únicamente teníamos valores de dos de los cuatro pacientes, marcados en rojo en la figura 1. El paciente con diagnóstico de linfoma B tenía un CEA de 1,8μg/L y el CA 19.9 de 222 U/mL. Uno de los pacientes con anatomía patológica de NMQ tenía un CEA de 27,8μg/L y el CA 19.9 de 224 U/mL.
El 51% de los pacientes con QSH tenían una determinación de CA 19,9 superior al punto de corte de 15000 U/mL; y el 59%, un CEA superior a 30μg/L. Esto refleja un valor predictivo positivo del 0% en ambos MKT y en un valor predictivo negativo (VPN) del 89 y 91% respectivamente.
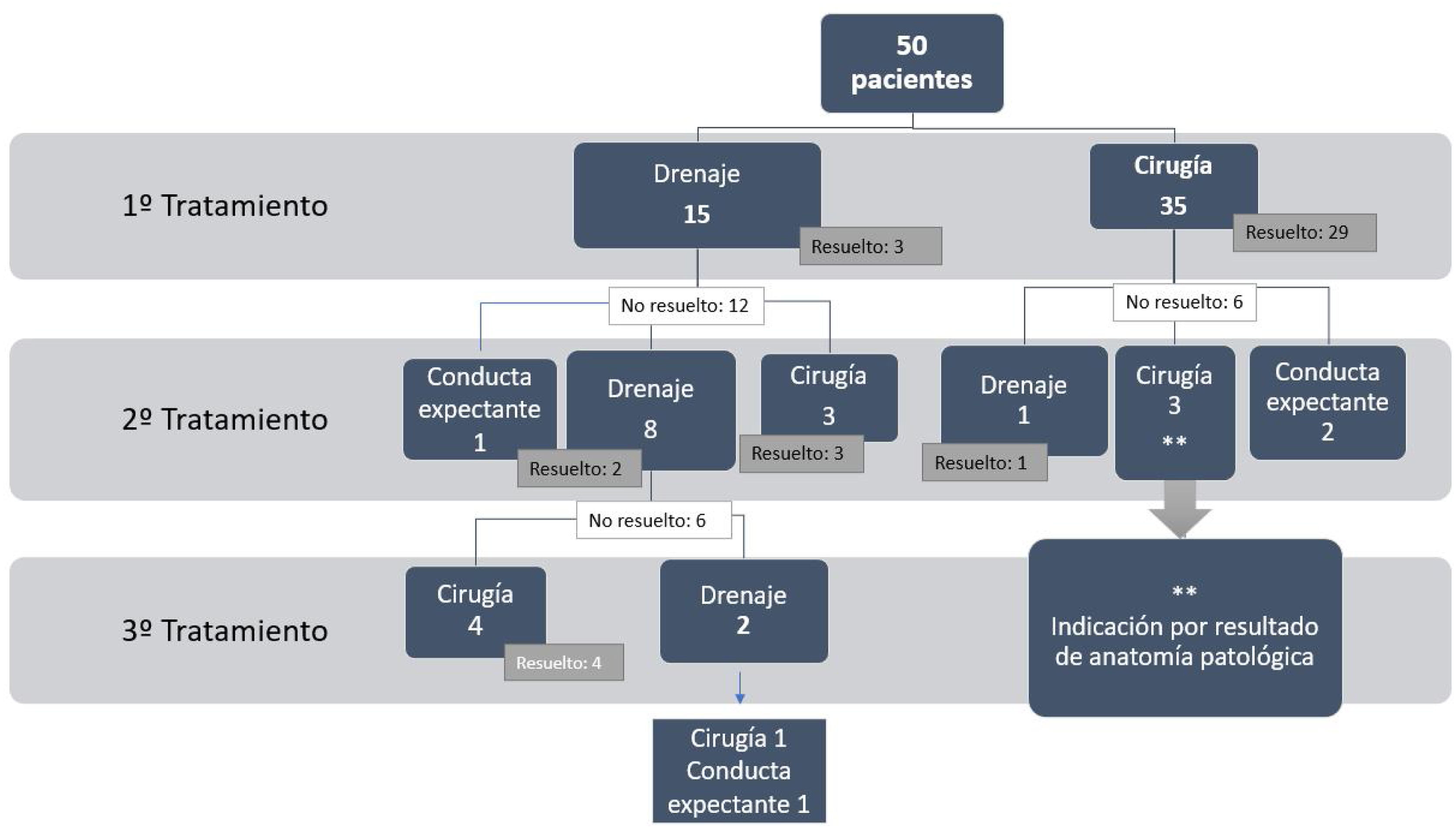
Los 50 pacientes estudiados en nuestra serie se sometieron a tratamiento por aparición de síntomas (fig. 2). Se indicó tratamiento conservador con drenaje y esclerosis percutánea en 15 pacientes, siendo efectivo únicamente en tres pacientes. De los pacientes en los que no fue efectivo (12/15), en tres pacientes se indicó cirugía como segundo tratamiento, en un paciente se decidió conducta expectante por escasos síntomas y en ocho pacientes se realizó un segundo drenaje y esclerosis. En cuatro pacientes que persistían con síntomas se realizó cirugía siendo efectiva como tercer tratamiento y dos pacientes requirieron de un tercer drenaje sin ser resolutivo, por lo que finalmente uno derivó en una cirugía exitosa y con el segundo paciente se decidió conducta expectante por comorbilidades.
En 35 pacientes se indicó fenestración quirúrgica como primer tratamiento, siendo resolutiva en la mayoría (29/35; 82,8%). De los seis pacientes que fracasaron tras la cirugía, una paciente requirió de drenaje percutáneo por reaparición de síntomas y en dos pacientes se decidió conducta expectante por mejoría de los síntomas. En tres pacientes se indicó una segunda cirugía por el resultado de la anatomía patológica de la pared del quiste. Dada la evolución clínica se consideró que ninguno de los pacientes con esclerosis y no operados tenía una neoplasia quística.
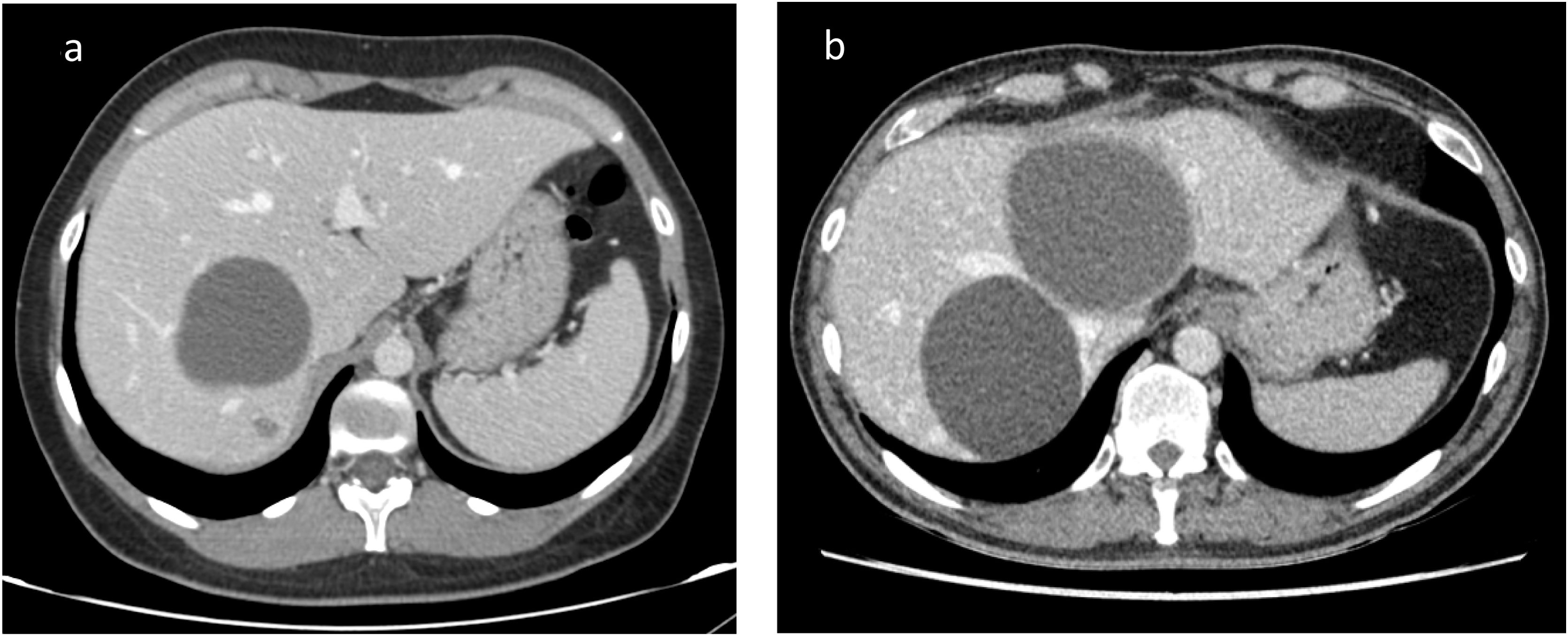
En tres pacientes se indicó una segunda cirugía por el diagnóstico anatomopatológico de la pared del quiste; en dos pacientes el diagnóstico fue de NMQ por lo que se indicó una enucleación en un paciente y una hepatectomía derecha en el segundo, técnicas indicadas según la localización de las lesiones (fig. 3). Un tercer paciente requirió de un trasplante hepático por diagnóstico de NPIB y afectación multifocal y contactos vasculares. Los tres pacientes evolucionaron de forma correcta sin complicaciones en el postoperatorio ni durante el seguimiento. El resto de resultados anatomopatológicos informaron de quiste simple en 40 casos y un paciente se diagnosticó de linfoma. Esta última paciente fue valorada por el servicio de hematología; se diagnosticó de un linfoma B de célula grande asociada a fibrina, una entidad de buen pronóstico y siendo un hallazgo casual no requiere de ningún tratamiento, únicamente seguir con controles.
DiscusiónEl diagnóstico y manejo de las lesiones quísticas hepáticas está establecido en diferentes guías clínicas1,2. El tratamiento está indicado si existen síntomas o si hay sospecha de malignidad. Sin embargo, el diagnóstico diferencial entre el quiste hepático simple y la lesión quística hepática premaligna o maligna (NMQ o NPIB) es complejo. Recientemente se ha alertado del exceso de diagnóstico de sospecha de NMQ, llevando a cirugías innecesarias6. Un correcto diagnóstico preoperatorio es necesario para la correcta indicación terapéutica.
Una vez confirmado el diagnóstico de QSH sintomático, el tratamiento será individualizado según las características del paciente. De forma general no se recomienda la realización de drenaje o aspiración del quiste por la alta tasa de recidivas. El tratamiento de elección que se recomienda es la cirugía siempre que sea posible. Si no existe sospecha de malignidad y únicamente se indica la cirugía por síntomas estaría indicada la fenestración laparoscópica, por lo contrario, si la cirugía se indica por sospecha de malignidad recomiendan realización de escisión completa del quiste1,2. Para la escisión completa siempre que sea posible se indicará enucleación; en algunos casos puede ser necesaria una hepatectomía o en algunos casos incluso trasplante hepático1.
Sin embargo, no siempre es fácil indicar el tratamiento correcto, ya que dada la inespecificidad de los síntomas de estos pacientes puede ser difícil indicar un tratamiento quirúrgico sin poder ofrecer con seguridad una remisión de los síntomas. Por lo tanto, en nuestro centro el tratamiento inicial que se recomienda es el quirúrgico mediante la fenestración en pacientes jóvenes y operables con síntomas específicos en relación al quiste hepático. Por otro lado, si se trata de pacientes mayores, con comorbilidades o si existen dudas de que los quistes sean realmente sintomáticos se decide tratamiento percutáneo con drenaje o esclerosis.
Las técnicas radiológicas no permiten diferenciar de forma concluyente entre quiste simple y una lesión quística premaligna5,10. El estudio anatomopatológico de la pared del quiste tras la fenestración posibilita su correcto diagnóstico, permitiendo indicar una reintervención quirúrgica en los casos de neoplasia quística hepática. Sin embargo, sería de gran interés disponer de alguna prueba que permita establecer el diagnóstico preoperatoriamente con precisión. Con esta finalidad de mejorar la fiabilidad radiológica recientemente se han desarrollado algoritmos que pueden mejorar la fiabilidad diagnóstica11. Otra línea de estudio es la determinación de MKT intraquísticos.
Desde el punto de vista patológico e inmunohistoquímico, las lesiones quísticas pancreáticas y hepáticas premalignas tienen muchas características comunes12. Si bien en el manejo de las lesiones quísticas pancreáticas el papel de la determinación de CEA intraquístico tiene papel en el diagnóstico diferencial, no está claramente establecido su utilidad en el manejo de las lesiones quísticas hepáticas. Fuks et al.10 estudiaron esta relación con un tamaño muestral de 118 pacientes, incluyendo quistes simples y tumores quísticos hepáticos. No obtuvo diferencias significativas para los MKT de Ca19.9 y CEA, sin embargo, definió unos puntos de corte a partir de los cuales la sospecha de lesiones quísticas mucinosas malignas podría estar aumentada con una sensibilidad y especificidad muy bajas.
Teniendo en cuenta el punto de corte propuesto por Fuks et al.10 observamos que hasta un 60% de los pacientes de nuestra serie con QSH tenían un CA 19.9 por encima del valor referencia, y un 54% superaba el valor de referencia como patológico de CEA. Al revisar los pacientes con MKT elevados (CA 19.9 >250000μg/L y CEA >300 U/mL) confirmamos que la anatomía patológica era diagnóstica en todos ellos de QSH. Por el contrario, los valores de los MKT de los dos pacientes con lesiones premalignas estaban por debajo de los valores establecidos como puntos de corte. Así pues, en nuestra experiencia la determinación de MKT no parece ser de utilidad en el diagnóstico diferencial de las lesiones quísticas hepáticas.
Se ha descrito un tercer marcador tumoral que tiene relación con diferentes tipos de tumores, es el «tumor associated glycoprotein» 72 (TAG72). Ouyang et al.13 estudiaron el TAG72 como factor pronóstico en relación con la neoplasia de vesícula biliar, concluyendo que el TAG72 no está presente en células biliares normales y que la presencia de este MKT en pacientes con tumores de vesícula biliar puede ser un criterio clínico patológico de agresividad. A raíz de estos hallazgos, Fuks et al.10 estudiaron la relación entre el TAG72 y las lesiones quísticas hepáticas concluyendo que la mayoría de los pacientes con quistes mucinosos expresaban un TAG72 elevado (26/27) en comparación con los pacientes con quistes simples (12/75). Así pues, parece que este marcador podría ser de utilidad. Sin embargo, en nuestro caso no se pudo analizar pues no es posible su determinación en nuestro centro.
Valorando los resultados de los tratamientos realizados en nuestra serie coincidimos con lo descrito previamente, ya que el tratamiento más resolutivo en nuestra experiencia fue la cirugía con una tasa de eficacia de hasta el 87%, frente al 23% del drenaje simple o con esclerosis.
La revisión de nuestra experiencia muestra la baja eficacia del drenaje y esclerosis percutánea4. El tratamiento más resolutivo de los quistes simples hepáticos sintomáticos es la fenestración laparoscópica con baja morbimortalidad y recidiva. Teniendo en cuenta la alta tasa de recidiva, consideramos que el drenaje con esclerosis debería reservarse para intentar mejorar la sintomatología en pacientes no óptimos para cirugía14.
Nuestro trabajo permite una descripción del diagnóstico y tratamiento de los quistes simple sintomáticos; sin embargo, cabe destacar una serie de limitaciones, en primer el número limitado de casos, especialmente considerando la baja frecuencia de NQ. La selección de QSH sintomáticos puede ser un sesgo de selección; sin embargo, nos centramos en estos casos pues es el escenario clínico más frecuente. Dado que el estudio es un análisis retrospectivo de una base de datos prospectiva, no todos los pacientes fueron estudiados de igual forma ni disponemos de la determinación de MKT en todos los casos. La pérdida de seguimiento a largo plazo es otra limitación a tener en cuenta. Por último, tal como hemos comentado, si bien la determinación de TAG72 parece ser un marcador de utilidad, su análisis no está disponible en nuestro centro.
Sin embargo, cabe destacar la escasa bibliografía publicada, por lo que este trabajo puede ser útil para aportar más información en el manejo de la patología quística hepática en nuestro medio y ser un primer paso para futuros estudios. Los estudios futuros quizás deberán basarse en la búsqueda de nuevos marcadores intraquísticos.
Como conclusión, los valores de marcadores tumorales CEA y CA 19-9 intraquísticos no permiten distinguir los quistes simples de las neoplasias quísticas hepáticas dado el nulo valor predictivo positivo.
El diagnóstico de las lesiones quísticas, sobre todo si existen sospechas de malignidad, no se debe basar únicamente en una prueba diagnóstica si no en la combinación de ellas, así como la revisión de los casos individualizados en un comité multidisciplinar.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial o entidades sin ánimo de lucro.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.