La sarcomatosis peritoneal es una enfermedad rara, con múltiples orígenes histológicos y pronóstico global infausto. La opción de la cirugía citorreductora radical (CRS) con quimioterapia intraperitoneal hipertérmica (HIPEC) es controvertida. Se analizan y discuten los resultados de un equipo quirúrgico experimentado en estos procedimientos en función de la evidencia disponible.
MétodosEstudio sobre una base de datos prospectiva de pacientes con sarcomatosis peritoneal intervenidos mediante CRS y HIPEC, desde 2016 a 2022, en un centro referente nacional en sarcomas y cirugía oncológica peritoneal, que cumplieron los criterios de inclusión/exclusión establecidos.
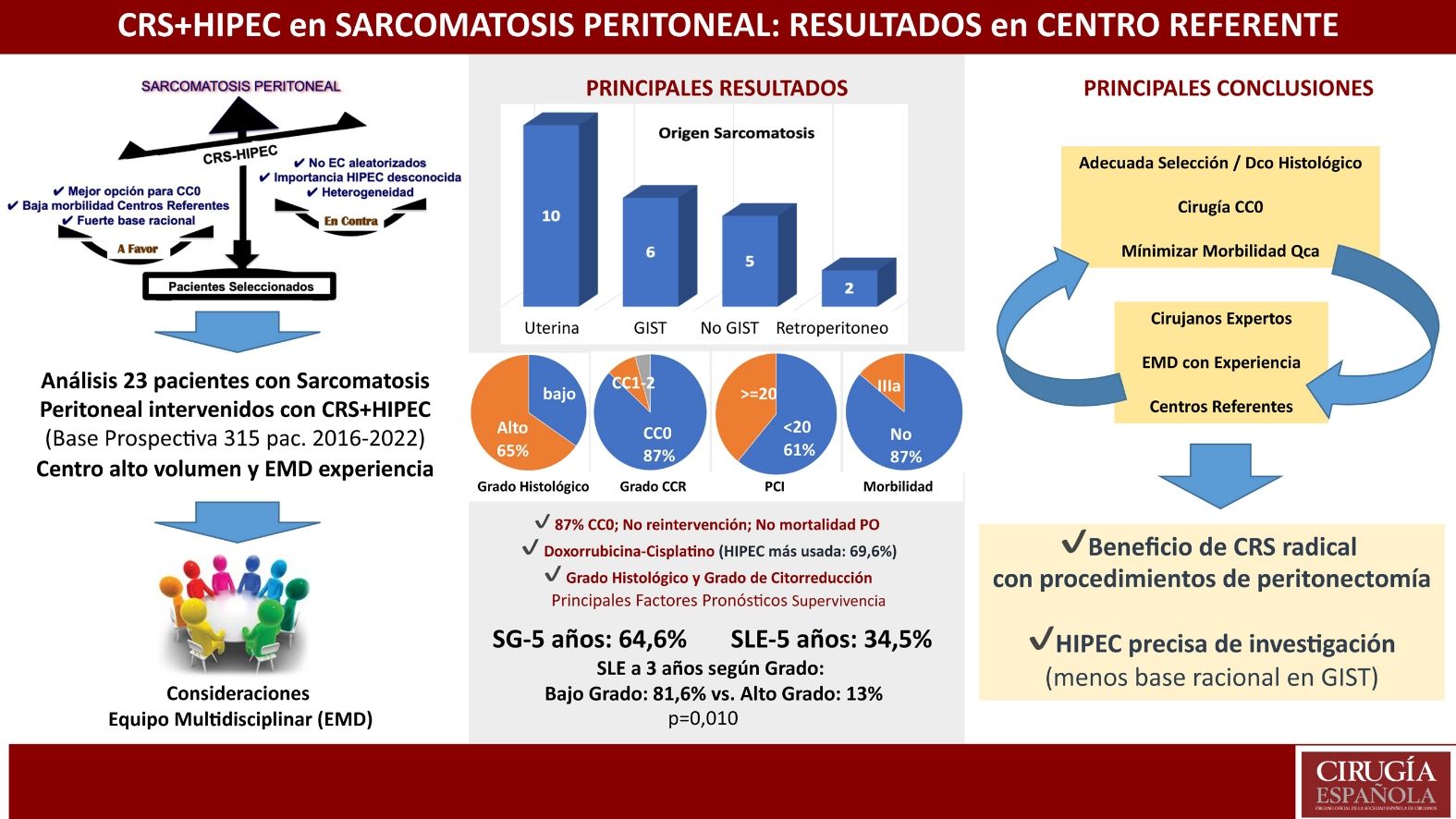
ResultadosSe incluyeron en el estudio a 23 pacientes, con mediana de edad de 53 años (6-68). Predominó la presentación clínica recurrente/persistente (78,3%). El origen visceral (incluyendo GIST y peritoneal no GIST) supuso el 47,8% de los pacientes, frente al 43,5% uterino y del 8,7% retroperitoneal. La mediana de PCI fue de 17 (3-36), con citorreducción CC0 del 87%. Morbilidad postoperatoria (Clavien-Dindo III-IV) del 13%, sin mortalidad postoperatoria en la serie. La supervivencia global y la supervivencia libre de enfermedad a 5 años, fueron del 64,6 y 34,5%, respectivamente. El grado histológico fue el factor pronóstico de supervivencia más influyente.
ConclusionesLos resultados de la serie, con baja morbilidad, apoyan el beneficio de cirugía oncológica peritoneal radical en los pacientes con sarcomatosis peritoneal tras una adecuada selección de los mismos, siempre que se realice en centros de alto volumen, cirujanos experimentados y equipos multidisciplinares expertos. Sin embargo, el papel de la HIPEC está por demostrar y pendiente de futuros estudios.
Peritoneal sarcomatosis is a rare disease, with multiple histological origins and poor overall prognosis. The option of radical cytoreductive surgery (CRS) with hyperthermic intraperitoneal chemotherapy (HIPEC) is controversial. The results of a surgical team experienced in these procedures are analyzed and discussed based on the available evidence.
MethodsStudy on a prospective database of patients with peritoneal sarcomatosis who underwent CRS and HIPEC, from 2016 to 2022, in a national reference center for sarcomas and peritoneal oncological surgery, who met the established inclusion/exclusion criteria.
ResultsTwenty-three patients were included in the study, with a median age of 53 years (6-68). Recurrent/persistent clinical presentation predominated (78.3%). Visceral origin (including GIST and non-GIST peritoneal) accounted for 47.8% of patients, compared to 43.5% uterine and 8.7% retroperitoneal. The median PCI was 17 (3-36), with CC0 cytoreduction of 87%. Postoperative morbidity (Dindo Clavien III-IV) of 13%, with no postoperative mortality in the series. Overall survival and disease-free survival at 5 years were 64.6% and 34.5%, respectively. Histological grade was the most influential prognostic factor for survival.
ConclusionsThe results of the series, with low morbidity, support the benefit of radical peritoneal oncological surgery in patients with peritoneal sarcomatosis after adequate selection, as long as it is performed in high-volume centers, experienced surgeons and expert multidisciplinary teams. However, the role of HIPEC remains to be demonstrated and pending future studies.
Los sarcomas de partes blandas (soft tissue sarcoma [STS]) son tumores mesenquimales malignos, con una extensa variedad de subtipos histológicos, representando solo el 1% de los cánceres sólidos. Un 30% de ellos se localizan en la cavidad abdominopélvica o retroperitoneal. En esta localización distinguimos los sarcomas viscerales del estroma gastrointestinal (GIST), aquellos sarcomas viscerales o peritoneales no GIST, los sarcomas ginecológicos y los sarcomas retroperitoneales. La mayoría de ellos se asocian con altas tasas de recidiva locorregional tras la cirugía y se caracterizan por la posibilidad de producir diseminación peritoneal durante su evolución, frecuentemente como consecuencia de la manipulación intraoperatoria del tumor primario y su posible rotura durante la resección quirúrgica1.
En tales circunstancias, la sarcomatosis peritoneal es considerada como una enfermedad rara, con múltiples orígenes histológicos y pronóstico global infausto. Por otra parte, a diferencia de otros tumores epiteliales que desarrollan enfermedad maligna peritoneal como el ovario, apéndice, colon o el propio peritoneo, entre otros, la opción de la cirugía citorreductora radical (CRS) con procedimientos de peritonectomía, con quimioterapia intraperitoneal hipertérmica (HIPEC) es controvertida2. Sin embargo, hay una fuerte base racional que apoya el tratamiento locorregional agresivo en estos pacientes, fundamentado en 2 circunstancias clave. De una parte, las semejanzas clínico-epidemiológicas que encontramos entre los STS que pueden desencadenar sarcomatosis peritoneal, y la propia carcinomatosis peritoneal que frecuentemente tratamos con radicalidad. De otra, los condicionantes de calidad terapéutica exigidos a estos procedimientos y que pueden coincidir en ambas situaciones clínicas.
El objetivo del presente trabajo es realizar un estudio acerca de lo que puede suponer un abordaje quirúrgico radical actualizado en los pacientes con sarcomatosis peritoneal, intervenidos mediante CRS+HIPEC en un centro referente nacional en sarcomas y cirugía oncológica peritoneal, con amplio volumen y experiencia en estos procedimientos que permita limitar la morbilidad y variabilidad de los mismos; incorporando las reflexiones, al respecto, en función de la evidencia científica actual.
MétodosPacientes y diseño del estudioEstudio analítico observacional a partir de una base de datos prospectiva de 315 pacientes con enfermedad maligna peritoneal intervenidos mediante CRS+HIPEC en la Unidad de Cirugía Oncológica Peritoneal y Retroperitoneal (COPER) del Hospital Universitario Virgen del Rocío de Sevilla, unidad de referencia del Sistema Nacional de Salud en Tumores Mesenquimales-Sarcomas y centro referente de cirugía oncológica peritoneal, durante el periodo julio-2016 a diciembre-2022. Se incluyeron en el estudio una serie consecutiva de 23 pacientes con diagnóstico de sarcomatosis peritoneal, intervenidos por el mismo equipo quirúrgico, con amplia experiencia en dichos procedimientos.
Todos los casos fueron previamente discutidos en un comité multidisciplinario experto. Igualmente, todos los pacientes firmaron un consentimiento informado por escrito y todos ellos fueron tratados según un protocolo aprobado por el Comité de Ética Institucional. El seguimiento del estudio fue continuado hasta diciembre de 2023.
Criterios de inclusión y exclusiónTodos los pacientes cumplieron los siguientes criterios: 1) confirmación histológica, por anatomopatólogos de la institución, de sarcomatosis peritoneal por sarcoma de partes blandas de cualquier subtipo histológico, tanto de carácter sincrónico con el tumor primario como metacrónico tras una cirugía previa, 2) tratamiento quirúrgico realizado mediante procedimientos CRS+HIPEC y 3) estado funcional Eastern Cooperative Oncology Group (ECOG) de grado 2 o menos. Los criterios de exclusión fueron: 1) presencia de enfermedad metastásica extraabdominal no tratada previamente de forma completa o con resección intraoperatoria incompleta, 2) pacientes con progresión tumoral a pesar de tratamiento neoadyuvante, 3) disfunción orgánica significativa (cardiovascular, respiratoria, renal o hepática), 4) otra neoplasia maligna coexistente sin tratamiento curativo, 5) pacientes con recurrencia local exclusivamente en el mismo sitio de la resección primaria y 6) pacientes intervenidos mediante CRS sin administración de HIPEC.
Procedimiento quirúrgico (CRS+HIPEC)CRS+HIPEC está basado en la técnica descrita por Sugarbaker3, ampliamente definida y utilizada por nuestro equipo quirúrgico4. El objetivo de la cirugía era la extirpación completa de toda la enfermedad neoplásica macroscópicamente visible (fig. 1). Una vez concluida la citorreducción quirúrgica y antes de practicar cualquier anastomosis digestiva, se administró HIPEC mediante una bomba de hipertermia homologada por la FDA (Belmont Hyperthermia PumpTM) con una velocidad de flujo alta (1l/min). La infusión de la quimioterapia al interior del abdomen, diluida en solución de dextrosa al 1,5%, se realizó a través de 2 catéteres, y la extracción mediante 4 drenajes aspirativos colocados en la cavidad abdominal (subdiafragmáticos y pélvicos). También se utilizaron cuatro sondas de temperatura para control de la misma durante el procedimiento realizado con abdomen abierto según la técnica del Coliseo4,5. Como citostáticos, el esquema más utilizado fue cisplatino (50mg/m2/2l solución) con doxorrubicina (15mg/m2/2l solución), versus doxorrubicina aislada a la misma dosis en casos de intolerancia a cisplatino, o paclitaxel (60mg/m2/2l solución) en algún caso ginecológico coincidente también con posible toxicidad a platino, todos ellos durante 60min a 41-43°C (tabla 1).
Imágenes de diferentes etapas de una cirugía citorreductora radical con procedimientos de peritonectomía (CRS) en un paciente con sarcomatosis peritoneal, incluido en la serie estudiada: A) Exposición de cavidad abdomino-pélvica, con sarcomatosis peritoneal; B) Cirugía citorreductora en bloque con realización de peritonectomía centrípeta en zona pélvica; C) Pieza quirúrgica extirpada tras la citorreducción radical del área pélvica (incluye peritoneo parietocólico bilateral y pélvico-vesical-fondo de saco de Douglas, útero, trompas, ovarios, recto-sigma, colon descendente, colon transverso y anastomosis ileocólica previa), y D) Pelvis con citorreducción completa (CC0).
Características demográficas y clínicas de los pacientes
| Características pacientes de la serie (n: 23) | Número | Porcentaje |
|---|---|---|
| Género | ||
| Masculino | 7 | 30,4 |
| Femenino | 16 | 69,6 |
| Edad mediana en años (rango) | 53 (6-68) | |
| Presentación | ||
| Primario | 5 | 21,7 |
| Recurrente/persistente | 18 | 78,3 |
| Histología tumoral | ||
| Visceral | 11 | 47,8 |
| Gastrointestinal (GIST) | 6 | 26,1 |
| Peritoneal no GIST | 5 | 21,7 |
| -Tumor miofibroblástico inflamatorio epitelioide | 1 | 4,3 |
| -Tumor desmoplásico de células redondas | 1 | 4,3 |
| -Sarcoma con reordenamiento NUTM 1 | 1 | 4,3 |
| -Tumor fibroso calcificante bajo grado | 1 | 4,3 |
| -Sarcoma de células dendríticas foliculares | 1 | 4,3 |
| Uterino | 10 | 43,5 |
| Leiomiosarcoma | 3 | 13,0 |
| Sarcoma del estroma endometrial | 5 | 21,7 |
| Indiferenciado | 2 | 8,7 |
| Retroperitoneal | 2 | 8,7 |
| Liposarcoma bien diferenciado | 1 | 4,3 |
| Liposarcoma desdiferenciado (grado II) | 1 | 4,3 |
| Grado histológico | ||
| Bajo | 8 | 34,8 |
| Alto | 15 | 65,2 |
| PCI mediana (rango) | 17 (3-36) | |
| PCI<10 | 7 | 30,4 |
| PCI: 10-20 | 7 | 30,4 |
| PCI>20 | 9 | 39,1 |
| Enfermedad metastásica extraperitoneal | ||
| Hígado | 1 | 4,3 |
| Pulmón | 2 | 8,7 |
| Tratamiento previo | ||
| Ninguno | 1 | 4,3 |
| Cirugía aislada | 1 | 4,3 |
| Quimioterapia/hormonoterapia (QT/HT) aislada | 4 | 17,4 |
| Radioterapia (RT) aislada | 0 | 0 |
| Combinación (cirugía+QT/HT±RT) | 17 | 73,9 |
| PSSscore | ||
| PSS: 0-1 | 10 | 43,5 |
| PSS: 2-3 | 13 | 56,5 |
| Grado de citorreducción (CC) | ||
| CC0 | 20 | 87,0 |
| CC1 | 2 | 8,7 |
| CC2 | 1 | 4,3 |
| Procedimientos de peritonectomía | ||
| Pélvica/local (<3 procedimientos) | 6 | 26,1 |
| Extenso (3-4 procedimientos) | 11 | 47,8 |
| Total (>4 procedimientos) | 6 | 26,1 |
| Tipo de HIPEC | ||
| Doxorrubicina | 4 | 17,4 |
| Doxorrubicina-cisplatino | 16 | 69,6 |
| Paclitaxel | 3 | 13,0 |
| Tiempo quirúrgico mediana en horas (rango) | 7 (5-10) | |
| Morbilidad grave (Clavien-Dindo III-IV) | 3 | 13 |
| Mortalidad postoperatoria (30 días) | 0 | 0 |
| Estancia hospitalaria mediana en días (rango) | 14 (9-42) | |
| Estado actual | ||
| Vivo sin enfermedad | 8 | 34,8 |
| Vivo con enfermedad | 9 | 34,8 |
| Muerto con enfermedad | 5 | 26,1 |
| Muerto otra causa | 1 | 4,3 |
HIPEC: quimioterapia intraperitoneal hipertérmica; PCI: índice cáncer peritoneal; PSS: Prior Surgical Score.
Las variables del estudio, así como las características de los pacientes incluidos en la serie, se muestran en la tabla 1.
La histología tumoral original del sarcoma fue clasificada en 4 grupos: visceral o peritoneal tipo GIST (tumor del estroma gastrointestinal), visceral o peritoneal no GIST, ginecológico (uterino) y retroperitoneal. El grado del tumor se evaluó según la clasificación Federation Nationale des Centres de Lutte Contre le Cancer (FNCLCC). A efectos del presente estudio, los sarcomas de grado 1 y 2 se describen como bajo grado, y los sarcomas de grado 3 como alto grado. Mediante la variable Prior Surgical Score (PSS) se determinaron los antecedentes de cirugía previa (PSS-0 en pacientes sin antecedentes de cirugía por cáncer, PSS-1 pacientes que previamente habían sido sometidos a cirugía en una región abdominopélvica o biopsia simple, PSS-2 en aquellos pacientes que habían sido intervenidos previamente en 2 a 5 regiones y como PSS-3 aquellos que habían sido intervenidos en más de 5 regiones abdominopélvicas). El índice de cáncer peritoneal (PCI), determinado previamente a cualquier exéresis quirúrgica, la extensión de la citorreducción expresada en función del número de procedimiento realizados y el grado de citorreducción obtenido tras finalizar la intervención (CCR score), fueron definidos previamente por Sugarbaker4.
La morbilidad postoperatoria al alta hospitalaria, incluyendo siempre los primeros 30 días del postoperatorio, se constató según la clasificación de Clavien-Dindo6, considerando la morbilidad grados III y IV como morbilidad grave.
Análisis estadísticoLos datos se expresaron como frecuencias y medianas. Los criterios de valoración del estudio fueron la supervivencia global (SG) y la supervivencia libre de enfermedad (SLE). Se estimaron a partir de la fecha de CRS+HIPEC, mediante análisis de Kaplan-Meier. La SG se fechó desde el día de CRS+HIPEC hasta el momento de la muerte; La SLE se fechó desde el día de CRS+HIPEC hasta el momento de la progresión de la enfermedad local o a distancia. El análisis multivariado se realizó siguiendo el método de regresión múltiple de Cox. Los intervalos de confianza se calcularon al 95%. Se consideró estadísticamente significativo una p<0,05. El análisis estadístico se realizó utilizando el programa estadístico IBM SPSS® versión 20.0 para Windows (SPSS Inc., Chicago, IL, EE. UU.).
ResultadosAnálisis descriptivoLos datos descriptivos de los pacientes con sarcomatosis peritoneal incluidos en el estudio se muestran en la tabla 1. Entre ellos, se observó un predominio del carácter recurrente o persistente tras una cirugía previa subóptima (78,3%), frente a los pacientes con enfermedad peritoneal sincrónica con el sarcoma primario (21,7%). Entre las cirugías previas subóptimas, como principal particularidad, se incluyó un paciente infantil de 6 años con múltiples intervenciones quirúrgicas y esquemas de quimioterapia, incluso RT abdominal total, por tumor desmoplásico de células redondas pequeñas. El origen histológico tumoral predominante fue el uterino (10/23, 43,5%), siendo la mitad de ellos del estroma endometrial (3 de bajo grado y 2 de alto grado). La morbilidad postoperatoria grave descrita del 13% consistió en 3 pacientes con grado IIIa de Clavien-Dindo. En la actualidad viven 16 pacientes (69,6%), habiendo fallecido 7 pacientes (30,4%) entre los que se incluye una paciente fallecida en el segundo mes del alta hospitalaria, por enfermedad SARS-CoV-2 y shock séptico (tabla 1).
Análisis de supervivenciaCon una mediana de seguimiento de 23 meses, la SG a 5 años fue del 64,6% y la SLE del 34,5%. De todas las variables estudiadas, el grado histológico fue la más influyente en la supervivencia, aunque no alcanzó la significación estadística en la SG (52% de supervivencia a 3 an&#¿;os en alto grado vs. 100% en bajo grado; p=0,062), sí la alcanzó en la SLE (13% de supervivencia a 3 an&#¿;os en alto grado vs. 81,6% en bajo grado; p=0,010) (fig. 2).
Otra variable que obtuvo mejores resultados de SG, sin significación estadística, fue el carácter primario de la sarcomatosis peritoneal frente al recurrente o persistente (100% de supervivencia a 5 an&#¿;os vs. 56,3%, respectivamente; p=0,118). Por otra parte, el estudio multivariante confirmó la importancia pronóstica del grado histológico en lo que respecta a la SLE, así como el grado de citorreducción (tabla 2).
Análisis univariante y multivariante de las variables clínico-patológicas
| Variables | Supervivenciaglobal (SG) | Supervivencialibre de enfermedad (SLE) | ||
|---|---|---|---|---|
| Univariante(Valor de p) | Univariante(Valor de p) | HR(IC 95%) | Multivariante(Valor de p) | |
| Género, (masculino vs. femenino) | 0,870 | 0,172 | ||
| Presentación, (primario vs. recurrente/persistente) | 0,118 | 0,897 | ||
| Origen histológico tumoral, (GIST vs. visceral vs. útero vs. retroperitoneo) | 0,275 | 0,817 | ||
| Grado histológico, (bajo vs. alto) | 0,062 | 0,010 | 0,126(0,160-0,993) | 0,049 |
| PCI (índice cáncer peritoneal). (<10 vs. 10-20 vs. >20) | 0,727 | 0,918 | ||
| Enfermedad metastásica extraperitoneal, (no vs. si (hígado/pulmón) | 0,861 | 0,527 | ||
| Tratamiento previo, (no vs. cirugía vs. QT/HT vs. combinado) | 0,455 | 0,585 | ||
| PSS score, (0-1 vs. 2-3) | 0,817 | 0,930 | ||
| Grado de citorreducción (CC), (CC0 vs. CC1/CC2) | 0,812 | <0,001 | 0,305(0,135-0,686) | 0,004 |
| Procedimientos de peritonectomía, (<3 vs. 3-4 vs. >4) | 0,935 | 0,283 | ||
| Tipo de HIPEC, (doxorrubicina vs. doxo-cisplatino vs. paclitaxel) | 0,937 | 0,176 | ||
GIST: tumor del estroma gastrointestinal; HIPEC: quimioterapia intraperitoneal hipertérmica; HR: hazard ratio; HT: hormonoterapia; IC 95%: intervalo de confianza del 95%; QT: quimioterapia.
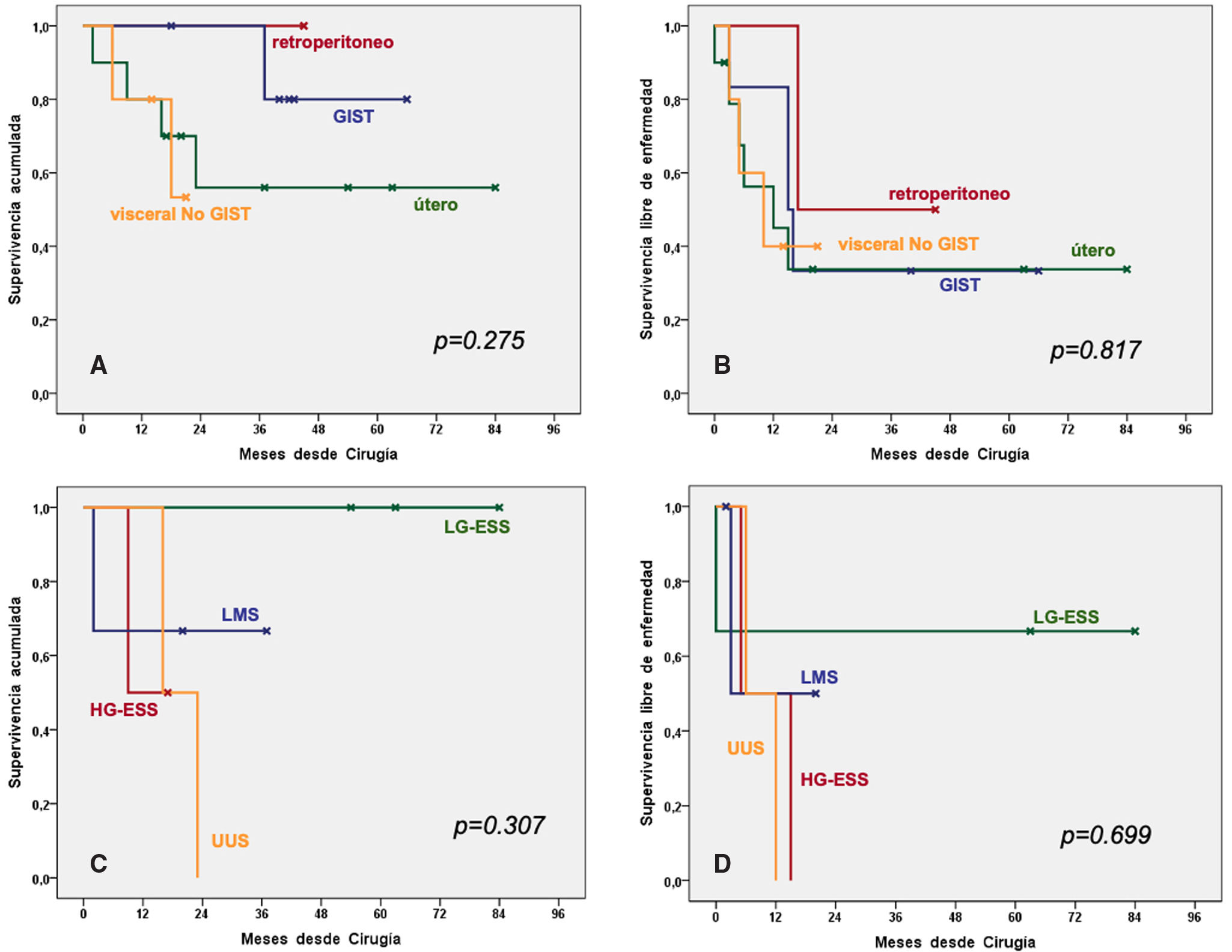
En el análisis univariante con respecto al origen histológico, la SG a 3 años fue del 100% para la gistosis peritoneal y sarcomatosis de origen retroperitoneal, frente al 56% para la sarcomatosis uterina (p=0,328). En cuanto a la SLE a 3 años, fue del 50% para los sarcomas retroperitoneales de bajo grado, del 33,3% para la gistosis peritoneal y del 33,8% para la sarcomatosis uterina (p=0,817). El análisis específico de los sarcomas ginecológicos mostró los mejores resultados de supervivencia en los casos de sarcomatosis del estroma endometrial de bajo grado, con el 100% de SG y del 66,7% de SLE, a 5 años (fig. 3).
Curvas de supervivencia de Kaplan-Meier: A) Supervivencia global (SG) según origen histológico tumoral; B) Supervivencia libre de enfermedad (SLE) según origen histológico tumoral; C) SG del subgrupo de sarcomatosis uterina, según subtipo histológico, y D) SLE del subgrupo de sarcomatosis uterina, según subtipo histológico.
HG-ESS: sarcoma del estroma endometrial de alto grado; LG-ESS: sarcoma del estroma endometrial de bajo grado; LMS: leiomiosarcoma; UUS: sarcoma indiferenciado.
El análisis inicial de esta serie muestra que la sarcomatosis peritoneal, a pesar de sus numerosas variantes histológicas, supuso solo el 7,3% del porcentaje total de pacientes con enfermedad maligna peritoneal que recibieron CRS+HIPEC en un centro referente con una Unidad específicamente dedicada al tratamiento de estas patologías. Este hecho, observado en otras series publicadas7,8, confirma la rareza de la misma y justifica el escaso número de pacientes analizados en la literatura científica, así como la dificultad para desarrollar estudios prospectivos amplios y bien diseñados que permitan una correcta validación de los resultados9–19 (tabla 3).
Revisión de la literatura sobre cirugía citorreductora radical (CRS) + quimioterapia intraperitoneal hipertérmica (HIPEC) en sarcomatosis peritoneal con series de 20 pacientes o más
| Autor | Año | Diseño del estudio | Pacientes(n) | Histología tumor primario | HIPEC (citostático) | PCI | Citorreducción(%) | MorbilidadGrados 3-4(%) | Mortalidad(%) | SLE a5 años (%) | SG a5 años(%) | SGmediana(meses) |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Berthetet al.10 | 1999 | Retrospectivounicéntrico | 43 | 22 LMS, 9 LPS, 4 FS,4 DSRCT, 1 MPNST,1 SFT | HIPEC con cisplatino(3 HIPEC, 13 HIPEC+EPIC, 14 EPIC, 13 No | 9 con <1334 con >13 | CC0-1: 63 | 19 | 7 | ND | CC0-CC1: 39 | 20 |
| Rossiet al.11 | 2004 | Prospectivo multicéntrico | 60 | 14 GIST, 12 uterinos(8 ULMS, 4 EES), 34 RPS (20 LPS, 6 UPS,4 MPNST, 2 FS, 2 DSRCT) | doxo+cisplatino | medio 7,7(2-21) | CC0: 68CC0-1: 100 | 23 | 0 | ND | 38 | 34 |
| Limet al.12 | 2007 | ProspectivoFase 1ComparativoNo aleatorizado | 28 | 17 LMS/GIST, 5 DSRCT, 2 LPS, 4 otros | 19 HIPEC: cisplatino9 HIPEC: cisplatino+mitoxantrone | ND | CC0-1:95 (CDDP)frente a 100 (CDDP+MITOX) | 16 (CDDP)frente a44 (CDDP+MITOX) | 0 | ND | ND | 16,9 (CDDP)frente a5,5 (CDDP+MITOX) |
| Barattiet al.13 | 2010 | Retrospectivounicéntrico | 37 | 13 LPS, 11 ULMS, 8 GIST pre-imatinib, 5 Otros | doxo+mitom C o cisplatino | medio 14,7(2-34) | CC0: 76CC0-1: 84 | 21,6 | 2,7 | 17,8 | 24,3 | 26,2(34 en LPS) |
| Hayes-Jordanet al.14 | 2015 | Retrospectivo unicéntrico | 34 | 21 DSRCT, 7 RMS, 2 LPS, 4 otros sarcomas, 12 otros tumores | cisplatino | mediana 16 | CC0: 95CC0-1: 100 | 28 | 0 | ND | ND(DSRCT 30) | 31,4 |
| Sardiet al.15 | 2017 | Retrospectivomulticéntrico | 36 | 29 ULMS, 3 ESS, 3 AS,1 otro | 22 doxo+cisplatino,10 melphalan, resto cisplatino/mitom C | mediana 16 (2-39) | CC0-1: 94 | 21 | 2,8 | 32 | 32 | 37 |
| Hayes-Jordanet al.16 | 2018 | ProspectivoFase 2No aleatorizado | 20 | 14 DSRCT, 2 RMS, 2 UPS, 1 T. granulosa, 1 Sarcoma de Ewing | cisplatino | mediana 15 | CC0-1: 100 | 40 | 0 | ND | ND(83 a3 años) | 58,4 para DSRCT |
| Karamveriet al.17 | 2019 | Retrospectivounicéntrico | 20 | 5 LPSDD, 5 RMS, 4 LMS, 2 LPSWD, 4 otros | doxo+cisplatino | medio 6(2-24) | CC0: 86 | 20,7 | 0 | ND | 43 | 55 |
| Spiliotiset al.18 | 2021 | Retrospectivomulticéntrico | 21 | 7 LPS, 6 LMS, 4 RMS,4 FS | 11 mitom C7 doxo, 3 cisplatino | mediana 10(3-20) | CC0: 52,4CC0-1: 90 | 14,3 | 4,7 | ND | ND | 20,5 |
| Almasriet al.19 | 2024 | Retrospectivounicéntrico | 29 | 12 LPS, 7 LMS, 3 FS,2 UPS, 5 otros | Ifosfamida iv+HIPEC (24 doxo+cisplatino,5 doxo+mitom C) | mediana 6(3-12) | CC0: 51,7CC0-1: 68,9 | 31 | 0 | ND(35 a2 años) | ND(73 a2 años) | NA |
| Serieactual | 2024 | Retrospectivounicéntrico | 23 | 10 uterinos (5 EES,3 ULMS, 2 UUS), 6 GIST,5 visceral no GIST, 2 LPS | 16 doxo-cisplatino, 4 doxo, 3 paclitaxel | mediana 17(3-36) | CC0: 87CC0-1: 96 | 13 | 0 | 34 | 64 | NA |
AS: angiosarcoma; CDDP: cisplatino; doxo: doxorrubicina; DSRCT: tumor desmoplásico de células redondas pequeñas; EES: sarcoma del estroma endometrial; FS: fibrosarcoma; GIST: tumor del estroma gastrointestinal; LMS: leiomiosarcoma; NA: no alcanzada; ND: no determinada; LPS: liposarcoma: LPSDD: liposarcoma desdiferenciado; LPSWD: liposarcoma bien diferenciado; mitom C: mitomicina C; MITOX: mitoxantrone; MPNST: tumor maligno de la vaina nerviosa periférica; ND: no determinada; RMS: rabdomiosarcoma; RPS: sarcoma retroperitoneal; SFT: tumor fibroso solitario; UPS: sarcoma pleomórfico indiferenciado; ULMS: leiomiosarcoma uterino; UUS: sarcoma uterino indiferenciado.
Fuente: PubMed Database.
Ante estas circunstancias, el diseño de este estudio, centrado en una única institución con alta experiencia en el manejo de esta patología, ha buscado depurar al máximo la morbilidad inherente a estos procedimientos que han sido realizados en pacientes con una considerable carga tumoral y alto porcentaje CC0, para comprobar la aportación que pudiera suponer la cirugía radical en esta enfermedad localmente avanzada.
La primera conclusión que se podría hacer al respecto sería que una morbilidad grave del 13% sin reintervenciones quirúrgicas ni mortalidad postoperatoria asociadas, en una serie de 23 pacientes y en la línea de otras publicaciones recientes17, mejoran considerablemente otros resultados previos que asociaban a estos procedimientos con una morbilidad excesiva y limitante para su realización12. Por otra parte, los resultados globales de series como la nuestra, con supervivencias a 5 años que superan el 60% y libres de recurrencia del 34%, permiten seguir considerando a la cirugía como piedra angular terapéutica en pacientes adecuadamente seleccionados por un equipo multidisciplinar experto, incluso en situaciones de metástasis peritoneal.
Asimismo, en consonancia con la inmensa mayoría de trabajos publicados, se ha mostrado el grado histológico como el factor de supervivencia clave en el pronóstico de los pacientes con sarcomatosis peritoneal11. Los excelentes resultados obtenidos en la sarcomatosis de bajo grado, son un estímulo para intentar conseguir una citorreducción radical completa, el otro factor pronóstico que asocian estos procedimientos y que refuerza la recomendación de su derivación a centros especializados.
Con la limitación del número de pacientes incluidos, el análisis de subgrupos muestra algunos detalles interesantes. Así, sorprenden positivamente los resultados de los sarcomas retroperitoneales, aunque probablemente no tanto si se tiene en cuenta que solo incluyen a dos pacientes y se trata de liposarcomas de bajo grado, en los que una citorreducción completa es factor clave20. Por otra parte, los excelentes resultados obtenidos con la gistosis peritoneal, a diferencia de otras series de la era pre-imatinib13, son probablemente consecuencia de haber realizado la intervención tras los 6-12 primeros meses de tratamiento y respuesta con inhibidores de la tirosina kinasa (ITK), prolongando su terapia tras la cirugía, tal como mostraron Bryan et al.21 y como aconsejan las guías actuales22,23, evitando la intervención en momentos de resistencia al tratamiento24. En este sentido, el único paciente fallecido en la actualidad del subgrupo de gistosis peritoneal, tenía larga evolución de la enfermedad y se encontraba en tratamiento de segundas líneas de ITK a las que finalmente se hizo resistente. Así, excluir la cirugía radical en patologías que tengan una buena sensibilidad inicial a la quimioterapia o terapias dirigidas, o bien realizarla en situaciones de progresión, entendemos que pudiera ser un gran error estratégico. En cuanto a los sarcomas uterinos, los leiomiosarcomas, tal como indicaban los trabajos del grupo de Sardi et al.15 y Díaz-Montes et al.25, y los sarcomas del estroma endometrial de bajo grado en los que la cirugía completa es el arma terapéutica más efectiva, se postulan como los más beneficiados con estos procedimientos de citorreducción radical26. Por último, el subgrupo de sarcomatosis visceral/peritoneal no GIST entre los que se incluyen diferentes tipos histológicos de sarcomas, como el desmoplásico de células redondas pequeñas o el tumor miofibroblástico inflamatorio, con gran afinidad por afectación peritoneal y más frecuentes en edades jóvenes, pudieran beneficiarse también de una cirugía citorreductora agresiva con procedimientos de peritonectomía, tal como se refleja en la literatura científica14,16,27,28.
En lo que se refiere a la HIPEC, la combinación más usada fue doxorrubicina+cisplatino, en la línea del reciente metaanálisis de Wong et al. y la mayoría de trabajos publicados9. No obstante, el beneficio de la HIPEC se desconoce y no podemos atribuirle un claro papel protagonista. El lavado de células diseminadas por el propio cirujano durante cirugías tan largas, para evitar su implantación, así como la acción citolítica sobre la enfermedad microscópica residual en aquellos casos con quimiosensibilidad demostrada, pudieran ser sus beneficios. Sin embargo, a falta de estudios prospectivos aleatorizados, no podemos proponerlo como estándar de tratamiento. Menos aún en pacientes con gistosis peritoneal respondedores a ITK, en los que la administración de citostáticos habituales puede carecer de fundamento racional.
Finalmente, se observó un gran porcentaje de pacientes en nuestra serie con tratamiento oncológico previo al procedimiento quirúrgico radical. Es primordial que esta decisión y el tipo de tratamiento administrado esté argumentada por un equipo multidisciplinario experto, tal como recomiendan las guías de consenso de STS. Incluso, en algunos casos, la nula respuesta de control a ese tratamiento previo, pudiera ser un factor clave para determinar la no indicación de estos procedimientos.
En resumen, los resultados de la serie muestran pacientes seleccionados de sarcomatosis peritoneal que pueden recibir un tratamiento quirúrgico radical con altas tasas de citorreducción completa y baja morbilidad asociada, siempre que se realice en centros de alto volumen, por cirujanos experimentados y equipos multidisciplinares expertos. La heterogeneidad histopatológica y escaso número de pacientes incluidos en las series publicadas, dificulta la discriminación argumentada de los subtipos histológicos que más beneficio obtienen. Sin embargo, el bajo grado histológico parece ser un factor pronóstico especialmente favorable para estos procedimientos quirúrgicos, en los que desconocemos el verdadero papel de la HIPEC, pendiente de futuros estudios.
FinanciaciónEste trabajo no ha recibido ningún tipo de financiación
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses