Los tumores secretores de catecolaminas son neoplasias raras, presentando una incidencia anual de 1-2 personas/100.000 habitantes-año, siendo malignos solo el 10%, sin diferencia histológica ni bioquímica respecto los benignos, excepto la invasión local en tejidos y órganos circundantes o metástasis a distancia1-4.
Los pacientes con feocromocitoma sufren persistencia de la enfermedad en el 3-13% y una recurrencia del 6-23%, tanto local como metastásica (el riesgo de recurrencia acumulada a los 5 años es del 5% y el riesgo de por vida del 20-25%), con mayor riesgo los que forman parte de síndromes hereditarios, los que presentan mayor tamaño del tumor primario (> 5cm) y ubicación extraadrenal (paragangliomas)3,5.
Se ha postulado la rotura de la integridad de la cápsula durante la resección del tumor o el derrame de células tumorales durante la manipulación de tumores friables y hemorrágicos, como el mecanismo de siembra responsable de la recidiva peritoneal2,3,5,6. Definido por algunos como feocromocitomatosis, que representa una forma muy rara de recurrencia, refiriéndose a nuevos, múltiples y, a menudo, pequeños feocromocitomas que crecen dentro y alrededor del lecho de resección quirúrgica de una adrenalectomía previa5.
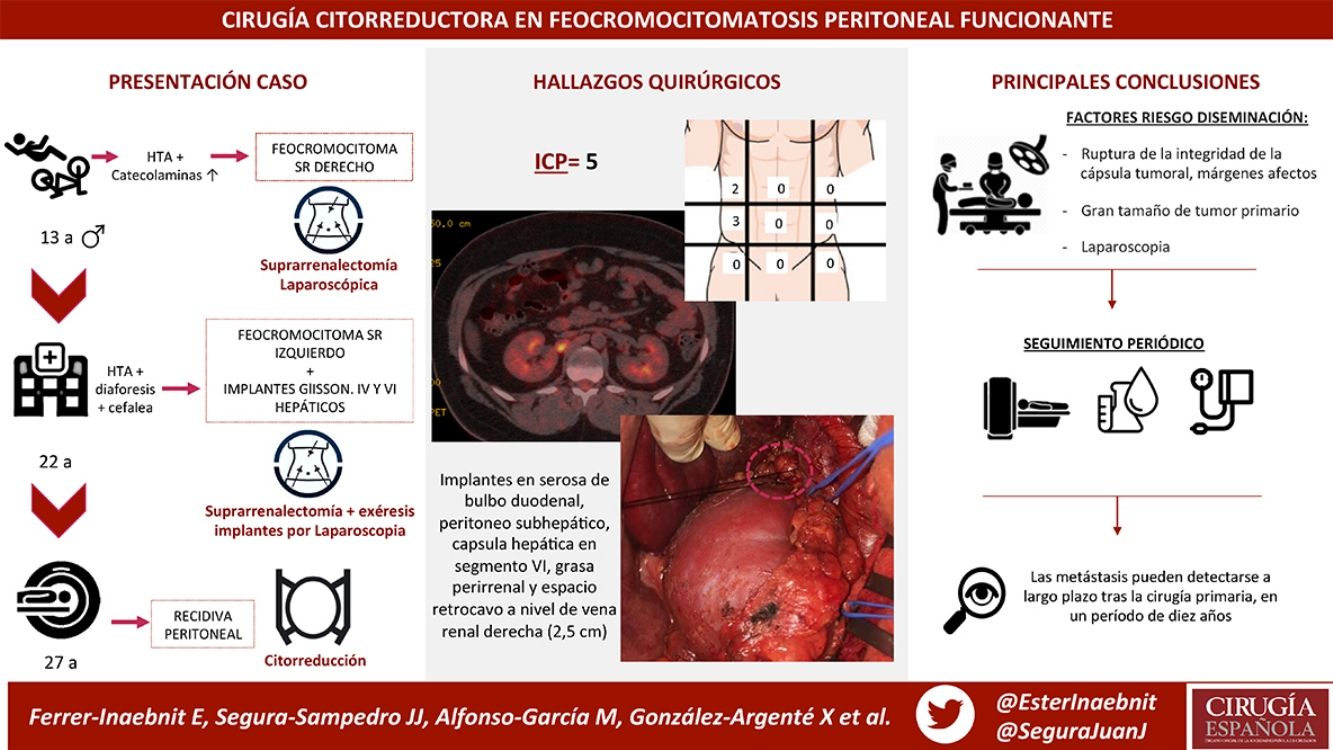
Presentamos el caso de un varón que, a los 13 años, es diagnosticado de feocromocitoma suprarrenal derecho, realizándose adrenalectomía derecha laparoscópica, hallándose una glándula de 6cm con tumoración parcialmente encapsulada de 4×3cm con márgenes no valorables.
En controles periódicos, 9 años más tarde, con 22 años, a raíz de HTA, diaforesis y cefalea, se diagnostica de feocromocitoma izquierdo e implantes peritoneales capsulares en la cápsula de Glisson en segmentos iv y vi hepáticos. Se le realiza adrenalectomía izquierda y exéresis de los implantes por vía laparoscópica, hallándose una glándula adrenal de 6,5×3×2cm, observándose 2nódulos de 1,8 y 0,8cm, con integridad de la cápsula del tumor, presentándose en afectación del margen quirúrgico. Dos implantes peritoneales, uno de 1cm en el inicio del ligamento redondo y uno subcapsular hepático de 1,5cm en segmento iv.
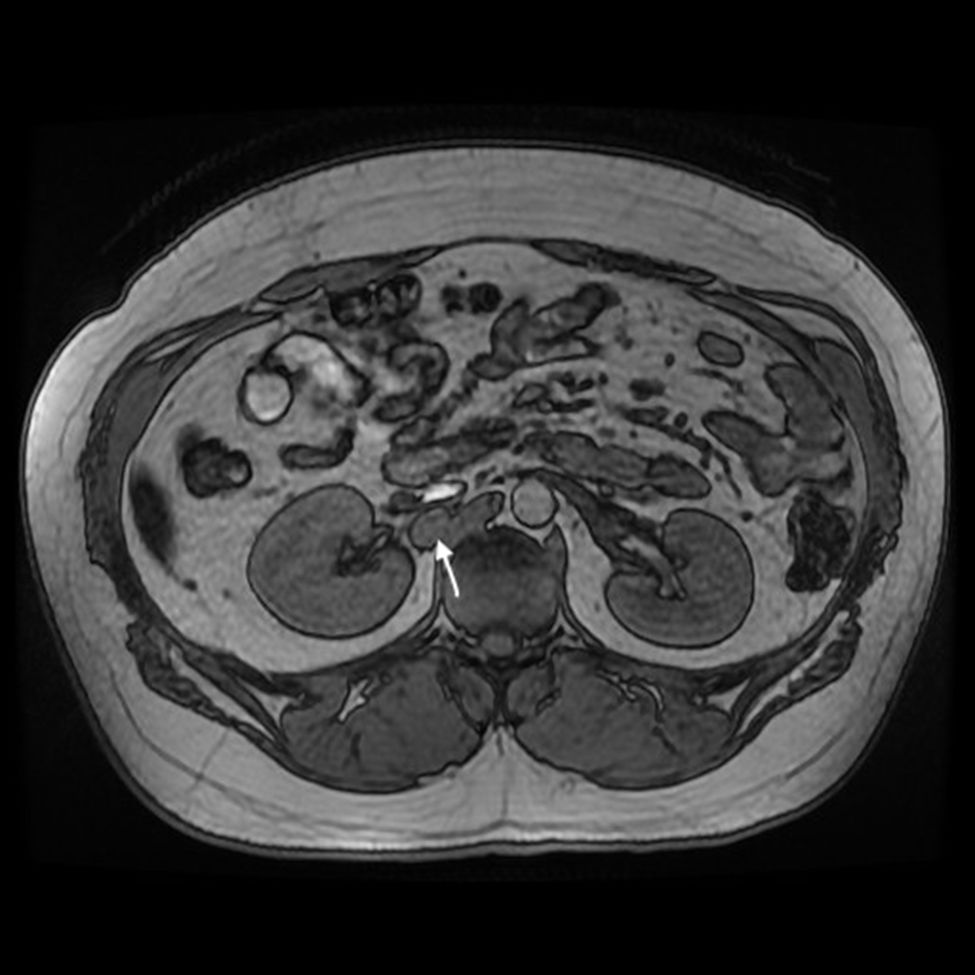
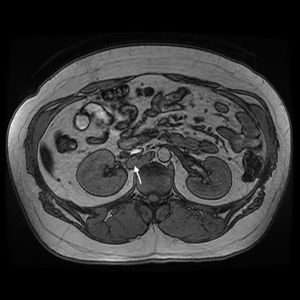
Actualmente, con 27 años, presenta obesidad e insuficiencia suprarrenal en tratamiento sustitutivo. En controles periódicos se detecta un aumento de metanefrinas y cromogranina en sangre, ampliando estudio con pruebas radiológicas (TAC y resonancia magnética) (fig. 1), diagnosticando nueva recidiva peritoneal y retroperitoneal que no capta 131I MIBG con octreoscan negativo.
Tras ser comentado en comité multidisciplinar de tumores peritoneales, se realiza premedicación con nicardipino y se plantea cirugía citorreductora.
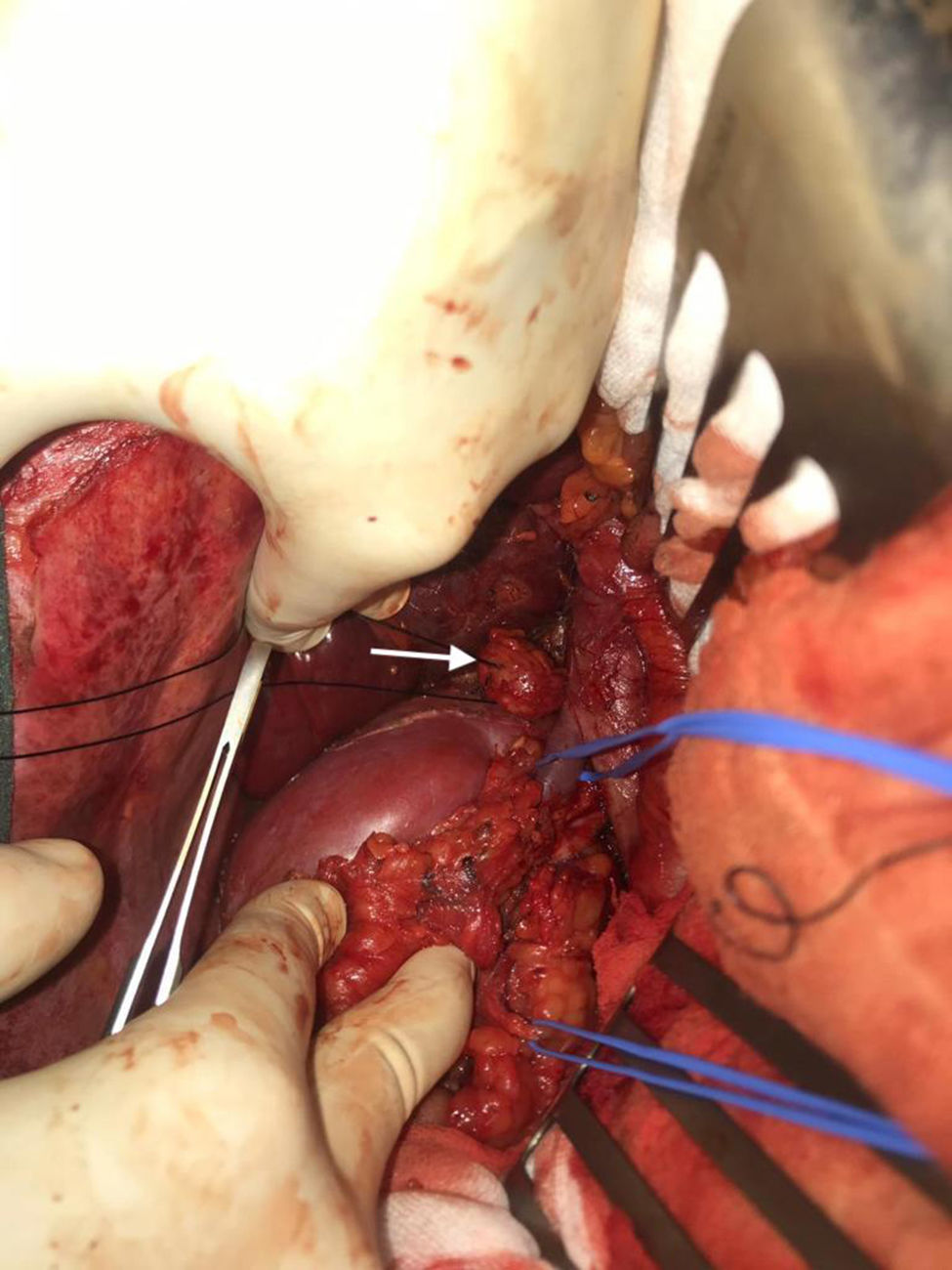
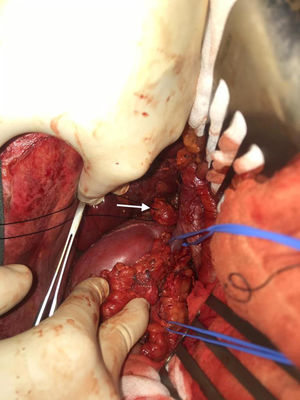
Se realiza una laparotomía media, hallando implantes milimétricos múltiples (< 6mm) en serosa de bulbo duodenal, peritoneo subhepático, superficie hepática en segmento vi, cápsula de Gerota y otro mayor de 2,5cm en espacio retrocavo a nivel de vena renal derecha (cuya movilización intraoperatoria provocaba elevación de la presión arterial, monitorizada mediante Vigileo® (Edwards Lifescience, Irvine, CA, EE. UU.) y controlada mediante terapia guiada por objetivos7) (fig. 2). Todos ellos fueron extirpados; el mayor requirió la movilización del duodeno con exposición de vena cava, posterior apertura de cápsula de Gerota, movilización de riñón derecho y disección de la cara posterior de la cava. Se calculó un ICP de 5, localizado en el hipocondrio y el flanco derechos.
Presentó un postoperatorio correcto, sin complicaciones, con correcta evolución; fue dado de alta al 5.° día postoperatorio.
En la muestra remitida a anatomía patológica se confirma que las piezas quirúrgicas corresponden a tumoración neuroendocrina compatible con feocromocitoma (cromogranina y sinaptofisina positivas, Ki 67 del 5%).
El paciente continúa libre de enfermedad tras un año de la cirugía.
Debido a la ausencia de características definidas de malignidad del feocromocitoma, es difícil determinar el potencial maligno del tumor1,4. Las únicas características malignas probadas son la presencia de metástasis a distancia, síndromes multiendocrinos ya diagnosticados o trastornos genéticos, en muchos casos de los síndromes familiares2,4,5.
Las metástasis pueden detectarse a largo plazo tras la cirugía primaria, a veces en un período de 10años (media: 60 meses)5. El inicio de los síntomas característicos del feocromocitoma después del tratamiento quirúrgico de un tumor suprarrenal sugiere la existencia de metástasis a distancia con actividad hormonal, que requerirá una evaluación endocrina exhaustiva, así como la exclusión de la predisposición genética mediante un análisis mutacional para genes de susceptibilidad y pruebas radiológicas (TAC o gammagrafía con 123I-MIBG)4.
En nuestro caso, los síntomas recurrentes comenzaron a los 9 años después de la primera operación, por lo que se realizó una segunda intervención con controles periódicos, hallándose a los 5 años nuevos implantes peritoneales.
En la literatura existen casos similares descritos, con una serie de factores comunes:
- –
Intervalo libre de enfermedad de años de duración (entre 1 y 10 años) antes de la recidiva2-4.
- –
La recurrencia fue invariablemente el peritoneo o el retroperitoneo3.
- –
Rotura de la integridad de la cápsula tumoral o manipulación de tumores friables en la cirugía inicial2,3,5,6.
- –
Gran tamaño de tumor primario (mediana de 6cm de diámetro)2,3,5,6.
En el feocromocitoma, dado un mayor riesgo de rotura y de friabilidad en tumores especialmente grandes, se ha de seleccionar cuidadosamente la idoneidad del abordaje laparoscópico ante el alto riesgo de recidiva que supone la rotura capsular2,3,6. En el caso actual, ya la primera recidiva con implantes subcapsulares hepáticos debería haber desaconsejado un segundo abordaje laparoscópico. La siembra secundaria a la pérdida de integridad capsular y bordes afectados es un factor determinante en la feocromocitomatosis peritoneal6.
Se ha descrito la inyección de 123I-MIBG preoperatoria para plantear la cirugía guiada por radioisótopos, con el objetivo de localizar implantes tumorales pequeños que no se han identificado en las pruebas radiológicas2. La cirugía citorreductora permite la exéresis completa de la enfermedad, única terapia definitiva por el momento8,9.
La siembra peritoneal durante el tratamiento quirúrgico del feocromocitoma puede originar cuadros de feocromocitomatosis funcional incluso años después de la cirugía original, por lo que el seguimiento debe prolongarse durante años ante el riesgo de diseminación de las células cromafines2-6. El abordaje laparoscópico, la pérdida de integridad capsular y los bordes afectados contribuyen a este cuadro3,5,6.
Ante nueva clínica compatible, se han de realizar controles radiológicos con TAC y gammagrafía con 123I-MIBG para lograr una detección precoz y prevenir el daño a largo plazo efectos de los altos niveles de catecolaminas circulantes1,2,4. La cirugía citorreductora peritoneal ofrece una opción quirúrgica radical ante estos pacientes9.
Conflicto de interesesLos autores confirman la ausencia de conflicto de intereses, así como la ausencia de financiación alguna para la realización de este caso.