La cirugía citorreductora seguida de quimioterapia intraperitoneal hipertérmica (HIPEC) se asocia frecuentemente a alteraciones de la hemostasia y a elevados requerimientos transfusionales perioperatorios. El propósito de este estudio fue analizar los trastornos hemostáticos asociados a cada una de las fases de este procedimiento terapéutico mediante tromboelastometría rotacional (ROTEM), niveles de fibrinógeno y recuento plaquetario, así como su posible relación con las necesidades transfusionales.
MétodosSe efectuó un estudio prospectivo longitudinal. Se registraron niveles de hemoglobina, recuento plaquetario, niveles de fibrinógeno y parámetros tromboelastométricos: tiempo de coagulación (CT), tiempo de formación del coágulo (CFT), firmeza máxima del coágulo (MCF), y ángulo α (EXTEM, INTEM, FIBTEM). Las mencionadas determinaciones se realizaron: antes del inicio de la cirugía; al finalizar la cirugía citorreductora y al concluir la HIPEC. Se utilizaron los test estadísticos apropiados. Los valores de p<0,05 se consideraron estadísticamente significativos.
ResultadosSe incluyó en el estudio a 41 mujeres con una mediana de edad de 54 años (rango: 34-76). Tras la cirugía citorreductora se observó una caída de la tasa de hemoglobina desde 11,4±1,5 a 10,6±1,6g/dl; un descenso del fibrinógeno sérico desde 269±69 hasta 230±48mg/dl (p<0,01) y una reducción de MCF en FIBTEM desde 20±10 hasta 16±8mm (p<0,01). La HIPEC no se asoció a alteraciones hemostáticas. Se observó una moderada relación negativa entre el número de concentrados de hematíes administrados y los niveles de fibrinógeno (ρ=−0,5; p=0,002) y los valores de MCF EXTEM (ρ=−0,43; p=0,006) registrados tras la HIPEC.
ConclusionesLas alteraciones hemostáticas observadas aparecen tras la cirugía citorreductora, probablemente a consecuencia de la hemorragia quirúrgica. Se requieren más estudios para confirmar una correlación entre las necesidades transfusionales y las pruebas de coagulación postoperatorias.
Cytoreductive surgery and hyperthermic intraperitoneal chemotherapy (HIPEC) is frequently associated with coagulation impairment and perioperative blood transfusion. Our aim was to investigate the impact of each procedure step on hemostasis, as measured by rotational thromboelastometry™ (ROTEM), fibrinogen level and platelet count as a primary outcome, along with its relationship with transfusion needs.
MethodsA prospective longitudinal study was performed. Hemoglobin level, fibrinogen level, platelet count and ROTEM parameters: clotting time (CT), clot formation time (CFT), maximum clot firmness (MCF), α-angle (EXTEM, INTEM, FIBTEM) were measured before the procedure, at the end of cytoreductive surgery and after HIPEC. Appropriate statistical tests were used for comparison. A P<.05 was considered as significant.
ResultsForty-one women, with median age 54 (range 34-76) were recruited. Cytoreductive surgery was followed by a reduction of hemoglobin level from 11,4±1,5g/dl to 10,6±1,6g/dl, a reduction of serum fibrinogen level from 269±69mg/dl to 230±48mg/dl (P<.01) and MCF decline from 20±10 to 16±8mm (P<.01), in the FIBTEM test. HIPEC was followed by no hemostatic impairment. The number of packed red blood cells administered during patients stay kept a mild significant relationship with both fibrinogen level (ρ = −0.5, P=.002), and MCF EXTEM values (ρ= -0.43, P=0.006), recorded after HIPEC.
ConclusionsThe mild observed hemostatic impairment appeared after cytoreductive surgery instead of HIPEC, involving surgical hemorrhage as the most likely responsible factor. Further studies are required to confirm a correlation between transfusion needs and postoperative hemostatic tests.
La cirugía citorreductora (CCR) con quimioterapia hipertérmica intraperitoneal (HIPEC) ha demostrado mejorar la supervivencia en pacientes seleccionados afectos de carcinomatosis peritoneal1,2. Esta modalidad de tratamiento se basa en la extirpación quirúrgica de toda neoplasia visible, seguida de la perfusión intraperitoneal de quimioterapia hipertérmica, con el fin de incrementar la actividad citotóxica, alcanzando altas concentraciones intraperitoneales con una absorción sistémica limitada3-5.
El 28% de los pacientes tratados mediante este procedimiento presentan complicaciones hematológicas1, sobre todo sangrado excesivo que es la causa del 18% de las reoperaciones. Hasta el 51% de los pacientes4 pueden necesitar ser transfundidos debido a las elevadas pérdidas sanguíneas intraoperatorias, provocadas por la cirugía y por la aparición de una coagulopatía perioperatoria atribuida a la pérdida de proteínas hacia la cavidad peritoneal, al elevado recambio de fluidos y posiblemente a la acción de la quimioterapia hipertérmica4.
Los cambios hemostáticos descritos consisten en un descenso de los niveles de antitrombina III y del recuento plaquetario, así como en alteraciones de las pruebas de coagulación habituales. Dichas pruebas analizan solamente la fase plasmática de la coagulación, mientras que los test viscoelásticos, como la tromboelastometría rotacional (ROTEM), reproducen mucho más fielmente el proceso fisiológico de la coagulación, guardan una buena correlación con el sangrado perioperatorio y facilitan un manejo adecuado de los pacientes6-11.
El propósito del presente estudio clínico es analizar las alteraciones de la hemostasia que puedan aparecer en cada una de las fases del procedimiento, mediante la determinación de niveles de fibrinógeno, recuento plaquetario y realización de ROTEM, así como investigar la posible relación entre dichas alteraciones hemostáticas y las necesidades transfusionales perioperatorias.
MétodosSe ha realizado un estudio prospectivo observacional en una muestra consecutiva de pacientes afectos de carcinomatosis peritoneal primaria o secundaria, que completaron la CCR y posterior HIPEC en un único centro hospitalario.
El cálculo del tamaño muestral se efectuó empleando los valores basales de la concentración de fibrinógeno sérico, cuya varianza fue calculada utilizando los 20 primeros casos. Considerando un nivel de confianza del 95% (a=0,05), una precisión del 7%, una proporción prevista del 50% y una proporción de pérdidas esperadas del 10%, una muestra de 41 pacientes fue considerada adecuada para la realización del estudio.
Todos los pacientes eran mayores de 18 años y otorgaron por escrito su consentimiento para ser incluidos, de manera anónima, en el presente estudio, el cual, dado su carácter puramente observacional, no requirió de la aprobación por el Comité Ético del hospital.
Previamente a la inducción anestésica, todos los pacientes recibieron 0,2mg de cloruro mórfico intratecal para control del dolor postoperatorio. La inducción de la anestesia se realizó con propofol 2-2,5mg/kg, fentanilo 3-5μg/kg y cisatracurio 0,2mg/kg. El mantenimiento anestésico consistió en sevofluorano 0,5-1 CAM, remifentanilo 0,25-0,3μg/kg/min y cisatracurio 1,2μg/kg/min. Durante el procedimiento quirúrgico se monitorizó la presión arterial invasiva, electrocardiograma, pulsioximetría, CO2 telespiratorio, temperatura esofágica y presión venosa central. La fluidoterapia consistió en la administración de Ringer lactato a 15ml/kg/h. La transfusión de concentrados de hematíes se consideró indicada con valores de hemoglobina <8g/dl. A fin de prevenir la aparición de trombosis venosa profunda, en miembros inferiores, se empleó un dispositivo de compresión secuencial, de modo que los pacientes no recibieron heparina durante las primeras 24 h del postoperatorio. Se mantuvo la normotermia durante la cirugía mediante el calentamiento de fluidos y la utilización de una manta térmica con circulación forzada de aire a 39°C.
Una vez terminada la CCR, en la fase de HIPEC, la cavidad abdominal se irrigó con una solución quimioterápica, consistente en cisplatino (75mg/m2) o paclitaxel (60mg/m2) en los pacientes portadores de neoplasias ováricas, o mitomicina C (20mg/m2) en los pacientes afectos de cáncer colorrectal. El quimioterápico elegido se diluyó en salino, a razón de 2 l/m2 de superficie corporal. La solución resultante se mantuvo a 41,5°C y se sometió a recirculación forzada durante 60-90min, empleando una bomba Stockert S-III Double Headed Pump System (Stöckert Instrumente GmbH, Snia, Italia). Treinta minutos antes de la fase HIPEC los pacientes recibieron metilprednisolona (1mg/kg), dextroclorfeniramina (2mg), ranitidina (50mg) y ondansetron (0,15mg/kg).
Todas las determinaciones analíticas realizadas a lo largo del estudio se efectuaron con muestras de sangre arterial, que se extrajeron antes de comenzar la cirugía (fase 1); tras finalizar la CCR (fase 2) y 30min después de terminar la HIPEC (fase 3). Simultáneamente se anotó la temperatura esofágica existente en el momento de la extracción de cada muestra de sangre.
Cada muestra fue procesada para obtener pH, calcemia, niveles de hemoglobina, hematocrito, recuento plaquetario, niveles de fibrinógeno y ROTEM. La ROTEM se realizó con un único aparato (ROTEM™ Gamma: Thromboelastometer unit TEM-International GmbH, Munich 81829, Alemania), siempre por el mismo investigador y en los primeros 10min tras la extracción de la sangre. Cada muestra fue estudiada mediante los test INTEM™, EXTEM™ y FIBTEM™. Todos ellos se programaron para una duración de 45min y se realizaron con las cubetas y los reactivos específicos proporcionados por ROTEM™, siguiendo las instrucciones detalladas por el fabricante. En los test INTEM y EXTEM se registraron los siguientes parámetros: tiempo de coagulación (CT), tiempo de formación del coágulo (CFT), ángulo alfa (α) y firmeza máxima del coágulo (MCF). En el test FIBTEM sólo se recogió la MCF.
El estudio estadístico se realizó mediante el análisis de la varianza para medidas repetidas (ANOVA), empleando la corrección de Bonferroni para realizar las comparaciones post-hoc. Previamente se comprobó la presencia de una distribución normal, mediante la prueba de Kolmogorov-Smirnov y la igualdad de las varianzas de las diferencias entre todas las parejas posibles, mediante la prueba de esfericidad de Mauchly. Se utilizó el coeficiente de correlación de Spearman como medida de asociación entre el número de concentrados de hematíes trasfundidos, a lo largo de la estancia hospitalaria, y los datos analíticos medidos tras finalizar la intervención (niveles de fibrinógeno plasmático y MCF.
El análisis estadístico se efectuó empleando el programa SPSS statistical software, versión 22.0 (SPSS Inc., Chicago, IL, EE. UU.), considerándose significativos aquellos valores de p < 0,05. Las variables cuantitativas fueron expresadas como media±DE, o como mediana y rango, y las variables categóricas como número de pacientes y porcentaje.
ResultadosSe incluyó a 41 pacientes, mujeres de raza blanca, con edades comprendidas entre 34 y 76 años (mediana: 54 años). La neoplasia primaria fue de localización ovárica en 31 pacientes (75,6%), colorrectal en 7 pacientes (17,1%) y 3 pacientes (7,3%) presentaban un pseudomixoma peritoneal.
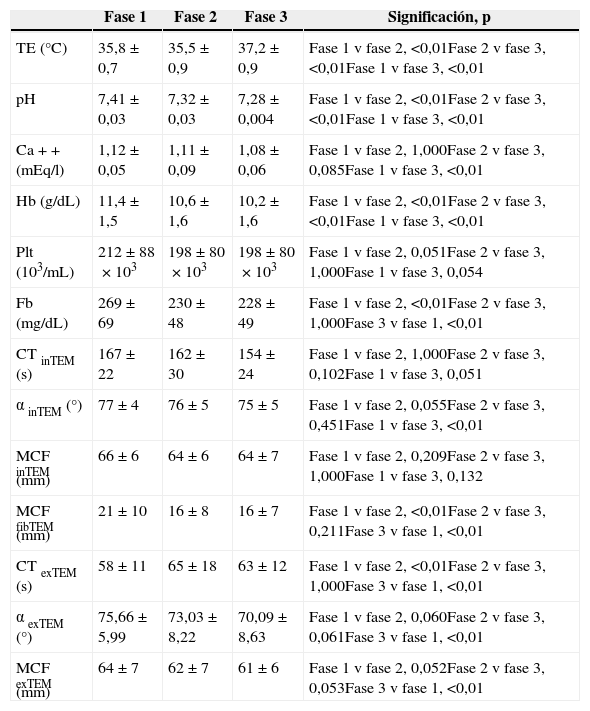
El índice de carcinomatosis peritoneal fue de 12,9±9 y la duración media del procedimiento quirúrgico fue de 336±86min (rango: 180-550min). El aclaramiento de creatinina preoperatorio fue 107,61±39ml/min, mientras que la actividad de protrombina preoperatoria fue del 89%, como mediana, con un rango de 62-100%. Los cambios experimentados en los parámetros analizados se muestran detallados en la tabla 1.
Resumen de los resultados
| Fase 1 | Fase 2 | Fase 3 | Significación, p | |
|---|---|---|---|---|
| TE (°C) | 35,8±0,7 | 35,5±0,9 | 37,2±0,9 | Fase 1 v fase 2, <0,01Fase 2 v fase 3, <0,01Fase 1 v fase 3, <0,01 |
| pH | 7,41±0,03 | 7,32±0,03 | 7,28±0,004 | Fase 1 v fase 2, <0,01Fase 2 v fase 3, <0,01Fase 1 v fase 3, <0,01 |
| Ca++ (mEq/l) | 1,12±0,05 | 1,11±0,09 | 1,08±0,06 | Fase 1 v fase 2, 1,000Fase 2 v fase 3, 0,085Fase 1 v fase 3, <0,01 |
| Hb (g/dL) | 11,4±1,5 | 10,6±1,6 | 10,2±1,6 | Fase 1 v fase 2, <0,01Fase 2 v fase 3, <0,01Fase 1 v fase 3, <0,01 |
| Plt (103/mL) | 212±88×103 | 198±80×103 | 198±80×103 | Fase 1 v fase 2, 0,051Fase 2 v fase 3, 1,000Fase 1 v fase 3, 0,054 |
| Fb (mg/dL) | 269±69 | 230±48 | 228±49 | Fase 1 v fase 2, <0,01Fase 2 v fase 3, 1,000Fase 3 v fase 1, <0,01 |
| CT inTEM (s) | 167±22 | 162±30 | 154±24 | Fase 1 v fase 2, 1,000Fase 2 v fase 3, 0,102Fase 1 v fase 3, 0,051 |
| α inTEM (°) | 77±4 | 76±5 | 75±5 | Fase 1 v fase 2, 0,055Fase 2 v fase 3, 0,451Fase 1 v fase 3, <0,01 |
| MCF inTEM (mm) | 66±6 | 64±6 | 64±7 | Fase 1 v fase 2, 0,209Fase 2 v fase 3, 1,000Fase 1 v fase 3, 0,132 |
| MCF fibTEM (mm) | 21±10 | 16±8 | 16±7 | Fase 1 v fase 2, <0,01Fase 2 v fase 3, 0,211Fase 3 v fase 1, <0,01 |
| CT exTEM (s) | 58±11 | 65±18 | 63±12 | Fase 1 v fase 2, <0,01Fase 2 v fase 3, 1,000Fase 3 v fase 1, <0,01 |
| α exTEM (°) | 75,66±5,99 | 73,03±8,22 | 70,09±8,63 | Fase 1 v fase 2, 0,060Fase 2 v fase 3, 0,061Fase 3 v fase 1, <0,01 |
| MCF exTEM (mm) | 64±7 | 62±7 | 61±6 | Fase 1 v fase 2, 0,052Fase 2 v fase 3, 0,053Fase 3 v fase 1, <0,01 |
α exTEM (°): ángulo alfa (en grados), medido en el test EXTEM; α inTEM (°): ángulo alfa (en grados), medido en el test INTEM; Ca++: calcemia en sangre arterial; CT exTEM (s): tiempo de coagulación, en segundos, medido en el test EXTEM; CT inTEM (s): tiempo de coagulación, en segundos, medido en el test INTEM; Fb (mg/dL): concentración de fibrinógeno en miligramos por decilitro; Hb (g/dL): tasa de hemoglobina en gramos por decilitro; MCF exTEM (mm): firmeza máxima del coágulo (enmm), medida en el test EXTEM; MCF fibTEM (mm): firmeza máxima del coágulo (enmm), medida en el test FIBTEM; MCF inTEM (mm): firmeza máxima del coágulo (enmm), medida en el test INTEM; Plt (103/mL): recuento plaquetario en millares por mililitro; TE: temperatura esofágica.
Todas las variables reflejadas en la tabla siguen una distribución normal y fueron estudiadas mediante el análisis de la varianza para medidas repetidas.
La CCR (tabla 1: comparación fase 1 vs. fase 2) se acompañó de una elevación significativa de la temperatura esofágica (p<0,01); descenso significativo del pH arterial (p<0,01); caída de los niveles de hemoglobina (p<0,01); reducción de la concentración de fibrinógeno sérico (p<0,01); disminución de la MCF alcanzada en el test FIBTEM (p<0,01) y prolongación del CT en el test EXTEM (p<0,01).
La HIPEC (tabla 1: comparación fase 2 vs. fase 3) se siguió de una elevación de la temperatura esofágica (p<0,01); descenso del pH arterial (p<0,01) y caída de la tasa de hemoglobina desde 10,6±1,6g/dl hasta 10,2±1,6g/dl (p<0,01). No se modificaron el recuento plaquetario, el fibrinógeno ni los parámetros tromboelastométricos.
Durante el acto quirúrgico, no se administraron concentrados de hematíes, plaquetas ni otros hemoderivados. Todos los pacientes permanecieron en la unidad de cuidados postoperatorios durante 24h, siendo la estancia media hospitalaria de 6,8±2,7 días. Ningún paciente falleció durante los 30 días siguientes a la cirugía.
Durante su estancia hospitalaria, 9 pacientes (21,9%) recibieron concentrados de hematíes, con una mediana de 2 unidades (rango: 1-3). Se observó una correlación negativa moderada entre el número de concentrados de hematíes administrados durante la estancia y los niveles de fibrinógeno en la fase 3 (n=35; ρ=−0,5; p=0,002). Igualmente, se encontró una correlación negativa débil entre el número de concentrados de hematíes recibidos y los valores de MCF EXTEM recogidos en la fase 3 (n=39; ρ=−0,43; p=0,006). Los niveles de hemoglobina en el momento del alta domiciliaria fueron 9,8±1,3g/dl.
DiscusiónLa CCR con HIPEC se ha asociado con sangrado perioperatorio profuso, el cual se ha atribuido a la agresividad del procedimiento y a un deterioro de la hemostasia, posiblemente relacionado con el gran intercambio de fluidos, la pérdida de proteínas a la cavidad peritoneal y el impacto de la quimioterapia hipertérmica4.
Hasta ahora, los cambios hemostáticos inducidos por este procedimiento terapéutico se han caracterizado utilizando pruebas de coagulación realizadas en el laboratorio, las cuales no fueron desarrolladas para su empleo en el periodo perioperatorio9. En cambio, los test viscoelásticos, como la ROTEM, reproducen más fielmente el proceso fisiológico de la coagulación, guardando una buena correlación con el sangrado perioperatorio6-11.
Cuando se comparan los datos obtenidos en situación basal con los obtenidos tras acabar la CCR se evidencia que, aunque permanecen dentro de los límites normales, tanto los niveles de fibrinógeno como los valores de MCF FIBTEM descienden de manera estadísticamente significativa. Este hallazgo parece una consecuencia inespecífica de la agresión quirúrgica y concuerda con estudios previos, en los cuales el fibrinógeno fue el primer factor de la coagulación que alcanzaba niveles críticos durante un sangrado progresivo, como ocurre durante el trauma quirúrgico12, siendo el deterioro de MCF FIBTEM una consecuencia de la disminución de la tasa de fibrinógeno plasmático o de un deterioro de su funcionalidad7,9.
En el presente estudio el deterioro de la hemostasia parece menor que el descrito de forma previa1,4, probablemente a consecuencia del refinamiento del procedimiento terapéutico13. Dicho deterioro no parece clínicamente relevante, si bien los resultados apuntan a una relación entre las necesidades transfusionales y los niveles de fibrinógeno y MCF EXTEM recogidos en la fase 3, hallazgo que concuerda con lo descrito en otros estudios12.
En el presente estudio, la HIPEC no se sigue de alteraciones hemostáticas, lo cual contrasta con estudios previos, que la consideran uno de los responsables potenciales del deterioro de la hemostasia4, si bien es cierto que dichos estudios no han intentado, tal como se pretende en el presente trabajo, estudiar separadamente el impacto sobre la hemostasia de la CCR y de la HIPEC.
En este estudio, la HIPEC se asoció a un leve descenso de la tasa de hemoglobina, que creemos que no había sido descrito previamente. No parece explicarse por pérdidas hemáticas, puesto que durante esta fase del procedimiento no hubo sangrado visible; tampoco parece probable que se deba a hemodilución, puesto que el ritmo de infusión de líquidos se mantuvo constante a lo largo de todo el procedimiento y, además, la duración de la HIPEC es considerablemente menor que la de la CCR. Podría deberse a hemólisis, inducida por la quimioterapia intraoperatoria14 o por la hipertermia.
En los pacientes tratados mediante HIPEC la temperatura esofágica se mantuvo por debajo de los 39°C, pero la temperatura alcanzada y mantenida dentro de la cavidad peritoneal está en el rango del llamado «máximo térmico humano», de modo que el lecho vascular esplácnico puede sufrir el mismo daño térmico descrito en los pacientes que experimentan un golpe de calor15-17. Desgraciadamente, no se realizaron frotis de sangre periférica en busca de esquistocitos ni determinaciones de hemoglobina libre, datos que de haber sido positivos habrían apoyado esta hipótesis.
El presente trabajo tiene varias limitaciones: en primer lugar solo se han estudiado los cambios intraoperatorios; en segundo lugar no se ha podido determinar la influencia del sexo como variable y, en tercer lugar, la administración de esteroides puede tener influencia en la hemostasia18, la cual, en el presente estudio, parece haber sido nula, puesto que los trastornos hemostáticos aparecen al final de la citorreducción, es decir antes de la administración de los esteroides. Cabe preguntarse si, a pesar de su levedad, dichas alteraciones hemostáticas deberían ser tratadas precozmente, con el ánimo de reducir las necesidades transfusionales de estos pacientes. Desgraciadamente el tamaño muestral del presente estudio no permite la identificación de un umbral de niveles plasmáticos de fibrinógeno o de MCF FIBTEM por debajo del cual la administración de concentrado de fibrinógeno conseguiría una reducción de las necesidades transfusionales, tal como se ha demostrado en otras situaciones clínicas19.
En resumen, el tratamiento de la carcinomatosis peritoneal mediante CCR seguida de HIPEC se acompaña de una reducción del fibrinógeno sérico y deterioro de los parámetros ROTEM, fundamentalmente MCF FIBTEM. Dichas alteraciones son leves y con una relevancia clínica limitada, aparecen tras la CCR y podrían ser una consecuencia de ella. Se requieren más estudios para confirmar una correlación entre las necesidades transfusionales y las pruebas de coagulación postoperatorias en este subgrupo de pacientes.
Conflicto de interesesNinguno declarado.
Una parte de este trabajo fue aceptada como comunicación, en el congreso anual de la Sociedad Americana de Anestesia, ASA Annual Meeting 2011, celebrado en Chicago (EE. UU.) en octubre de 2011.