La eficacia de la terapia de resincronización (RSC) en pacientes con insuficiencia cardíaca avanzada y asincronismo sistólico está ampliamente demostrada, aun cuando sus resultados se ven limitados por la variabilidad anatómica del sistema venoso coronario, el cual no siempre permite una adecuada colocación del electrodo ventricular izquierdo (VI). El asincronismo ventricular agudo es un factor de mal pronóstico que está presente en un considerable número de pacientes con indicación de cirugía cardíaca y disfunción sistólica.
La cirugía con circulación extracorpórea (CEC) proporciona el escenario adecuado para implantar el electrodo epicárdico en la base de la pared libre del VI, permitiendo realizar una RSC epicárdica completa concomitante, diferida o profiláctica.
En la mayoría de los casos de cardiopatía isquémica con asincronismo del VI, la revascularización (RVC) miocárdica ni revierte el asincronismo ni mejora la función sistólica. Tras la cirugía, la indicación de RSC se mantiene en la mayoría de los casos. La implantación epicárdica del sistema de RSC asociada a la RVC miocárdica facilita el manejo del paciente en el postoperatorio inmediato, mejora de forma significativa la función sistólica del VI y aumenta la supervivencia.
La insuficiencia mitral funcional (IMF) del ventrículo dilatado puede precisar de un enfoque terapéutico múltiple por su frecuente asociación con el asincronismo papilar y que incluye RVC miocárdica, reparación mitral, RSC e incluso remodelado ventricular.
La insuficiencia mitral funcional isquémica moderada sometida a RVC miocárdica solo mejora en los casos con presencia de miocardio viable y ausencia de asincronismo papilar. La determinación preoperatoria de estos hallazgos indica que la RVC puede tener que acompañarse de RSC para restablecer el sincronismo interpapilar.
La indicación de RSC asociada a la cirugía de la cardiopatía isquémica ha demostrado ser una estrategia quirúrgica de probada eficacia y durabilidad. El implante de electrodos epicárdicos de forma concomitante debe realizarse cuando existe indicación de RSC o de un upgrading.
The efficacy of cardiac resynchronization therapy (CRT) in patients with advanced heart failure and systolic dyssynchrony is clearly established, although its beneficial effects are in part limited by the anatomical variability of the coronary venous system, which does not always allow placement of the left ventricular (LV) lead at the adequate site. Ventricular dyssynchrony, a factor of poor prognosis, is present in a significant number of cases with systolic dysfunction and indication for cardiac surgery.
Surgery under cardiopulmonary bypass (CPB) offers the suitable scenario for epicardial placement of the electrode on the base of the LV free wall. Furthermore, it allows a complete concomitant epicardial CRT or a prophylactic implant for a deferred procedure.
In the majority of patients with ischemic heart failure and LV dyssynchrony, coronary artery bypass grafting (CABG) neither eliminates dyssynchrony nor improves systolic function. Besides, in a remarkable percentage of patients, it is maintained as the indication for CRT after surgery.
Ischemic functional mitral regurgitation (FMR) may require a multiple therapeutic approach due to the frequent association with dyssynchrony between the papillary muscles: CABG, mitral repair, CRT and LV remodeling.
In moderate ischemic FMR submitted to isolated CABG, improvement of FMR has been achieved only in cases with presence of viable myocardium and absence of dyssynchrony. Preoperative identification of these factors implies that the recovery of viable myocardium by means of CABG may need the aid of CRT to re-establish synchronized contraction of the papillary muscles. Concurrent implantation of epicardial leads during CPB surgery facilitates patient management in the early postoperative period, improves LV systolic function, and decreases the mortality rate.
Surgeons should be encouraged to implant ventricular epicardial leads during cardiac surgery when the indications for upgrading or CRT are present.
La eficacia de la RSC ventricular en pacientes con fallo cardíaco avanzado y asincronismo ventricular ha quedado claramente establecida1,2. Sin embargo, el beneficio de la RSC por vía percutánea ve limitada su eficacia por ciertos aspectos técnicos relacionados con el implante del electrodo izquierdo y la variabilidad anatómica del sistema venoso. El estudio CARE-HF3 ha puesto de manifiesto que el fracaso en el primer implante oscila entre el 10 y el 18%, y que una correcta colocación del electrodo del VI en la posición posterobasal/lateral solo se consigue en un 88% de los casos. Además, eventos adversos como el desanclaje del electrodo, la perforación o disección del seno coronario y la estimulación frénica tienen una incidencia cercana al 15%3. Por otro lado, el implante del electrodo epicárdico de rescate, mínimamente invasivo mediante videotoracoscopia, en pacientes con RVC previa, se ve dificultado por las adherencias pericárdicas, existiendo además el riesgo de dañar los injertos permeables.
El asincronismo sistólico está presente en un número considerable de pacientes con fallo cardíaco avanzado e indicación de RVC, alcanzando hasta un 15% de casos con RSC asociada4. Un estudio multicéntrico reciente5 ha mostrado que un porcentaje muy significativo de casos, hasta un 76%, mantiene la indicación de RSC tras la cirugía de la cardiopatía isquémica.
La cirugía con CEC proporciona un escenario óptimo para el implante epicárdico por la accesibilidad que ofrecen todas las cámaras cardíacas, especialmente la base de la pared libre del VI.
La resincronización concomitante es la que se realiza de modo completo, mediante implante de electrodos epicárdicos durante el acto operatorio; mientras que la RSC diferida, si persiste el asincronismo poscirugía, se lleva a cabo durante la estancia postoperatoria o dentro de los seis primeros meses de la cirugía, empleando el electrodo epicárdico del VI previamente implantado.
La estrategia de combinar-unificar en una sola intervención al menos dos procedimientos permite eliminar riesgos potenciales asociados al implante transvenoso, mantener el porcentaje de respondedores con escasas complicaciones, minimizar la radiación, evitar el impacto de un tedioso procedimiento sobre el paciente y, además, reducir costes adicionales5,6. Este concepto multidisciplinar ha quedado plasmado en las Guidelines for cardiac pacing and cardiac resynchronization therapy7.
Estudios clínicos recientes4,5,8–10, algunos de ellos cruzados, en pacientes con asincronismo ventricular y baja fracción de eyección de ventrículo izquierdo (FEVI) sometidos a RVC, cirugía de la insuficiencia mitral isquémica o remodelado ventricular, han mostrado mejoría clínica adicional e incremento significativo de la FEVI cuando se asocia con RSC epicárdica. Dicha mejoría se mantiene a lo largo del seguimiento, habiéndose verificado tanto en la RSC concomitante como en la diferida. Esta forma de instaurar la RSC, univentricular izquierda o biventricular (BiV) es factible de forma convencional, ya sea durante el postoperatorio en la unidad de cuidados críticos postoperatorios, durante la convalecencia hospitalaria o tras el alta hospitalaria, si se constata la persistencia de asincronismo en presencia de FEVI disminuida.
El objetivo ideal de la cirugía de la cardiopatía isquémica con RSC asociada se enmarca dentro del tratamiento quirúrgico integral de la miocardiopatía dilatada: restaurar la perfusión miocárdica mediante la RVC, corregir la insuficiencia valvular, restaurar la geometría ventricular y reestablecer el sincronismo ventricular (Tabla I).
El presente trabajo pretende sintetizar el contenido del tema expuesto en el curso de residentes organizado por la Sociedad Española de Cirugía Torácica-Cardiovascular (SECTCV) en Santiago de Compostela 2011.
Identificación Preoperatoria de Candidatos a Implante de Electrodo Epicárdico en Ventrículo IzquierdoPara establecer la indicación de RSC existen unos criterios básicos: FEVI < 35%, QRS > 120ms, evidencia de asincronismo con Doppler tisular, basado en al menos uno de los siguientes parámetros en ausencia de necrosis transmural significativa: retraso del periodo preeyectivo aórtico > 140ms, retraso mecánico interventricular y retraso de activación pared posterolateral del VI > 60ms (asincronismo interpapilar) (Tabla II).
Criterios DE selección para implante de electrodo epicárdico EN VI
| FEVI < 35% |
Datos de asincronismo:
|
| Ausencia de extensa necrosis transmural |
Adaptado de Vardas, et al.7.
Sin embargo, existe suficiente evidencia que demuestra que el QRS ancho (> 120ms) no siempre conlleva asincronismo mecánico11. Más aún, pacientes con QRS normal han mostrado tener asincronismo mecánico significativo por ecocardiografía12, por lo que estos casos también podrían beneficiarse de la RSC asociada. Por otro lado, se ha observado que el acortamiento del QRS durante la RSC temporal postoperatoria no siempre conlleva mejoría del gasto cardíaco (GC)13. Además, el restablecimiento del flujo coronario tras una RVC completa parece posibilitar una mejor respuesta cuando va asociado a la RSC4. Igualmente, se ha objetivado que la estimulación del VI incrementa la velocidad del flujo en la arteria circunfleja y la descendente anterior14, en contraposición a la del ventrículo derecho (VD), que lo enlentece por activación temprana del septum, el cual genera asincronismo, induciendo un aumento de las resistencias al flujo coronario sistólico15. Otra ventaja adicional asociada al implante epicárdico en el VI es aplicable a los pacientes con estimulación del VD, que podrían beneficiarse del upgrading mediante la estimulación BiV o VI, aboliendo así el efecto deletéreo de la estimulación del VD tanto aguda16,17 como crónica18.
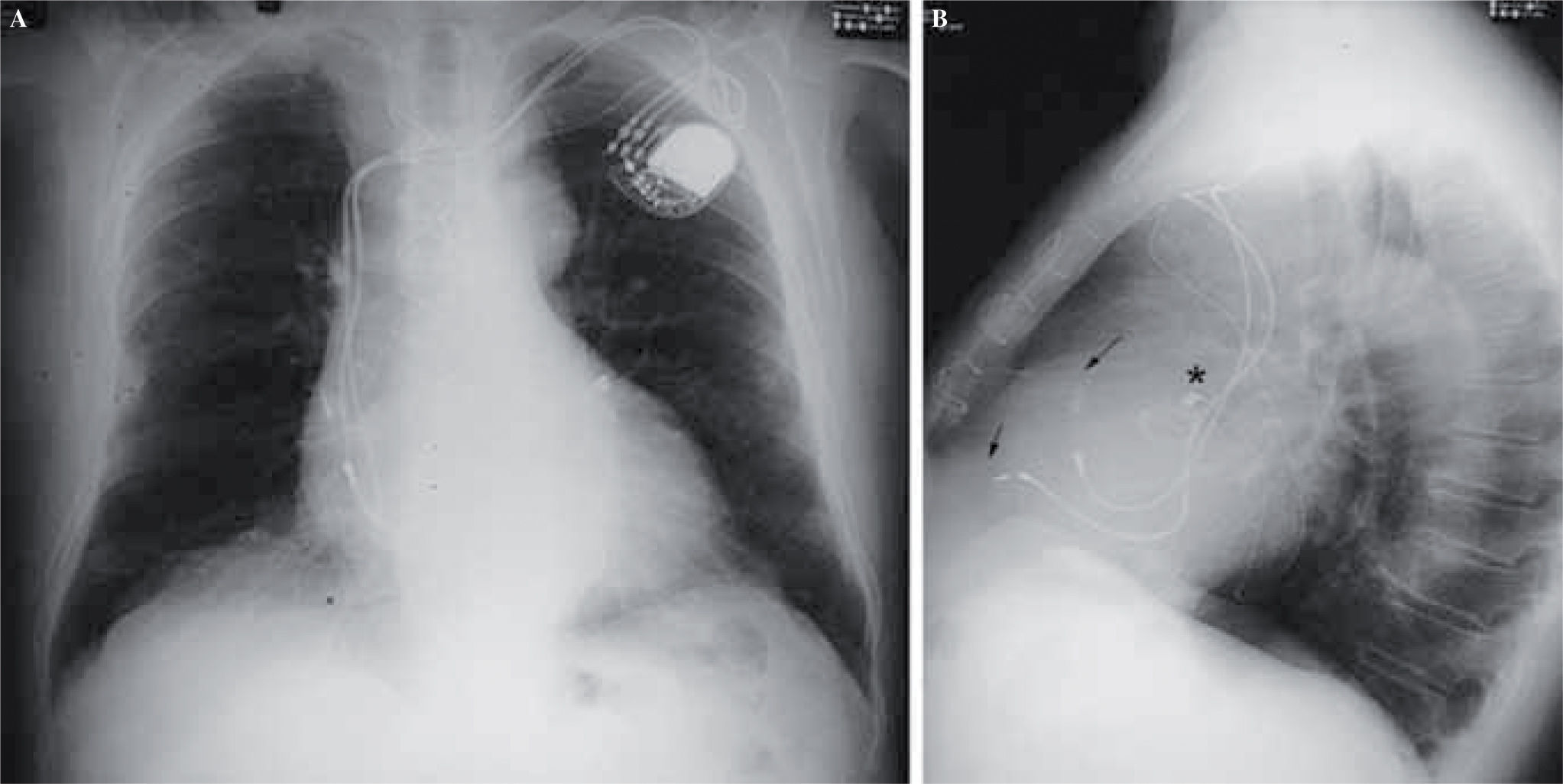
Consideraciones TécnicasTras completar el procedimiento quirúrgico con CEC y durante la reperfusión se implantan los electrodos temporales en la base del VI, cara diafragmática o paraseptal del VD y en la aurícula derecha (AD) alta, debiéndose verificar la adecuada captura del marcapasos temporal, con razonables umbrales y ausencia de estimulación frénica para la utilización postoperatoria. Durante la desconexión del sistema extracorpóreo, se inicia la estimulación con las distintas configuraciones previamente descritas en el curso de residentes17 y observando los cambios en el GC y la presión arterial media (PAM), se ajustan los parámetros de frecuencia cardíaca, retrasos aurícula-ventrículo (A-V) e interventricular (V-V). Este procedimiento suele ser útil para extrapolar los parámetros optimizados al dispositivo permanente. El electrodo epicárdico permanente del VI, casi siempre del tipo sin suturas, se implanta en la zona posterobasal libre de grasa o fibrosis, entre las arterias marginal y circunfleja. Es aconsejable implantarlo antes de que el ventrículo esté eyeccionando con presión, para evitar maniobras que generen inestabilidad hemodinámica. El sistema de RSC permanente univentricular izquierdo se completa implantando el electrodo auricular, si es posible cerca de la zona del nódulo sinusal. Finalmente, si se desea estimulación BiV se implanta el electrodo en el VD, preferentemente cercano al tabique interventricular. Se comprueban los parámetros de estimulación y la captura, idealmente con umbrales en el VI no superiores a 1,5 volts a 0,5ms para garantizar la durabilidad del dispositivo y evitar la estimulación frénica. La parte distal de los electrodos es extraída de la cavidad pericárdica de forma redundante a una bolsa creada detrás del recto anterior del abdomen, siendo fijados al músculo para evitar el desplazamiento del generador. De nuevo se adecúan los parámetros de estimulación monitorizando el GC y la PAM, y se analiza el restablecimiento del sincronismo mediante ecocardiografía transesofágica. En el caso de la RSC diferida, el electrodo del VI se exterioriza tunelizándose hasta una bolsa submuscular en la región retropectoral izquierda para facilitar la conexión del mismo y la de los electrodos endovenosos derechos al generador tricameral (Fig. 1).
Resultados de la Resincronización Asociada Concomitante o DiferidaA medida que se fue demostrando la capacidad de mejorar la función sistólica del VI, restableciendo la secuencia alterada de activación ventricular eléctrica y mecánica, mediante estimulación del VI o BiV (multisitio), surgió la idea de aplicarlo en el ámbito de la cirugía cardíaca en los casos con miocardiopatía y asincronismo.
Para ello es necesario realizar un adecuado implante del electrodo epicárdico en la base de la pared libre del VI, en función de los umbrales de estimulación y reversión del asincronismo. Sin embargo, el escenario poscirugía extracorpórea, con sus múltiples y variables etapas, convierte este objetivo hemodinámico en algo mucho más complejo que el de la RSC sin cirugía cardíaca.
Es necesario matizar que a pesar de la creciente tendencia a la estimulación BiV, el reciente estudio B-LEFT HF18, doble ciego, aleatorizado y multicéntrico, que compara la RSC BiV versus VI aislada, determinando la dP/dt máx, establece que la segunda alternativa puede considerarse válida siempre que se consiga la fusión de la conducción intrínseca con la onda de estimulación del VI, mediante la adecuación del retraso A-V. Este supuesto, en casos con intervalo PR normal, permite la estimulación AD-VI en triggered ya reportada con anterioridad por Van Gelder, et al.19 y Kurzidim, et al.20, debiendo ser tomado muy en cuenta por su mayor simplicidad y menor coste.
Tanaka, et al.21, en el año 2003, reportan su experiencia clínica en cuatro casos de etiología isquémica, tres de ellos con BRIHH, sometidos a RVC miocárdica y plastia enoventricular de Dor con RSC concomitante en configuración BiV bipolar. Todos los casos sobrevivieron a la intervención con la ayuda de la RSC, tras incrementarse la PAM en un 11%, constatando además el restablecimiento del sincronismo ventricular.
Sin embargo, son De Teresa, et al.22 los que reportan por primera vez la estimulación permanente doble cámara epicárdica en configuración AD-VI en un reemplazo valvular aórtico con BRIHH, objetivando una mejoría del 25% de la FEVI mediante angiografía isotópica, acompañada de un estrechamiento significativo del QRS. Desgraciadamente, este pionero e importante hito en el campo de la cirugía cardíaca con RSC concomitante es virtualmente desconocido.
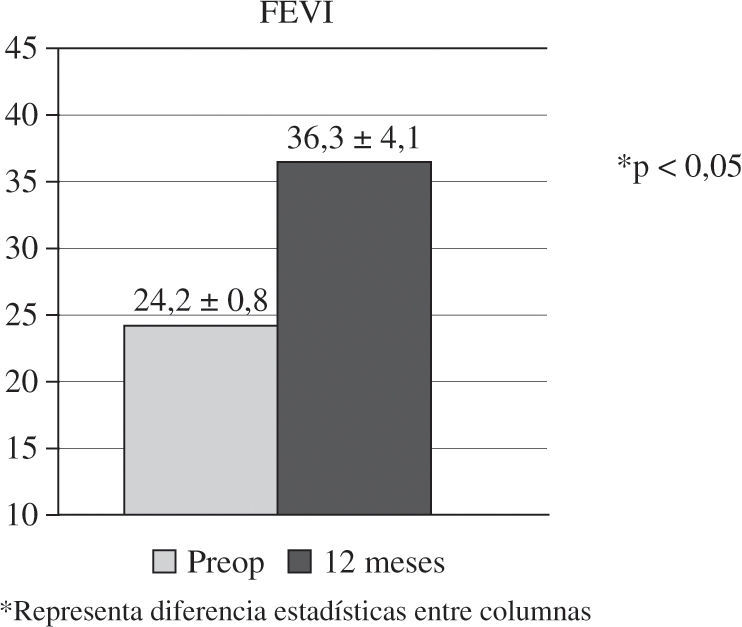
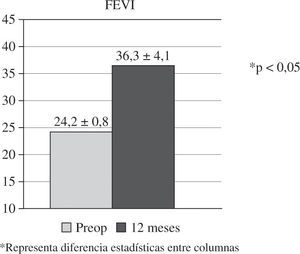
La experiencia de nuestro grupo en RSC ventricular combinada-asociada a cirugía cardíaca convencional coronaria o valvular, en pacientes con miocardiopatía dilatada, incluye un total de 18 casos intervenidos entre 2002 y 2007 (Tabla III)23. Todos los casos presentaban grave disfunción sistólica (FEVI 24,2±0,8%), asincronismo ventricular confirmado por ecocardiografía, electrocardiograma (ECG) con complejo QRS ancho (>130ms) y BRIHH, ausencia de necrosis transmural extensa y cumplían los criterios de indicación de RSC ya expuestos. La cirugía se realizó siempre con CEC, pinzamiento aórtico y protección miocárdica con cardioplegia hemática. En todos los casos se implantó el electrodo epicárdico VI sin suturas (Myopore, Biotronik, Berlín, Alemania) en la base de la pared libre tras la desconexión de la CEC, comprobándose ecocardiográficamente el acompañamiento septo-pared libre y obteniendo umbrales satisfactorios (1,28±0,8 V a 0,5ms) sin eventos adversos. En los pacientes con ritmo sinusal se implantó un electrodo auricular endocárdico en el postoperatorio. En cuanto al modo de estimulación ventricular, se realizó univentricular izquierda en 15 casos y BiV en tres. No existieron muertes operatorias ni hospitalarias, si bien dos casos precisaron balón de contrapulsación para la desconexión de CEC. Los umbrales, transcurrido un año, fueron de 1,36±0,6 V a 0,5ms, sin apreciar ningún caso de bloqueo de captura. El seguimiento clínico promedio fue de 37 meses (rango de 84–25) y completo. Se observaron tres muertes tardías, dos de causa cardíaca y un caso de reconversión a implante de desfibrilador. Se observó una mejoría de la clase funcional mantenida en el tiempo (3,2±0,6 preoperatoria vs 2,3±0,4 postoperatoria). En todos los casos se constató reversión, al menos parcial, del asincronismo ventricular por ecocardiografía, apreciándose una mejoría sustancial de la FEVI (p<0,05) (Fig. 2).
Características clínicas de los pacientes con RSC combinada/asociada a cirugía cardíaca
| Pacientes (n) | 18 |
| Varones/mujeres | 10/8 |
| Edad (años) | 72,8±8,4 |
| Clase funcional (NYHA) | |
| – III | 14 |
| – IV | 4 |
| FEVI (%) | 24,2±0,8 |
| Fibrilación auricular (n) (%) | 6 (33%) |
| Etiología miocardiopatía | |
| – Idiopática (n) | 3 |
| – Valvular (n) | 11 |
| – Isquémica (n) | 4 |
| Procedimiento realizado | |
| – Cirugía mitral aislada (n) | 5 |
| – Cirugía aórtica aislada (n) | 4 |
| – Cirugía polivalvular (n) | 5 |
| – Cirugía mitral + coronaria (n) | 3 |
| – Cirugía coronaria aislada (n) | 1 |
NYHA: New York Heart Association.
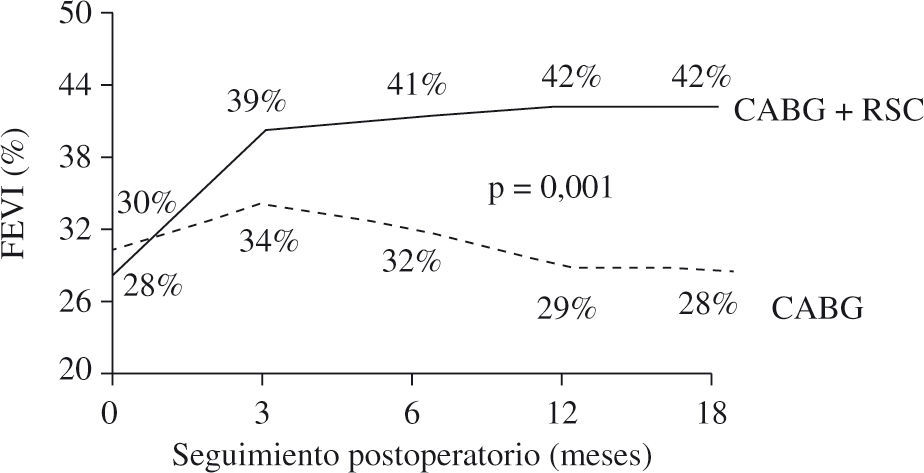
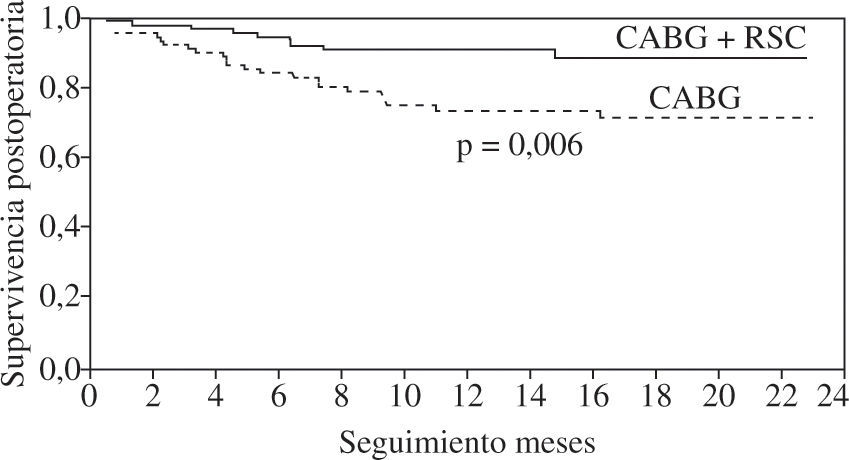
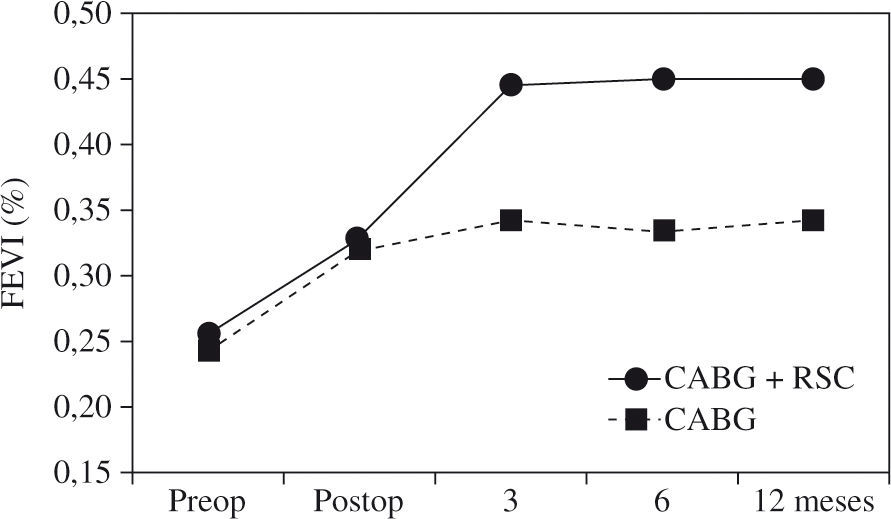
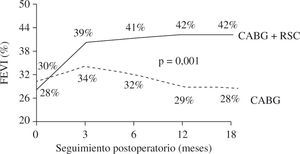
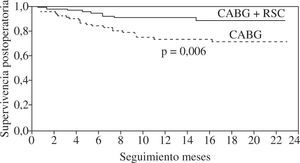
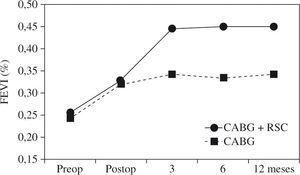
La presencia de asincronismo VI pre- o post-RVC miocárdica se asocia a una elevada mortalidad, tanto hospitalaria como tardía, por lo que debe considerarse la RSC asociada22. Aproximadamente una tercera parte de los pacientes sometidos a RVC miocárdica son diagnosticados de asincronismo VI, el cual casi siempre persiste a pesar de una adecuada RVC8. Igualmente, se ha constatado el efecto beneficioso de la RSC epicárdica completa4,8, asociada a la cirugía de RVC, incluso desde el postoperatorio precoz, poniéndose de manifiesto, además, que la abolición de la isquemia en presencia de asincronismo grave no mejora de forma estable la función del VI mientras no se restablezca el sincronismo. El estudio de Goscinska, et al.4, y también los de Pokushalov y Romanov8,25, estos últimos prospectivos, aleatorizados y doble ciego, en 178 pacientes consecutivos, comparan la RVC aislada con la asociada a RSC. Los estudios han mostrado que el grupo con RSC asociada mejora la FEVI de forma significativa y progresiva, desde el tercer mes poscirugía hasta el final de la evaluación (18 meses), mientras que el grupo sin RSC asociada obtiene una ligera mejoría durante los tres primeros meses, para posteriormente y a lo largo del seguimiento ir decayendo hasta retornar a la FEVI basal (Fig. 3). Es precisamente este dato adverso el que le concede, y de forma significativa, una mayor supervivencia al grupo de RVC con RSC asociada (Fig. 4). Este hecho tan relevante, de una ulterior mejoría significativa de la FEVI, es similar al reportado anteriormente por Tesler, et al.9 (Fig. 5).
Barosi, et al.5, en un estudio multicéntrico reciente, han analizado el porcentaje de casos que mantienen la indicación de RSC tras la cirugía y la eficacia de la RSC en los casos subsecuentemente tratados. La indicación de RSC se confirmó en el primer mes poscirugía en un 63% de casos y en un 71% durante los seis primeros meses. La evaluación de la respuesta clínica a un año mostró un 63% de respondedores en el primer grupo y un 80% en el segundo. Estos resultados demuestran que un importante número de casos de cardiopatía isquémica (76%) continúan con el asincronismo y mantienen la indicación de RSC. La importante conclusión de este estudio es que la cirugía asociada a la RSC supone un estrategia de eficacia probada, manteniéndose en el tiempo, como se demuestra por el remodelado ventricular de los respondedores.
Una limitación de este estudio es su no aleatorización, la cual impide discriminar completamente el beneficio intrínseco de la cirugía del de la RSC, aun cuando la ausencia de un remodelado ventricular significativo, en los casos sin RSC asociada tras meses de seguimiento, permite asumir la incapacidad de la cirugía para generar una ulterior mejoría adicional.
Resincronización Asociada a la Insuficiencia Mitral IsquémicaAunque las diversas técnicas quirúrgicas ya mencionadas son aceptadas como tratamiento estándar de los pacientes con insuficiencia cardíaca congestiva e IMF isquémica, se ha postulado que en presencia de asincronismo basal agudo la RSC se asocie a la cirugía de RVC, dado que la reducción del grado de la IMF guarda relación directa con la reversión del remodelado ventricular26.
Recientemente, Liang, et al.26 han demostrado, por primera vez, los efectos positivos que la RSC produce sobre los dos componentes, el temprano y el tardío, de la sístole bifásica presente en la IMF. El acortamiento del pico sistólico en la fase temprana y la reducción de las fuerzas del tethering en la tardía parecen ser los responsables de la disminución de la IMF. Tras la RSC ambas fases contribuyen a la reversión del remodelado, aunque de forma predominante, de la fase temprana.
Penicka, et al.26 han establecido que el asincronismo preoperatorio de la musculatura interpapilar <60ms es el factor predictivo más relevante de la mejoría de la IMF, observando también que el efecto agudo de la RSC en la disminución de la IMF es el resultado de una me-jor coordinación en el tiempo de activación del territorio de inserción muscular de ambos papilares.
El mismo grupo concluye que la presencia de miocardio viable y la ausencia de asincronismo interpapilar son factores determinantes en la mejoría de la IMF moderada tras la RVC aislada. Estos hallazgos sugieren que la recuperación de la función ventricular mediante la RVC miocárdica y la contracción sincronizada de los papilares mediante estimulación BiV, si existe viabilidad, suponen en la actualidad el tratamiento óptimo para mejorar la conformación anómala del VI, mecanismo responsable subyacente en la IMF. Por tanto, la determinación preoperatoria de viabilidad y asincronismo nos proporciona información fundamental que permite adoptar una decisión terapéutica global, que podría implicar cirugía de RVC miocárdica, RSC concomitante y reparación mitral.
En resumen, la miocardiopatía isquémica y la IMF afectan a una población muy heterogénea, que difiere en la extensión, grado y funcionalidad del miocardio viable, así como del grado del asincronismo, siendo la IMF el resultado de la gravedad de la alteración ventricular que la causa. La RSC ventricular asociada, en casos seleccionados, aporta una mejoría significativa.
ConclusionesLa implantación del electrodo epicárdico en VI durante la cirugía convencional de la miocardiopatía dilatada de origen valvular o coronario con asincronismo ventricular permite realizar una RSC completa en un solo acto quirúrgico o de forma diferida si tras la corrección quirúrgica persiste el asincronismo con función ventricular deprimida. La presencia de asincronismo asociado a disfunción sistólica conlleva un mal pronóstico. En la mayoría de los casos de miocardiopatía de origen isquémico, la RVC miocárdica aislada ni elimina el asincronismo ni mejora la función ventricular sistólica, mientras que la RSC asociada a la RVC miocárdica disminuye la mortalidad de forma significativa. La estrategia terapéutica de RSC unificada-asociada a la cirugía cardíaca permite corregir el asincronismo de forma eficaz y fiable en un gran porcentaje de respondedores.