Los dispositivos de asistencia ventricular se emplean en el tratamiento de diversas situaciones que comprometen gravemente la vida del paciente, siempre en el contexto de una disfunción ventricular aguda (aguda por shock cardiogénico o de forma crónica en la insuficiencia cardíaca refractaria). El concepto surge en la década de 1950 y en las décadas siguientes se desarrollan nuevos sistemas, hasta que a finales del pasado siglo la asistencia se consolida como un tratamiento demostrado y efectivo gracias, también, a un proceso paralelo de investigación y mejoras tecnológicas a lo largo del tiempo y en diversos campos, como modelos de flujo y mecanismos de bombeo, bioma-teriales o fuentes de energía, desembocando en lo que es la asistencia ventricular tal y como la entendemos a día de hoy.
En el presente artículo se analizan diversos aspectos relacionados con la asistencia ventricular del siglo XXi como son las indicaciones, los dispositivos disponibles y la experiencia recogida con ellos, tanto en España como a nivel mundial. se abordan también cuestiones clave en la actualidad tales como los aspectos económicos de la asistencia ventricular o la organización de un programa de asistencia circulatoria.
Ventricular assist devices are used in the treatment of various situations, always in the context of severe ventricular dysfunction (acute cardiogenic shock or chronic refractory heart failure). the concept emerged in the 1950s, and in the following decades new systems were developed until the end of the last century when ventricular assistance was positioned as a proven and effective treatment. The parallel processes of research and technological improvements over time and in various fields, such as models of flow and pumping mechanisms, bio-materials, and energy sources, have led to what ventricular assistance is today.
The present article discusses many aspects of ventricular assistance in the 21st century such as the indications, available devices, and the experience with them in spain and worldwide. Key issues, such as the economics of ventricular assistance or the organization of a circulatory assist program, are addressed.
Las enfermedades cardíacas son responsables de casi el mismo número de muertes que el resto de causas de mortalidad juntas, al menos en el mundo desarrollado. La insuficiencia cardíaca crónica progresiva y refractaria supone un problema de salud de primer orden, con implicaciones no solo para el paciente sino para toda la sociedad, dada su repercusión económica y su impacto en el gasto sanitario. En este contexto, los dispositivos de asistencia ventricular son útiles para el tratamiento de situaciones que comprometen gravemente la vida del paciente de forma aguda, como el shock cardiogénico de cualquier etiología, o de forma crónica como la insuficiencia cardíaca refractaria en estadio D.
Una asistencia circulatoria es un dispositivo mecánico de bombeo de sangre, implantado de forma paracorpórea o intracorpórea, capaz de apoyar o de suplir la función de bomba del corazón tanto de forma temporal como permanente. Esa gama de posibilidades hace que muy diversos dispositivos y sistemas con diferentes grados de complejidad técnica puedan ser considerados como asistencias circulatorias, y así distinguimos desde el balón de contrapulsación intraaórtica o el ECMO, pasando por sistemas intermedios (como el Impella o el TandemHeart) hasta los ventrículos artificiales paracorpóreos o intratorácicos y el propio corazón artificial total.
La experiencia mundial con estos dispositivos es grande, mientras que en España es corta, desigual y hasta cierto punto poco difundida; en el presente artículo se pretende arrojar algo de luz sobre la situación de la asistencia circulatoria a día de hoy analizando diversos aspectos, como las indicaciones, los dispositivos disponibles y la experiencia recogida con ellos tanto en España como a nivel mundial; se abordan también otras cuestiones no tan técnicas, como pueden ser los aspectos económicos de la asistencia ventricular o la organización de un programa de asistencia circulatoria.
La Asistencia Ventricular en Las Guías ClínicasLos dispositivos mecánicos son, junto a los inotrópicos y los cuidados paliativos finales, los tratamientos reservados para el estadio D como etapa final de la insuficiencia cardíaca. Aunque los ensayos clínicos aleatorios son la herramienta más potente para comparar de forma inequí-voca tratamientos o intervenciones, en el campo de la asistencia circulatoria no hay demasiada evidencia disponible basada en esos ensayos, y por ello debemos atenernos a lo que a día de hoy dicen las guías clínicas y las conferencias de consenso, que son indicaciones muy genéricas o bien dirigidas a grupos de pacientes de perfil clínico poco definido, por lo que en no demasiadas ocasiones nos ayudan a sentar una indicación o tomar una determinación en un caso concreto o ante un paciente en particular.
Guías de práctica clínica para diagnóstico y tratamiento de la insuficiencia cardíaca aguda y crónica (2008)En 2008, el Comité de Guías de Práctica Clínica de la European Society of Cardiology (ESC) consideró necesario revisar algunas de las recomendaciones incluidas en ediciones anteriores1,2, con la intención de unificar y modificar los documentos sobre insuficiencia cardíaca publicados con anterioridad basándose fundamentalmente en evidencia documentada y publicada, aunque para los dispositivos de asistencia ventricular remarca que, debido a la naturaleza de la población a la que están destinados, la documentación recabada en los ensayos clínicos es escasa y las recomendaciones que se proponen reflejan esta falta de evidencia, por lo que no hay consenso en cuanto a las indicaciones de los dispositivos ni sobre la población objetivo3:
- –
Con grado de recomendación IIa y nivel de evidencia C, los sistemas de asistencia ventricular izquierda y el corazón artificial están indicados en pacientes en espera de trasplante cardíaco y para el manejo de pacientes con miocarditis aguda grave.
- –
Aunque no se dispone de suficiente experiencia, se puede considerar el uso de estos dispositivos a largo plazo cuando no se haya establecido un tratamiento definitivo con un grado de recomendación IIb y nivel de evidencia C.
En el shock cardiogénico también son bastante genéricas en cuanto al papel de la asistencia circulatoria mecánica temporal al señalar, en su versión de 20051 que puede estar indicada en pacientes con insuficiencia cardíaca aguda que no responden al tratamiento convencional y que tienen posibilidad de recuperación miocárdica, o como un puente para el trasplante cardíaco u otras intervenciones que pueden producir una recuperación significativa de la función cardíaca con un grado de recomendación IIb, nivel de evidencia B.
La posterior revisión del año 2008 mejoró el grado de recomendación, pero no la precisión o especificidad de las indicaciones, pues considera el uso de un dispositivo de asistencia ventricular izquierda en la insuficiencia cardíaca aguda por causas potencialmente reversibles, como tratamiento puente mientras se espera la respuesta al tratamiento (cirugía o recuperación) con un grado de recomendación I, nivel de evidencia C3.
Actualización de 2010 de las Guías Clínicas de la European Society of CardiologyEstá especialmente orientada y dirigida al tratamiento de la insuficiencia cardíaca con dispositivos, por lo que supone una actualización detallada tanto de la guía de práctica clínica de la ESC de 2008 para el diagnóstico y tratamiento de la insuficiencia cardíaca aguda y crónica, como de la guía de práctica clínica de la ESC de 2007 para la terapia cardíaca y de resincronización.
Considera que las mejoras técnicas y el éxito demostrado de los dispositivos de asistencia ventricular implantables han hecho de ellos una opción de tratamiento razonable, bien como puente hacia el trasplante cardíaco bien como terapia de destino. Señala como puntos clave4:
- –
Los datos del registro INTERMACS indican que un 10% de los pacientes reciben una asistencia como terapia de destino.
- –
La población de pacientes está formada principalmente por pacientes con soporte inotrópico o mecánico previo a la implantación del dispositivo.
- –
La selección de pacientes es crucial; los candidatos no deben tener disfunción renal, pulmonar o hepática relevante ni infección.
- –
Las pruebas disponibles indican que un dispositivo de flujo continuo es mejor que un dispositivo de flujo pulsátil.
- –
No hay datos comparativos respecto al dispositivo como puente hacia el trasplante.
Se elaboraron como documento de Consenso de los Grupos de Trabajo de Revascularización Miocárdica de la ESC y de la European Association for Cardio-Thoracic Surgery (EACTS). Para el tratamiento del shock cardiogénico en el seno de un infarto agudo de miocardio (IAM) sitúan la asistencia mecánica en dos momentos diferentes dentro del algoritmo terapéutico, con un grado de recomendación IIa y un nivel de evidencia C:
- –
El soporte con ECMO está indicado ante la inestabilidad hemodinámica tras emplear todas las medidas farmacológicas y mecánicas (inotrópicos, ventilación mecánica, balón de contrapulsación), e intentar la reperfusión y la revascularización.
- –
El soporte con asistencia mecánica uni- o biventricular, tanto como puente a trasplante como asistencia definitiva, estará indicado si no hay recuperación de la función cardíaca y la valoración neurológica y de órganos diana son normales.
Dado su nulo impacto en mejorar la mortalidad a 30 días, no se recomienda el uso de bombas centrífugas percutáneas (grado de recomendación II y nivel de evidencia B).
Modelos DisponiblesLa descripción detallada de las características técnicas y resultados de cada uno de los aparatos excede el propósito del presente artículo y, puesto que existe abundante bibliografía sobre ello, nos limitaremos a relacionar ordenadamente los diferentes dispositivos disponibles a día de hoy y señalar los más comúnmente empleados. De acuerdo a un grado creciente de complejidad técnica podemos utilizar:
- –
Balón de contrapulsación intraaórtico.
- –
Catéteres de impulsión: Impella, PulseCath.
- –
Minibombas implantables: Synergy CircuLite.
- –
Sistemas de ECMO: Maquet Jostra Rotaflow, Medos Deltastream.
- –
Bombas centrífugas:
- •
Cinética: Biomedicus, Jostra, etc.
- •
Percutánea: TandemHeart.
- •
Levitación magnética: CentriMag Levitronix.
- •
- –
Bombas paracorpóreas de flujo pulsátil: Abiomed (BVS5000, AB5000), Thoratec PVAD, EXCOR Berlin Heart.
- –
Bombas implantables de flujo pulsátil: Thoratec IVAD, HeartMate XVE.
- –
Bombas implantables de flujo axial: HeartMate II, INCOR Berlin Heart, HeartAssist 5, Jarvik 2000.
- –
Bombas implantables centrífugas: HeartWare, Du-raHeart.
- –
Corazón artificial total: Syncardia TAH-t, AbioCor II.
Dejando aparte el balón de contrapulsación como asistencia parcial, los dispositivos más ampliamente utilizados para el soporte a corto plazo son, tanto en España como a nivel mundial, el ECMO (en asistencia circulatoria y asistencia respiratoria aislada) y la bomba centrífuga Levitronix, que en esta indicación han desplazado discretamente en número a los dispositivos pulsátiles paracorpóreos. Como soporte a medio y largo plazo se usan bombas pulsátiles paracorpóreas en España (ABIOMED, EXCOR) e implantables en el resto del mundo, tanto pulsátiles (Thoratec IVAD principalmente en EE.UU.) como de flujo continuo axial (HeartMate II, HeartAssist 5, INCOR) y centrífugo (HeartWare). El campo en expansión de la asistencia definitiva o permanente está ocupado por los dispositivos de flujo continuo, de forma mayoritaria en la experiencia mundial con el HeartMate II, si bien las centrífugas implantables buscan su lugar gracias a la experiencia acumulada (Ventrassist, DuraHeart) y a la actual de HeartWare con diversos ensayos clínicos en marcha.
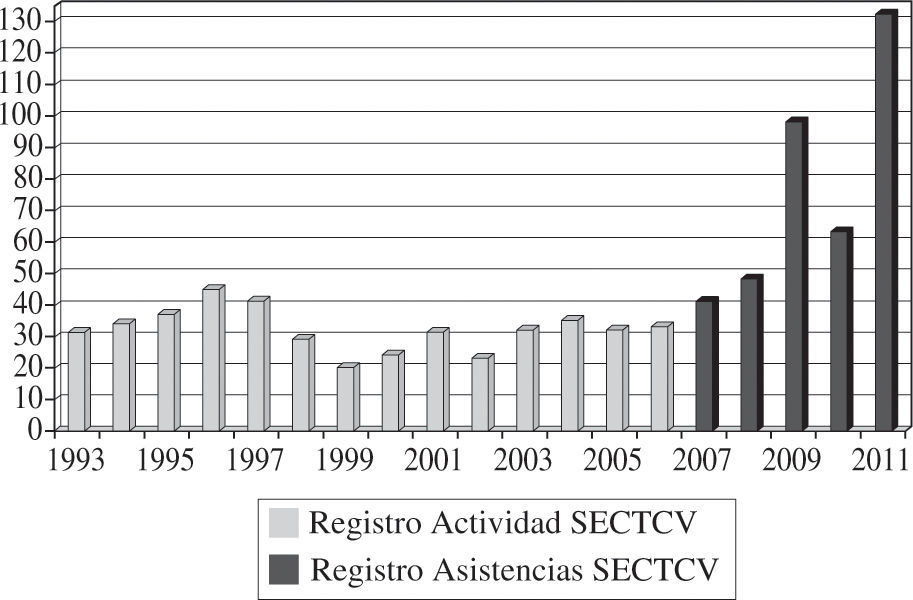
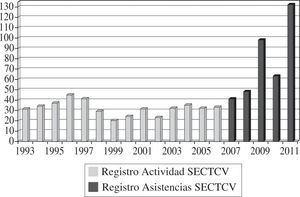
Experiencia Y Resultados de la Asistencia CirculatoriaAsistencia circulatoria en EspañaLa experiencia en España con asistencias ventriculares es variada pero desigual y hasta cierto punto poco difundida, por lo que resulta difícil conocer con exactitud cuándo comenzó a implantarse cada tipo de dispositivo y en qué número o grupo de indicaciones se ha empleado. Afortu-nadamente, la situación actual es mucho mejor conocida y disponemos de datos reales y fidedignos al haberse iniciado en 2007 un Registro de Asistencia Circulatoria dependiente de la Sociedad Española de Cirugía Torácica-Cardiovascular (SECTCV) y su Grupo de Trabajo de Asistencia Mecánica Circulatoria y Trasplante Cardíaco. Los datos del Registro de Asistencia Circulatoria y Respiratoria de la SECTCV han sido publicados en esta revista6 y en la web de la Sociedad (www.sectcv.es), donde pueden consultarse de forma exhaustiva, por lo que aquí tan solo presentaremos un resumen de los datos principales recogidos en él desde su inicio que reflejan a ciencia cierta la situación actual y, quizá, las tendencias de futuro de la asistencia en España.
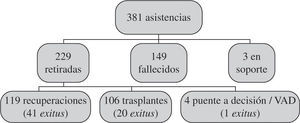
Desde el 1 de enero de 2007 y hasta el 31 de diciembre de 2011, la actividad total fue de 381 intervenciones para implantar una asistencia en 378 pacientes, con una actividad anual de 40 casos en 2007, 48 casos en 2008, 98 casos en 2009, 63 en 2010 y 132 en 2011 (Fig. 1).
PerfilEl perfil del paciente implantado es el de un varón (66%) de 50 años (con un amplio rango entre 7 meses y 80 años) no operado previamente, con disfunción biventricular en la mitad de los casos y una aguda depresión de la función izquierda (media de fracción de eyección de 24% y mediana de 20%). Más de la mitad (52%) llegaron a la asistencia con balón de contrapulsación.
ObjetivosLos dos objetivos principales con los que se implantó la asistencia fueron la recuperación ventricular (56%) y el puente a trasplante (41%), quedando de forma testimonial el puente a otra asistencia (2%) y la asistencia definitiva (1%).
Situaciones clínicasLas situaciones clínicas en las que se ha indicado la asistencia han sido las habituales para estos dispositivos, repartiéndose la experiencia de la siguiente forma:
- –
Poscardiotomía, 88 casos.
- –
Pretrasplante, 86 casos.
- –
Postinfarto agudo, 61 casos.
- –
Postrasplante, 53 casos.
- –
Fallo respiratorio, 37 casos.
- –
Miocarditis, 25 casos.
- –
Definitiva, 4 casos.
- –
Otros, 27 casos.
En cuanto al lado asistido, el ECMO supuso el mayor número de implantes (215 casos), seguido por igual de 69 asistencias izquierdas y 69 biventriculares, mientras que 28 pacientes recibieron una asistencia derecha.
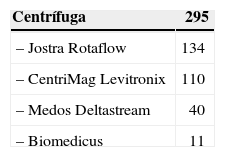
DispositivosSe implantaron un total de 450 dispositivos; la tabla I recoge una sumarización de los modelos utilizados, clasificados por el modo de impulsión, siendo los de flujo continuo centrífugo los más frecuentemente implantados (en ECMO o como ventrículo artificial) seguidos de los pulsátiles paracorpóreos.
Modelos empleados y número de implantes según modo de impulsión
| Centrífuga | 295 |
| – Jostra Rotaflow | 134 |
| – CentriMag Levitronix | 110 |
| – Medos Deltastream | 40 |
| – Biomedicus | 11 |
| Pulsátil | 137 |
| – Abiomed BVS5000 | 105 |
| – EXCOR Berlin Heart | 25 |
| – Abiomed AB5000 | 7 |
| Flujo continuo axial | 18 |
| – Impella Recover | 12 |
| – INCOR Berlin Heart | 4 |
| – HeartMate II | 2 |
En función del lado asistido podemos destacar la preponderancia de dispositivos pulsátiles en asistencia biventricular, mientras que en la derecha y en el ECMO (por la propia naturaleza del sistema) dominan las bombas centrífugas, siendo la distribución para la asistencia izquierda muy balanceada en cuanto al número de implantes con ambos modos de impulsión.
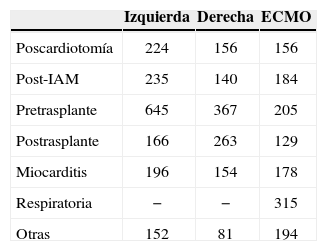
Duración de la asistenciaLos tiempos de soporte fueron muy diferentes, como es lógico, en función de la indicación clínica de la asistencia y del lado asistido, y así se recoge en la tabla II.
Duración media de la asistencia (en horas) según el grupo de indicación clínica y según el lado asistido
| Izquierda | Derecha | ECMO | |
| Poscardiotomía | 224 | 156 | 156 |
| Post-IAM | 235 | 140 | 184 |
| Pretrasplante | 645 | 367 | 205 |
| Postrasplante | 166 | 263 | 129 |
| Miocarditis | 196 | 154 | 178 |
| Respiratoria | − | − | 315 |
| Otras | 152 | 81 | 194 |
| tiempo | rango | |
| ECMO | 149 | 0,5–1.248 |
| Izquierda | 462 | 3–3.163 |
| Derecha | 214 | 1–1.032 |
| Biventricular | 243 | 5–3.288 |
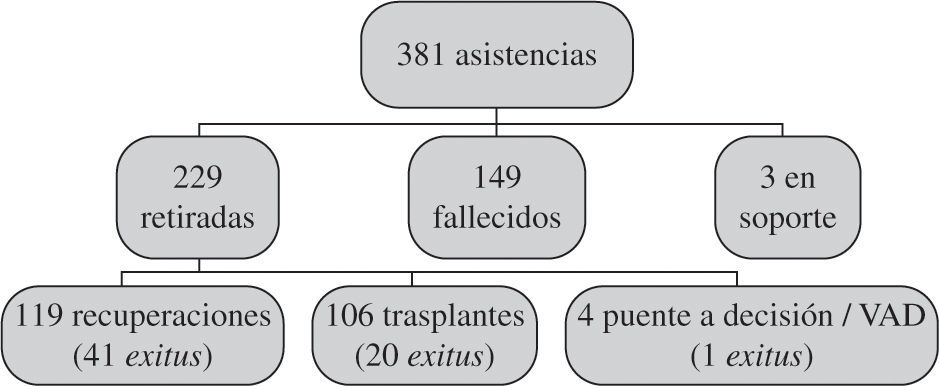
La evolución de todas las asistencias se expresa de forma gráfica en la figura 2. Como puede verse, fallecen con el dispositivo menos de la mitad de los pacientes (39%), y entre aquellos a los que se les puede retirar la asistencia las tasas de supervivencia son altas.
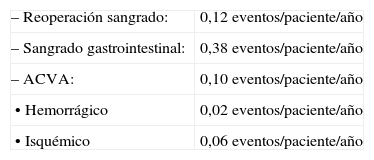
MorbilidadEl Registro recoge de forma exhaustiva la morbilidad que se ha reportado; como datos más relevantes y significativos podemos señalar:
- –
Quirúrgica: hubo un 23% de reoperaciones por hemorragia, 23 casos de taponamiento posquirúrgico y tan solo se operó un caso de mediastinitis.
- –
Neurológica: se recogieron ocho casos de embolismo periférico y 27 episodios centrales (cinco accidentes isquémicos transitorios [AIT], cuatro accidentes cerebrovasculares agudos [ACVA] recuperados y 18 ACVA con secuelas).
- –
Renal: la creatinina preoperatoria media fue de 1,52mg/dl (0,2–6,1); 143 pacientes presentaron en algún momento durante el soporte una insuficiencia renal (definida como creatinina > 2mg/dl o > 180μmol/l) con necesidad de diálisis en 103 casos.
- –
Infección: 106 pacientes presentaron algún episodio de infección significativa: 50 respiratorias, 27 sepsis, 16 bacteriemias y 11 de herida quirúrgica (siete correspondían a infecciones superficiales).
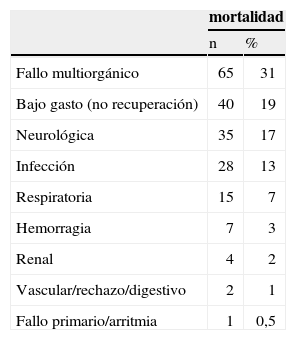
La mortalidad hospitalaria fue de 210 pacientes (55%), falleciendo 148 de ellos con la asistencia y 62 más tras el trasplante o tras la retirada del dispositivo por recuperación. Un paciente más falleció en su domicilio en espera de trasplante con una asistencia biventricular implantada. Las causas principales de mortalidad se recogen en la tabla III, con expresión del número de fallecidos y el porcentaje de cada causa respecto a la mortalidad global.
Análisis de supervivenciaLa mortalidad ha sido llamativamente alta en la asistencia derecha aislada (85%) y también ha resultado muy elevada la mortalidad postrasplante, es decir, la asistencia como soporte inicial en casos de fracaso agudo del injerto.
El resultado es bueno en términos globales para la asistencia pretrasplante y en la recuperación ventricular (post-IAM, miocarditis) así como para la asistencia con ECMO.
Es notable la tasa de recuperación de la función ventricular tras asistencia, pues el 66% de los pacientes a los que se les retiró el dispositivo por mejoría lograron ser dados de alta. Igualmente, el porcentaje de éxito en el trasplante tras asistencia es muy alto: de los 106 enfermos trasplantados tan solo fallecieron 20, lo que supone un 81% de supervivencia para pacientes con una situación previa muy precaria y en los cuales la implantación del dispositivo constituye un factor independiente de mortalidad en el trasplante7.
Asistencia circulatoria a nivel mundialDispositivos de primera generaciónLa experiencia acumulada con ellos en los últimos veinte años es muy grande y las cifras hablan por sí solas: el ABIOMED BVS5000 ha sido implantado en más de 6.500 pacientes con una supervivencia del 35% tras cardio-tomía y 45% tras infarto. Del Thoratec PVAD hay más de 6.000 dispositivos implantados en más de 4.000 pacientes en 240 centros; el máximo soporte logrado es de 1.204 días y la tasa de altas tras retirada o trasplante es del 89%. El Heart-Mate XVE, modelo implantable, ha sido utilizado en 186 centros de todo el mundo en más de 4.500 pacientes con una edad media de 51 años y un soporte máximo de 1.854 días.
A pesar de esta abrumadora experiencia es difícil dar resultados globales, puesto que estamos hablando de dispositivos diversos con una experiencia muy repartida en indicaciones variadas y de los que no hay registros globales. Además, la evolución tecnológica a lo largo de los años dificulta la comparación, pero de una forma general y con mucha cautela podemos decir que los resultados han sido mejores en la asistencia pretrasplante (miocardiopatía dilatada) que en la poscardiotomía, y que los resultados han sido globalmente mejores con dispositivos pulsátiles que con bombas centrífugas, al haberse logrado mayor número de desconexiones y altas hospitalarias.
Dispositivos actuales (segunda y tercera generación)Durante la última década ha habido una experiencia creciente con dispositivos de flujo continuo axial. La mayor evidencia corresponde, sin lugar a dudas, al HeartMate II, único con aprobación de la Food and Drug Administration (FDA) como puente a trasplante y como terapia definitiva, con más de 10.000 dispositivos implantados en el mundo y 4.000 actualmente en soporte (más de 1.300 por encima de dos años y casi 200 con más de cuatro años). La experiencia europea publicada incluye 571 pacientes soportados durante una media de 236 días (0–1.029), con una mortalidad precoz del 17% y una supervivencia del 69% al final del estudio (trasplante, recuperación o soporte continuado)8. John, et al.9 han comparado una cohorte reciente de 1.496 pacientes con un grupo de 486 enfermos que recibieron el dispositivo dentro del ensayo clínico como puente a trasplante y han comprobado que la supervivencia al año mejoró del 78 (ensayo) al 85% (actual), con un descenso del porcentaje de trasplantados al año del 48 al 39% y unas tasas de complicaciones realmente bajas:
Con los otros aparatos la experiencia es más reducida y menos difundida, como la del INCOR Berlin Heart, con unos 550 dispositivos implantados, o el Syncardia TAH-t, asistencia biventricular y ortotópica (requiere explante del corazón nativo) y de la que ya se han implantado 1.000 dispositivos entre EE.UU. y Europa.
Con el HeartWare HVAD la evidencia acumulada es creciente (2.000 implantes en el mundo) y prometedora: ha completado ya dos estudios como puente a trasplante y están en marcha otros dos como asistencia definitiva (ENDURANCE FDA DT y REVIVE-IT Trial).
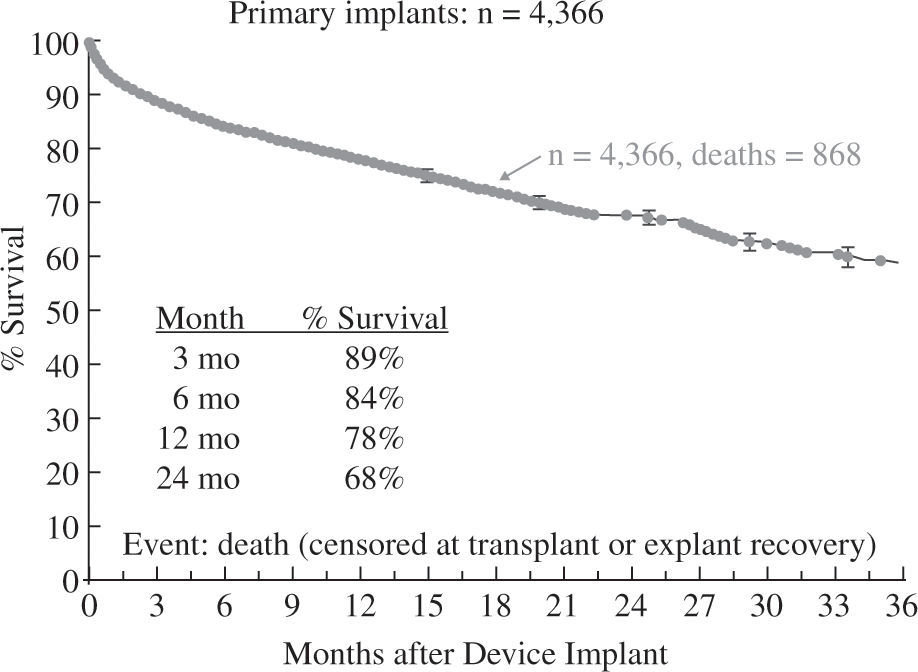
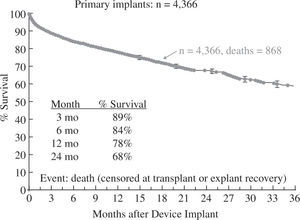
Los resultados globales en EE.UU. con estos dispositivos son conocidos gracias al registro INTERMACS, que recoge desde junio de 2006 todos los implantes de dispositivos de duración media y larga (excluyendo específicamente sistemas de ECMO y dispositivos paracorpóreos que no permitan el alta del paciente) y que anualmente elabora un análisis demográfico, de resultados y de supervivencia. El cuarto informe INTERMACS recoge 4.533 pacientes implantados durante cinco años, lo que permite describir la evolución a lo largo del tiempo de la tecnología para el bombeo, el cambio en las indicaciones y los diferentes perfiles clínicos preimplante10.
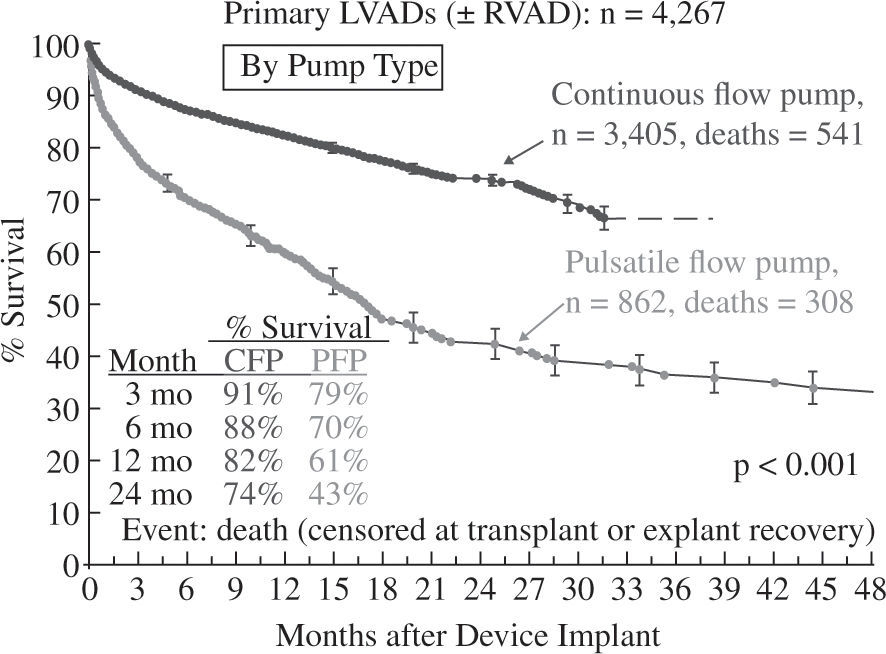
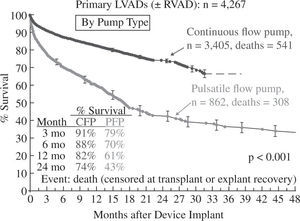
La supervivencia global a un año para toda la serie es del 78% (Fig. 3), pero debe tenerse en cuenta que ha habido un cambio en la tecnología utilizada, puesto que en 2006 y 2007 solo se emplearon aparatos pulsátiles y a partir de 2008 comenzaron a utilizarse dispositivos de flujo continuo en un número creciente hasta convertirse en el modo de impulsión casi exclusivo (95% en 2010 y 2011); ello ha tenido un evidente impacto en la super-vivencia, que con dispositivos de flujo continuo alcanza el 82% a un año y el 74% a dos años (Fig. 4), confirmando las expectativas creadas tras el ensayo clínico de Slaughter, et al.11, que compara ambos tipos de flujo.
Supervivencia global en pacientes con asistencia circulatoria (4.o Informe INTERMACS10).
Supervivencia en pacientes con asistencia izquierda según el tipo de flujo (4.o Informe INTERMACS10). CFP: bomba de flujo continuo; PFP: bomba de flujo pulsátil; RVAD: asistencia derecha.
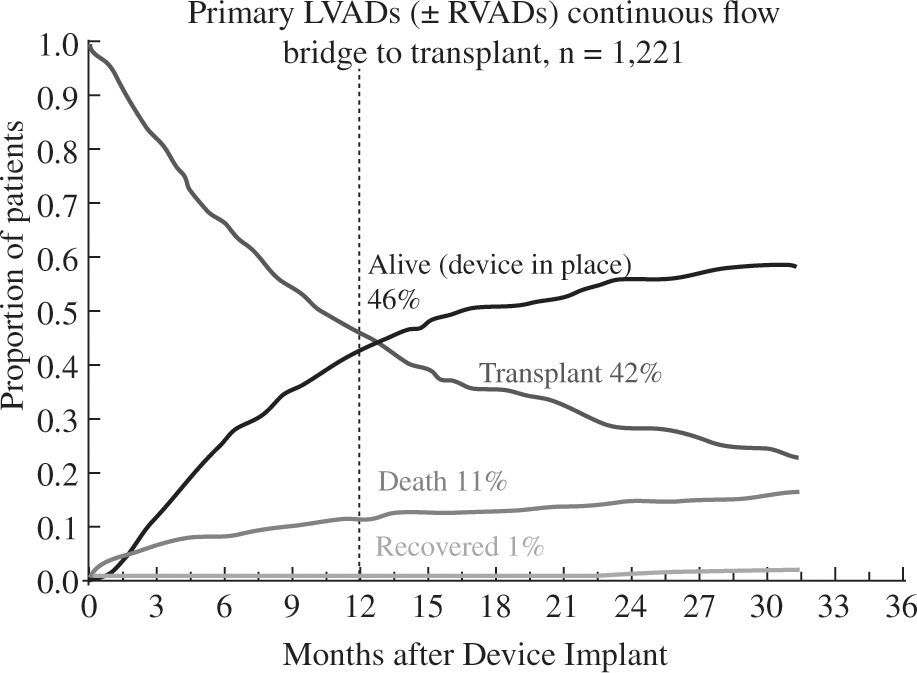
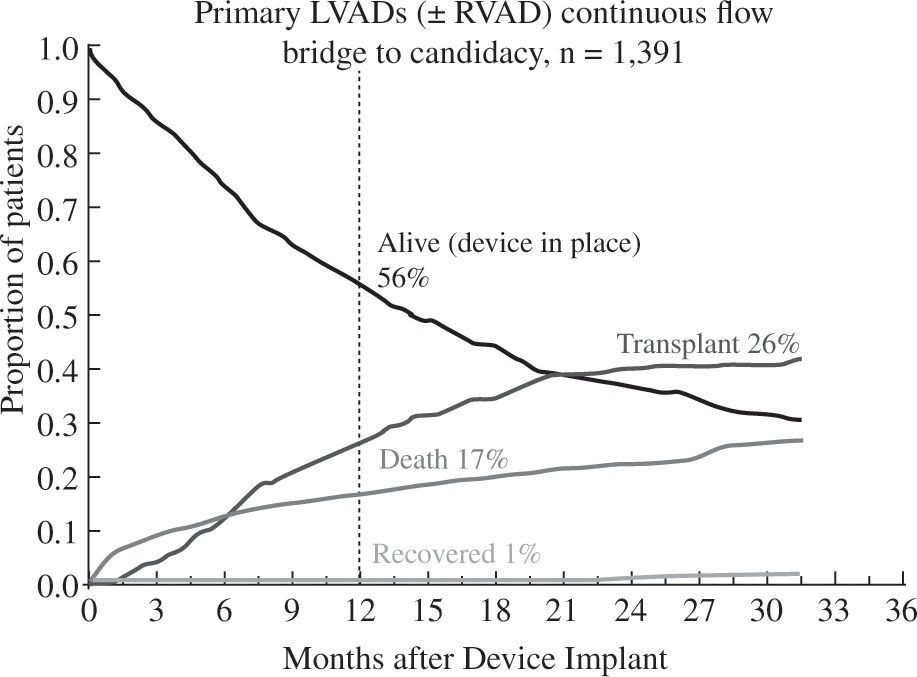
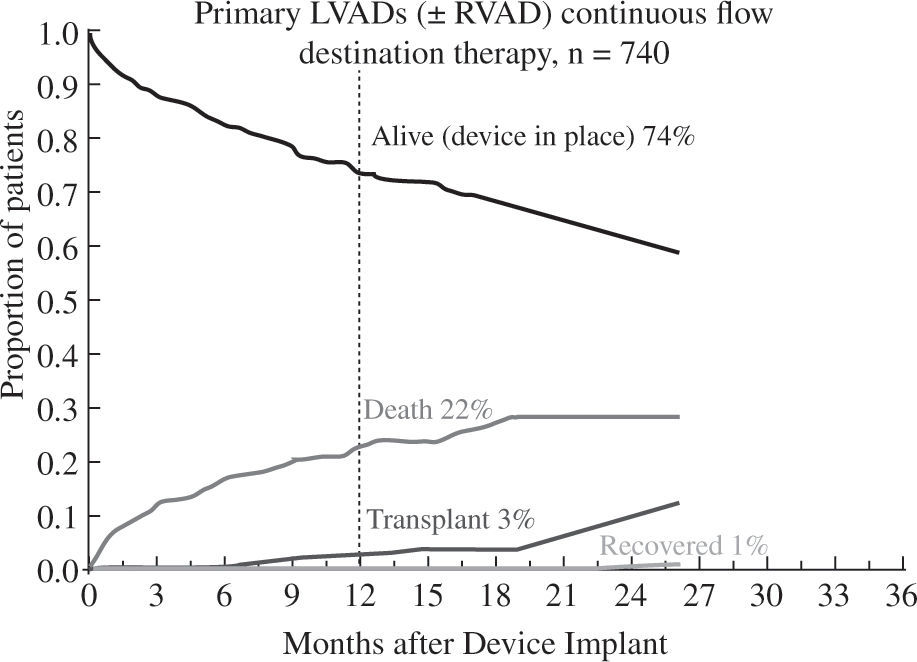
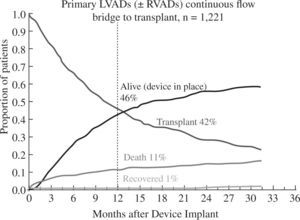
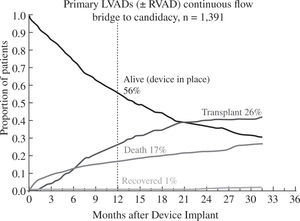
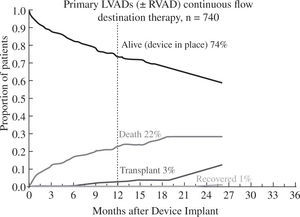
Los buenos resultados se mantienen al analizar la super-vivencia en función de la indicación clínica del dispositivo: como puente a trasplante el 88% de pacientes permanecen vivos y asistidos o se han trasplantado al cabo del año (Fig. 5), cifra que desciende al 82% con un incremento en la mortalidad por razones obvias en el puente a decisión (Fig. 6). Para la asistencia definitiva la supervivencia al año es del 74% con una mortalidad del 22%, lo que demuestra la baja tasa de recuperación ventricular y de trasplante en este grupo de pacientes (Fig. 7).
Evolución de los pacientes implantados como puente a trasplante (4.o Informe INTERMACS10).
Evolución de los pacientes implantados como puente a decisión (4.o Informe INTERMACS10).
Evolución de los pacientes implantados para asistencia definitiva (4.o Informe INTERMACS10).
En relación con el perfil del paciente implantado, los factores de riesgo con más peso en los tres primeros meses son el fracaso ventricular derecho que hace indicar una asistencia biventricular (hazard ratio [HR]: 3,27) y un INTERMACS 1 (shock cardiogénico establecido) con un HR de 2,87; del análisis del registro se deduce que para estos casos lo indicado es una asistencia de corta duración que solvente la fase aguda y en un segundo tiempo, si procede, se indicará una asistencia de más larga duración como puente a trasplante o con carácter definitivo. Otros factores de riesgo de mortalidad son edad avanzada, enfermedad coronaria y niveles de bilirrubina elevados.
Aspectos Económicos de la Asistencia VentricularIntentar analizar la repercusión económica de un tratamiento o técnica efectivos produce en el médico una especial prevención, por cuanto se tiene la impresión de fiscalizar algo que es considerado positivo y beneficioso para el paciente. Y siendo esto particularmente válido en todo lo concerniente a la asistencia mecánica, no lo es menos el hecho de que el elevado coste del dispositivo hace que dicho análisis deba ser no solo obligado sino estricto. Se comprenderá, además, que abordar los aspectos económicos de la asistencia ventricular supone tan solo una aproximación parcial al problema del coste global del paciente, si consideramos la particular dificultad que en España tiene la cuantificación precisa y ajustada de los costes sanitarios. Partiendo de esta premisa, vamos a contemplar el análisis según el siguiente esquema:
- –
Beneficios de la asistencia.
- –
Coste de los aparatos.
- –
Coste del mantenimiento del paciente.
- –
Análisis de costes.
Podemos expresarlos de forma general en términos de:
- –
Supervivencia aumentada por recuperación ventricular, trasplante cardíaco tras asistencia o bien por soporte crónico permanente.
- –
Mejoría en la calidad de vida objetivada por valoraciones de tipo funcional (prueba de esfuerzo, consumo de oxígeno, etc.) y por cuestionarios de calidad de vida (Minnesota Living With Heart Failure, Kansas City Cardiomyopathy Questionnaire) u otros menos específicos como el índice de Karnofsky.
- –
Reincorporación laboral en algunos casos (con el beneficio «social» añadido del aumento de la productividad y la disminución de los subsidios).
- –
Beneficio económico directo por disminución del gasto sanitario imputable a tratamientos farmacológicos crónicos.
Es muy diferente en función de la tecnología y complejidad del dispositivo, y puede ir desde menos de 1.000 € de un balón de contrapulsación o los 2.000–3.000 € de un sistema de ECMO a los 8.000 € de una bomba centrífuga de levitación magnética o los 12.000–15.000 € de un ventrículo pulsátil paracorpóreo. Pero quienes verdaderamente dan «mala fama» a la asistencia circulatoria son los nuevos dispositivos implantables de flujo axial, cuyo precio asciende a los 85.000–90.000 € de un HeartMate II o los 100.000–110.000 € de un INCOR Berlin Heart.
Se trata de precios altos como corresponde a aparatos de complejo desarrollo tecnológico que son y como los que tienen otros dispositivos como DAI (5.000–7.000 €), resincronizadores (25.000–30.000 €) o válvulas aórtica transcatéter (24.000 €), por no salir del ámbito cardiológico. La gran diferencia es que mientras al cabo del año se implantan en España unas 100 asistencias (y de ellas tan solo 2 o 3 unidades son por ahora de flujo axial), el rango de válvulas implantadas es de cientos y los DAI/resincronizadores se indican por miles, por lo que la factura final, en términos absolutos, es infinitamente más abultada para cualquiera de estos otros dispositivos que para las asistencias. Por tanto, resulta no solo ilógico, sino también absolutamente injusto, para la asistencia ventricular el plantear que el coste del dispositivo debe ser un freno para su indicación e implante.
Coste del mantenimiento del pacienteHay dos premisas incuestionables en lo referente al mantenimiento del paciente asistido:
- –
Es un paciente que precisa estancia en una Unidad de Cuidados Intensivos (UCI) todo el tiempo del implante (excepción hecha de los modelos «portables» que, tras el postoperatorio inicial, son dados de alta a planta).
- –
Una vez implantado el dispositivo, su cuidado y mantenimiento no requieren ninguna atención especial que genere un gasto extra (salvo para los implantables definitivos, que precisarán recambios y ciertos chequeos periódicos), sino que se necesita tan solo la vigilancia del correcto funcionamiento del dispositivo por parte de un personal cualificado previamente adiestrado y los controles analíticos y ecocardiográficos que valoren la evolución del paciente.
Como consecuencia de lo anterior, podemos inferir que tras su llegada a la UCI un paciente con una asistencia ventricular implantada no genera per se un mayor gasto sanitario que cualquier postoperatorio de cirugía cardíaca mayor compleja, por lo que el coste final será el coste de un enfermo ingresado en Cuidados Intensivos postoperatorios de cirugía cardíaca si bien matizado por una mayor duración de la estancia en la unidad.
Dadas las peculiares características del sistema sanitario, surgen aquí dificultades para hacer una valoración más precisa del coste promedio por día de ingreso, tan variable de un servicio a otro o de un hospital a otro aún dentro del mismo sistema de gestión (sea nacional o autonómico), y por ello parece más prudente no entrar en disquisiciones que reflejarían tan solo una realidad muy parcial.
Evaluación económica y análisis de costesLa asistencia circulatoria es un claro ejemplo de que el constante avance tecnológico consigue cambiar el curso clínico de muchas enfermedades, mejorando no solo la expectativa de vida sino la calidad de esta. Como contra-partida, y dado el creciente coste de los dispositivos, esas sucesivas mejoras producen un incremento del gasto sanitario gracias a un progresivo crecimiento de la partida presupuestada para Sanidad.
Si partimos de que el interés de los gestores suele ir en la dirección contraria (reducción de costes) y que eso puede entrar en colisión con nuestro objetivo de proporcionar la mejor calidad asistencial con los mejores tratamientos disponibles, se hace evidente que es imprescindible realizar una precisa evaluación económica y un análisis de costes que demuestren que la asistencia es rentable y que su coste está compensado de forma objetiva por los beneficios que proporciona.
Puesto que los recursos son finitos y escasos se hace necesario priorizar, y por tanto debemos tomar decisiones comparando los costes y los beneficios no solo clínicos, sino también de eficiencia, de utilidad, de eficacia, etc. Para ello se han desarrollado varios tipos de análisis de costes que miden diferentes parámetros:
- –
Análisis de coste según producción: se basa en los grupos funcionales homogéneos (GFH), definidos como la unidad mínima de gestión, que se caracteriza por tener una actividad homogénea, un único responsable, una ubicación física, unos objetivos propios, una responsabilidad definida y un código identificativo. Cada GFH es el centro de coste a efectos de contabilidad analítica.
- –
Análisis de coste por proceso: está centrado en los grupos relacionados por el diagnóstico (GRD), que utilizan variables demográficas y de diagnóstico para clasificar a los pacientes en grupos que se puedan comparar clínicamente, con duraciones de estancia en el hospital y consumos de recursos similares. Los pesos GDR establecen los recursos que se pueden necesitar para tratar cada proceso de un GDR determinado y por ende los costes de tratamiento para los casos incluidos en cada GDR deben ser similares.
- –
Análisis coste-beneficio: valora coste y beneficios de cada alternativa terapéutica midiéndolo en unidades monetarias y eligiendo la alternativa que más beneficios aporta para un coste dado. Es el método más simple pero menos específico, puesto que es difícil valorar en términos monetarios los beneficios indirectos y los intangibles.
- –
Análisis coste-efectividad: mide la efectividad de los diversos tratamientos en unidades naturales (años de vida ganados, número de gripes evitadas, años libres de incapacidad, casos diagnosticados, etc.). Su desventaja es que no es útil para comparar tratamientos en distintos procesos o enfermedades, solo compara entre sí las alternativas terapéuticas que conducen al mismo resultado en un proceso dado.
- –
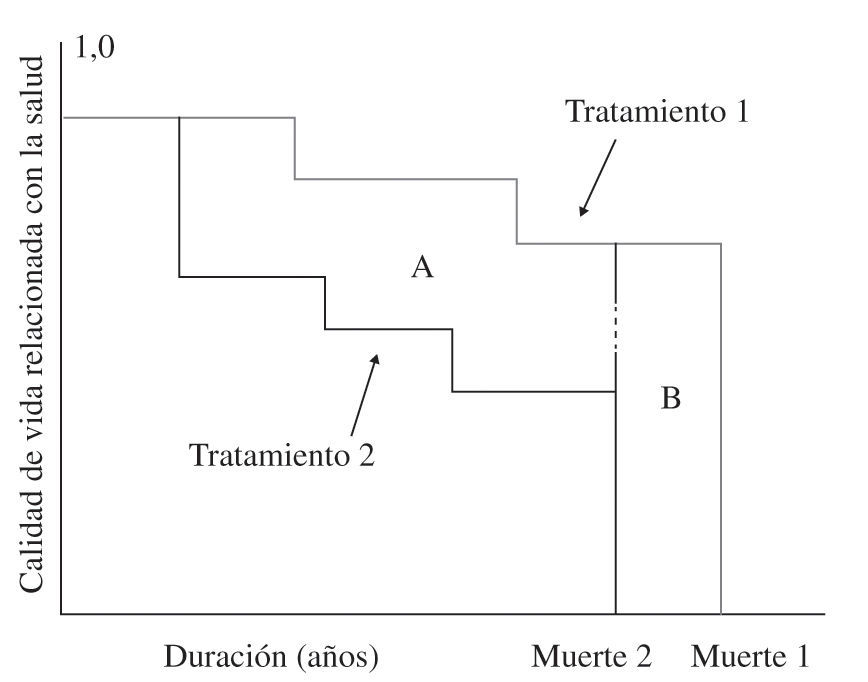
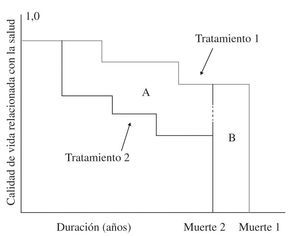
Análisis coste-utilidad: permite comparar entre todos los tratamientos que tienen como resultado la mejora en la cantidad de vida o la calidad de vida y mide el resultado en años de vida ajustados por calidad (AVAC), que corresponderían al número de años adicionales de vida con una calidad razonable que una persona puede ganar como resultado del tratamiento: a cada año en perfecto estado de salud se le asigna el valor de 1 y un valor de 0 para la muerte, y si los años de más no se viven en plena salud (disminución de capacidad funcional, pérdida de miembros, etc.), entonces se asigna a cada periodo de tiempo un peso que varía de 0 a 1 en función de la calidad de vida de ese periodo (Fig. 8). Por tanto, este método integra la mortalidad (supervivencia) con la morbilidad (calidad de vida) en un solo índice que mide supervivencia en años de vida con buena salud, lo que permite orientar los recursos a favor de protocolos o tratamientos que proporcionan más AVAC en función de lo que cuestan.
En el caso de la asistencia circulatoria, un estudio AVAC debe valorar el impacto sobre los costes (fármacos, reingresos, etc.) y el impacto sobre el estado de salud (mortalidad, calidad de vida) tanto de la asistencia como del tratamiento farmacológico. De forma esquemática, el proceso sería:
- •
Efecto sobre el estado de salud: el cálculo da como resultado la diferencia en AVAC entre la asistencia y el tratamiento médico: AVAC ganados gracias a la asistencia.
- •
Efecto sobre los costes: se calcula la diferencia en costes directos para el sistema de salud entre la asistencia y el tratamiento médico, lo que nos daría el coste incrementado debido a la asistencia ventricular.
- •
El cociente entre el coste incremental debido a la asistencia y los AVAC ganados gracias a la asistencia nos da como resultado final el coste por AVAC, que se expresa como «euros por AVAC» y es una medida del coste-utilidad (rentabilidad) del tratamiento: si este cuesta más de una cifra tabulada (por ejemplo 120.000 € por AVAC) no se considera rentable y debe rechazarse y si está por debajo de un margen determinado (por ejemplo, 35.000 € por AVAC) resulta muy rentable y debe adoptarse.
La respuesta a la pregunta ¿Quién debe disponer de asistencia ventricular? no es sencilla ni tampoco única, ya que dependerá del tipo de asistencia y de su nivel de complejidad:
- –
Si planteamos asistencias de corta duración (ECMO, centrífuga) es evidente que todos los servicios de cirugía cardíaca deben disponer de un sistema en su práctica diaria para la atención del shock cardiogénico (poscardiotomía, postinfarto, etc.).
- –
Dispositivos más sofisticados o de duración intermedia (ventrículos paracorpóreos) deberían ser el segundo escalón y por ello parece razonable que sean implantados y ofertados por servicios con experiencia previa en asistencia circulatoria para casos más complejos. Así mismo, deberían formar parte de la cartera de servicios de cualquier programa de trasplante cardíaco para asegurar el mantenimiento de pacientes críticos en espera de trasplante o la mejoría orgánica y funcional de algunos de ellos antes y/o después del procedimiento.
- –
Los modelos intracorpóreos de flujo continuo, los más complejos y costosos, deberían reservarse para unos pocos centros especializados que, funcionando como unidades de referencia, acumulasen toda la casuística y experiencia nacionales con indicaciones poco frecuentes como la asistencia permanente.
Con esta filosofía se aseguraría la atención «universal» de las enfermedades más frecuentes, mientras que se concentra la atención de casos menos habituales en grupos más experimentados evitando multiplicar el gasto y atomizar la experiencia. La optimización de recursos produce mejores resultados clínicos, un menor gasto final en la factura sanitaria y como consecuencia de ello una mayor rentabilidad (medida como coste-utilidad) por lo que debería ser el objetivo perseguido por los gestores, pero incluso un somero análisis de la realidad nos demuestra que la situación es muy diferente al haberse introducido factores de distorsión como la competencia entre los diversos sistemas de salud autonómicos o las diferentes carteras de servicios que se ofertan, con el agravante de que al final no siempre el que más ofrece es quien mejores resultados obtiene o quien da una asistencia más universal.
La existencia de una tecnología efectiva no garantiza que todas las personas que la necesitan tengan acceso a ella, y así diferentes estudios han demostrado que hay una variabilidad geográfica en el tratamiento del IAM o en la realización de coronariografías y procedimientos de revascularización coronaria que no se explica por diferencias en la carga de enfermedad sino por la riqueza regional; incluso en algunos países se ha observado que las personas que más asistencia sanitaria precisan son las que con frecuencia tienen menos probabilidades de recibirla, fenómeno que se ha denominado «ley de asistencia inversa»12.
Estas diferencias en el acceso a los servicios en función de la comunidad autónoma en la que se viva ha sido puesta de manifiesto por Fitch-Warner, et al.13 en un trabajo que pretende describir la variabilidad entre comunidades autónomas en el uso de intervenciones coronarias percutáneas (ICP), desfibriladores automáticos implantables (DAI) y terapia de resincronización cardíaca (TRC) tratando de explicar la variabilidad encontrada en el caso de las dos primeras. Tras un exhaustivo análisis y comparación de los datos disponibles, el estudio llega a varias conclusiones interesantes:
- –
Hay una importante variabilidad regional en el uso de las tres tecnologías que es más elevada cuanto más moderno es el procedimiento en cuestión.
- –
Existe una asociación entre el número de procedimientos cardiovasculares del tipo intervencionismo percutáneo coronario o implante de DAI y la riqueza regional, asociación que es independiente de la carga de cardiopatía isquémica en cada comunidad autónoma.
- –
La desigualdad en el acceso a distintas tecnologías puede ser explicada por las diferencias socioeconómicas (riqueza regional, oferta de servicios) y no por la necesidad o la carga de enfermedad.
Es decir, que la oferta de servicios depende de la riqueza regional y no de la carga de la enfermedad o de las necesidades de los pacientes, lo que provoca un cierto grado de inequidad.
Parece, pues, que estamos lejos no solo de la optimización de recursos sino también del correcto acceso de los ciudadanos a estos; si queremos ser más equitativos (proporcionando mayor acceso a quien más lo necesita) y de una forma más eficiente (aplicando los servicios donde mayor beneficio producen) es evidente que deberemos dirigir los recursos a la necesidad de los pacientes, trascendiendo a otros criterios más políticos pero mucho menos «saludables».
Regulación sanitariaEl Real Decreto 1302/2006, de 10 de noviembre14 establecía en su Artículo 1 que su objetivo era «garantizar la equidad en el acceso a una atención sanitaria de calidad, segura y eficiente a las personas con patologías que, por sus características, precisan de cuidados de elevado nivel de especialización que requieren concentrar los casos a tratar en un número reducido de centros, estableciendo las bases del procedimiento para la designación y acreditación de los centros, servicios y unidades de referencia del Sistema Nacional de Salud». Esta orientación podría ayudar a introducir racionalidad y optimización de recursos en diversos campos y la asistencia ventricular parece uno de ellos, puesto que las enfermedades tratadas en estos centros de referencia deberían ser enfermedades que requiriesen para su adecuada atención técnicas tecnologías y procedimientos preventivos, diagnósticos y terapéuticos de elevado nivel de especialización, para los que es esencial la experiencia en su utilización, que solo es posible alcanzar y mantener a través de ciertos volúmenes de actividad, o bien enfermedades que requieren alta tecnología para su prevención, diagnóstico o tratamiento y para las que, atendiendo a su relación coste-efectividad y a los recursos disponibles, se precise la concentración de un número mínimo de casos.
Como a menudo sucede, las intenciones son buenas y el espíritu de la norma parece claro, pero su materialización práctica resulta más complicada y requiere de acuerdos y decisiones que con frecuencia trascienden de lo meramente técnico o científico y caen de lleno en el campo de lo político. En este sentido, podemos señalar que:
- –
Los criterios específicos de designación serán elaborados por un comité de designación de centros, servicios y unidades de referencia que elevará su propuesta al pleno del Consejo Interterritorial del Sistema Nacional de Salud.
- –
El Comité de Designación estará presidido por el titular de la Dirección General de Cohesión del Sistema Nacional de Salud y Alta Inspección, y se integrarán en él, como vocales, un representante de cada una de las comunidades autónomas, del Instituto Nacional de Gestión Sanitaria, de la Subdirección General de Análisis Económico y Fondo de Cohesión, del Instituto de Salud Carlos III, de la Agencia de Calidad del Sistema Nacional de Salud y de la Organización Nacional de Trasplantes. Este comité podrá incorporar a sus deliberaciones, con voz pero sin voto, a los expertos en cada una de las materias que se consideren oportunas.
- –
Los centros, servicios y unidades de referencia incluidos en las propuestas deben contar con la correspondiente autorización sanitaria y disponer del informe favorable de la autoridad competente de la comunidad autónoma donde estén ubicados, siendo designados para un periodo máximo de cinco años.
Esta iniciativa se ha puesto en marcha lentamente y de forma independiente en cada comunidad autónoma, que ha comenzado a designar para diversas especialidades los procedimientos y enfermedades para los que debe certificarse un centro de referencia; a nivel nacional y para el caso de la asistencia circulatoria aún no hay nada establecido a pesar de que ya han transcurrido seis años desde la publicación del Real Decreto.
Organización de un programa de asistencia circulatoriaIndependientemente de la normativa y de los condicionantes administrativos que el Real Decreto pueda establecer, la organización de un programa de asistencia circulatoria atendiendo a criterios estrictamente profesionales requiere de una serie de premisas sobre las que comenzar a trabajar:
- –
Existencia de un programa de insuficiencia cardíaca avanzada y trasplante cardíaco consolidado y con una estructura independiente.
- –
Experiencia del grupo tanto en trasplante cardíaco como con dispositivos de asistencia ventricular.
- –
Colaboración y apoyo protocolizado de otros servicios y unidades implicados (cuidados intensivos, ecocardiografía, hemodinámica, hematología, rehabilitación, etc.).
- –
Evaluación económica que permita la racionalidad tanto en gasto como en inversión (análisis de coste-utilidad).
Todo este trabajo previo es fundamental pero no suficiente; una serie de factores serán claves para el éxito y sin ellos difícilmente se puede consolidar el programa:
- –
Liderazgo definido y efectivo: el programa es multidisciplinar, pero existe un responsable máximo, perfectamente identificado por todos los miembros y por el personal externo.
- –
Estructura organizada: el trabajo está protocolizado, todos los pasos del proceso son conocidos y existen planes de contingencia.
- –
Eficacia individual y capacidad de trabajar en equipo: cada uno de los miembros del programa está especializado y rinde en su campo, pero se integra sin fricciones en el equipo; los «lobos solitarios» pueden ser brillantes individualidades, pero no tienen cabida en una estructura como esta.
- –
Motivación personal y de grupo: es una labor continua del líder para mantener la cohesión del grupo y el espíritu del programa.
Existen dos modelos de organización práctica del programa de asistencia que están bien desarrollados en países con experiencia y tradición en asistencia ventricular (EE.UU., Alemania, Francia); cualquiera de ellos tiene sus ventajas e inconvenientes, y la elección de uno u otro dependerá no solo de nuestra preferencia y capacidad, sino también de la estructura sanitaria y hospitalaria que rodee a nuestro programa:
- 1.
Centro de referencia («Hub & Spoke»): nuestro programa será el que disponga de asistencias de diferente nivel de complejidad y es el centro de referencia para otros grupos periféricos más pequeños que tienen programa propio más limitado (ECMO, asistencias de corta duración). Los pacientes así implantados o los más complejos serán trasladados al centro de referencia para manejo e implante de otros dispositivos, si es preciso.
Presenta ventajas evidentes, como el permitir acumular experiencia con un uso más eficiente de recursos y lograr mejores resultados al disminuir las posibles complicaciones derivadas de un manejo incorrecto o una indicación tardía o equivocada.
Requiere una labor previa de formación de esos grupos periféricos y una comunicación fluida y frecuente con ellos que permita tomar decisiones de forma rápida y clara en cuanto a indicaciones, momento del traslado de un paciente o actitud terapéutica a seguir en cada caso.
- 2.
Programa de desplazamiento («Equipo móvil»): nuestro programa es el único que dispone de los medios y es el que se desplaza para realizar el implante de la asistencia en el hospital periférico, trasladando luego al paciente recién implantado a nuestro hospital para manejo de la asistencia y del paciente (desconexión, trasplante).
Sus ventajas son claras (menor inversión al tratarse de un solo centro implantador y mejores resultados por la concentración de la experiencia), pero los posibles inconvenientes no son despreciables:
- –
Puede implicar en el desplazamiento a otros servicios locales (anestesia, enfermería, etc.) que deben tener una organización definida y establecida que dé respuesta a las necesidades en el momento de la urgencia.
- –
Depende para el implante de la estructura de otros hospitales locales o regionales que pueden tener diferentes niveles de implicación o compromiso en una actividad que les es ajena.
- –
Presenta una mayor dificultad de manejo del personal: el número de personas implicadas es mayor (equipo local, equipo de desplazamiento, equipo del hospital de destino), el liderazgo en determinados momentos puede no estar claro o no ser fácilmente identificable y el nivel de cooperación o de especialización de cada eslabón de la cadena suele ser variable y menos predecible.
El «todos pueden hacerlo todo» es, a priori, una solución cómoda, aparentemente igualitaria y que evita susceptibilidades y potenciales enfrentamientos entre servicios o administraciones, pero desde un punto de vista práctico no es una actitud justa ni tampoco real pues, como hemos visto:
- –
No mejora los resultados globales.
- –
Crea desigualdades en el acceso de los usuarios a los recursos.
- –
Es caro, poco eficaz y más ineficiente.
Por tanto, lo sensato y realmente equitativo es racionalizar la asistencia con un enfoque de planificación de conjunto que tienda a minimizar y corregir esos problemas, proporcionando los servicios de acuerdo a los recursos disponibles no solo desde el punto de vista material sino también humano. Eso inevitablemente debería conducir al desarrollo y planificación de programas de asistencia circulatoria con diversos niveles de complejidad centrados en servicios y unidades de referencia.
Reflexiones FinalesLa asistencia ventricular es una posibilidad terapéutica consolidada en 2012; la experiencia mundial lo avala y los resultados son especialmente buenos cuando la indicación se establece tempranamente. Pese a ello, la experiencia nacional sigue siendo pequeña, por lo que a modo de corolario podemos realizar algunas reflexiones:
- –
Hay que seguir dando a conocer las posibilidades de estos dispositivos entre la comunidad cardiológica y predicar con el ejemplo, promoviendo y difundiendo los implantes.
- –
Debemos progresar en aspectos concretos de la asistencia:
- •
Adecuación del momento de la indicación.
- •
Selección de pacientes: en este sentido son fundamentals las distintas escalas de riesgo que se han ido desarrollando.
- •
Prevención de los principales factores de mor-bimortalidad: tromboembolia e infección.
- •
- –
La indicación puede y debe abarcar a grupos de pacientes menos graves, no críticos, que se pueden beneficiar de asistencia a medio y largo plazo con carácter definitivo.