La endocarditis infecciosa derecha (EID), que afecta principalmente las válvulas tricúspide y pulmonar, representa entre el 5% y el 15% de los casos de endocarditis infecciosa. A diferencia de la endocarditis izquierda, la evidencia sobre su epidemiología, diagnóstico y tratamiento es limitada. Este artículo revisa los aspectos clínicos y terapéuticos más relevantes.
Aunque históricamente asociada al uso de drogas por vía parenteral, su perfil epidemiológico ha cambiado con el aumento de dispositivos intracardíacos, catéteres venosos de larga duración y la mayor supervivencia de pacientes con cardiopatías congénitas. Los microorganismos más frecuentes son Staphylococcus aureus y estreptococos, con variaciones según la población afectada.
El diagnóstico combina criterios clínicos, microbiológicos y de imagen. Los avances en ecocardiografía, tomografía computarizada y PET/TC-18F-FDG han mejorado la sensibilidad, especialmente en prótesis y anatomías complejas. Las complicaciones más comunes son la insuficiencia valvular derecha y las embolias pulmonares sépticas.
El tratamiento antibiótico dirigido es eficaz en la mayoría de los casos, aunque alrededor del 18% de los pacientes en España requieren cirugía. Las guías actuales recomiendan la reparación tricuspídea frente al reemplazo y, cuando este es necesario, el uso de prótesis biológicas en tricúspide y pulmonar por su menor necesidad de anticoagulación y mejor compatibilidad con procedimientos percutáneos posteriores. En pacientes con cardiopatías congénitas, la cirugía debe planificarse considerando la posible afectación de materiales protésicos.
Técnicas emergentes como la aspiración percutánea de vegetaciones son una alternativa en casos sin opción quirúrgica. La EID continúa siendo un desafío diagnóstico y terapéutico que requiere un abordaje multidisciplinar especializado.
Right-sided infective endocarditis (RIE), which primarily involves the tricuspid and pulmonary valves, accounts for 5% to 15% of all cases of infective endocarditis. In contrast to left-sided endocarditis, evidence regarding its epidemiology, diagnosis, and management remains limited. This article reviews the most relevant clinical and therapeutic aspects.
Although historically associated with intravenous drug use, its epidemiological profile has evolved due to the increased use of intracardiac devices, long-term central venous catheters, and improved survival of patients with congenital heart disease. The most frequently isolated microorganisms are Staphylococcus aureus and streptococci, with variations according to the affected population.
Diagnosis relies on clinical, microbiological, and imaging criteria. Advances in echocardiography, computed tomography, and 18F-FDG PET/CT have enhanced diagnostic sensitivity, particularly in prosthetic cases and complex anatomies. The most common complications include tricuspid or pulmonary valve insufficiency and septic pulmonary emboli.
Targeted antibiotic therapy is effective in most cases; however, approximately 18% of patients in Spain require surgical intervention. Current guidelines recommend tricuspid valve repair over replacement and, when replacement is necessary, favor the use of bioprosthetic valves in both tricuspid and pulmonary positions due to their lower anticoagulation requirements and better compatibility with subsequent percutaneous procedures. In patients with congenital heart disease, surgical planning should consider the potential involvement of adjacent prosthetic material.
Emerging techniques such as percutaneous vegetation aspiration offer an alternative for patients who are not surgical candidates. RIE remains a diagnostic and therapeutic challenge that demands a multidisciplinary, specialized approach.
La endocarditis infecciosa derecha (EID), que afecta las válvulas tricúspide y pulmonar, es una entidad poco frecuente, representando el 5-15% de todos los casos de endocarditis infecciosa (EI)1. Sin embargo, su relevancia clínica aumenta debido a la evolución de los factores de riesgo, como el hecho de ser portador de catéteres intravasculares de larga duración o dispositivos intracardíacos, la mayor supervivencia de pacientes con cardiopatías congénitas y el uso de drogas por vía parenteral (UDVP)1. A estos factores se suma el creciente interés que está despertando la patología valvular derecha en las unidades de hemodinámica con las nuevas técnicas de reparación e implante de prótesis percutáneas, lo que probablemente incrementará la incidencia de endocarditis protésica en esta localización en el futuro.
Comparada con la EI izquierda, la EID cuenta con menos literatura sobre epidemiología, diagnóstico, manejo y pronóstico, lo que resalta la necesidad de revisiones integrales que sinteticen el conocimiento actual.
Las complicaciones graves, como embolias pulmonares sépticas, insuficiencia cardíaca derecha y sepsis, requieren un enfoque diagnóstico y terapéutico preciso. Los avances en imagen, microbiología y cirugía han mejorado los resultados, pero la complejidad de la EID demanda una gestión multidisciplinar. Este artículo realiza una revisión narrativa de la epidemiología, diagnóstico, manejo médico-quirúrgico y pronóstico de la EID, destacando sus particularidades y las consideraciones quirúrgicas para optimizar resultados en esta población de alto riesgo.
EpidemiologíaEntre 2016 y 2018, el registro ESC-EORP-EURO-ENDO recogió de forma prospectiva 3.316 episodios de EI en individuos adultos de 40países2, reportando una afectación de la válvula tricúspide en el 14,2% y de la válvula pulmonar en el 2,4% de los casos. Aunque el peso de las EI derechas fue relativamente bajo en el global de la cohorte, estos porcentajes eran superiores a los reportados en la cohorte española GAMES entre 2008 y 2012 (5,5% y 1,6%, respectivamente)3. Dentro de las razones que explican estas diferencias se hallan los recientes cambios epidemiológicos que ha experimentado esta enfermedad.
Históricamente, en España, la EI sobre válvulas derechas se ha asociado al UDVP en hombres jóvenes y fue un problema de salud de primer orden en las dos últimas décadas del siglo pasado4. Ya entrados en el sigloxxi, el consumo de opiáceos ha disminuido considerablemente en nuestro medio y, en consecuencia, también lo ha hecho la incidencia de EID por este mecanismo5. De forma paralela, el aumento en los implantes de dispositivos cardíacos (marcapasos, desfibriladores y resincronizadores)6 y de catéteres vasculares centrales de larga duración (por ejemplo, para hemodiálisis o quimioterapia)7, y la mayor supervivencia de pacientes con cardiopatías congénitas con patología tricúspide o pulmonar (nativa o reparada)8, han diversificado el espectro de esta entidad. Además, el auge de técnicas percutáneas de reparación (Triclip®, Pascal® o Cardioband®) y remplazo tricuspídeo heterotópico (como TricValve® o TRICENTO®) u ortotópico (EVOQUE®, INTREPID®)9 probablemente incrementará la incidencia de las EI protésicas tricuspídeas en pacientes de mayor edad o más frágiles, como ocurre en la EI izquierda.
Endocarditis sobre válvulas derechas en usuarios de drogas por vía parenteralActualmente, la EI causada por el UDVP es marginal en España, hasta tal punto que la última serie publicada al respecto data de 201510. En ella, el 5% de todas las EI, derechas e izquierdas, ocurrían en este grupo de población. Este porcentaje se redujo al 3% en la serie GAMES, algo más reciente3. En la primera de estas dos series, la EID ocurría fundamentalmente en hombres (88%) jóvenes (edad media 35años), estaba causada mayoritariamente por Staphylococcus aureus (68%), presentaba vegetaciones grandes (tamaño medio 16mm), afectaba fundamentalmente la válvula tricúspide (88%), y la mortalidad, aunque menor que la de la población general, no era despreciable (15%)10.
Endocarditis derecha relacionada con dispositivos intracardíacosUn estudio realizado en un hospital de referencia de Barcelona y publicado en 2022 analiza la evolución de la EI relacionada con los dispositivos intracardíacos en un periodo de 40años6. Muestra que la incidencia se multiplicó por4 en los últimos años y que en el 22% se demostró la presencia de vegetaciones en la válvula tricúspide. Al igual que en los UDVP, en este subgrupo de pacientes la infección ocurrió predominantemente en hombres (84%), pero en este caso la mediana de edad fue de 67años (RIC 45-74). Los estafilococos negativos para la coagulasa y S.aureus fueron los microorganismos más frecuentemente responsables de la infección (48% y 32%, respectivamente). La mortalidad hospitalaria fue del 16%, superior a la de los pacientes con EI sobre dispositivos intracardíacos pero sin afectación valvular (11%).
Endocarditis en pacientes con cardiopatías congénitasCerca del 90% de los nacidos vivos con una cardiopatía congénita (CC) sobreviven hasta la edad adulta11. Según reporta el registro ESC-EORP-EURO-ENDO, en 2023 el 11,7% de los pacientes con EI tienen una CC, y, de estos, el 20,1% presentan EI derecha12. La EID es una complicación relevante en pacientes con prótesis pulmonares o defectos estructurales complejos13.
En el registro español (2008-2018), de más de 3.000 casos de EI, 60 correspondieron a EI pulmonar, distribuidos equitativamente entre válvulas nativas y protésicas. Los pacientes con EI protésica pulmonar son jóvenes (edad media 22años), con CC complejas y sin comorbilidades significativas, a diferencia de aquellos con EI en válvulas nativas (edad media 50años). Los microorganismos más comunes son Streptococcus spp., S.aureus y el grupo HACEK. La mortalidad es baja en EI protésica pulmonar (5,6%), frente al 30% en válvulas nativas14.
Endocarditis en prótesis pulmonares percutáneasEl implante percutáneo de válvulas pulmonares, especialmente con prótesis bovinas yugulares como la válvula Melody®, ha aumentado significativamente en los últimos años, acompañado de un incremento en la incidencia de EI, con tasas anuales de hasta un 3,6% en algunos estudios15. Ante esta preocupación, se realizaron estudios comparativos entre grupos de pacientes sometidos a implante valvular quirúrgico frente a los tratados de forma percutánea, con el fin de analizar diferencias en la incidencia de EI. En 2017 un metaanálisis realizado por Sharma et al.16 apuntó que existía una mayor incidencia de EI en prótesis bovinas yugulares que en otros tipos de prótesis; sin embargo, no se observaron diferencias entre las válvulas implantadas mediante catéter y las implantadas quirúrgicamente, lo que sugeriría que el sustrato para una futura infección está relacionado con el tejido protésico y no con el método de implantación.
Más adelante, el trabajo de Georgiev et al.17 reporta una tasa anual de EI del 1,6% en prótesis Melody frente al 0,5% en prótesis implantadas quirúrgicamente, aunque estas diferencias no alcanzaron significación estadística.
Por último, un estudio multicéntrico en 2021 analizó 2.500 pacientes con implantes percutáneos (Melody: 2.000; Edwards Sapien: 500). La incidencia de EI fue del 2,5% por paciente/año para Melody y del 0,8% para Edwards Sapien. Aunque la prótesis Melody mostró mayor incidencia de EI, el análisis multivariante indicó que esto no se debía al tipo de prótesis, sino a factores como la anatomía del paciente (conductos más pequeños) y mayores gradientes residuales18.
DiagnósticoEl diagnóstico de la EID se fundamenta en la sospecha clínica, respaldada por hallazgos microbiológicos y de imagen cardíaca. Clínicamente, la EID se manifiesta con fiebre y bacteriemia en pacientes con enfermedad predisponente o UDVP. Además, se puede asociar a síntomas pulmonares secundarios a embolias sépticas (tos, hemoptisis, dolor torácico) o presentarse con signos de insuficiencia cardíaca derecha en casos avanzados.
Los criterios modificados de Duke, actualizados en 202319, integran criterios mayores (identificación del microorganismo y daño valvular por técnicas de imagen) y menores (enfermedad cardíaca predisponente, fenómenos inmunológicos y vasculares de la EI, fiebre y evidencia microbiológica que no cumpla criterios mayores). El uso de otras modalidades de imagen, como la tomografía computarizada (TC) y el PET/TC con 18F-FDG, ha mejorado la sensibilidad diagnóstica, especialmente en casos con ecocardiografía no concluyente. Por dicho motivo se incluyeron en las guías ESC 2015 y 2023 como criterios diagnósticos.
EcocardiografíaLa ecocardiografía transtorácica (ETT) es la técnica inicial para el diagnóstico de la EID tricúspide, ofreciendo una buena sensibilidad debido a la posición anterior de la válvula. Sin embargo, puede requerir vistas modificadas y enfrenta dificultades para diferenciar vegetaciones de trombos o estructuras anatómicas normales (como la red de Chiari o la válvula de Eustaquio). La ecocardiografía transesofágica (ETE) aumenta la sensibilidad y la especificidad, sobre todo en presencia de dispositivos intracardíacos o catéteres centrales, y es útil para evaluar el foramen oval permeable en casos de ictus asociado. La afectación perianular es rara en la EID tricúspide.
La ETT y la ETE permiten valorar el grado, el mecanismo y la repercusión hemodinámica de la insuficiencia tricúspide (IT), así como la función ventricular derecha. La afectación perianular grave es rara en la EID tricúspide1.
En la válvula pulmonar, la detección de vegetaciones es más complicada tanto por ETT (si la ventana ecocardiográfica es mala) como por ETE (por la posición anterior de la válvula), teniendo ambas técnicas por separado un rendimiento diagnóstico bajo en pacientes con anatomías complejas o con material protésico en posición pulmonar. La combinación de ambas técnicas aumenta la detección de las lesiones hasta un 88%20. En cualquier caso, en pacientes con cardiopatías congénitas portadores de prótesis pulmonares y con sospecha clínica o microbiológica de EI, un ETT/ETE negativo no la descarta, requiriendo técnicas complementarias.
La ecocardiografía 3D aporta información adicional para planificar la reparación quirúrgica de la válvula tricúspide, pero su utilidad en la válvula pulmonar es limitada.
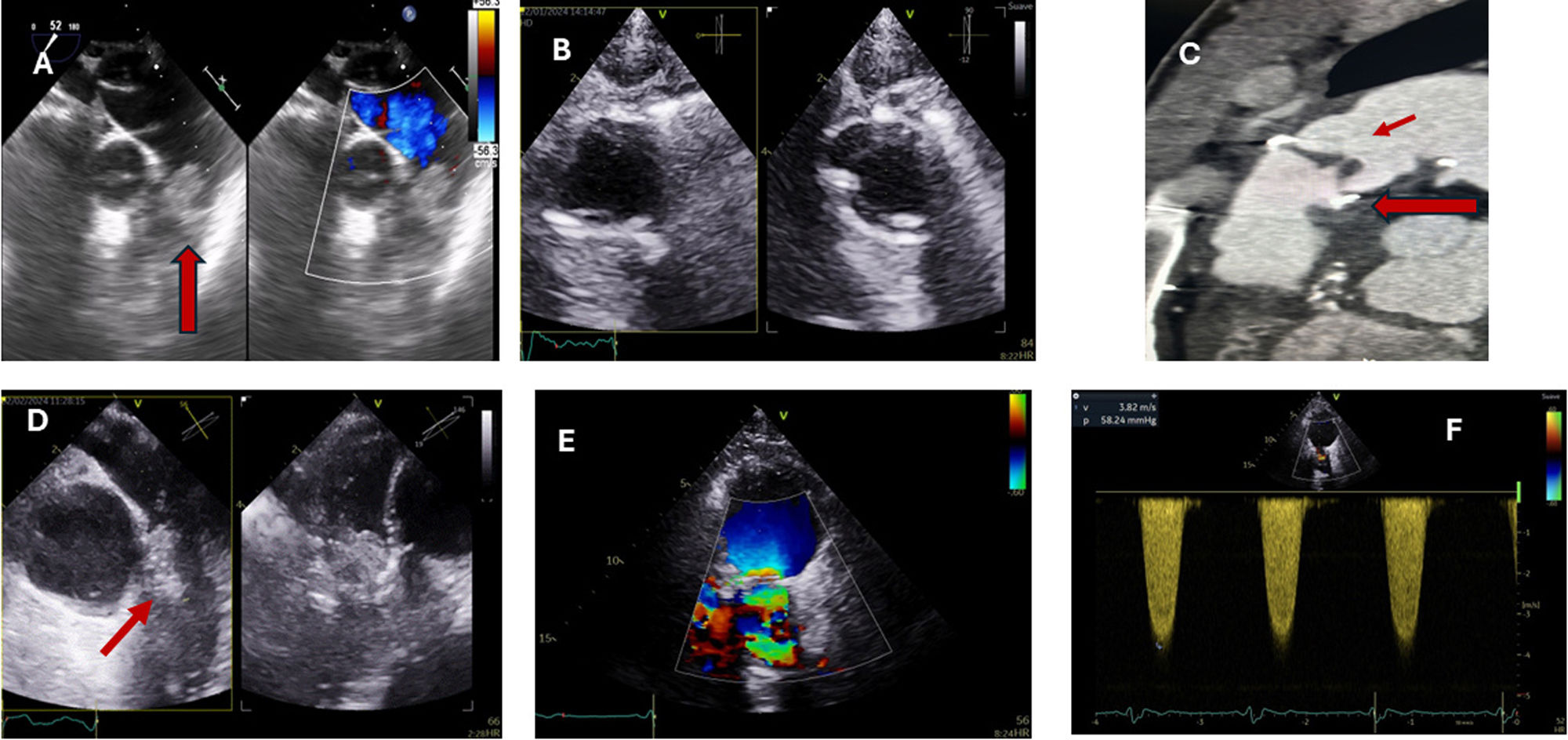
La figura 1 muestra distintas imágenes ecocardiográficas de endocarditis pulmonar.
Imágenes de endocarditis pulmonar. A)Imagen de ETE de endocarditis pulmonar nativa en paciente en UCI. Vegetación de gran tamaño en planos valvular pulmonar en plano medioesofágico alto de grandes vasos. B,C)Endocarditis protésica pulmonar. Imagen de ETT sin vegetaciones (B). TAC con engrosamiento de velos protésicos y absceso perianular (flechas). D-F)Imágenes de paciente con vegetaciones y trombo en prótesis pulmonar biológica percutánea (Melody) (ETE flechas [D]). Turbulencia en flujo transvalvular pulmonar y gradientes elevados (E,F).
La TC cardíaca con sincronización ECG ofrece una excelente resolución espacial para evaluar estructuras cardíacas, siendo especialmente útil en EI protésica y complicaciones perivalvulares, como abscesos, pseudoaneurismas y dehiscencias protésicas. Aunque la ETE tiene mayor sensibilidad para detectar vegetaciones (94% vs. 86%) y perforaciones de velos (81% vs. 41%), la TC supera a la ETE en la identificación de abscesos y pseudoaneurismas (87% vs. 69%) gracias a su mejor resolución espacial y anatómica21,22. Por ello, la TC cardíaca se incorporó como criterio diagnóstico en las guías ESC 2015, consolidándose en 202323. Asimismo, la actualización de los Criterios de Duke-ISCVID incluye la TC y el PET/TC como criterios diagnósticos de imagen19.
En la EID, la TC cardíaca es valiosa para identificar vegetaciones cuando la ecocardiografía presenta limitaciones debido a dificultades técnicas o artefactos. Es particularmente útil en casos de EI protésica para detectar complicaciones perianulares y en pacientes con cardiopatías congénitas cuya anatomía compleja dificulta la evaluación.
En dispositivos intracardíacos infectados permite evaluar la extensión de la infección a lo largo de los electrodos de marcapasos o desfibriladores, identificando trombos, vegetaciones o afectación valvular asociada. Además, la TC es clave para identificar la afectación del parénquima pulmonar incluyendo infartos y abscesos pulmonares, presentes hasta en el 80% de los casos24.
Otro valor añadido de la TC cardíaca es que permite obtener reconstrucciones 3D, que facilitan la planificación quirúrgica en pacientes con anatomía compleja, y para evaluar de forma no invasiva la anatomía coronaria y la presencia de enfermedad aterosclerótica en el estudio preoperatorio.
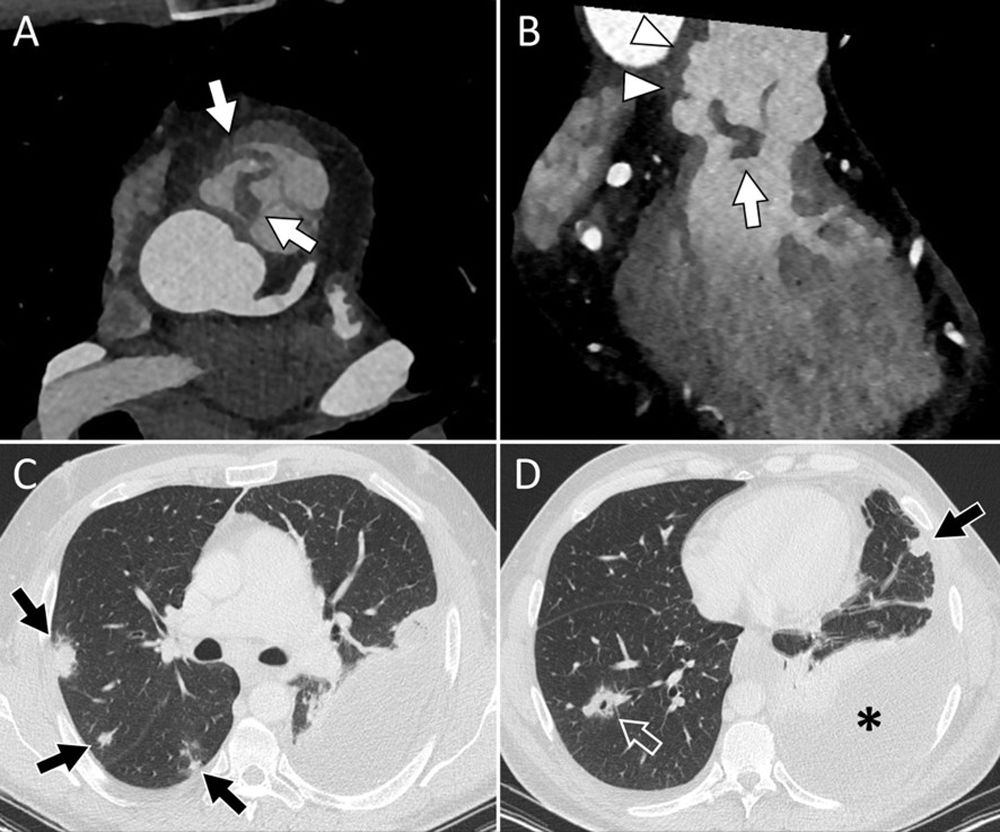
La figura 2 muestra distintos ejemplos del papel de la TC en el diagnóstico de la EID.
Varón de 47 años, ex-ADVP, que ingresa por fiebre y bacteriemia por Staphylococcus aureus. Las imágenes en planos axial (A) y coronal oblicuo (B) confirman la presencia de vegetaciones de gran tamaño sobre la válvula pulmonar nativa (flechas blancas), así como aumento de partes blandas perivalvular sugestivo de flemón/absceso e irregularidad con saculación de la raíz de la pulmonar compatible con pseudoaneurisma (B, cabezas de flecha). Se identificaron múltiples lesiones nodulares pulmonares bilaterales (flechas negras), alguna de ellas cavitada (D, flecha vacía), compatibles con embolias pulmonares, asociadas a derrame pleural izquierdo (D, asterisco).
El 18F-FDG PET/TC es una técnica híbrida de gran utilidad en EI protésica, ya que reclasifica casos etiquetados como «posibles» en la evaluación inicial y detecta lesiones embólicas a distancia25.
La experiencia con el 18F-FDG PET/TC en EID es menor que en válvulas izquierdas. La mayoría de las prótesis pulmonares se encuentran en pacientes con cardiopatías congénitas, donde el PET/TC muestra una sensibilidad comparable a la EI protésica izquierda, con un valor relativo mayor debido a las limitaciones de la ecocardiografía en esta localización. La incorporación del PET/TC ha mejorado significativamente la sensibilidad diagnóstica en EI, alcanzando un 79-90% al reclasificar un 57-86% de los casos dudosos o «posibles»26. Asimismo, el PET/TC es muy útil para diagnosticar infecciones en tubos valvulados en posición pulmonar. Las anuloplastias tricuspídeas pueden presentar hipermetabolismo «fisiológico», requiriendo experiencia en la interpretación para evitar falsos positivos.
El diagnóstico de EI se basa en el patrón de captación de 18F-FDG (una captación focal o heterogénea sugiere infección, mientras que una captación difusa y homogénea suele corresponder a inflamación reactiva), combinando análisis visual, análisis semicuantitativo (SUV) y correlación con la presencia de lesiones anatómicas en la TC. En este contexto, los parámetros cuantitativos obtenidos del PET/TC, especialmente los valores de SUV (Standardized Uptake Value), aportan información adicional de interés. Los principales índices empleados son el SUVmax, el SUVmean y el SUVratio, siendo el primero el más utilizado.
Sin embargo, el valor absoluto del SUV puede variar en función de múltiples factores técnicos (equipo empleado, protocolo, tiempo de adquisición, etc.) y del propio paciente (por ejemplo, tratamiento antibiótico prolongado), por lo que no existe un valor de corte universalmente aceptado o extrapolable. Aun así, se ha demostrado que la probabilidad de infección aumenta conforme se elevan los valores de SUVmax y/o SUVratio. De forma orientativa, las guías de Endocarditis de la ESC 202323 consideran que un SUVmax >5 y un SUVratio >2,5 son altamente sugestivos de infección.
En nuestra institución, la cuantificación del SUV se interpreta como información complementaria al resto de hallazgos, dado que puede verse influida por los factores mencionados. No obstante, aceptamos los valores umbral propuestos en las guías: un SUVmax superior a5 se considera muy altamente sugestivo de endocarditis.
El 18F-FDG PET/TC es, además, altamente sensible para embolias sépticas pulmonares y resulta especialmente útil en cardiopatías congénitas para evaluar infecciones en materiales protésicos o monitorizar el tratamiento antibiótico en pacientes no quirúrgicos. Sin embargo, su sensibilidad es baja en válvulas nativas tricúspide y pulmonar, por lo que no sustituye la evaluación estándar, aunque puede detectar lesiones a distancia como criterio diagnóstico menor.
Complicaciones, manejo e indicaciones de cirugíaLas complicaciones más frecuentes de la EID son la insuficiencia valvular y las embolias pulmonares sépticas27. A diferencia de la EI izquierda, las complicaciones invasivas, como abscesos, cavidades o pseudoaneurismas, son raras en la EID (0,7%)28. La invasión de estructuras adyacentes y la aparición de abscesos, fístulas o bloqueo auriculoventricular suelen asociarse a la extensión de la infección desde la válvula aórtica hacia el lado derecho, más que a una EI originada en la válvula tricúspide28.
En las prótesis pulmonares la EI se manifiesta como obstrucción valvular (hasta en el 50% de los casos) en lugar de insuficiencia29. Esta obstrucción puede evolucionar hacia una estenosis crítica del tracto de salida del ventrículo derecho, provocando una situación de shock cardiogénico que requiere una intervención urgente.
La EID es generalmente más benigna que la EI izquierda, con un manejo médico exitoso en aproximadamente el 90% de los casos23. La terapia antimicrobiana ajustada al antibiograma es la base del tratamiento. La duración habitual es de 4-6semanas, aunque en pacientes con EI no complicada asociada a UDVP o dispositivos intracardíacos pueden considerarse ciclos más cortos, pudiendo finalizar el tratamiento con antibióticos orales23.
La proporción de pacientes que requieren cirugía en el curso de la EID varía entre un 4 a un 50% en diferentes series30.
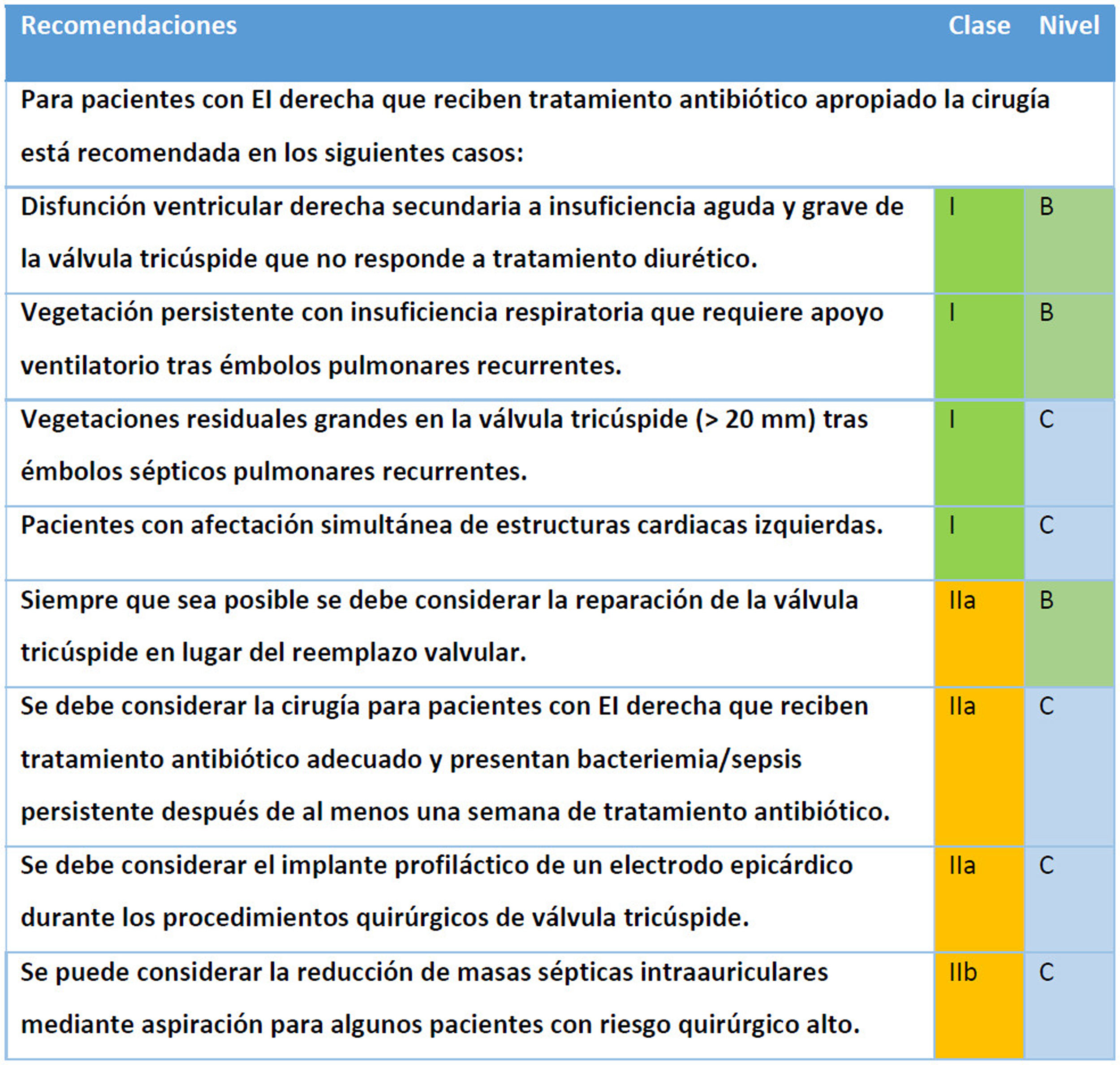
La decisión terapéutica debe individualizarse en el marco de un equipo especializado en EI. Las indicaciones quirúrgicas, según las guías ESC 2023 (fig. 3)23, incluyen:
- •
Bacteriemia persistente después de, al menos, una semana de tratamiento antibiótico adecuado, sobre todo en presencia de organismos multirresistentes u hongos.
- •
Disfunción ventricular derecha secundaria a insuficiencia tricuspídea aguda grave que no responde a tratamiento diurético.
- •
Insuficiencia respiratoria que requiere apoyo ventilatorio tras émbolos pulmonares recurrentes.
- •
Afectación de estructuras cardíacas izquierdas.
- •
Vegetaciones residuales grandes en la válvula tricúspide (>20mm) tras embolias pulmonares recurrentes.
Podemos estimar que en España la proporción de pacientes que precisan cirugía en el tratamiento de la EID no relacionada con dispositivos implantables es de alrededor del 18% de los casos diagnosticados. Hay diferencia entre los distintos grupos epidemiológicos; así, los pacientes UDVP presentan un menor porcentaje de intervención (6%), ya que se prioriza el tratamiento médico, mientras que el 40% de los no UDVP son sometidos a cirugía31.
Los grupos de pacientes UDVP y portadores de catéteres de larga duración o dispositivos intracardíacos tienen una afectación predominante de la válvula tricúspide, siendo la EI pulmonar concomitante o aislada un hecho raro31. En pacientes con CC la localización predominante es la pulmonar, generalmente sobre material protésico13.
Independientemente de la válvula afectada, el tratamiento quirúrgico se basa en los mismos principios que en la EI izquierda: extracción de todo el material protésico involucrado en la infección, incluyendo catéteres intravasculares y electrodos intracavitarios, desbridamiento amplio de todo el tejido infectado y reconstrucción posterior de las estructuras afectadas a fin de restaurar la funcionalidad cardíaca.
Válvula tricúspideComo se ha comentado, la EI tricuspídea suele limitarse a los velos y el anillo, siendo infrecuente la invasión de otras estructuras contiguas28. La técnica quirúrgica puede ir desde la simple exéresis de vegetaciones hasta el reemplazo valvular en casos graves no reparables, e incluso la valvulectomía en casos extremos.
Como en las patologías valvulares del lado izquierdo, la comunidad quirúrgica coincide en preferir la reparación valvular a la sustitución, siempre que esta sea factible. Sin embargo, hay que tener presente que no parece haber diferencia en la mortalidad a corto o a largo plazo entre ambas técnicas32, situándose la operatoria alrededor del 7%33. Hay mayor riesgo de IT residual y de recurrencia de la misma en la reparación32, debido a la diferencia en los resultados entre las distintas técnicas34 y a que es preferible una reparación con IT residual a una sustitución valvular tricuspídea. Por otro lado, la reparación presenta menor tasa de reintervención en el seguimiento y menor necesidad de marcapasos permanente32. Además se documenta menos recurrencia de EI en los pacientes reparados32, aunque este hecho puede ser debido a que la sustitución se realiza en individuos que presentan una enfermedad más agresiva con una destrucción valvular mayor.
A la hora de evaluar los resultados inmediatos o a largo plazo del cierre de defectos en el velo, así como del uso de parches de ampliación o de la inserción de neocuerdas, su efectividad es difícil de determinar. Esto se debe a que, en todos los estudios publicados, estos casos se incluyen dentro del grupo de reparación valvular, generalmente combinados o añadidos a las técnicas habituales de anuloplastia, por lo que no es posible diferenciar su utilidad ni su durabilidad reales respecto a la técnica principal empleada. En consecuencia, y ante la falta de datos que aclaren su valor específico, su utilización depende fundamentalmente de la experiencia y del juicio clínico del cirujano.
Las técnicas de reparación son las clásicas descritas para la patología tricuspídea no infecciosa: la bicuspidización de Kay, la anuloplastia con sutura de De Vega y sus modificaciones, así como las anuloplastias con anillo rígido, flexible o con banda de pericardio. Al comparar las distintas técnicas puede afirmarse que los anillos rígidos son preferibles a la anuloplastia con sutura, ya que se asocian con una menor tasa de recurrencia de IT en el seguimiento34.
En la sustitución valvular, no hay diferencias claras en supervivencia o reoperación entre prótesis mecánicas y biológicas35,36. Las complicaciones trombóticas son superiores en los portadores de prótesis mecánicas (1,69%-7,81% vs 0-2,20%), pese a recibir tratamiento anticoagulante adecuado36. Los pacientes con prótesis tricuspídeas mecánicas y los portadores de prótesis biológicas se reoperan en la misma proporción, solo que los que llevan mecánicas lo hacen por trombosis, y el grupo de bioprótesis, por degeneración protésica.
No existen datos consistentes sobre la incidencia de reinfección en la EID en función del tipo de prótesis utilizada. Si analizamos los estudios realizados sobre la patología del lado izquierdo podemos concluir que no hay diferencias significativas entre los tipos de prótesis en cuanto a la tasa de reEI37. Asimismo, algunos trabajos sugieren una mayor supervivencia a largo plazo en los pacientes portadores de prótesis mecánicas en el lado izquierdo37, aunque esta diferencia podría deberse al perfil clínico y epidemiológico de los pacientes más que a complicaciones derivadas de la naturaleza de la prótesis.
Si se consideran la equivalencia en supervivencia, libertad de reintervención y reinfección entre prótesis mecánicas y biológicas, la necesidad de anticoagulación con objetivos de INR elevados en las mecánicas, y la posibilidad de realizar procedimientos percutáneos de «válvula dentro de válvula» para tratar la degeneración de las prótesis biológicas, se explica la preferencia actual por implantar prótesis biológicas en patologías del lado derecho.
Otra alternativa es el uso de homoinjertos mitrales criopreservados en posición tricuspídea, ya sea de forma completa38 o parcial39. Aunque hay reportes de casos con una buena durabilidad a largo plazo y en los que se muestra que es posible realizar una reparación sobre el homoinjerto deteriorado40, las series publicadas tienen un seguimiento corto41, y si añadimos estos resultados a las de la posición mitral, que tienen un seguimiento más largo con una libertad de reintervención y de deterioro estructural a los 10años de 79% y 76%, respectivamente42, se puede concluir que la durabilidad de los estos homoinjertos es, en el mejor de los casos, similar a la de las prótesis biológicas.
Válvula pulmonarComo ya se ha comentado, la EI pulmonar (EIP) es la localización menos frecuente de la enfermedad. Según el registro GAMES, la mitad de las EIP diagnosticadas son sobre válvula nativa y la otra mitad sobre válvula protésica14, aunque en centros de referencia para el tratamiento de las cardiopatías congénitas del adulto puede haber una sobrerrepresentación de este segundo grupo.
En la EI pulmonar nativa es rara la afectación infecciosa invasiva y perianular28: lo más frecuente es la presencia de vegetaciones y la destrucción de las valvas, por lo que la reparación valvular no es posible y el procedimiento que se aplica es la sustitución, a menudo con parche de ampliación pulmonar43 para implantar una prótesis lo suficientemente grande que permita albergar más de una prótesis percutánea en el futuro si fuera necesario.
La gran mayoría de pacientes afectados por EIP protésica pertenecen al grupo de adultos con cardiopatía congénita. Estos pacientes precisan una planificación prequirúrgica cuidadosa, definiendo bien las particularidades anatómicas con pruebas de imagen y evaluando la extensión de la infección. Hay que tener en cuenta que además de la prótesis pulmonar estos pacientes suelen tener más material protésico cerca del foco infeccioso, como parches de Dacron® o pericardio cerrando defectos septales o ampliando el tracto de salida derecho. Es importante documentar la afectación de este material con pruebas como el 18F-FDG PET/TC y valorar su sustitución en la cirugía, teniendo en cuenta que hacerlo aumenta la dificultad y el riesgo del procedimiento. Estas decisiones deben abordarse en las reuniones del equipo de endocarditis y adaptarse a los hallazgos intraquirúrgicos. En estos pacientes a menudo es necesario reemplazar el tronco pulmonar con una prótesis vascular, ya sea porque la prótesis original era un conducto valvulado o porque, siendo una prótesis simple, tras el explante de la misma y el desbridamiento del tejido infectado es más sencillo reemplazar todo el tronco pulmonar por una prótesis vascular recta con una válvula en su interior que intentar reparar la propia arteria pulmonar, que es una estructura frágil.
A la hora de elegir el tipo de prótesis nos encontramos con la misma situación expuesta en el apartado de la cirugía tricúspide: No hay diferencias claras en cuanto a libertad de reintervención entre prótesis mecánicas y biológicas, siendo el motivo de reintervención en las mecánicas la trombosis, y en las biológicas, la degeneración44,45. Por ello la tendencia es a implantar prótesis biológicas con el fin de evitar la anticoagulación y permitir procedimientos de sustitución percutánea en el futuro.
También hay que valorar la utilización en esta posición de homoinjertos pulmonares criopreservados, con una libertad de reintervención a 10años del 89%46, similar al 83% reportado para algunas prótesis de pericardio bovino47. El uso de estos injertos está sujeto a la experiencia y a la preferencia del equipo quirúrgico.
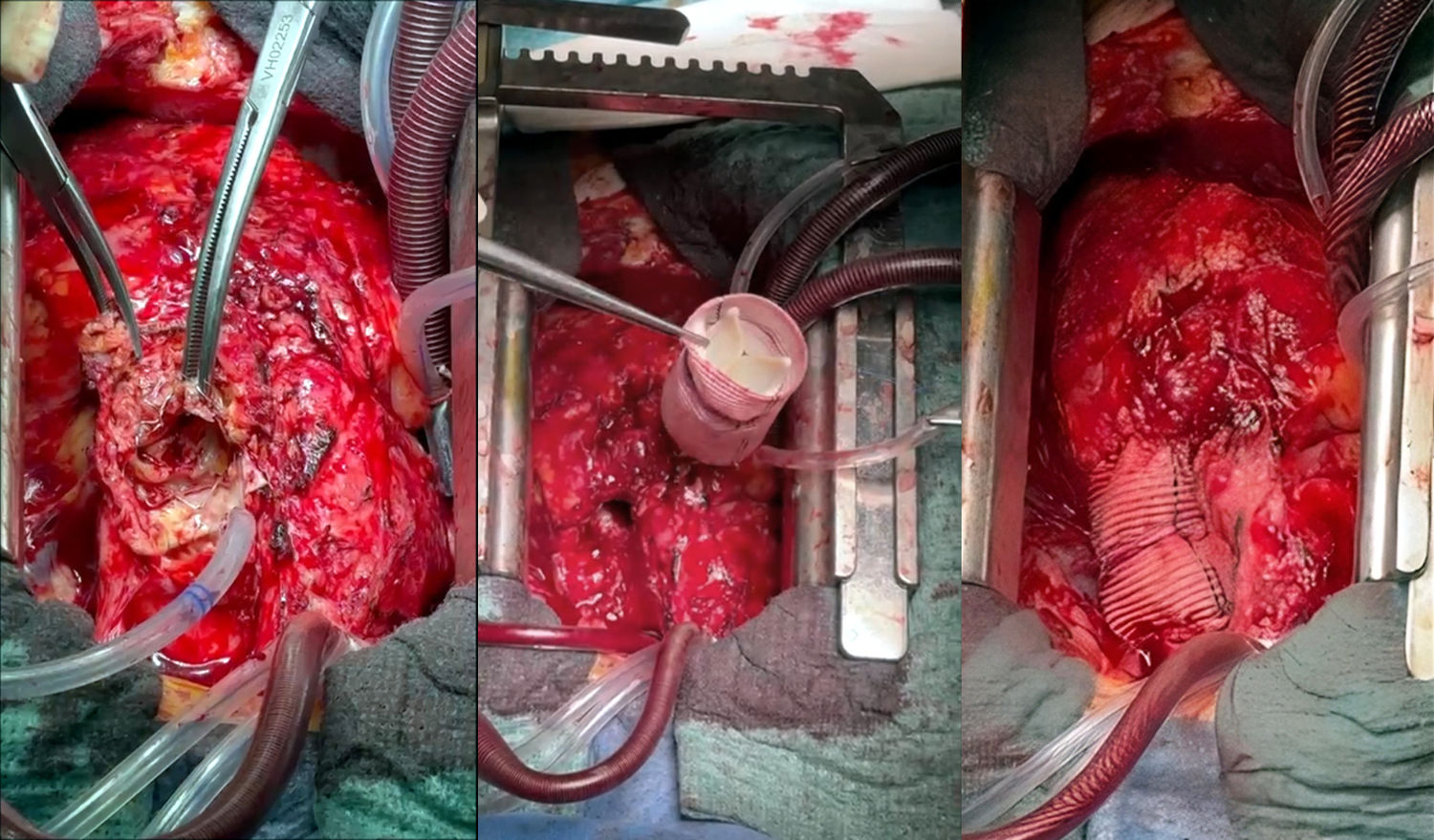
La figura 4 muestra imágenes intraoperatorias de la sustitución de un conducto pulmonar infectado.
Otras técnicasEn los últimos 10 años ha surgido un interés creciente en el uso de dispositivos de aspiración percutánea de masas intracardíacas (como AngioVac®) para reducir las masas sépticas auriculares o valvulares con el objetivo de lograr la estabilización clínica en casos de sepsis persistente, incluso como puente a la cirugía o como alternativa si esta está contraindicada. Con estos dispositivos se consigue una reducción de al menos el 50% de la masa séptica en el 89% de los casos y un éxito clínico (entendido como supervivencia al procedimiento, ausencia de bacteriemia recurrente y la no necesidad de intervención posterior sobre las válvulas tratadas) del 79%48.
Debe tenerse en cuenta que esta técnica se reserva fundamentalmente para pacientes sin opción quirúrgica convencional. Las guías de práctica clínica de la ESC 202323 recomiendan que la reducción de la masa séptica mediante aspiración percutánea se limite a pacientes seleccionados con alto riesgo quirúrgico, con una recomendación claseIIb y nivel de evidenciaC, reflejando el carácter aún limitado de la evidencia disponible. Además, no debe obviarse que la práctica de este procedimiento no está exenta de complicaciones potencialmente graves, incluso fatales, por lo que su indicación debe individualizarse cuidadosamente en el contexto de un equipo multidisciplinar especializado.
ConclusiónLa EI infecciosa derecha, aunque menos frecuente que la izquierda, representa un desafío clínico creciente debido a la diversificación de sus factores de riesgo. El uso de drogas por vía parenteral ha disminuido en nuestro entorno, pero hay un aumento en el uso de dispositivos intracardíacos, catéteres de larga duración y una mayor supervivencia de pacientes con cardiopatías congénitas. Su diagnóstico se fundamenta en la integración de criterios clínicos, microbiológicos y de imagen, con avances en técnicas como la ecocardiografía, la TC y la 18F-FDG PET/TC que han mejorado la sensibilidad diagnóstica, especialmente en casos protésicos o anatómicamente complejos.
Las complicaciones, como insuficiencia valvular y embolias pulmonares sépticas, son manejadas exitosamente con terapia antimicrobiana en la mayoría de los casos, pero un subgrupo requiere cirugía, guiada por indicaciones precisas de las guías ESC 2023. Las estrategias quirúrgicas priorizan la reparación tricúspide cuando es factible, y en el caso de que sea preciso sustituir la válvula enferma se favorecen las prótesis biológicas en ambas posiciones por su menor necesidad de anticoagulación y viabilidad para procedimientos percutáneos futuros. En pacientes con cardiopatías congénitas la planificación quirúrgica debe considerar la extensión de la infección y materiales protésicos adyacentes. Ciertas técnicas emergentes, como la aspiración percutánea, ofrecen alternativas en casos no quirúrgicos. La gestión óptima de la EID requiere un enfoque multidisciplinario, liderado por un «Equipo de endocarditis», para individualizar decisiones y optimizar resultados en esta población heterogénea y de alto riesgo.
FinanciaciónEste trabajo no ha recibido ninguna financiación externa o interna para su realización o preparación.
Consideraciones éticasEste artículo de revisión narrativa se basa en la literatura científica publicada y no incluye datos primarios de pacientes ni intervenciones clínicas. Por lo tanto, no fue necesario obtener consentimiento informado de participantes, ni se han utilizado datos identificativos de individuos. El manuscrito se ha elaborado respetando las directrices éticas generales de publicación científica, incluyendo la Declaración de Helsinki y las normas de confidencialidad y privacidad de datos.
Declaración sobre el uso de la inteligencia artificialDurante la preparación de este trabajo, los autores utilizaron Grok®, desarrollado por xAI, de manera limitada para la revisión ortográfica y semántica del manuscrito, con el fin de mejorar la claridad y corrección lingüística. Tras utilizar esta herramienta los autores revisaron y editaron el contenido según fue necesario y asumen toda la responsabilidad por el contenido del artículo publicado.
Contribución de los autoresTodos los autores cumplen con los criterios de autoría sustancial según las directrices del International Committee of Medical Journal Editors (ICMJE). Cada autor ha contribuido en la redacción de una sección específica del artículo correspondiente a su campo de especialidad. Miguel A. Castro ha realizado la concepción y diseño general del artículo, la integración de las secciones individuales en un manuscrito unificado, la unificación de la literatura relevante, así como la revisión crítica del contenido completo. Posteriormente, todos los autores han revisado el manuscrito integrado, proporcionado comentarios y sugerencias de cambios, y aprobado la versión final enviada para publicación. No se han realizado cambios en la autoría desde la concepción inicial del trabajo.
Conflicto de interesesLos autores declaran no tener conflictos de intereses relevantes con respecto al contenido de este artículo, incluyendo relaciones financieras, consultorías, propiedad de patentes o cualquier otra influencia potencial en la objetividad del trabajo.
AgradecimientosLos autores expresan su agradecimiento al Grupo de Endocarditis del Hospital Vall d’Hebron por su destacada labor clínica y científica en el campo de la endocarditis, que sirvió como inspiración para el desarrollo de esta revisión.




![Imágenes de endocarditis pulmonar. A)Imagen de ETE de endocarditis pulmonar nativa en paciente en UCI. Vegetación de gran tamaño en planos valvular pulmonar en plano medioesofágico alto de grandes vasos. B,C)Endocarditis protésica pulmonar. Imagen de ETT sin vegetaciones (B). TAC con engrosamiento de velos protésicos y absceso perianular (flechas). D-F)Imágenes de paciente con vegetaciones y trombo en prótesis pulmonar biológica percutánea (Melody) (ETE flechas [D]). Turbulencia en flujo transvalvular pulmonar y gradientes elevados (E,F). Imágenes de endocarditis pulmonar. A)Imagen de ETE de endocarditis pulmonar nativa en paciente en UCI. Vegetación de gran tamaño en planos valvular pulmonar en plano medioesofágico alto de grandes vasos. B,C)Endocarditis protésica pulmonar. Imagen de ETT sin vegetaciones (B). TAC con engrosamiento de velos protésicos y absceso perianular (flechas). D-F)Imágenes de paciente con vegetaciones y trombo en prótesis pulmonar biológica percutánea (Melody) (ETE flechas [D]). Turbulencia en flujo transvalvular pulmonar y gradientes elevados (E,F).](https://static.elsevier.es/multimedia/11340096/unassign/S1134009625003080/v1_202512240418/es/main.assets/thumbnail/gr1.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)





