En este artículo presento el estado actual en el desarrollo fisiopatológico del remodelado ventricular tras el infarto de miocardio empleando como técnica de imagen la resonancia magnética. De esta forma, podemos conocer y entender mejor la eficacia de las técnicas de reconstrucción ventricular.
This article describes the current state in the pathophysiological development of ventricular remodeling after myocardial infarction, using imaging techniques such as MRI. In this way we can know and understand the effectiveness of ventricular reconstruction techniques.
En la mayoría de los casos, tras un infarto de miocardio (IM), la insuficiencia ventricular progresiva puede tener una evolución variable llamada remodelación ventricular y está relacionada con la cicatriz parietal, como ya demostraron Klein y Gorlin1 en 1967, cuando el 20% de la superficie es asinérgica (acinésica o discinésica), y McKay et al. en 19862, cuando la cicatriz afecta al 40% de la circunferencia ventricular. Esta cicatriz aparece en más del 90% de los casos después de un IM, incluso tras repermeabilización con trombólisis o angioplastia, como demostraron Christian3 en 1991 y en 1994, y Bolognese et al.4 en 2001. Resulta muy importante en el manejo terapéutico de la cardiomiopatía isquémica, distinguir lo que deriva de la isquemia miocárdica (intermitente o residual) del miocardio no infartado, de lo que deriva de la cicatriz del miocardio (con necrosis irreversible). Esta distinción no es semántica, sino realista y necesaria para los cardiólogos, puesto que la isquemia es considerada como tratable, por abordaje tanto quirúrgico como endoluminal, mientras que la cicatriz parietal es considerada en general como intratable y abocada a un tratamiento médico paliativo, y en caso de ineficacia (no infrecuentemente) abocado a tratamientos terapéuticos heroicos y difíciles de generalizar, como el trasplante cardíaco o la asistencia ventricular.
Sin embargo, desde los años 90, la resonancia magnética (RMN), mejor que la ecografía (mono, bi o tridimensional), o la angiografía (cine-angiografía o isotópica), no solo nos permite obtener mediciones hemodinámicas más precisas y reales de la función miocárdica5, también nos ayuda a distinguir claramente lo que es viable de lo que está en proceso cicatricial. Y la comparación de imágenes dinámicas en las proyecciones de 2, 3, 4 cavidades y eje corto, así como el estudio de la necrosis parietal (transparietal o subendocárdica), mediante la detección de realce tardío de gadolinio (gadolinium let enhancement [GLE])6, permite conocer de manera precisa el porcentaje exacto de perímetro ventricular con cicatriz y entender el mecanismo deletéreo que conduce a la remodelación ventricular progresiva.
Ya, en 1935, Tennant y Wiggers7 estudiaron los movimientos de la pared ventricular tras IM, demostrando un claro contraste entre la normocinesia (contracción concéntrica sistólica), la hipocinesia y la acinesia (asinergia); esta última podría ser acinesia o discinesia. Entendiendo por discinesia la expansión sistólica centrífuga y por acinesia una afectación más difusa y de peor pronóstico. Al conjunto de estas zonas asinérgicas lo denominamos cicatriz miocárdica tras IM.
La capacidad de identificar la necrosis irreversible por RMN-GLE («no reflow» u obstrucción microvascular en las primeras horas o días, de color negro, y posteriormente cicatriz fibrosa irreversible, de color blanco) ha permitido distinguir en la dinámica parietal, entre lo que sería patología orgánica (discinesia o bulging o expansión sistólica) de una cicatriz transparietal adelgazada (contrastando con la hipercinesia del resto de la pared), y lo que sería patología funcional: la deletérea expansión sistólica centrífuga («deleterious excentric systolic motion» [DESM]) que afecta al miocardio sano que circunda la cicatriz necrótica.
Esta inversión de la contracción sistólica del miocardio sano aparece ya en las primeras horas tras la necrosis y la RMN con la superposición de imágenes dinámicas (vídeo) con imágenes fijas tras impregnación por gadolinio permite no confundir esta zona intermedia con la cicatriz. Si la cicatriz es limitada (menos de un cuarto de la circunferencia ventricular), la DESM afecta únicamente a un área limitada (confundida por eco y angiografía con la cicatriz) y la evolución se hace hacia un asinergia (discinesia o acinesia) limitada, compensada por una hipercinesia concéntrica del área miocárdica normal. Sin embargo, si la cicatriz se extiende a más de un tercio de la circunferencia, esta DESM del miocardio sano provoca la dilatación progresiva del ventrículo hacia lo que será el remodelado post-IM. Identificar de forma precisa, tras un IM, la extensión y la localización de la necrosis resulta capital para un tratamiento eficaz.
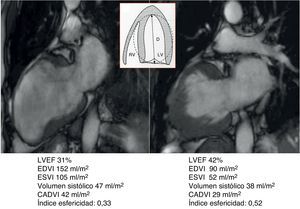
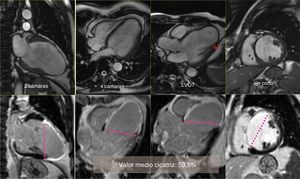
Cartografía cardíaca por resonancia magnéticaEn nuestro centro, un equipo de RMN está en funcionamiento desde el año 2001, dirigido por un cardiólogo especialista; de esta forma miles de pacientes se han podido beneficiar de este enfoque en las diferentes etapas de la evolución tras un IM. Sistemáticamente, en cada prueba se toman los valores hemodinámicos, los volúmenes ventriculares y auriculares, el diámetro del anillo mitral, así como el porcentaje de cicatriz que afecta a la circunferencia del ventrículo analizado en 4 proyecciones (2, 3, 4 cámaras y en eje corto a nivel de la inserción de los músculos papilares), estos 4 valores sumados y divididos por 4 nos proporcionan el porcentaje medio de cicatriz, pudiéndose realizar una cartografía para cada paciente (fig. 1).
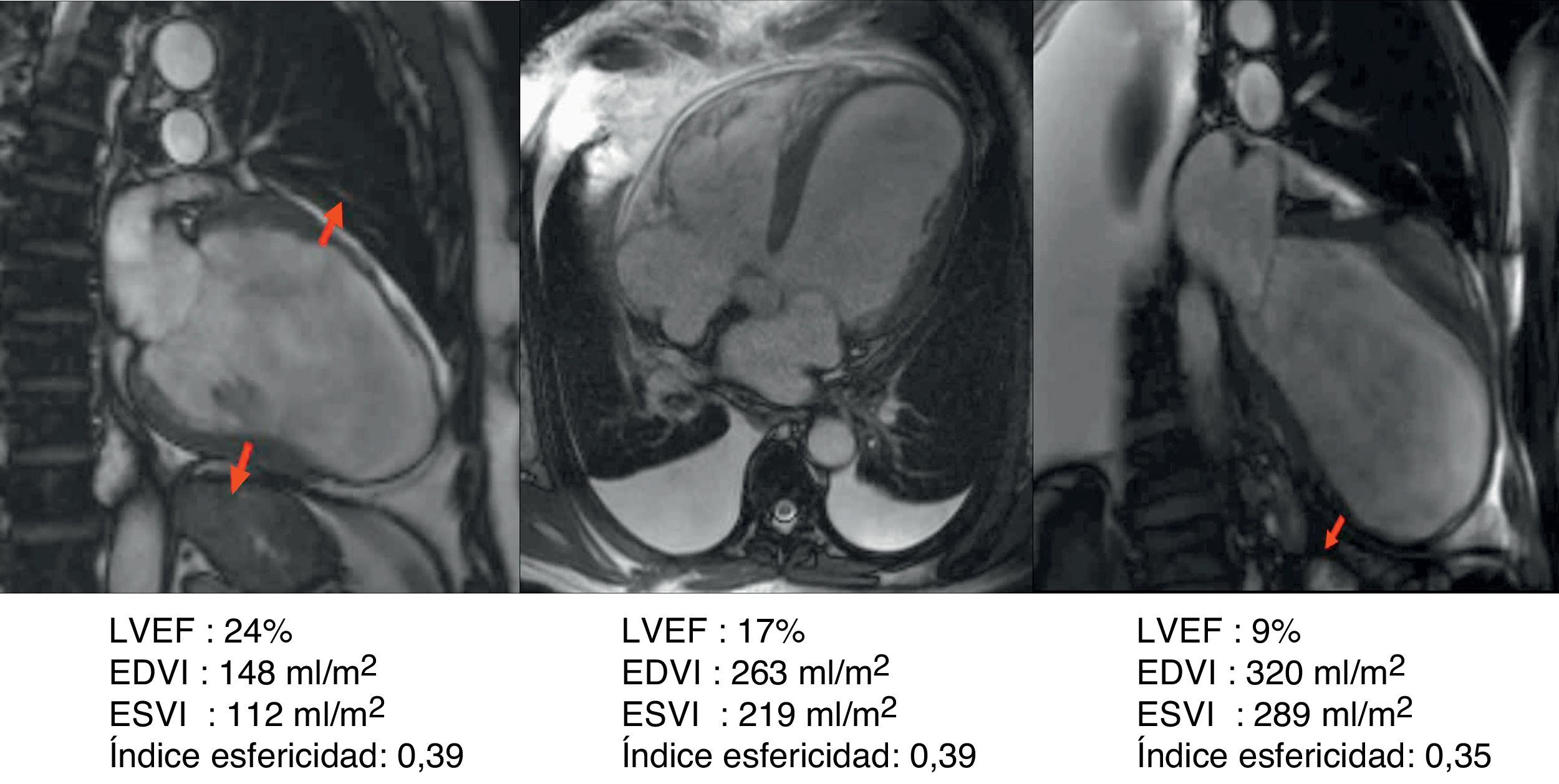
Caso clínico de paciente de 57 años con stent en arteria descendente anterior por infarto de miocardio. Seis años después desarrolla insuficiencia cardíaca grado iii. En el estudio con resonancia magnética muestra fracción de eyección del 24%, índice de volumen telediastólico 148ml/m2, índice volumen telesistólico 112ml/m2, índice esfericidad 0,39, volumen sistólico > 60ml/m2. El estudio del porcentaje medio de cicatriz en la pared (área asinérgica) es del 53,5%. El índice de volumen teórico de la cavidad contráctil es de 68ml/m2, calculado a través de la formula CADVI (Contractile Area Diastolic Volume Index)=EDVI – (EDVI×53,5%)/100.
El análisis de las cavidades cardíacas en las 4 proyecciones resulta indispensable para localizar la extensión de la cicatriz. Estas 4 proyecciones, así como el eje corto, permiten ver claramente las cicatrices septales y aquellas de la cara lateral izquierda del ventrículo, no visibles en la clásica proyección angiográfica oblicua anterior derecha, empleada para calcular los volúmenes, por angiografía o ecocardiografía (usando el método Simpson), incluso utilizada para una supuesta clasificación de los aneurismas postinfarto totalmente obsoleta.
La ecografía 3D no está sujeta a estas críticas del análisis inadecuado de las paredes; no obstante, el haz frontal de ultrasonido puede ser burlado por lesiones antero-septo-apicales amplias que lo rebasen, mientras que la RMN es exacta y precisa en todos los casos.
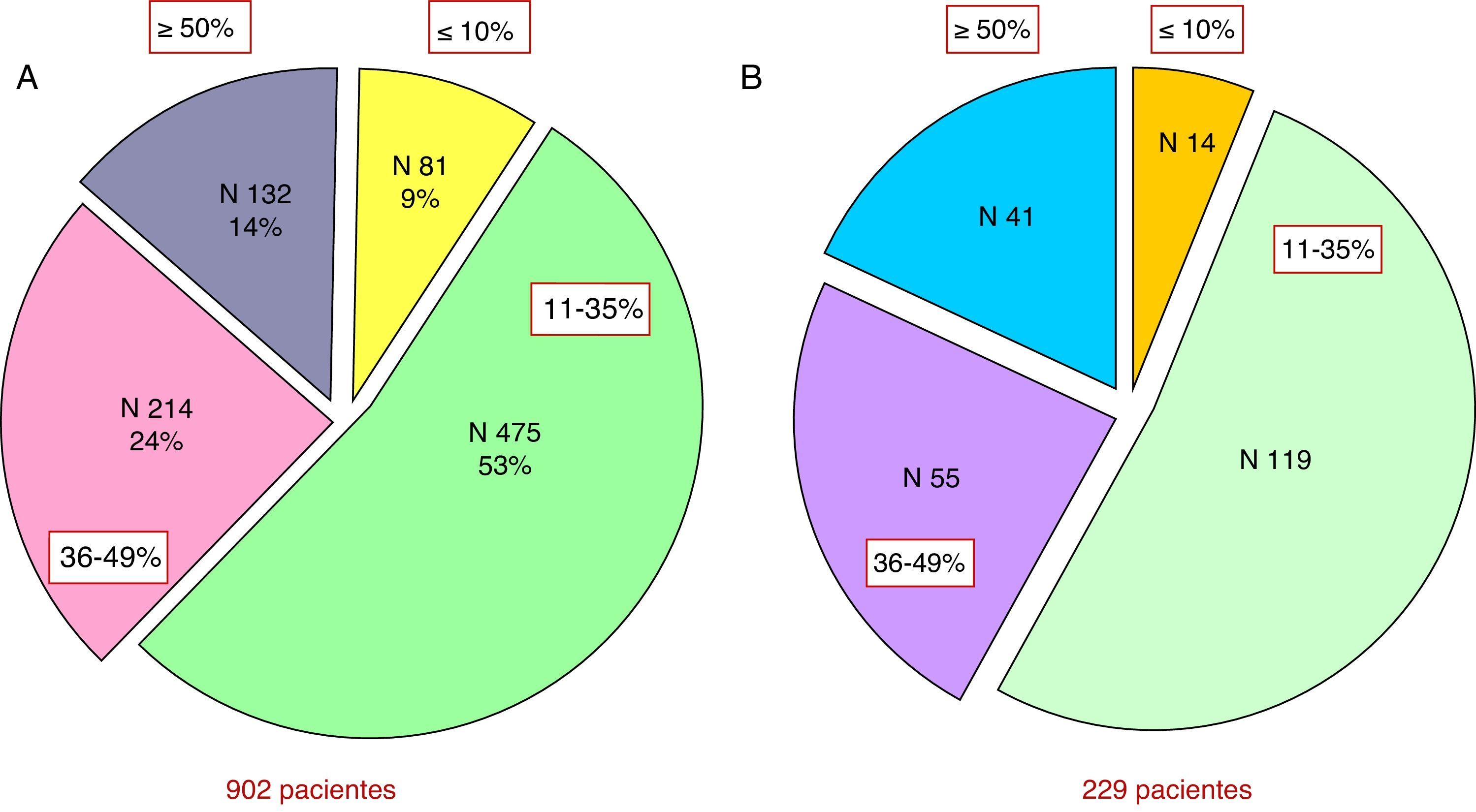
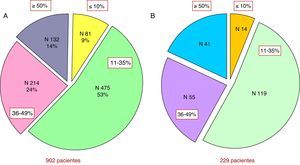
Tamaño de la cicatriz y remodelación ventricularUna serie de 902 pacientes (2002-2006) a los que se les realizó una cartografía tras IM han sido estudiados clínica y estadísticamente por di Donato. Este estudio ha buscado la relación entre el tamaño de la cicatriz y las consecuencias hemodinámicas, así como la relación entre el tamaño de la cicatriz y el grado de la insuficiencia cardíaca avanzada (advanced heart failure [AHF]), es decir, los criterios de insuficiencia cardíaca analizados y propuestos por la Sociedad Europea de Cardiología8.
Para realizar esto, las cicatrices postinfarto se clasificaron en 4 categorías, de acuerdo con el porcentaje de la circunferencia del ventrículo afectado: del 0 al 10%, del 11 al 34%, del 35 al 49% y mayor al 50%. Hemos de tener en cuenta que, independientemente del tratamiento aplicado, menos de 10% de los pacientes tienen una cicatriz inferior al 10% del perímetro ventricular incluso tras repermeabilización. En la figura 2 podemos apreciar el porcentaje de pacientes según el porcentaje cicatricial en la circunferencia del ventrículo afectado.
Estudio del tamaño de la cicatriz y la remodelación ventricular en 902 pacientes del Centro Cardio-Torácico de Mónaco. A) Distribución por porcentajes en el grupo global de 992 pacientes según el grado de afectación del perímetro de ventrículo izquierdo con cicatriz. B) Distribución en el subgrupo de 229 pacientes con repermeabilización coronaria previa.
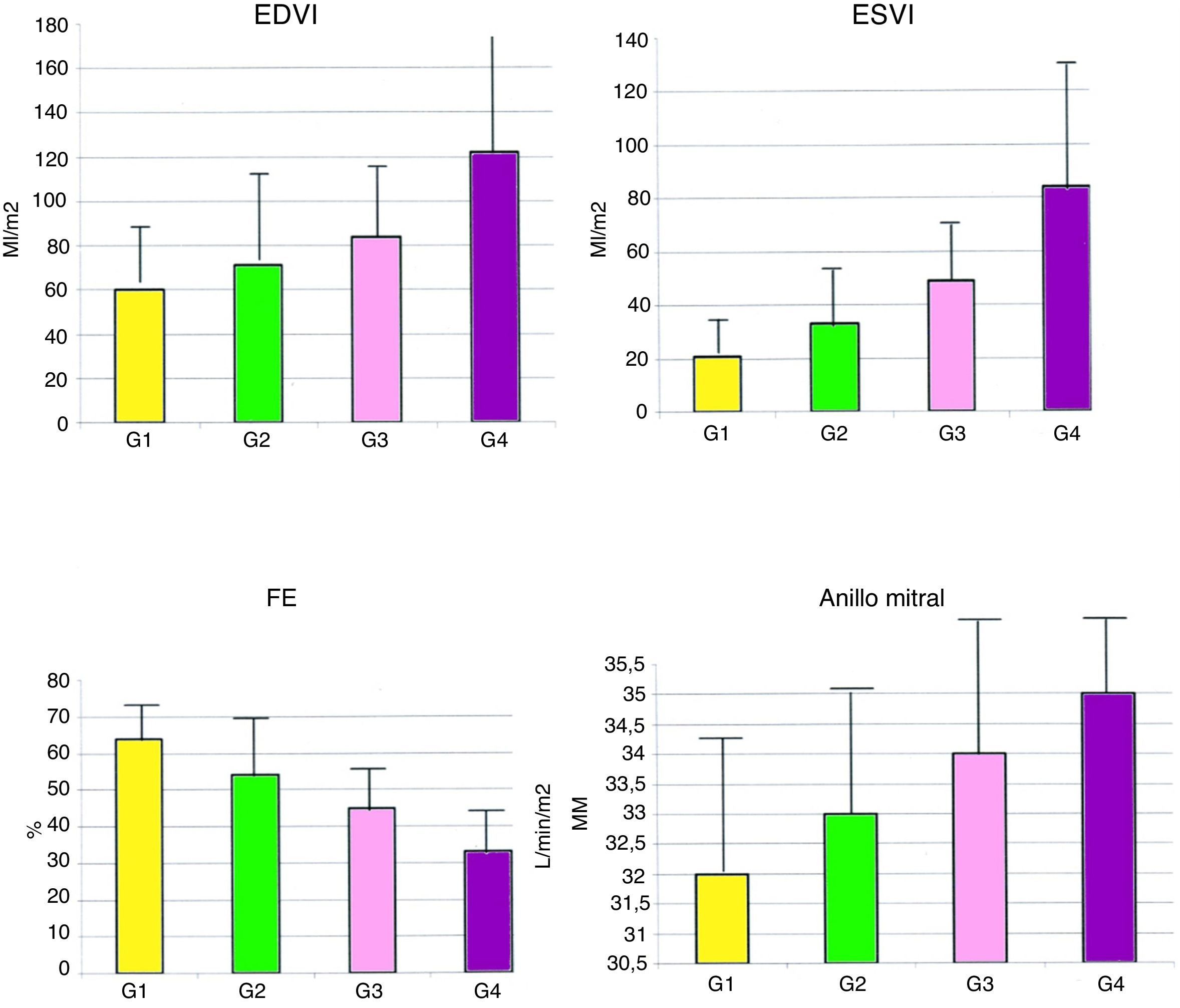
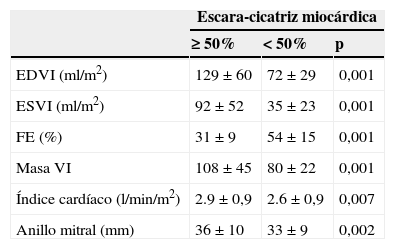
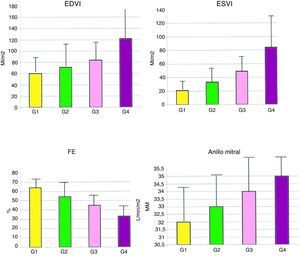
La figura 3 muestra que hay una relación directa entre el tamaño de la cicatriz y la hemodinámica ventricular. En la tabla 1 se aprecian los datos.
- •
Valor casi normal para las cicatrices inferiores al 10%.
- •
Volumen ventricular y fracción de eyección, moderadamente modificados para las cicatrices entre el 10 y el 35%.
- •
Volumen ventricular aumentado y fracción de eyección, notablemente reducida para las cicatrices entre el 35 y el 50%.
- •
Volúmenes ventriculares y fracción de eyección en el umbral de tolerancia diámetro telesistólico del ventrículo izquierdo ESVI > 60ml/m2, como demostraron White et al.9 con insuficiencia cardíaca permanente para las cicatrices superiores al 50%.
Gráficos con la relación entre el tamaño de la cicatriz y la hemodinámica ventricular en el grupo global de 902 pacientes.
EDVI: diámetro telediastólico del ventrículo izquierdo; ESVI: diámetro telesistólico del ventrículo izquierdo; FE: fracción de eyección; G: porcentaje de la circunferencia del ventrículo afectado: G1 del 0 al 10%, G2 del 11 al 34%, G3 del 35 al 49%, y G4 mayor del 50%.
Parámetros morfológicos del ventrículo izquierdo según el tamaño de la cicatriz miocárdica
| Escara-cicatriz miocárdica | |||
|---|---|---|---|
| ≥ 50% | < 50% | p | |
| EDVI (ml/m2) | 129±60 | 72±29 | 0,001 |
| ESVI (ml/m2) | 92±52 | 35±23 | 0,001 |
| FE (%) | 31±9 | 54±15 | 0,001 |
| Masa VI | 108±45 | 80±22 | 0,001 |
| Índice cardíaco (l/min/m2) | 2.9±0,9 | 2.6±0,9 | 0,007 |
| Anillo mitral (mm) | 36±10 | 33±9 | 0,002 |
EDVI: diámetro telediastólico del ventrículo izquierdo; ESVI: diámetro telesistólico del ventrículo izquierdo; FE: fracción de eyección; VI: ventrículo izquierdo.
Los datos que se presentan son de media ± DE.
En 560 pacientes, los criterios para la AHF, propuesta por la Sociedad Europea de Cardiología, por Metra et al., han podido registrarse con precisión y hemos comprobado una relación directa entre el grado de insuficiencia cardíaca y el porcentaje de cicatriz (áreas de necrosis) de la circunferencia de la pared ventricular detectadas mediante RMN cardíaca con el estudio de realce tardío de gadolinio. Los pacientes con insuficiencia cardíaca tienen un 41% de escara frente a los que no tiene insuficiencia cardíaca, con tan solo un 21% de escara. Estadísticamente, la receiver operating curve (curva ROC) creada a partir de esta serie muestra que el punto de corte es 0,32, o sea que el 32% de la circunferencia ventricular predice insuficiencia cardíaca (OR 0,8, IC del 95%, 0,761-0,853; p<0,001).
Mecanismos de la dilatación ventricular progresiva (remodelación)El principal detonante de la remodelación es la cicatriz, pero el mecanismo de dilatación ventricular, es la contracción sistólica centrífuga deletérea del miocardio sano que rodea el área de la cicatriz, y si esta última excede el 30% del perímetro ventricular, ello conllevará una dilatación progresiva e irreversible de la cavidad sea cual sea el tratamiento paliativo aplicado. Esta inversión de la contracción sistólica del miocardio sano aparece en las primeras horas tras el infarto, cuando la cavidad ventricular todavía tiene un volumen normal.
Esta contracción sistólica invertida solo se ve en las imágenes de vídeo en movimiento y un software específico se está desarrollando a fin de señalizarla mediante flechas en sístole sobre imágenes fijas.
En resumen, la fisiopatología de la remodelación ventricular se asocia al tamaño del infarto:
- •
El desencadenante es la extensión de la cicatriz del miocardio, ya sea subendocárdica o transmural, cuando excede de un tercio de la circunferencia ventricular.
- •
El mecanismo de la expansión gradual del miocardio no infartado es debido a la expansión sistólica centrífuga deletérea circundante a la zona de la cicatriz del miocardio sano. Esta dilatación puede ser beneficiosa inicialmente a fin de mantener el volumen sistólico (ley Starling), pero resulta perjudicial por su efecto de distensión de la pared (ley de Laplace). Esta dilatación conlleva una compleja respuesta inflamatoria y neuro-hormonal, bien descrita por Pfeffer y Braunwald10, del sistema cardiovascular, pero esta reacción que contrarrestan los inhibidor de la enzima conversiva de la angiotensina y los betabloqueantes es tan solo una consecuencia, una reacción, y no la causa del remodelado.
Por lo tanto, hay que distinguir en el abordaje terapéutico en el tratamiento de las consecuencias, que es paliativo, y en el tratamiento de la causa, que tendrá una finalidad curativa.
El tratamientoDeberá ser lógico y basado en un profundo conocimiento de la anatomía patológica y la fisiopatología del paciente. Si la isquemia, tanto en reposo como en esfuerzo, persiste en determinadas zonas (repermeabilizadas, pero no revascularizadas), no hace falta decir que se impone una revascularización lo más completa posible, endoluminal o quirúrgica, dependiendo de las circunstancias.
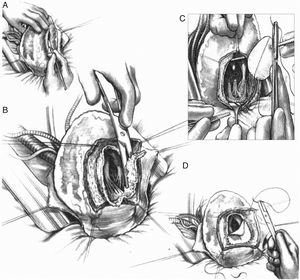
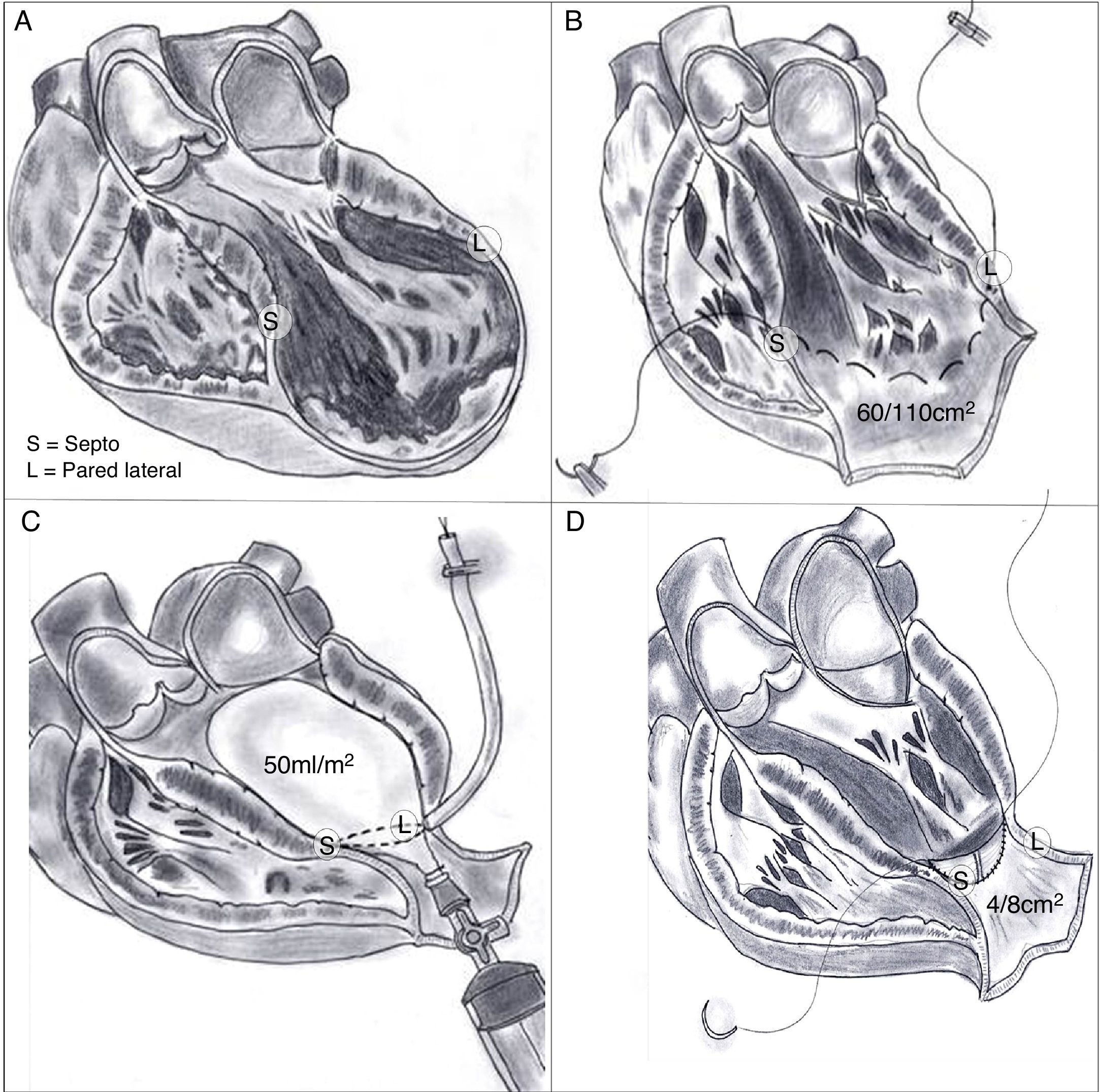
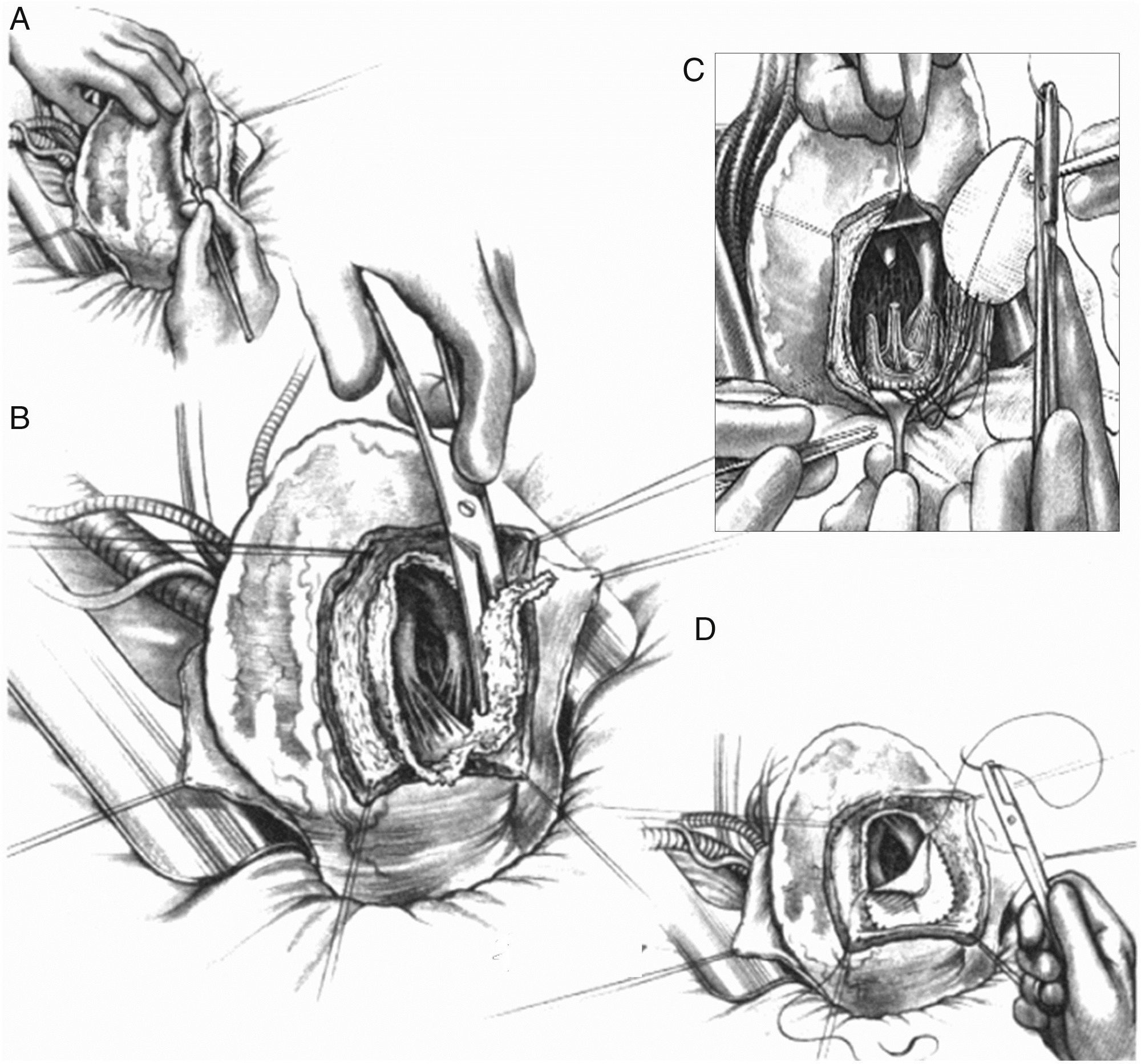
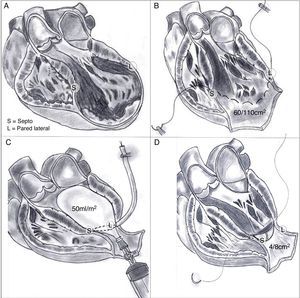
Pero si la cicatriz definitiva de la pared ventricular supera el 30% de la circunferencia, el único tratamiento lógico implica la reconstrucción ventricular izquierda. En 1984, siguiendo los principios de Harken y Horovitz11, que demostraron la eficacia de las endocardiectomías subtotales para tratar arritmias malignas, surgió la necesidad, tras esa actitud eficaz frente a los trastornos del ritmo pero sin mejora alguna de la función ventricular, de completar el gesto para una reorganización del miocardio restante. Para ello se empleó un parche circular implantado tras una sutura circular en el borde del miocardio sano ajustada, con el fin de restaurar la curvatura adecuada del miocardio («Fontan trick»), publicado por primera vez en 198512 y posteriormente en 198913 (fig. 4).
Técnica para la restauración del ventrículo izquierdo. A) Aneurisma antero septal-apical. B) Una vez abierto el ventrículo izquierdo, una sutura en bolsa de tabaco («Fontan trick») se ha fijado en el límite entre el miocardio normal y fibrosa, y se frunce con el fin de reorganizar la curvatura del tabique y la pared del ventrículo, distendido por dilatación. C) Para evitar la reducción excesiva del volumen, esta sutura se ata con un globo inflado en el interior del ventrículo a la capacidad teórica diastólica del paciente (50ml/m2 por BSA). D) Posteriormente, se sutura un parche sintético que complete la reconstrucción endoventricular. El parche es suturado sobre miocardio contráctil.
Los objetivos de esta reconstrucción ventricular izquierda mediante plastia con parche endoventricular (endoventricular patch plasty) (fig. 5) son:
- •
Eliminar (mediante resección o exclusión de la cavidad ventricular) la zona de la cicatriz, causa de la remodelación, sea la cicatriz transmural o subendocárdica.
- •
Restaurar la curvatura normal del miocardio sano distendido alrededor de la cicatriz, a través de la sutura circular al borde de la resección endocárdica.
- •
Mantener un adecuado volumen diastólico ventricular, mediante la colocación en la cavidad ventricular de un globo de látex lleno al volumen diastólico fisiológico del paciente (50ml/m2 de la superficie corporal) mientras se ajusta la sutura circular. Todo esto a fin de evitar, tras una resección amplia parietal o exclusión endoventricular, una cavidad ventricular reducida con riesgo de cardiopatía restrictiva.
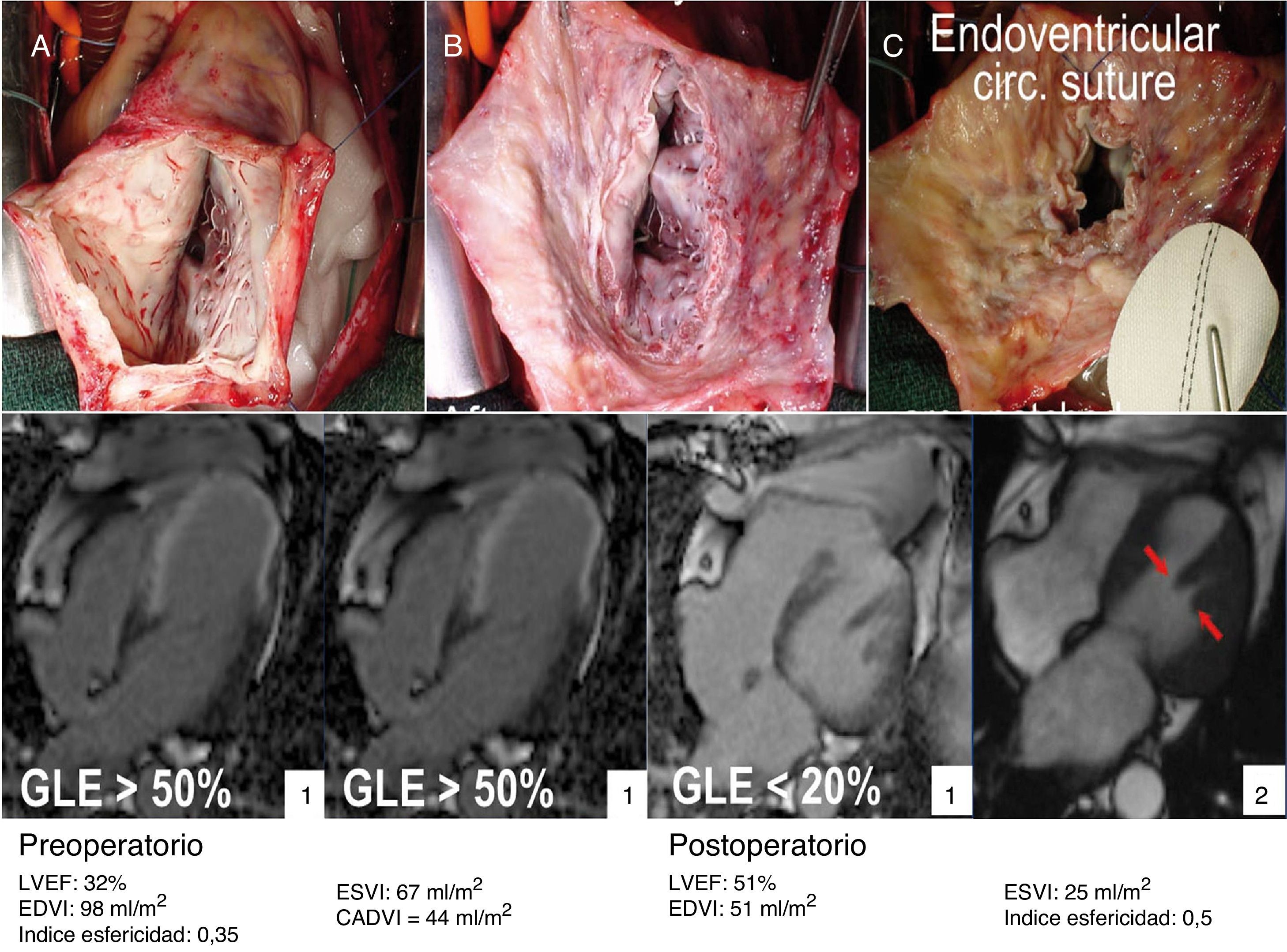
En el panel superior, se puede apreciar una visión quirúrgica. A) Ventriculotomía izquierda sobre aneurisma anteroseptal, con extensa escara cicatricial endocárdica. B) Tras escarectomía, se puede apreciar el límite donde se encuentra el miocardio contráctil. C) Sutura de Fontan y sutura de parche de 6cm2. En el panel inferior, la secuencia de imágenes de resonancia magnética pre y postoperatorias del caso anterior. Mediante la detección de realce tardío de gadolinio (gadolinium let enhancement [GLE]) se calcula el área de cicatriz ventricular.
Esta técnica se acompaña en el 95% de los casos de una revascularización coronaria (arterial en la mayoría de los casos), y en más del 50% de los casos de una anuloplastia mitral posterior con el fin de reducir la expansión posterior entre los 2 trígonos (considerando al anillo aórtico anterior no distensible). Esta técnica ha sido objeto de numerosas publicaciones y presentaciones14,15.
Dependiendo de la ubicación anatómica, existen diferencias en la técnica quirúrgica:
- •
Ubicación antero-septal, la endocardiectomía debe realizarse en el Septem, al igual que en la cara lateral izquierda, teniendo en cuenta de realizar la sutura circular en la base de los músculos papilares mitrales. El parche se corta entonces según el tamaño del orificio restante tras ajustar la sutura circular, siendo el parche oval o circular, ajustado siempre al orificio, en ningún caso predeterminado.
- •
Ubicación estrictamente posterior (fig. 6), si el pilar posterior mitral debe ser desinsertado para la endocardiectomía, este debe ser reinsertado en el parche, el cual será generalmente triangular (triángulo isósceles) con base posterior, a fin de mantener la arquitectura del anillo mitral. Esta base del triángulo se sutura muy cerca del anillo, mientras que los 2 bordes laterales servirán para aproximar el miocardio sano de la cara lateral izquierda al tabique, por encima de la zona cicatricial.
En los infartos posteriores o postero-laterales, si los pilares mitrales están totalmente en la zona de la cicatriz, es mejor reemplazar la válvula mitral por vía endoventricular. Tras esta sencilla técnica, se deberá implantar el parche triangular o longitudinal manteniendo el volumen adecuado.
- •
En caso de rotura septal, el parche debe ser colocado sobre la zona necrótica, excluyendo toda la zona antero-apical o postero-apical necrótica. En estas circunstancias, a menudo, pocos días, incluso pocas horas tras el infarto, el anclaje del parche debe hacerse con puntos sueltos en U, transparietales, apoyados en pericardio o teflón, en el borde del miocardio infartado, a fin de asegurar la solidez de la fijación.
En estas circunstancias, la medición de la cavidad ventricular es esencial puesto que los únicos fracasos de esta técnica en nuestra serie fueron debidos a problemas de cardiopatía restrictiva grave en el postoperatorio.
En todos los casos, la factibilidad de esta técnica no depende ni de la edad, ni del estado hemodinámico, o de los parámetros biológicos del paciente, sino esencialmente de la posibilidad de reconstruir una cavidad ventricular con un volumen correspondiente a la fisiológica, es decir, 50ml/m2 de superficie corporal.
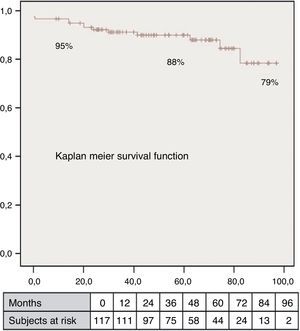
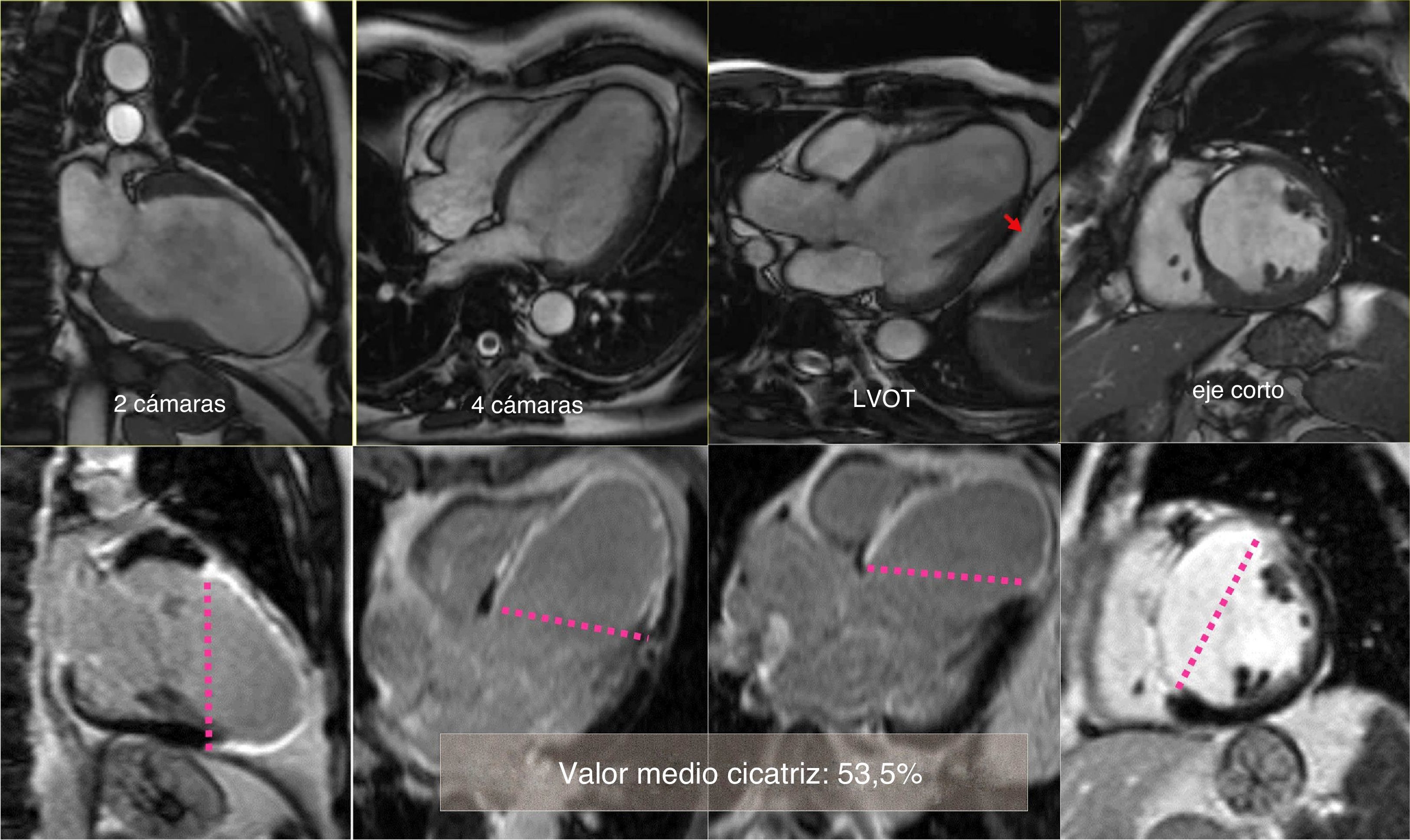
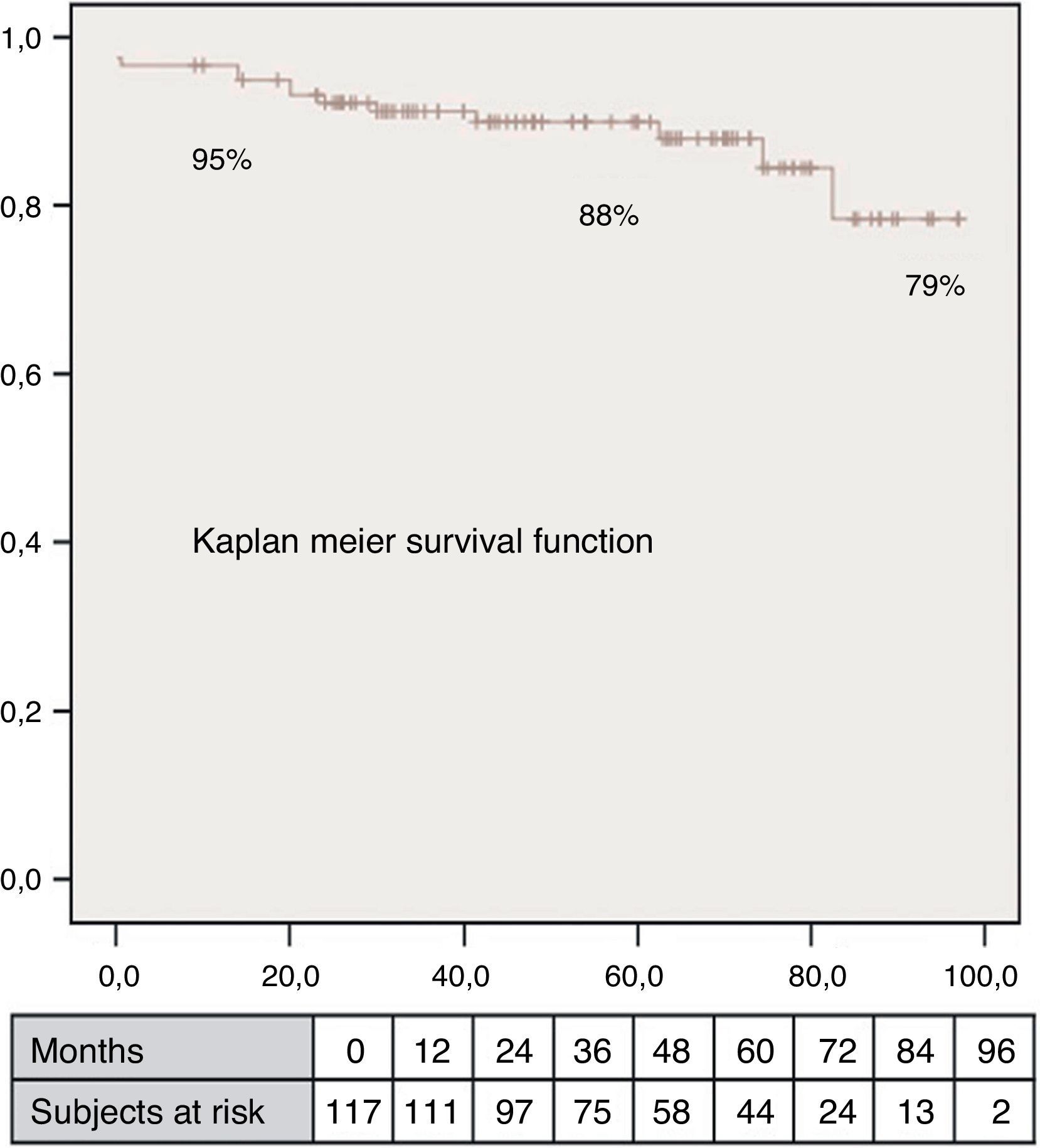
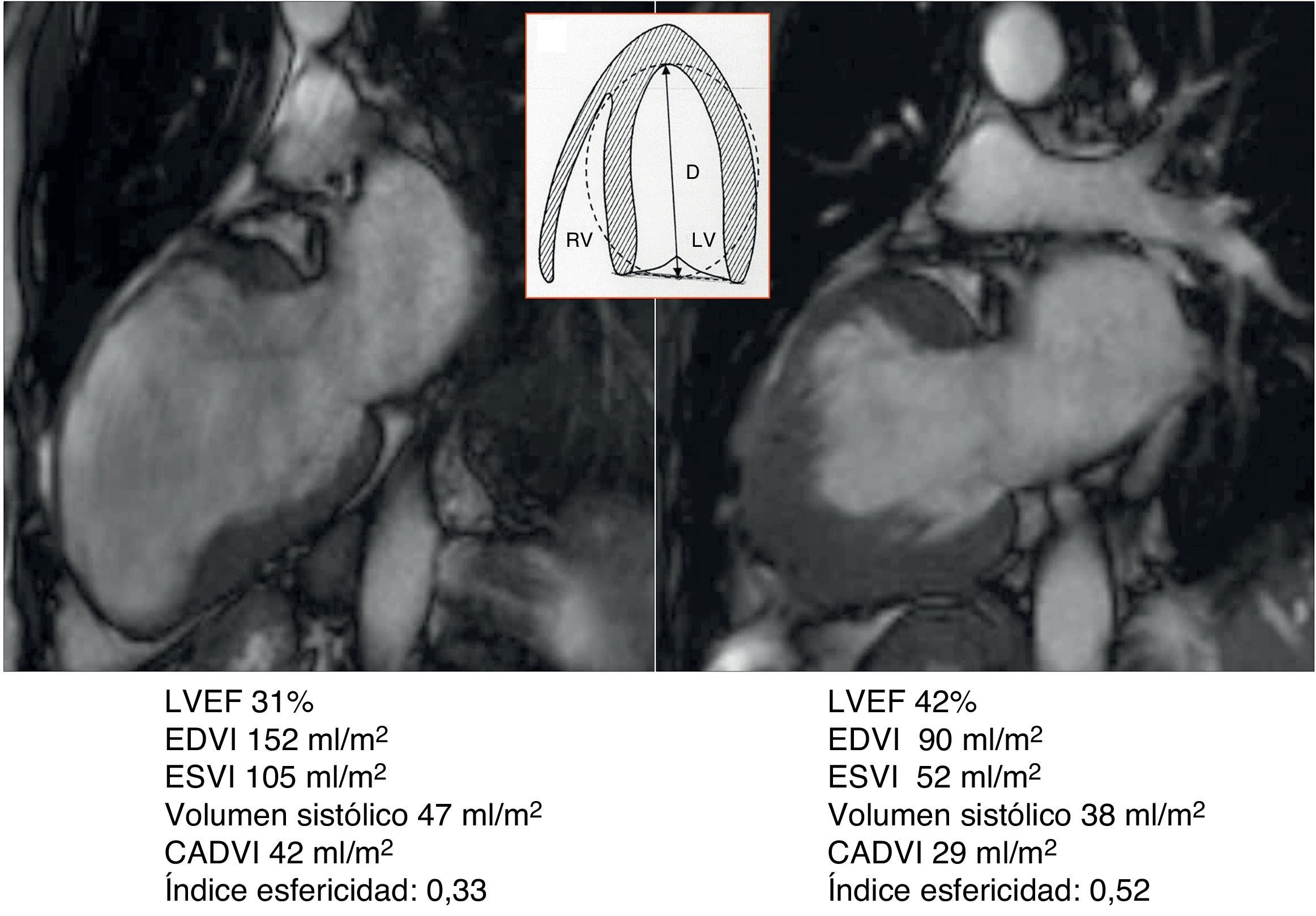
El volumen teórico de la cavidad contráctil resultante (Contractile Area Diastolic Volume Index [CADVI]) debe ser calculado antes de la cirugía mediante la medición de volumen diastólico indexado teórico de la cavidad contráctil no infartada restante. Esta la obtendremos tras la exclusión del volumen ventricular correspondiente a la zona cicatricial (fig. 1). Si esta CADVI está entre 45 y 50ml/m2, la reconstrucción será factible, con independencia de la gravedad del caso, como se demuestra en la figura 7. Esta técnica es eficaz y los controles al mes, al año y posteriormente demuestran que la mejoría está ligada a la restauración de la contracción sistólica concéntrica, a que la zona cicatricial (o sea el parche) no exceda del 20% de la circunferencia y a que el volumen ventricular sea superior a 50ml/m2. La supervivencia a los 8 años de una serie de pacientes en estado de insuficiencia ventricular isquémica es superior al 80% (fig. 8).
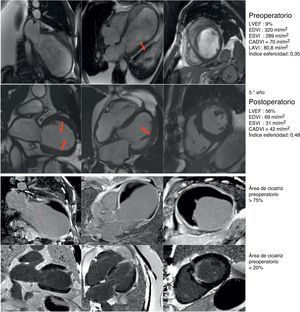
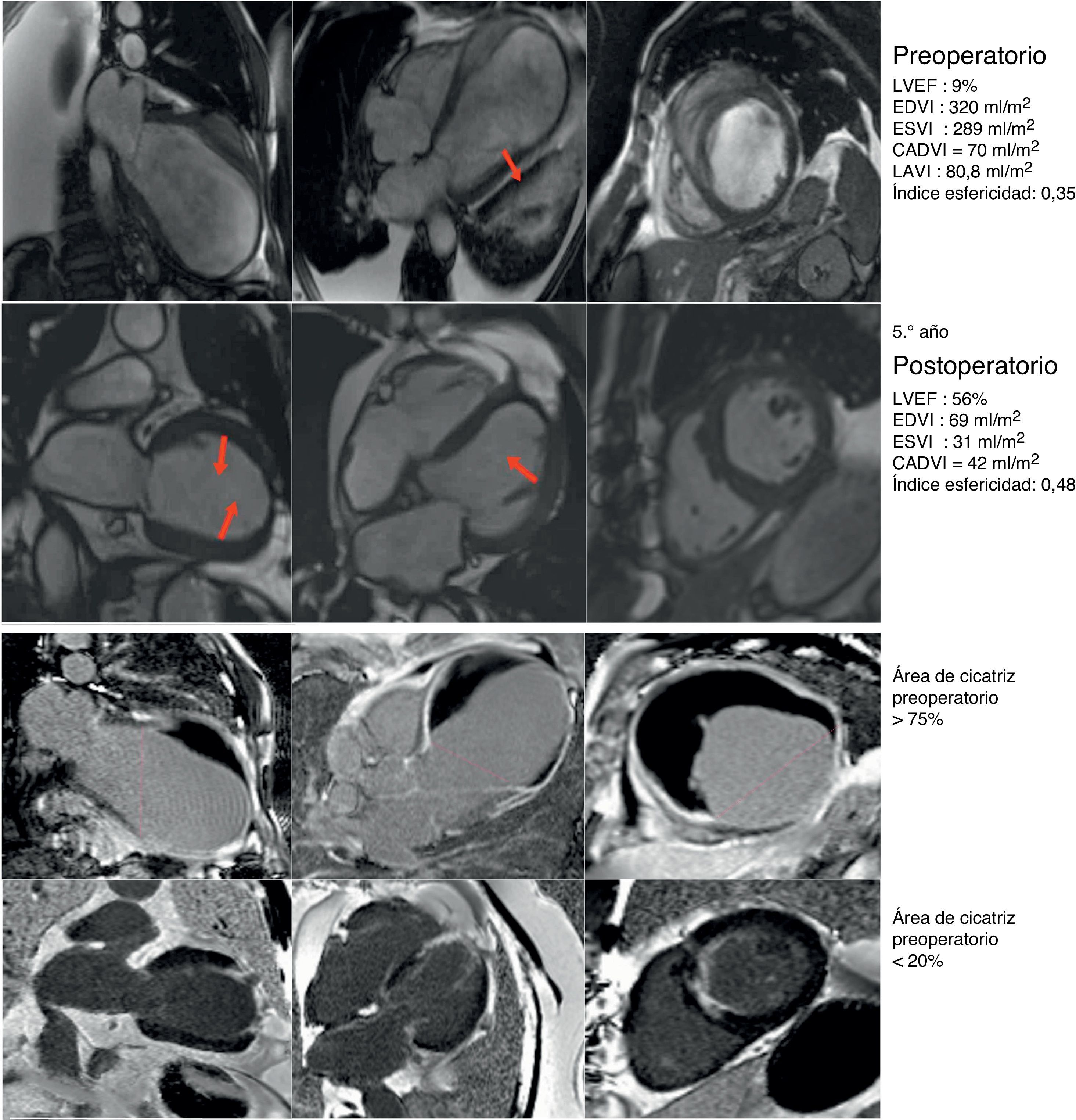
Caso clínico de paciente de 75 años con cirugía de remodelado ventricular. Estudio preoperatorio con resonancia magnética y tras 5 años de seguimiento. Paciente considerado inoperable, con insuficiencia cardíaca de difícil control con tratamiento inotrópico y volúmenes ventriculares gigantes (EDVI: 320ml/m2), pero con un CADVI de 70ml. Intervenido con excelente resultado al cabo de uno, 3 y 5 años, así como posteriormente. Hay que tener en cuenta que el EDVI posquirúrgico se corresponde exactamente con el CADVI preoperatorio. Panel de la parte superior: comparativo de los parámetros morfológicos del ventrículo izquierdo pre y postoperatorio en los ejes de 2, 4 cámaras y eje corto. En la parte inferior: estudio del porcentaje medio de cicatriz en la pared (área asinérgica) preoperatorio > 75%, y postoperatorio menor del 20%. El índice de volumen teórico de la cavidad contráctil calculado a través de la formula CADVI.
CADVI: Contractile Area Diastolic Volume Index; EDVI: índice de volumen telediastólico; ESVI: índice volumen telesistólico; LVEF: fracción eyección ventrículo izquierdo; LAVI: volumen sistólico ventrículo izquierdo.
- •
La resección anterior seguida de sutura lineal (Cooley et al.16) o de plicatura vertical (Stoney et al.17) solo es eficaz para cicatrices anteriores y apicales, en los que el septum no esté implicado. Desde Froelich et al.18, sabemos que esta resección lineal tiene una muy mala reputación, ya que este autor estudió 18 casos de aneurismas ventriculares sometidos a resección, 6 de los cuales fueron seguidos posteriormente, demostrando que no había beneficio ni morfológico ni hemodinámico con este procedimiento. Era obvio que la resección de la cara anterior, sin tener en cuenta la zona septal del aneurisma, no podría dar buenos resultados. Sin embargo, esta publicación se ha convertido en una norma e incluso en una recomendación a largo plazo de las sociedades científicas y de la Cardiología oficial, al considerar que la resección de un aneurisma no mejora la función ventricular.
- •
En 1985 Jatene propuso, ilustrándolo en el año 199219, la resección de la cicatriz externalizada y la plicatura del septum in situ, seguida de una sutura circular exterior con o sin parche, restaurando la curvatura anterior del ventrículo; no obstante, el abandono el tabique dentro de la cavidad ventricular puede explicar algunos fracasos.
- •
La surgical ventricular restoration (o reconstrucción): este término fue propuesto a principios de 2000 por Buckberg20,21 para renombrar la reconstrucción ventricular izquierda o la endoventricular patch plasty. Este colega, muy interesado en esta última técnica, recolectó los resultados de varios centros y publicó estudios estadísticos, pero sobre todo propuso una unificación patológica para miocardiopatías, ya fueran idiopáticas, isquémicas, tóxicas o parasitarias. Esta unificación se basó en la esfericidad como un mecanismo para la insuficiencia cardíaca, considerando como normal la forma elíptica. Esto permite clasificar a la intervención de Battista et al.22 en el marco de la terapéutica. El objetivo de la surgical ventricular restoration es reducir el volumen ventricular y restaurar la forma elíptica sin tener que preocuparse precisamente de la cicatriz parietal o endoventricular.
El ensayo STICH23, inspirándose en esta visión morfológica, fue organizado en el año 2002 por el National Heart, Lung and Blood Institute of the National Institutes of Health, con un grupo de cardiólogos, ecocardiografistas y cirujanos, que buscaron comparar en pacientes con miocardiopatía isquémica, en un brazo, «Arm i», enfermos con tratamiento médico o revascularización quirúrgica, y, en el otro brazo, «Arm ii», pacientes tratados con revascularización aislada o la asociada a surgical ventricular restoration, sin descripción técnica alguna salvo: «to create a smaller LV with a more eliptical shape».
Quiero precisar al respecto que:
- •
Claramente, se especifica que solo las asinergias de la pared anterior son evaluadas mediante ecografía, sin estudios por RMN, sin precisión y sin tener en cuenta a la dimensión o localización.
- •
La función diastólica no ha sido estudiada en profundidad, al igual que la insuficiencia mitral, de la que no se precisa el tratamiento.
- •
El índice de esfericidad no se determina ni en el pre, ni en el postoperatorio.
Los resultados publicados23 o presentados en el American College of Cardiology permiten a los autores concluir que:
- •
En el brazo i, no hay diferencia entre la revascularización quirúrgica asociada al tratamiento médico y el tratamiento médico aislado.
- •
En el brazo ii, no hay ningún beneficio para la surgical ventricular restoration en comparación con la revascularización quirúrgica aislada.
Estas conclusiones se han convertido en una especie de «guidelines» o recomendaciones de la cardiología oficial.
Sin embargo, estas conclusiones merecen algunas objeciones evidentes:
- •
La conclusión de Arm i confirma lógicamente que si no abordamos la cicatriz causal, no hay un resultado positivo.
- •
En la Arm ii, observamos:
- ∘
En primer lugar, que casi el 30% de los pacientes no tenía antecedentes de IM.
- ∘
Que 445 pacientes (de 1.000) fueron excluidos del estudio porque murieron en los primeros 4 meses, o por documentación inválida («non reliable data»).
- ∘
Que más del 25% tenían fracciones de eyección superior al 36% y volúmenes indexados inferiores a 60ml/m2, y por ello deberían quedar excluidos del estudio.
- ∘
Que en la categoría de las verdaderas cardiomiopatías isquémicas, con fracción de eyección inferior al 25% y volumen sistólico indexado superior a 90ml, la reducción del volumen fue no significativa (de 0 a menos del 30% en el 75% de los casos), por lo que la fracción de eyección no se mejoró más que del 22 al 25%, lo que calculado por ecocardiografía no tiene ningún significado.
- ∘
De hecho, este ensayo aleatorizado, con la experiencia añadida de más de 100 centros, de metodología y resultados cuestionables, permite a los autores concluir que no hay motivo para realizar una surgical ventricular restoration, en caso de miocardiopatía isquémica postinfarto, lo que confirma, sin darse los autores cuenta, que si no eliminamos la causa (la cicatriz) y si no eliminamos el mecanismo (la «deleterious excentric systolique motion»), no se realiza, en realidad, una reconstrucción ventricular.
ConclusionesEl abanico terapéutico de la miocardiopatía isquémica tras IM es tal que se hace necesario que todo paciente se beneficie de una exploración y un análisis colegiado médico-quirúrgico antes de cualquier decisión, y que toda técnica propuesta solo sea aplicada en el momento oportuno.
Los 3 errores que se deben evitar son:
- •
En primer lugar, un estudio incompleto y sobre todo la imposibilidad de una RMN en el postinfarto, especialmente en el caso de la implantación no consensuada y prematura de un marcapasos o un desfibrilador antes de una exploración miocárdica y de ritmo completa.
- •
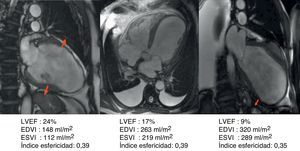
Los procedimientos quirúrgicos inadecuados, como las contenciones externas, que no tratan más que la consecuencia (la dilatación) y no la causa, o las resecciones morfológicas que buscan solo la forma elíptica, que nunca ha sido causa de la dilatación o insuficiencia cardíaca. El estudio de más de 1.000 estudios por RMN tras IM con cálculo del índice de esfericidad demuestra que la dilatación es ciertamente evidente, pero es más ovoide que cilíndrica (fig. 9) y que en los controles postoperatorios, con muy buenos resultados funcionales, este índice de esfericidad es mucho más esférico que elíptico (fig. 10).
- •
Por último, deberían evitarse indicaciones extensivas de trasplante cardíaco o asistencia circulatoria para las cicatrices postinfarto con insuficiencia cardíaca grave cuando el cálculo del volumen teórico de la cavidad no infartada permita un gesto conservador, al precio de un riesgo quirúrgico inferior al 10% y aportando más de una década de mejora.
Los autores declaran que los procedimientos seguidos se conformaron a las normas éticas del comité de experimentación humana responsable y de acuerdo con la Asociación Médica Mundial y la Declaración de Helsinki.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes y que todos los pacientes incluidos en el estudio han recibido información suficiente y han dado su consentimiento informado por escrito para participar en dicho estudio.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesEl autor declara no tener ningún conflicto de intereses.
Esta revista, a través de su editor jefe y la sociedad científica que representa, quieren agradecer públicamente al Dr. Vincent Dor su colaboración y aportación científica. Estas páginas representan un esfuerzo de muchos años de estudio en la restauración ventricular que, sin duda, nos permitirá a los cirujanos alcanzar una mejor práctica quirúrgica en nuestra labor asistencial. Igualmente, agradecer al Dr. Rafael Rodríguez Lecoq su colaboración en la adaptación del escrito a nuestra lengua.




![En el panel superior, se puede apreciar una visión quirúrgica. A) Ventriculotomía izquierda sobre aneurisma anteroseptal, con extensa escara cicatricial endocárdica. B) Tras escarectomía, se puede apreciar el límite donde se encuentra el miocardio contráctil. C) Sutura de Fontan y sutura de parche de 6cm2. En el panel inferior, la secuencia de imágenes de resonancia magnética pre y postoperatorias del caso anterior. Mediante la detección de realce tardío de gadolinio (gadolinium let enhancement [GLE]) se calcula el área de cicatriz ventricular. En el panel superior, se puede apreciar una visión quirúrgica. A) Ventriculotomía izquierda sobre aneurisma anteroseptal, con extensa escara cicatricial endocárdica. B) Tras escarectomía, se puede apreciar el límite donde se encuentra el miocardio contráctil. C) Sutura de Fontan y sutura de parche de 6cm2. En el panel inferior, la secuencia de imágenes de resonancia magnética pre y postoperatorias del caso anterior. Mediante la detección de realce tardío de gadolinio (gadolinium let enhancement [GLE]) se calcula el área de cicatriz ventricular.](https://static.elsevier.es/multimedia/11340096/0000002200000002/v2_201505050931/S113400961400120X/v2_201505050931/es/main.assets/thumbnail/gr5.jpeg?xkr=ue/ImdikoIMrsJoerZ+w96p5LBcBpyJTqfwgorxm+Ow=)