La reparación quirúrgica de la insuficiencia mitral por prolapso de uno o varios segmentos del velo anterior, tanto aislada como en combinación con patología comisural o de velo posterior, es compleja. Las técnicas resectivas presentan menos indicaciones y peores resultados que en el prolapso del velo posterior (PrVP). Las técnicas de preservación son la transposición o acortamiento de cuerdas o de músculos papilares, la reparación borde-con-borde o, más frecuentemente, la implantación de neocuerdas. En este trabajo se pretenden revisar las diferentes variantes técnicas para el abordaje del prolapso del velo anterior mitral, que en el caso de la implantación de neocuerdas son tremendamente variadas, junto a sus indicaciones y resultados.
Surgical mitral valve repair due to anterior leaflet prolapse is complex, both isolated or combined with commisural and/or posterior leaflet pathology. Resective techniques are less indicated and are associated with worse long-term results that those observed after posterior leaflet resection. Leaflet preservation techniques are pappilary muscle or chordae transposition or shortening, the edge-to-edge repair and, more frequently, artificial neochordae implantation. This paper aims to describe the most important techniques used for anterior leaflet prolapse repair, extremely numerous in the neochordae implantation subset, in addition to their indications and results.
La reparación valvular mitral (RepM) es la técnica de elección para el tratamiento de la insuficiencia (IM) por patología degenerativa de esta válvula, tanto por los excelentes resultados a corto plazo como por la significativa reducción de eventos valvulares que ofrece respecto a la sustitución valvular protésica1. La reparación del prolapso de uno o varios segmentos del velo anterior (VAnt), tanto aislada como en combinación con patología comisural o de velo posterior (VPost), es considerada como una RepM compleja. Debido a una menor reserva de coaptación y a la imposibilidad de realizar plicatura anular, las técnicas resectivas que tan buenos resultados han ofrecido históricamente en los casos de prolapso del velo posterior (PrVP)2,3 están escasamente indicadas en este contexto y se limitan a resecciones triangulares en prolapsos de pequeños segmentos. Alternativamente, en casos de afectación más extensa, se deben utilizar sistemáticamente técnicas de preservación que tienen, en conjunto, peores resultados a largo plazo que las técnicas reparativas del VPost4,5 y que están menos estandarizadas: la transposición o acortamiento de cuerdas o de músculos papilares, la reparación borde-con-borde o, más frecuentemente, la implantación de neocuerdas de politetrafluoroetileno expandido (ePTFE). En este último caso, concretamente, se han descrito infinidad de técnicas para intentar estandarizar las diferentes dificultades con que el cirujano se tiene que enfrentar, como son la correcta cuantificación del prolapso y, por tanto, de la longitud de las neocuerdas y su anudado.
En este trabajo se pretenden revisar las diferentes variantes técnicas para el abordaje del prolapso del velo anterior (PrVA) mitral, junto a sus indicaciones y resultados, haciendo especial énfasis en las técnicas de implantación de neocuerdas.
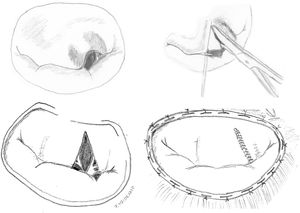
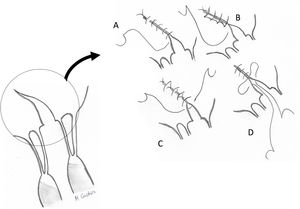
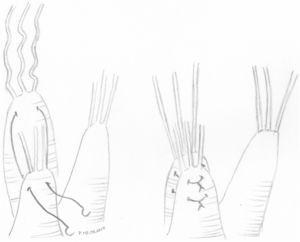
Técnicas resectivas en el velo anterior: resección triangularLa técnica de resección de VAnt, concretamente la resección triangular, está clásicamente indicada en prolapsos limitados, cuando la longitud del borde libre que prolapsa es inferior a 1/5 de la longitud total de comisura a comisura. Por tanto, no se debe resecar más del 10% de la superficie total del VAnt4. En casos de mayor extensión del prolapso cuando no existe redundancia de tejido, produce tensión y tracción de otros segmentos del velo, cambios significativos sobre la geometría del VAnt y repercusión sobre la superficie de coaptación y la durabilidad a largo plazo2,6. Cuando, sin embargo, existe redundancia significativa de tejido, lo cual es condición indispensable para la realización de esta técnica en algunos centros de gran experiencia6,7, la resección triangular se puede indicar en prolapsos mayores siempre que la sutura del velo remanente se pueda hacer sin generar tensión del tejido.
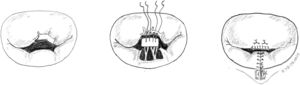
Técnicamente, tras identificar los límites del prolapso representados por las cuerdas no elongadas adyacentes, se marcan con dos suturas de polipropileno de 5/0 en el borde libre. Se realiza la resección triangular hasta el vértice estimado, siguiendo una línea biconvexa con tijeras curvas, dejando un remanente de tejido a ambos lados de la resección para su sutura. La altura del triángulo debe superar ligeramente su base en el borde libre4. El vértice del triángulo debe orientarse hacia la porción media del cuerpo del velo7 (fig. 1). La sutura de los bordes de resección se realiza mediante sutura de monofilamento de polipropileno (generalmente 5/0 o 6/0) con puntos sueltos evertidos o invertidos (nudos en cara auricular o ventricular respectivamente), o bien con sutura continua que puede ser sencilla o, más conveniente, bloqueante para no acortar la profundidad del velo (fig. 2). Se aconseja realizar siempre anuloplastia mitral (AM) adicional para estabilizar la reparación. En estos casos la AM se puede realizar antes o después de la resección, dado que la técnica no implica al anillo valvular.
Esta técnica es sencilla y muy reproducible, y aunque no se utiliza con frecuencia ofrece buenos y duraderos resultados cuando se seleccionan adecuadamente los pacientes. Grossi et al.6 y Saunders et al.7 han reportado series de pacientes libres de reintervención en el 95,5% a 10 años y 93% a cinco años respectivamente tras una adecuada selección de pacientes con redundancia de tejido del VAnt. Adicionalmente, la resección de VAnt se asocia a una reducción del riesgo de movimiento sistólico anterior en el postoperatorio, dado que el exceso de longitud residual del VAnt es uno de los factores que pueden inducir esta complicación y la resección elimina eficazmente las áreas redundantes del velo y su longitud final7.
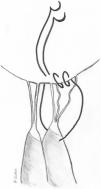
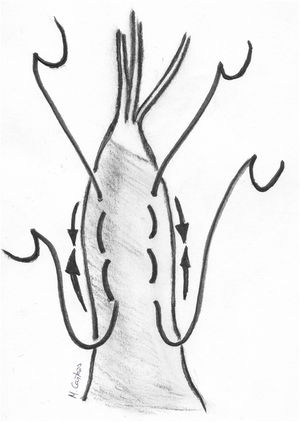
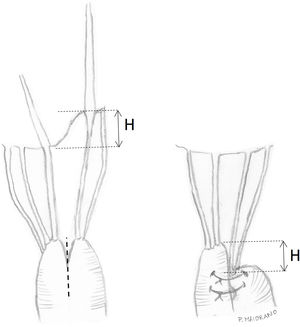
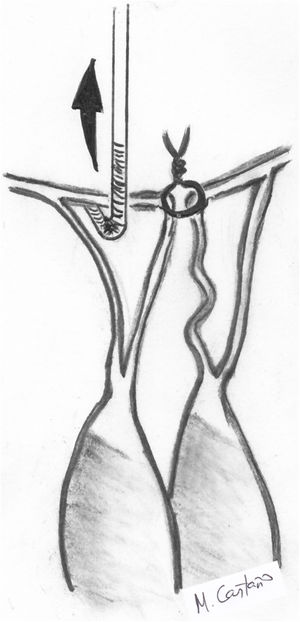
Transposición de cuerdasLa transposición de cuerdas del VPost se puede emplear en casos de prolapsos del VAnt cuando presentan segmentos de VPost opuestos dependientes del mismo músculo papilar, sin patología y con cuerdas de buena calidad. En algunos casos, cuerdas del VPost levemente elongadas pueden ser utilizadas para este propósito, ya que en condiciones normales las cuerdas del VPost suelen ser más cortas que las del anterior y la sutura de las mismas puede neutralizar ese exceso de longitud8. Técnicamente se realiza una resección del borde libre del segmento elegido del VPost de unos 3-4 mm de profundidad y de una longitud acorde al tamaño del segmento de VAnt prolapsante. Si es necesario, puede movilizarse la cabeza del músculo papilar correspondiente de la pared del ventrículo izquierdo (VI) u otras cabezas para facilitar su transferencia anterior. Posteriormente, se sutura el borde libre de la zona del prolapso anterior con el borde libre del segmento de VPost resecado con sutura continua simple o bloqueante de monofilamento 5/0 o 6/0. Finalmente, la solución de continuidad del VPost se repara mediante resección triangular o cuadrangular convencionales, según su amplitud (fig. 3).
Los resultados de esta técnica a largo plazo en centros experimentados son buenos. Salati et al.,8 realizaron 89 trasposiciones de cuerdas, de las cuales 39 fueron por PrVA aislado y 50 bivalvares. La sutura del VPost traspuesto al VAnt se realizó con sutura continua. En 11 casos se requirió alguna técnica adicional por prolapso residual (en dos acortamiento de cuerdas, siete acortamiento de cuerdas traspuestas y en dos casos implantes de neocuerdas). Se requirieron cinco recambios mitrales (dos intraprocedimiento y tres tardías). Tras 41 (1-106) meses de seguimiento medio, el 79% presentaban IM 0-1+, 17% IM 2+ y un 5% IM 3+, todos ellos reoperados (libertad de reintervención a los cinco años 88,6±4,8%). En ningún caso se observó dehiscencia de la sutura de ambos velos. En algunos trabajos se han descrito resultados mejores que el implante de neocuerdas. Bourguignon et al. compararon los resultados de la transposición de cuerdas (n = 67) frente al implante de neocuerdas (n = 29) para tratar PrVA, en un total de 96 pacientes9. Los tiempos de circulación extracorpórea y pinzamiento aórtico fueron significativamente más largos en el grupo de neocuerdas. A cinco años, la supervivencia (87 ± 5% vs. 89 ± 6%, 89± %, p = 0,84) y la libertad de reintervención (95 ± 3% vs. 91 ± 7%, p = 0,24) fueron similares en los dos grupos. Sin embargo, la recurrencia de IM moderada (≥ 2 + ) y severa (≥ 3) fue significativamente mayor en los pacientes sometidos a neocuerdas (p = 0,04 y 0,01, respectivamente).
También se ha utilizado el acortamiento del musculo papilar mediante una resección transversal en forma de cuña de uno de los laterales de la cabeza correspondiente. Posteriormente, se realiza una aproximación con sutura de 4/0 de los dos extremos de la cuña cogiendo una longitud de 8-10 mm de músculo hacia la parte apical.
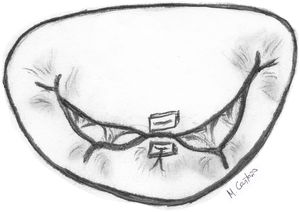
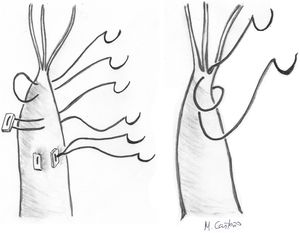
Cuando existe PrVA por elongación de musculo papilar se puede realizar resección de un fragmento de la cabeza del musculo papilar correspondiente y sutura de esta con el musculo restante4. También se puede realizar la plicatura del músculo papilar mediante suturas subendocárdicas longitudinales de 4/0 («concertino technique»), aunque esta técnica solo consigue reducir la altura del músculo 4-5 mm., por lo que se reserva para elongaciones pequeñas de músculos papilares (MMPP)4 (fig. 4).
Los resultados de todas estas técnicas están descritos en series antiguas que, aunque con seguimientos muy largos, son pequeñas y no han sido comparadas adecuadamente con otras técnicas de reparación del VAnt mitral10,11.
Acortamiento de cuerdasEl acortamiento de cuerdas tendinosas según la técnica clásica de Carpentier se indicaba cuando existía un prolapso extenso de VAnt por elongación severa de cuerdas (>10 mm). Tras realizar una incisión longitudinal en la zona superior del musculo papilar donde se halla la cuerda elongada, se suturan las dos mitades rodeando la misma, lo que resulta en el desplazamiento apical de la cuerda, ya que queda embutida en el espesor del músculo papilar12. Esta técnica presenta una alta incidencia de fallo de reparación con índices de reoperación a los cinco años de entre el 24 y el 26%, frecuentemente por rotura de la cuerda acortada13 y significativamente mayor que la transferencia de cuerdas (26% vs. 10% a los cinco años, respectivamente, p = 0,003)14 y que el implante de neocuerdas (1,4% vs. 14,8% a 3,5 años, p = 0,002)13, por lo que es una técnica actualmente en desuso.
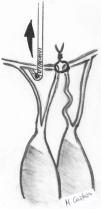
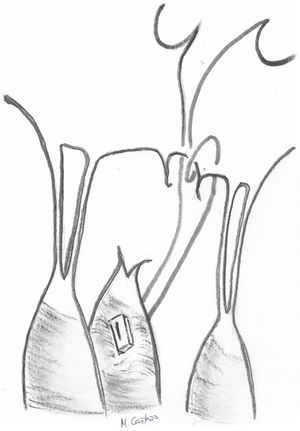
Técnica de Alfieri («edge-to-edge») en el prolapso del velo anteriorLa técnica de reparación mitral borde con borde («edge to edge» [EtoE]) o técnica de Alfieri consiste en la sutura del borde del festón prolapsante al borde del segmento de la valva contralateral correspondiente15,16 (fig. 5).
Esta técnica ha sido utilizada para tratar la IM de múltiples causas con buenos resultados17, especialmente cuando el segmento prolapsante es central y corresponde al VAnt mitral (A2)18. Las ventajas principales de esta técnica son su gran reproducibilidad y sencillez, lo que acorta el tiempo de pinzamiento aórtico.
Entre las principales indicaciones están el prolapso o flail mitral anterior18 y el rescate («bail-out») cuando otras técnicas obtienen resultados subóptimos y se quiere realizar una técnica sencilla y rápida durante un sucesivo pinzamiento aórtico. Sus contraindicaciones son la IM reumática, el prolapso multifestón de bordes no enfrentados, la mala localización del jet de regurgitación, la calcificación intensa del anillo mitral y el anillo valvular mitral de pequeño tamaño19. De hecho, se ha sugerido que para evitar la estenosis mitral residual tras la intervención no deberían implantarse concomitantemente a la técnica anillos protésicos de diámetros menores de 30 mm19.
Los resultados a largo plazo del EtoE en prolapso del VAnt en pacientes seleccionados han sido excelentes. Tras un seguimiento a 10 años de 150 pacientes en los que se realizó AM en el 93,3% (140/150, 118 anillos semi-rígidos, 18 bandas de pericardio posterior y tres de sutura), Alfieri reportó una supervivencia del 91,6% ± 3,16 y libertad de reintervención 96,6% ± 1,74 a los nueve años de la intervención. Tras un seguimiento ecocardiográfico medio de 4,25 ± 3,21 años, el 88% de pacientes presentaban IM 0-1+, 9,3% grado 2+ y cuatro pacientes IM 4+ (todos ellos reintervenidos)20. A todavía más largo plazo, en 139 pacientes con EtoE con AM el 89,6% ± 2,7% de los pacientes estaban libres de reoperación a los 17 años de seguimiento con una supervivencia de 72,4 ± 7,9% y una libertad de IM ≥ 3+ del 80,2 ± 5,9%21.
La AM asociada al EtoE es prácticamente obligatoria para evitar futuras dilataciones del anillo mitral18,20,22. La dilatación anular es, además, mucho más frecuente en el PrVA23. La ausencia de AM asociada es un factor de recurrencia y reintervención a medio-largo plazo17 e, incluso, la anuloplastia con banda de pericardio posterior podría ser factor independiente de recurrencia de IM en comparación con la reparación con anillo rígido21. Sin embargo, los resultados del EtoE sin AM también son relativamente buenos a corto-medio plazo24, lo cual conlleva a extremar la precaución en cuanto a las indicaciones de EtoE percutáneo cuando el seguimiento es limitado17. En una comparativa unicéntrica de 143 pacientes con miocardiopatía dilatada tratados con MitraClip® vs. EtoE + AM, la libertad de IM ≥ 3+ a cuatro años fue 75 ± 7,6% con MitraClip® vs. 94 ± 3,3% con EtoE + AM (p = 0,04) y de IM ≥ 2+ de 37 ± 7,2 vs. 82 ± 5,2%, respectivamente (p = 0,0001). Los pacientes no fueron coetáneos, pero tenían similares grados de IM al alta, fracción de eyección de VI (28 ± 9,7 vs. 28 ± 6,5%, p = 0,4), volúmenes (188 ± 66,2 vs. 203 ± 58,02 ml, p = 0,1) y diámetros (54 ± 9,1 vs. 52 ± 7,9 mm, p = 0,3) telediastólicos de VI totalmente comparables, así como idénticas profundidades de coaptación y área de tenting. Comparativas similares en IM por PrVA no están disponibles.
Técnicas sobre músculos papilaresActualmente las técnicas sobre MMPP para la reparación del PrVA son poco utilizadas.
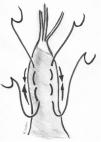
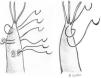
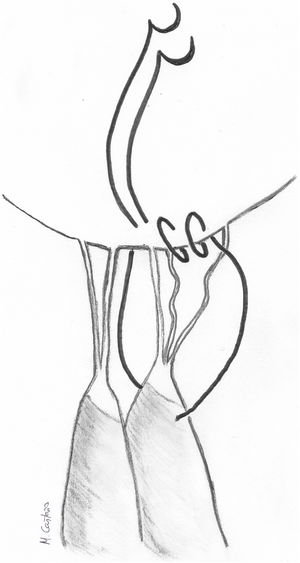
El reposicionamiento del músculo papilar ha sido bien estudiado. En el caso del VAnt, consiste en separar de la cabeza intermedia del músculo papilar anterolateral la cabeza anterior de la que se originan las cuerdas elongadas y suturarla mediante un punto en U a la cabeza posterior en una posición más apical25 (fig. 6). La distancia a acortar se mide comparando mediante tracción la altura de las cuerdas elongadas con las del correspondiente festón del VPost. Tras un seguimiento medio de 36,4 ± 29,2 (18-121) meses, un paciente (1/40, 2,5%) requirió reintervención, y la causa fue por hemólisis a pesar de presentar una IM leve. Igualmente es una buena herramienta para corregir prolapsos comisurales con resultados excelentes a largo plazo26. Esta técnica es muy similar a la plastia por deslizamiento («sliding plasty») descrita por Carpentier, indicada cuando existe un prolapso extenso de VAnt por elongación moderada de cuerdas (<10 mm)4. Cuando solo un pequeño número de cuerdas procedentes de la misma cabeza papilar del musculo papilar están elongadas, se separa longitudinalmente dicha cabeza del resto del musculo papilar y se sutura a la cabeza adyacente en un nivel más apical (fig. 7).
Implante de neocuerdasLa implantación de neocuerdas de ePTFE para restaurar la línea de coaptación de segmentos de velo con prolapso ha supuesto un enorme avance en las posibilidades de RepM en los casos en los que las técnicas resectivas no son posibles, como es el PrVA más o menos extenso.
El ePTFE es un material monofilamentoso, pero microporoso. Las suturas de ePTFE más utilizadas son de Gore-tex®, más frecuentemente de 4/0 (CV 4)27–29 o de 5/0 (CV 5)30–35. Actualmente, existen reportes de implantes de este tipo de neocuerda con seguimientos a 25 años con libertades de IM severa recurrente superiores al 90%32 y sin evidencia de ruptura o degeneración del material durante su análisis histopatológico. Macroscópicamente preservan su longitud y flexibilidad, y microscópicamente están cubiertas de tejido fibroso y endotelio sin calcificación o microtrombos28. Existen casos reportados de fallo de la reparación por ruptura de la neocuerda, tanto precoces36,37 como tardías36,38, aunque son excepcionales. Estos casos habitualmente se asocian a calcificación.
El proceso de implante de neocuerdas consta de diversos pasos: exposición de músculos papilares, implantación de las neocuerdas en el músculo papilar y en el velo, medición de su longitud y anudado y, finalmente, comprobación de la competencia valvular.
Actualmente, existe una gran multitud de técnicas encaminadas a una adecuada implantación y, sobre todo, medición y anudado de neocuerdas, aunque ninguna se ha impuesto como una técnica totalmente infalible y definitiva. En este apartado se expondrán las técnicas más frecuentes y, a criterio de los autores, más seguras y reproducibles, así como los resultados disponibles. En varias extensas revisiones se pueden encontrar enumeradas y descritas prácticamente todas ellas39–42.
Exposición de músculos papilaresUna vez expuesta la válvula mitral por la atriotomía elegida, la exposición de los MMPP es, en ocasiones, dificultosa, y se puede realizar mediante diversos métodos. Se pueden aplicar suturas de tracción por debajo de cuerdas primarias para rechazar el VAnt hacia el anillo anterior. También se puede introducir en el orificio valvular medidores de prótesis o diversos utensilios flexibles (reglas plásticas milimetradas43 o mallas especialmente diseñadas para ello (fig. 8) que, al desplegarse en el interior de la válvula se abren hasta el diámetro máximo del anillo, de manera que se puede acceder fácilmente a la cavidad ventricular a su través. Cuando se va a realizar un procedimiento resectivo de VPost concomitante, se puede aprovechar el momento de la resección para exponer el músculo papilar (MPap) y aplicar las neocuerdas27. Para optimizar la exposición, se puede presionar con una torunda la superficie cardiaca en la cara lateral del VI para exponer el MPap anterolateral o en la región del septo interventricular proximal inferior para el MPap posteromedial. Estas maniobras centran el MPap correspondiente en el centro del orificio mitral y lo hacen más accesible.
Implantación de las neocuerdas en el músculo papilarLa implantación de las cuerdas se realiza en una de las cabezas del músculo papilar correspondiente al velo a corregir, de manera que nunca se debe cruzar la línea media de la válvula (por ejemplo, las cuerdas para reparar prolapsos de A1 y P3 deben implantarse en los músculos anterolateral y posteromedial respectivamente, nunca al contrario). Igualmente, el trayecto de las cuerdas desde el músculo papilar al velo no debe distorsionar la trayectoria de ninguna de las cuerdas nativas del paciente. La neocuerda se debe implantar preferiblemente en la parte fibrosa del MPap, mediante un punto amplio de tejido músculo-fibrótico.
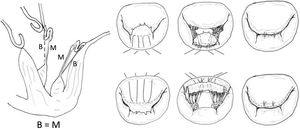
La técnica de implantación en el músculo es variable (fig. 9). Algunas técnicas contemplan un paso con ambas agujas en U con o sin parche, que puede anudarse o no al músculo. En teoría, el anudado sobre doble parche podría inducir isquemia del MPap41 y provocar elongación o ruptura del mismo. Otros autores realizan una sutura en ocho («figure-of-eight»), pasando el músculo dos veces con la misma aguja44 y otros, incluso, un paso único con una sola aguja45. Recientemente, se ha sugerido que las técnicas que no fijan ambos cabos entre sí son preferibles porque al final del anudado de la neocuerda en el velo ambos cabos soportan la misma tensión y permiten una medición más fiable y más estable una vez que se inicia el ciclo cardiaco46.
Medición de la longitud de las cuerdasLa mayor dificultad de esta técnica radica en la medición de la longitud adecuada necesaria para corregir el prolapso, pero sin generar sobrecorrección y, por tanto, restricción sistólica que impida un cierre valvular correcto. Adicionalmente, pequeñas elongaciones de cuerdas de solo un 3% incrementan hasta en un tercio su tensión41, lo que podría hacer más frecuente su rotura. Por todo ello es esencial una correcta medición de la longitud final de las neocuerdas. La determinación de la longitud se puede realizar funcional o anatómicamente.
Medición funcional de la longitud de las neocuerdasLa medición funcional suele ser intraoperatoria y realizarse llenando el VI con suero salino para simular una telediástole27,33,45–48. Para evitar que las suturas pasadas por el velo se deslicen hacia la cavidad auricular durante el llenado del VI existen diversas técnicas. Una técnica sencilla es pasar uno de los cabos de nuevo por el velo de la cara ventricular a auricular, para crear una sutura en ocho («figure-of-eight»)49 (fig. 10). Adams et al.27 aconsejan igualmente pasar uno de los cabos de la sutura dos veces por el velo y, después, dar un nudo doble único que refuerza el efecto antideslizante. Otros autores postulan utilizar el festón contralateral sano como referencia y aplicar un punto EtoE temporal entre ambos bordes libres. La altura de la cuerda se determina llenando el VI con suero salino dado que los velos coaptan a la perfección gracias al punto EtoE33,47.
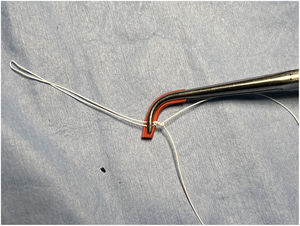
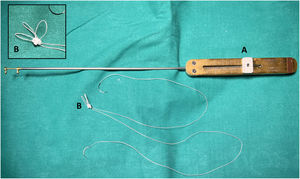
Safadi et al. utilizan un doble nudo ajustable («Dubai stitch»). Un cabo de la sutura se pasa por la parte fibrosa del músculo papilar y el otro por el velo, de cara atrial a ventricular. Posteriormente, se realizan una serie de lazadas similares al nudo de una corbata45 (fig. 11). Este nudo evita el deslizamiento tanto durante el proceso de llenado del VI, como durante el anudado y se puede acortar y alargar fácilmente cuantas veces sea necesario simplemente tirando del cabo correcto. Otra ventaja es que el nudo, una vez finalizado, puede ser desplazado hacia el músculo papilar para evitar que interfiera con el cierre de los velos en la línea de coaptación. Se recomienda implantar al menos dos cuerdas para cada segmento prolapsante para distribuir mejor la tensión, dado que solo se realiza una única pasada por el velo50.
Aunque, como se ha dicho, el llenado de VI con suero («saline test») es la técnica más utilizada en la medición funcional, la competencia de la válvula mitral depende de la correcta función de todas sus estructuras durante el ciclo cardiaco (anillo mitral, velos, cuerdas tendinosas, MMPP y pared ventricular). Con el corazón en parada diastólica propia de estos procedimientos, el test de suero salino puede reproducir la funcionalidad mitral en situación de telediástole, pero es incapaz de predecir completamente la misma en condiciones normales de ciclo cardiaco completo, donde existe un continuo dinamismo del anillo mitral, de los MMPP y la pared ventricular. Por ello, algunos autores postulan la determinación de la longitud mediante ecocardiografía transesofágica (ETE) preoperatoria. Calafiore et al. realizan una medición de la magnitud del prolapso en relación al anillo mitral por ETE y posteriormente restan esa longitud a la de la cuerda elongada, lo que resulta en la longitud correcta de la neocuerda51 (fig. 12). La regla de Melnitchouk52 mide la distancia en centímetros del anillo mitral al ápex ventricular en la proyección de dos cámaras y calcula la longitud de las neocuerdas mediante la fórmula:
VPost: anillo mitral-ápex VI (en cm) x 2 = longitud (en mm)
VAnt: anillo mitral-ápex VI (en cm) x 2 + 10 = longitud (en mm)
Se han planteado iniciativas análogas guiadas por tomografía53 y resonancia magnética cardiaca54, aunque ninguna está suficientemente afianzada en la práctica habitual.
Finalmente, Lawrie et al.35 proponen un testado dinámico intraoperatorio de la forma y posición de todos los elementos que conforman la funcionalidad valvular, asociado a la implantación sistemática de anillos flexibles. Con esta estrategia han conseguido un 100% de reparabilidad de la IM por patología degenerativa, con libertades de IM severa tras un seguimiento medio de 6,56 + - 4,66 años de 94,0% a 10 años y del 89,6% a 15 años, sin diferencias entre la patología de VAnt y Vpost.
Medición anatómica de la longitud de las neocuerdasPor su parte, la medición anatómica normalmente determina la longitud de la neocuerda comparándola con la longitud de las cuerdas de segmentos no prolapsantes adyacentes o contralaterales, a los que se denomina punto de referencia («reference point»). Esta comparación se suele realizar traccionando del segmento sano con un gancho de nervios34. Otros aplican un punto EtoE entre el segmento prolapsante y el sano contralateral. Al traccionar del segmento sano se tensa su cuerda nativa y se puede anudar la neocuerda a su altura con gran facilidad46,48 (fig. 13).
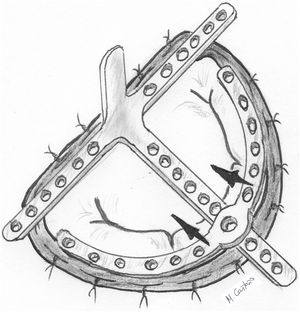
Otros trabajos determinan anatómicamente la longitud de la cuerda tomando como punto de referencia el anillo mitral. García-Fuster et al. han descrito una ingeniosa técnica para prolapsos complejos multisegmento, tanto anteriores como comisurales o posteriores («folding technique»)55. Tras su paso por el músculo papilar correspondiente, las neocuerdas se suturan a los segmentos prolapsantes del velo mediante varias pasadas sucesivas hasta una línea imaginaria que delimita la nueva línea de coaptación deseada. El borde libre del velo se sutura temporalmente al anillo mitral correspondiente mediante puntos de polipropileno 5/0 y las neocuerdas se anudan tomando como referencia ese nivel anular (fig. 14). Los resultados descritos de esta técnica por los mismos autores a medio plazo han sido satisfactorios. Se trataron 68 pacientes de los cuales 12 padecían prolapso aislado de VAnt. De los 41 pacientes seguidos a dos años, siete presentaban IM leve residual sin regurgitación en el resto56.
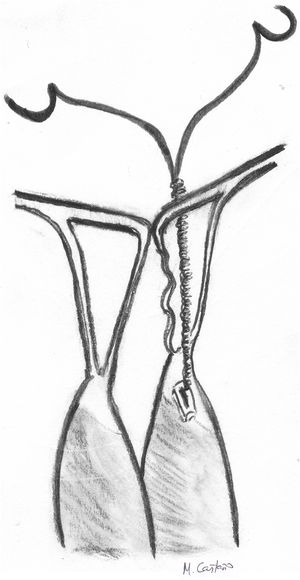
Este mismo concepto se utiliza en otra técnica que mide la longitud de las cuerdas equiparándola a la distancia entre el músculo papilar y el origen del VAnt en el anillo mitral correspondiente. La neocuerda se pasa inicialmente de cara atrial a ventricular en el segmento prolapsante del velo, después una única vez por el MPap y después de nuevo por el velo, a 1 cm de distancia de la pasada anterior. Después se realiza una pequeña sutura continua en el borde del velo hasta unir la salida de los dos cabos y se anuda (fig. 15). La longitud de las cuerdas se estima tensando la neocuerda hasta que el nudo llega justo hasta el anillo anterior correspondiente al segmento a reparar57.
Anudado de las neocuerdasUna vez medida la longitud adecuada, se deben anudar las neocuerdas. El ePTFE es un material que, al ser anudado, se desliza muy fácilmente por lo que si se anuda en el aire sin resistencia siempre existe riesgo de acortar la longitud final de la cuerda, o de que el nudo quede excesivamente flojo en sus primeras lazadas e induzca el efecto contrario cuando el ciclo cardiaco hace que el velo empuje contra ellas en dirección atrial. Existen también múltiples técnicas para conseguir anudar a la altura deseada, alguna de las cuales ya se han mencionado.
La más utilizada es que el ayudante sujete firmemente y contratraccione con un gancho de nervios a la altura del velo contralateral sano o a la altura elegida. También se ha propuesto marcar la altura elegida de la neocuerda con rotulador y después anudar sobre una pinza hemostática fijada en ese punto y protegida en una sola fauce para que ni traumatice la sutura ni permita que deslice el nudo31 (fig. 16). Chocron et al.58 han propuesto fijar ambos cabos de la sutura a la altura elegida mediante clips hemostáticos removibles (Hem-o-lok®) que impiden que deslice el nudo y son atraumáticos para la sutura (fig. 17). Tras una mediana de 6,0 años de seguimiento en 47 pacientes sometidos a esta técnica, el 96% presentaba IM 0-1/4 y solo un paciente requirió reintervención por IM severa (no se especifica la causa de la IM), con una supervivencia a seis años de 87,2 ± 5,258.
También se han diseñado dispositivos para favorecer un anudado más firme y seguro. Ruyra et al.59 propusieron un sistema compuesto por una zona en cruz que se fija temporalmente al anillo protésico y otra circular (el «arco») que se desliza sobre la anterior para superponerse a la línea de coaptación. El borde libre del velo por donde se han pasado las neocuerdas se anuda con suturas de polipropileno al dispositivo para fijarlo a nivel anular y después se anuda el Gore-tex® con precaución. El propio dispositivo supone una barrera mecánica para impedir al cirujano anudar la neocuerda demasiado tensa y corta o demasiado floja y larga (fig. 18). No se han descrito resultados a medio o largo plazo con este dispositivo.
Igualmente, se han diseñado anillos para anuloplastia que facilitan el anudado de las neocuerdas mediante suturas-guía sobre las que se puede apoyar el nudo de la neocuerda temporalmente antes de retirarlas (fig. 19).
Una técnica que intenta solucionar tanto la longitud de la cuerda como el deslizamiento del nudo ha sido descrita por Shudo et al.60, quienes tras pasar la cuerda por el MPap la anudan múltiples veces hasta que la «torreta» de nudos llega a la altura del borde libre del VPost sano. Tras ello se pasa la sutura por el borde libre del velo y se anuda, con lo que resulta imposible que deslice el nudo en absoluto (fig. 20). Los resultados a cinco años en una serie corta de pacientes (n = 34) son buenos, con una libertad de IM recurrente de 94,0 ± 4,0%. Un 24% de pacientes presentaban un gradiente medio > 5 mmHg en el seguimiento tardío. En el análisis multivariante se asociaron a gradientes elevados el uso de anillos completos (OR 8,9; IC al 95% 1,2–64; p =0,031) y anillos de 26 mm (OR 7,5; IC al 95% 1,1–50; p = 0,037). Se realizó anuloplastia restrictiva uno o dos tamaños en todos los pacientes, lo cual pudo influir negativamente a ese respecto. El movimiento del segmento reparado por ecocardiografía fue visualmente normal y no se ha evidenciado ruptura de neocuerdas durante el seguimiento, a pesar de utilizarse suturas de Gore-tex CV 5 en el inicio de la experiencia.
Técnicas de implantación de lazadas múltiples de cuerdas. Indicaciones, técnicas y resultadosExisten una serie de técnicas que igualmente implican el implante de neocuerdas pero que se basan en la implantación de lazadas múltiples de cuerdas (LMC), o «loops» de ePTFE. Esta técnica fue inicialmente descrita por von Oppell y Mohr34, aunque David et al.61, describieron un procedimiento de reparación mitral con múltiples pasos laxos de sutura entre el borde libre del velo y el músculo papilar. Aunque puede aplicarse en ambos velos, destaca su utilidad para la corrección de los prolapsos del VAnt.
Básicamente, la LMC comprende un sistema preconfigurado de suturas de ePTFE que forman lazadas dependientes de un anclaje a un parche de teflón. Las longitudes de las lazadas pueden ser variables, en rangos entre los 14 y los 24 mm, pudiendo ser todos ellos iguales o de longitudes diferentes40.
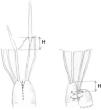
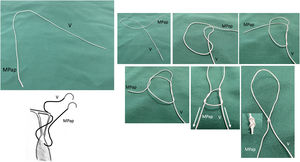
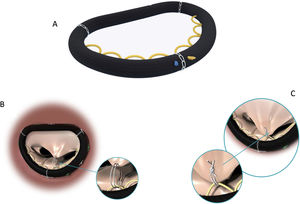
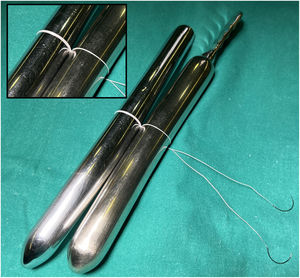
La LMC se inicia con la medición de la longitud normal de las cuerdas tendinosas nativas adyacentes a la zona de prolapso mediante un calibre convencional62 o especialmente diseñado con una ergonomía adecuada para el abordaje mitral abierto o por abordajes mini-invasivos63 (fig. 21). La medición se suele realizar apoyando uno de los extremos del calibre en la inserción de las cuerdas tendinosas responsables del prolapso en el músculo papilar y el otro en el sitio de inserción del velo de las cuerdas adyacentes al prolapso, consideradas de longitud normal34,64. En ausencia de segmento de referencia se sugiere realizar la medición desde la inserción de las cuerdas en el músculo papilar hasta el anillo nativo, a cuyo nivel coapta normalmente el VAnt. En otros trabajos se propone apoyar el calibre sobre el músculo papilar y ajustar el otro extremo en la línea de coaptación durante el test de suero de competencia valvular65. Matsui et al.66 han diseñado un calibre, con el extremo ventricular en forma de cúpula y el de los velos con forma de gancho, para facilitar la medición y anudado.
Con la longitud obtenida, algunos autores proponen la utilización de lazadas preformadas, que actualmente están disponibles comercialmente63, mientras que otros prefieren construirlas anudándolas sobre el calibre manualmente con antelación a la intervención62 o durante la misma34. Cagli et al30 idearon una ingeniosa forma de elaborar neocuerdas, hasta dos sets de lazadas con cada sutura de Gore-tex®. Tras calcular la longitud idónea de la neocuerda, se calcula el diámetro circular necesario para conseguir esa longitud mediante la fórmula:
D = 2L/πdonde D es el diámetro circular y L la longitud de la neocuerda.
Posteriormente, se realizan lazadas alrededor de un tallo de Hegar de dicho diámetro y tras cada lazada se aplican tres nudos. Cuando se han completado las lazadas requeridas, se pone otro tallo de Hegar adyacente del diámetro correspondiente a la 2 ª longitud de neocuerda deseada y se realiza el mismo proceso. Finalmente se fijan ambas lazadas con otros tres nudos y ambas agujas se pasan por un parche para ser suturadas al MPap (fig. 22).
En cualquiera de estas técnicas el implante de las lazadas se inicia con su anclaje a la unión fibromuscular del músculo papilar, por medio de una sutura en U apoyada sobre el mismo parche de teflón que incorpora los loops. La sutura en U apoyada en parches puede inducir isquemia o distorsión del músculo papilar por lo que se ha propuesto realizar una pasada única sobre el papilar, sobre la que se anclan las múltiples lazadas utilizadas58.
La fijación de las lazadas al borde libre del velo se realiza mediante suturas de ePTFE en la cara auricular del velo a 3-5 mm del borde libre, que se pasan desde la cara auricular para ser anudadas en la cara ventricular40. Ello evita que los nudos interfieran con la coaptación valvular y se consigue cierta incurvación del borde libre «en palo de hockey» para conseguir mejor coaptación56. La fijación de las lazadas al velo con otros materiales diferentes al ePTFE (polipropileno o poliéster trenzado) puede producir ruptura de las lazadas y fallo de la reparación67. Esta filosofía soluciona en sí misma el problema de la fijación de la cuerda al velo y el deslizamiento de los nudos, ya que al anclarse al velo mediante suturas independientes no implica ningún riesgo de alargar o acortar la neocuerda.
Al igual que con el uso de cuerdas aisladas, es aconsejable que las lazadas no crucen la línea media para no provocar la aparición de fuerzas no fisiológicas durante el ciclo cardiaco56,65.
La práctica totalidad de la evidencia disponible en cuanto a los resultados de la LMC hace referencia a experiencias unicéntricas. Diferentes trabajos confirman excelentes resultados a largo plazo con tasas de supervivencia y de libertad de reintervención a cinco años superiores al 95% y 92%, respectivamente68. Los trabajos comparativos con otras técnicas son escasos. Algunos refieren mejoría de los resultados respecto a las técnicas resectivas68 o al EtoE69. Dada la sencillez de su anclaje al borde libre del velo, se ha popularizado su utilización en el campo de la cirugía mínimamente invasiva65,68,69, aunque no se dispone de estudios relevantes que comparen la LMC con las técnicas de implantación convencional de neocuerdas en el VAnt. En este tipo de cirugías se han utilizado U-clips de nitinol para fijar las cuerdas al velo70.
ConclusionesActualmente, la RepM en el prolapso de VAnt por patología degenerativa se puede realizar con resultados similares a los obtenidos en el VPost. Existen multitud de técnicas validadas con buenos resultados a largo plazo entre las cuales destacan la implantación de neocuerdas de ePTFE, la técnica de borde-con-borde asociada a anuloplastia y la resección triangular en casos de prolapsos limitados asociados a exceso de tejido. El seguimiento a largo plazo de los resultados de las diferentes técnicas es esencial para poder conjugar la sencillez y reproducibilidad de muchas de ellas con una adecuada durabilidad.
FinanciaciónNo se ha obtenido financiación para este trabajo.
Conflicto de interesesLos autores declaran que no presentan conflictos de intereses.