El cambio en el perfil de los pacientes susceptibles y el un aumento del intervencionismo diagnóstico y terapéutico está provocando un incremento de la incidencia de la endocarditis infecciosa (EI). Los enfermos tienen mayor edad, más comorbilidad y más riesgo de infecciones relacionadas con la asistencia sanitaria, lo que determina que Staphylococcus aureus (S. aureus), Staphylococcus coagulasa-negativo y Enterococcus spp hayan adquirido un mayor protagonismo. El mayor conocimiento sobre esta enfermedad y las nuevas pruebas de diagnóstico han elevado el nivel de sospecha de los clínicos que diagnostican la EI en escenarios diferentes al de su presentación clásica. Los programas de tratamiento antibiótico domiciliario endovenoso (TADE) y la simplificación a tratamiento antibiótico oral han demostrado la misma eficacia que el tratamiento intrahospitalario y permiten reducir la estancia hospitalaria. Los nuevos tipos en endocarditis (endocarditis sobre transcateter insertados por vía percutánea [TAVI] o endocarditis asociada a dispositivos de estimulación cardiaca [DEC]), en pacientes con un elevado riesgo operatorio, obliga a individualizar las indicaciones en el seno de equipos multidisciplinarios «equipos de endocarditis».
El objetivo de este trabajo es revisar las novedades sobre el manejo de la EI aparecidas en los primeros años del presente siglo.
Changes in the profile of susceptible patients and an increase in diagnostic and therapeutic interventionism are leading to an increase in the incidence of infectious endocarditis. Patients are older, have more comorbidities, and are at greater risk of healthcare-associated infections, which means that S. aureus, coagulase-negative Staphylococcus, and Enterococcus spp. have become more prevalent. Greater knowledge about this disease and new diagnostic tests have raised the level of suspicion among clinicians who diagnose infectious endocarditis in settings other than its classic presentation. Oupatient parenteral antibiotic treatment (OPAT) programs and the simplification from intravenous to oral antibiotic treatment have proven to be as effective as inpatient treatment and reduce hospital stays. New types of endocarditis (endocarditis on TAVI or endocarditis associated with cardiac pacing devices) in patients with high surgical risk require individualized indications within multidisciplinary “endocarditis teams.”
The objective of this study is to review the developments in the management of infective endocarditis that have emerged in the early years of this century.
La endocarditis infecciosa (EI) es una enfermedad rara pero devastadora, con una mortalidad cercana al 25% en el primer año y con necesidad de cirugía cardiaca, en algún momento de su evolución, en más del 50% de los pacientes. Su incidencia se estima entre 10 y 20 casos por 100.000 habitantes y año1 aunque se ha detectado un notable aumento en los últimos años. En España aumentó significativamente desde 2,72 en 2003 a 3,49 por 100.000 personas-año en 2014 con una incidencia casi el doble en hombres que en mujeres2. El 30,4% de las EI ocurre sobre válvulas protésicas (EIVP)3 siendo la incidencia de EI en pacientes portadoras de prótesis valvulares de 0,5 a un caso por 100 personas-año, con un mayor el riesgo para las prótesis biológicas que para las prótesis mecánicas4.
Entre las razones para este aumento en la incidencia hay que destacar:
- a)
Un cambio en la población susceptible, con un aumento progresivo de la edad de los pacientes con EI (46% son mayores de 65 años)5 que se acompaña de una mayor comorbilidad (hemodiálisis, cáncer y diabetes mellitus se han relacionado con mayor riesgo de EI) y fragilidad, y un mayor contacto con el sistema sanitario; b) un mayor intervencionismo diagnóstico y terapéutico (accesos vasculares, procedimientos invasivos genitourinarios o endoscópicos) lo que ha motivado que la tercera parte de las EI estén relacionadas con los cuidados sanitarios; c) el aumento de las indicaciones para implante de dispositivos de estimulación cardiaca (DEC) y de válvulas aórticas transcateter insertados por vía percutánea (TAVI) de tal manera que la incidencia de EITAVI se estima en cinco casos por 1.000 procedimientos-año3; d) un cambio en los criterios diagnósticos para la EI de la International Society of Cardiovascular Infectious Diseases (ISCVID) (criterios de Duke modificados) para la EI lo que ha mejorado la sensibilidad diagnóstica y ha ampliado el espectro de microorganismos considerados como «típicos» de EI, elevando el índice de sospecha ante las bacteriemias causadas por estos gérmenes6.
Por este motivo resulta conveniente revisar las novedades para el manejo de la EI que han sido publicadas durante la primera parte del siglo XXI.
EtiologíaLa etiología de la EI en países con recursos medios o altos ha cambiado. El Streptococcus del grupo viridans ha dejado de ser el microorganismo más frecuente en la EI sobre válvula nativa (EIVN) (16,7%) cediendo su lugar al género Staphyloccus spp (26,3% Staphylococcus aureus [S. aureus] y 14,8% Stahylococcus coagulasa negativo [ScoN]). En tercer lugar, aparecen Enterococus spp (12,5%) y S. gallolyticcus (9%)7. En la EIVP, en cambio, ScoN alcanza un 32,3% seguido por S. aureus (23,6%), Streptoccocus spp (19,4%) y Enterococus spp (16%)8. S. lugdunesis tiene una personalidad propia, con una agresividad y un pronóstico comparable a S. aureus9. El riesgo de EI estreptocócica depende también de la especie: S. mutans, S. gordonii, S. sanguinis, S. gallolyticus, y S. mitis/oralis tienen mayor probabilidad de asociarse con una EI10. Del mismo modo, la especie también influye en el riesgo de complicaciones: Streptococcus del grupo anginosus tienen más riesgo de complicaciones perivalvulares y S. agalactiae se asocia con vegetaciones de gran tamaño que embolizan con frecuencia11. La EI fúngica se ha mantenido estable (1,2%) y está causada, fundamentalmente, por levaduras del grupo Candida spp3. Enterococcus spp es la principal causa de EI sobre TAVI (24,6%-38,5%) seguida estrechamente por S. aureus y en menor proporción ScoN8. EI desarrollo del diagnóstico molecular mediante la secuenciación de gen RNA 16s, en el material procedente de la vávula, ha permitido disminuir el porcentaje de EI con hemocultivo negativo (EIHCN) (del 8% al 1,1%)7: gracias a estas técnicas Bartonella spp y Coxiella burnetti se han consolidado como etiologías de EIHCN, más allá del diagnóstico serológico, y Tropheryma wipplei ha emergido como un agente que anteriormente había permanecido «oculto» dentro de este grupo. En los últimos años se han publicado brotes de EI por micobacterias (M. chimera) relacionados con la contaminación de dispositivos (módulos de normo-hipotermia) utilizados en la cirugía cardiaca con necesidad de circulación extracorpórea12.
ClínicaLa presentación clínica de la EI ha cambiado en gran medida y cada vez resulta más infrecuente que se presente con el cortejo semiológico «clásico» de la EI subguda13. Los criterios de Duke modificados se crearon con fines de investigación14, pero se han convertido en el «estándar» por el que los clínicos deciden tratar a los pacientes con sospecha de EI. Recientemente han sido revisados6 y, junto a los criterios de la Sociedad Europea de Cardiología (SEC)15, son utilizados para realizar el diagnóstico de EI. Por ello una bacteriemia persistente por microorganismos «típicos» en pacientes con una valvulopatía predisponente o con un dispositivo de DEC, o un síndrome febril que recurre tras finalizar varios ciclos de antibioterapia empírica, prescritos para otras posibles etiologías en este contexto clínco, puede ser la forma de presentación de una EI y alertar al clínico sobre este posible diagnóstico. En otras ocasiones, la presencia de un evento embólico sintomático (presente en el momento del ingreso en el 25,3% de los pacientes), una osteomileitis vertebral (5%) o una insuficiencia cardiaca de reciente aparición (27%)16,17 son las claves para poner en marcha la cascada diagnóstica. Incluso, el resultado del cultivo de una muestra obtenida tras embolectomía puede ser la prueba que permita diagnosticar una EI, por lo que este material debería ser enviado de manera sistemática a Microbiología en todo paciente con fiebre e ictus, en el que se sospeche este diagnóstico.
DiagnósticoLos criterios de Ducke modificados6 y las guías de las SEC de 202315 han supuesto una mejora significativa para el diagnóstico de la EI, aumentado su sensibilidad (de 75 a 81%) a expensas de una ligera reducción de la especificidad (de 99 a 96%). La ampliación del número de microorganismos considerados como «típicos», para los que no se consideraría necesario su presencia en los hemocultivos seriados, el refuerzo de la importancia de la bacteriemia persistente para las otras etiologías y la trascendencia de la bacteriemia enterocócica, independientemente de su origen, han elevado en gran medida el indice de sospecha de EI. Como hemos comentado previamente, el diagnóstico molecular, a partir de las valvulas resecadas y del material protésico extraído18,19 ha aumentado el espectro diagnóstico, incluso, en pacientes con hemocultivos negativos por haber recibido un tratamiento antibiótico previo. Se ha publicado una experiencia preliminar sobre el uso de la metagenómica en sangre y plasma de pacientes con EIHCN, pero su utilidad futura está por determinar20.
La ecocadiografía transtorácia (ETT) continúa siendo la exploración clave en el diagnóstico de la EI. La ecocardiografía transesofágica (ETE) tiene una mejor sensibilidad y especificidad que la ETT y permite visualizar complicaciones (perforación, abscesos y fistulas) aunque su utilidad en la EIVP es menor (sensibilidad 82%; especificidad 86%) que en la EIVN. Por ello, si la sospecha de EI continúa siendo elevada, se recomienda repetir la ETE en los tres a 10 días posteriores21. La ecocardiografía 3D proporciona una información más detallada del daño valvular al valorar de manera más precisa la extensión de las complicaciones perianulares, cuantifica mejor la gravedad de la regurgitación periprotésica, y permite una mejor localización de las perforaciones valvulares, lo que ayuda a planificar la cirugía. La tomografía computarizada (TC) cardiaca es igual o superior a la ETE para demostrar complicaciones paravalvulares y está sujeta a menos artefactos en pacientes con prótesis metálicas. Proporciona información sobre la anatomía de las coronarias, pudiendo evidenciar una estenosis coronaria significativa, por lo que podría utilizarse como una alternativa a la angiografía. Es más eficiente que la ETE para el diagnóstico de abscesos y pseudoaneurismas, pero menos para vegetaciones pequeñas, fistulas, perforaciones valvulares y fugas periprotésicas22,23.
Los criterios de Duke modificados de 20236 y las nuevas guías europeas de EI15 han incluido como un criterio mayor las imágenes de TC de emisión de positrones con 18-F fluorodeoxiglucosa (PET-TC). Esta técnica tiene una buena sensibilidad (87%) y especificidad (90%) para EIVP y también puede ser de utilidad en las infecciones asociadas a DEC, especialmente en los casos en que no se consigue un diagnóstico concluyente con la ETE. Un patrón de captación focal o heterogéneo sobre la vávula protésica es considerado sugestivo de infección, independientemente del tiempo trascurrido desde la cirugía. Tiene una especial utilidad para el diagnóstico de la EITAVI, en la que no siempre son visibles las vegetaciones y permite, también, diagnosticar complicaciones embolígenas y posibles neoplasias relacionadas con algunas etiologías de la EI (Enterococcus spp y S. gallolyticus). La gammagrafía con leucocitos marcados (SPECT/TC) tiene mayor especificidad, pero menor sensibilidad15.
TratamientoTratamiento antibióticoLa mayor novedad en el tratamiento antibiótico de la EI es la posibilidad de completarlo en el domicilio del paciente24.
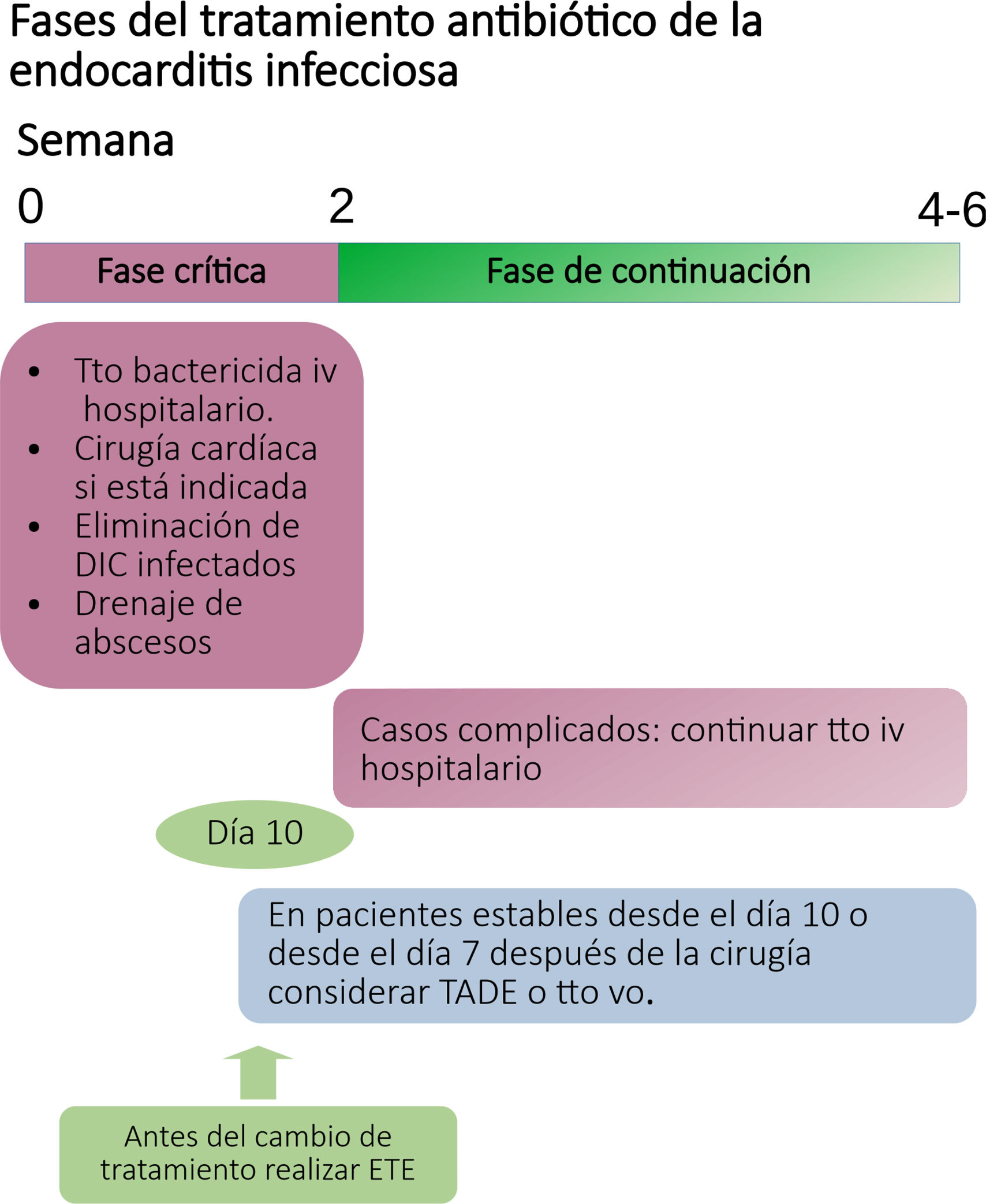
En el tratamiento de la EI se contemplan dos periodos: a) un «periodo crítico», entre 10-14 días, donde existe un mayor riesgo de complicaciones y en el que habitualmente se realiza la cirugía, cuando está indicada, y b) un «periodo de consolidación» entre dos y cuatro semanas, en el que el paciente, que no ha requerido cirugía, se encuentra estable. En este periodo, el tratamiento tiene como objetivo asegurar la curación microbiológica y evitar las recaídas (fig. 1)
Fases del tratamiento antibiótico de la endocarditis infecciosa.
DEC: dispositivos de estimulación cardiaca; TADE: tratamiento antibiótico domiciliario endovenoso; ETE: ecocardiografía transesofágica.
Adaptado de Delgado et al.15.
Los programas de tratamiento antibiótico domiciliario endovenoso (TADE) permiten administrar antibioterapia endovenosa en el domicilio del enfermo25. Para ello es necesario que el paciente haya superado la fase con mayor riesgo de complicaciones (periodo crítico), se encuentre hemodinámicamente estable, no requiera cirugía o, si se ha intervenido, haya transcurrido un tiempo razonable para descartar complicaciones posquirúrgicas. Las guías originales de la EI establecían unos criterios muy estrictos para la inclusión de pacientes con EI en programas de TADE aunque, en la práctica clínica, hasta el 75% de los pacientes con EI tratados en TADE no se ajuntaban estrictamente a estas recomendaciones. Por ello el Grupo de Apoyo para el Manejo de la Endocarditis Infecciosa (GAMES) publicó un estudio de cohortes restrospectivo que demostró que no había diferencia en la mortalidad entre los pacientes con EI que continuaban hospitalizados y los incluidos en TADE26. A partir de estos resultados, se establecieron unos nuevos criterios para la inclusión de pacientes con EI en TADE conocidos como los «criterios OPAT-GAMES». Estos criterios fueron validados en un estudio de cohortes prospectivo realizado entre 2008 y 201827 y han sido recogidos en las guías de la SEC15. Básicamente, se pueden incluir todos los pacientes con EIVN o EIVP tras 10 a14 de hospitalización o una semana después de la cirugía, excepto aquellos que presenten complicaciones embólicas graves, que requieran cirugía que se considera contraindicada por presentar un riego quirúrgico inasumible y también en aquellos que presenten complicaciones posquirúrgicas graves, o en los que la EI está causada por microorganismos de difícil tratamiento que, sin embargo, podrían incluirse a partir de la tercera semana (tabla 1).
Criterios de exclusión OPAT-GAMES para el tratamiento de la endocarditis infecciosa en programas de TADE
| 1. Cirrosis hepática Child B o C |
| 2. Embolia grave del SNCMúltiple (<3), de gran tamaño (>2 cm), hemorrágico o con déficits neurológico estable. |
| 3. Gran esplenomegalia o absceso esplénico no drenado |
| 4. Abscesos paravertebrales que requieren neurocirugía |
| 5. Complicaciones perivalvulares u otras condiciones graves que requieren cirugía cuando está contraindicada (excepto para TADE paliativo)Absceso previvalvular, perforación, fístula, pseudoaneurisma, derrame pericárdico severo con signos de taponamiento, etc. |
| 6. Complicaciones posquirúrgicas gravesAVC isquémico o hemorrágico grave, agravamiento de un AVC previo, colapso hemodinámico, sangrado por la herida quirúrgica que requiere reintervención, infección de la herida quirúrgica (mediastinitis/osteomielitis), neumonía asociada a ventilación mecánica, fracaso renal agudo que requiere hemodiálisis, bloqueo cardiaco con necesidad de marcapasos, polineuropatía del paciente crítico. |
| 7. Microorganismos de difícil tratamientoAquellos que requieren una combinación de antibióticos que no puede administrarse en programas de TADE o que requieren antibióticos que precisan un control estricto de niveles por su potencial toxicidad o estrecho índice terapéutico. Staphylococcus aureus o Enterococcus spp resistentes a vancomicina y a otros antibióticos alternativos (daptomicina y linezolid). Bacilos gramnegativos multirresistentes. Estreptococos del grupo viridans con alto nivel de resistencia a penicilina. Endocarditis por hongos distintos a Candida spp. |
| 8. Usuarios a drogas por vía intravenosa |
AVC: accidente vasculocerebral; SNC: sistema nervioso central; TADE: tratamiento antibiótico domiciliario endovenosa.
Adaptado de Pericàs et al.26.
Los programas de TADE supervisados por especialistas en enfermedades infecciosas han demostrado que mejoran el pronóstico (al evitar complicaciones derivadas de largas estancias hospitalarias) y disminuyen los reingresos por EI28. Para garantizar la eficacia del tratamiento es necesario asegurar la estabilidad del antibiótico (o de las combinaciones de antibióticos) a temperatura ambiente. Una de las pautas preferentes para tratar una EI enterocócica es la combinación de ampicilina-ceftriaxona29. Recientemente se han publicado varios trabajos que demuestran que ambos antibióticos son estables en la misma disolución manteniendo la sinergia30,31 lo que permite el uso de esta combinación para la EI enterocócica en los programas de TADE32.
El tratamiento de la EI por S. aureus ha generado mucho debate en la literatura. Cefazolina es tan eficaz como cloxacilina con menos nefrotoxicidad y menos complicaciones realcionadas con el acceso vascular, aunque su uso en EI ha estado condicionado por el, probablemente infundado, temor al «efecto inóculo». Varios metaanálisis33–35, un estudio observacional36 y un estudio de cohortes37 han demostrado que no existen diferencias de eficacia entre ambos antibióticos. Por otro lado, cefazolina es estable a temperatura ambiente durante cinco días, lo que permite administrarla cada 48h y optimizar los recursos necesarios para los programas de TADE. Se han publicado los resultados con esta pauta de dosificación que avalan su empleo en programas de TADE38. No obstante, la elevada mortalidad de la EI causada por este microorganismo ha llevado a la realización de estudios donde se combinan betalactámicos con daptomicina que habían evidenciado un efecto «sinérgico» in vitro. Sin embargo, a pesar de los resultados esperanzadores de los estudios realizados en modelos animales39, un estudio de cohortes40 y un ensayo clínico41 recientes no han logrado demostrar que el tratamiento combinado acorte la duración de la bacteriemia ni reduzca la mortalidad por lo que, en este momento, no debería considerarse como un estándar de tratamiento para la EI estafilocócica.
Para aquellos hospitales que no dispongan de programas de TADE, los antibióticos de larga vida media (dalbavancina, oritavancina) permiten alcanzar concentraciones plasmáticas y tisulares suficientes para acceder a su administración cada siete o 14 días. Recientemente se ha publicado la experiencia de una cohorte multicéntrica española sobre el tratamiento de la EI por cocos grampositivos con dalbavancina, incluidas endocarditis enterocócicas, con una eficacia superior al 95,9%42.
El tratamiento antibiótico de la EI por S. aureus resistente a meticilina (SARM) representa un reto por el alto indice de fracaso en monoterapia con vancomicina, especialmente para cepas con concentración mínima inhibitoria> 1,5 mcg/mL, probablemente por su actividad bacteriostática y su escasa actividad frente a biopelículas, y aún está por definir cual es la mejor pauta tratamiento para esta etiología. Daptomicina tiene actividad bactericida y actividad frente a biopelículas, y a dosis de 10-12mg/kg ha demostrado su eficacia en bacteriemias por SAMR. Sin embargo, se ha descrito la emergencia de cepas no sensibles a este fármaco durante el tratamiento. Por ello se han estudiado combinaciones sinérgicas con otros fármacos: a) daptomicina-fosfomicina podría ser una combinación que ha demostrado sinergia in vitro para esta etiología43 aunque aún falta experiencia clínica; b) ceftarolina, en monoterapia o en combinación con daptomicina, podría ser una alternativa de tratamiento, aunque no ha demostrado reducir la mortalidad cuando se compara con el «standard-of-care»44. La bacteriemia persistente por SARM, a pesar un tratamiento antibiótico dirigido por el antibiograma supone un reto para el clínico. Estudios preliminares sugieren que la combinación de ceftarolina con daptomicina podría reducir la duración de la bacteriemia y mejorar el pronóstico45.
Se ha publicado que rifampicina no mejora los resultados de la EIVP por S. aureus, por lo que probablemente no sería necesario incluirla en la pauta de tratamiento46,47.
Los aminoglicósidos han dejado de utilizarse en combinación con los betalactámicos para el tratamiento de la EI por su mayor nefrotoxicidad, sin que ello conlleve una mayor eficacia48. Como excepción, se siguen recomendando asociados a ceftriaxona en la pauta de dos semanas para la EI estreptocócica y combinados con ampicilina durante las dos primeras semanas de tratamiento de la EI enterocócica.
En 2019 se publicó el ensayo clínico POET que acabó con el paradigma de que el tratamiento de la EI debía administrarse exclusivamente por vía intravenosa. Se trata de un ensayo de no inferioridad que incluyó EIVN y EIVP causadas con cocos grampositivos: Streptococcus spp, E. faecalis, S. aureus y ScoN49. Tras un periodo de 10 días de tratamiento intravenoso o siete después la cirugía, los pacientes se aleatorizaron a continuar tratamiento intravenoso en régimen de hospitalización o cambiar a una combinación de dos antibióticos orales, con diferente mecanismo de acción y sensibilidad demostrada al microorganismo causante de la EI, lo que permitía su alta hospitalaria. La no inferioridad se confirmó a los tres y a los cinco años50,51. Como limitaciones del estudio: los pacientes ancianos y frágiles y los casos de EIVP sobre válvulas mecánicas están poco representados y los casos de EI que precisaron sustitución valvular fueron causados, mayoritariamente, Streptococcus spp. Un metaanálisis confirmó estos resultados y concluyó que la simplificación a tratamiento oral es una opción para pacientes estables con EI52 y se asocia, como era de esperar, con una mejora de la calidad de vida percibida por los pacientes. El ensayo OraPAT, actualmente en curso, intentará demostrar que no existe diferencia entre simplificar a tratamiento oral o continuar por vía intravenosa en programas de TADE53.
No ha habido cambios significativos en la duración del tratamiento, tanto para la EIVN como la EIVP. Sin embargo, no está bien establecido cual sería el mejor tratamiento antibiótico para pacientes con EIVP, con indicación de cirugía, a los que no se le puede retirar la prótesis por el elevado riesgo quirúrgico15. Se recomienda individualizar cada caso e incluso valorar el tratamiento supresor crónico para algunos pacientes.
CirugíaMás de la mitad de los pacientes con EI necesitarán cirugía en algún momento de su evolución. Las indicaciones de la cirugía se basan en la disfunción valvular o en el daño tisular secundario a la infección, en la infección no controlada o en el riesgo elevado de embolias15,54.
Ha quedado establecido que los ictus isquémicos de tamaño pequeño no deberían retrasar la cirugía, si estuviese indicada55. Por el contrario, en los ictus hemorrágicos se recomienda posponerla durante cuatro semanas, por el alto riego de resangrado durante la cirugía.
Para la EIVN, la reparación de la válvula mitral es no inferior a la sustitución valvular y debería ser la técnica de elección siempre que sea posible56–58. En la EIVP, la indicación del tratamiento quirúrgico debe ser individualizada y estar determinada por la disfunción valvular y por las complicaciones perivalvulares. Los pacientes con EIVP sin disfunción valvular pueden ser tratados exclusivamente con tratamiento antibiótico59. Para los pacientes con indicación de cirugía que no se pueden intervenir, por su elevado riesgo quirúrgico, las intervenciones transcateter (cierre de la fuga paravalvular, reparación de la mitral «borde a borde» (TEER) o la sustitución de la válvula sobre la válvula mitral o aórtica) han emergido como una alternativa a la cirugía60,61. Si es posible, estos procedimientos deberían retrasarse hasta que se complete el tratamiento antibiótico y no existan signos de infección activa21.
Se han utilizado varias escalas pronósticas para valorar el riesgo quirúrgico: PALSUSE, EuroSCORE y más recientemente APORTEI62. Todas ellas aportan una estimación de riesgo muy heterogénea, pues consideran factores diferentes, que son ponderados de distinta manera. Aunque ayudan a la toma de decisiones, hay factores de riesgo no incluidos como, por ejemplo, algunas circunstancias del paciente (cirrosis hepática avanzada), la disponibilidad de un tratamiento antibiótico apropiado o la experiencia del equipo quirúrgico, por lo que la indicación de cirugía siempre debe ser individualizada y resultado del consenso del equipo de endocarditis (endocarditis team) de cada centro. Estos son equipos multidisciplinarios constituidos por infectólogos, cardiólogos, cirujanos cardiacos, ecocardiografistas e intensivistas, junto a otros especialistas, cuando se requieran, y han revolucionado el manejo de la EI. Se ha demostrado que el manejo individualizado de la EI por los equipos de endocarditis puede reducir la mortalidad63,64.
Manejo de las complicaciones neurológicasHasta una cuarta parte de los pacientes con EI reciben tratamiento anticoagulante en el momento del diagnóstico, siendo las principales indicaciones la fibrilación auricular y ser portador de una prótesis mecánica. Entre los factores de riesgo para el desarrollo de complicaciones neurológicas relacionadas con la EI se refieren la localización mitral, la etiología por S. aureus, las vegetaciones de gran tamaño y la no interrupción del tratamiento anticoagulante, siendo la combinación de esta última con la etiología estafilocócica determinantes para el desarrollo de complicaciones hemorrágicas. Por ello algunos autores recomiendan la supresión transitoria de la anticoagulación en las EI estafilocócicas, al menos, durante una o dos semanas65,66.
Para los ictus isquémicos la trombectomía mecánica en pacientes con endocarditis es tan segura y eficaz como en la población general67. La realización de resonancia magnética (RM) para diagnosticar embolias cerebrales ocultas en las EI con alto potencial embolígeno, como la EI estafilocócica, no está recomendada de forma generalizada y su uso debe estar dirigido por la clínica del paciente, ya que se ha demostrado que solo los accidentes vasculares con repercusión clínica influyen sobre el pronóstico y una RM con estas lesiones sin traducción clínica puede inducir a una demora innecesaria en el tratamiento quirúrgico.
ProfilaxisHa habido incertidumbre sobre la eficacia de la profilaxis antibiótica para los procedimientos dentales para pacientes con riesgo de EI, hasta el extremo que las guías NICE del Reino Unido68 desaconsejaron su uso rutinario, sin embargo revisiones sistemáticas posteriores y un metaanálisis han demostrado que la profilaxis antibiótica podría ser beneficiosa para prevenir la EI en pacientes de alto riesgo (EI previa, prótesis valvulares o con materiales utilizados para la reparación valvular, cardiopatía congénita cianótica no tratada o con shunt residual)69. Por ello se recomienda su uso, especialmente para procedimientos dentales invasivos, en este grupo de pacientes.
Con respecto a procedimientos no dentales, la evidencia obtenida a partir de estudios observacionales, en pacientes con diversas manipulaciones, y la creciente importancia de E. faecalis en EIVP, obliga a reconsiderar la posibilidad de la profilaxis antibiótica para pacientes de alto riesgo, sometidos a procedimientos diagnósticos o terapéuticos invasivos del tracto respiratorio, digestivo o genito-urinario como recomiendan actualmente las guías de la ESC y la AHA70. No existen pautas específicas para cada procedimiento, aunque podrían considerarse regímenes que tuviesen actividad frente a bacterias que habitualmente colonizan estos tractos. En todo caso, se recomienda extremar la vigilancia por sospecha de EI para los pacientes de alto riesgo a los que se les haya realizado un procedimiento invasivo en los tres meses previos.
PronósticoEn los últimos años se ha demostrado un descenso en la mortalidad hospitalaria de la EI en series europeas (17,8%), a pesar de un aumento en su complejidad7. La mortalidad hospitalaria de la EIVN se sitúa entre 11,1% y 13,8%, y la mortalidad al año entre 30,9% y 59%71,72, y está relacionada con la etiología y las condiciones del paciente: es significativamente mayor en EI por S. aureus y E, faecalis, y para los pacientes de edad avanzada y frágiles73. En la EIVP ha descendido del 35,4% al 29,9%3. Las variables relacionadas con la mortalidad hospitalaria son, esencialmente, el índice de Charlson ajustado a la edad, el shock séptico, la insuficiencia cardiaca aguda, el fallo renal agudo, las complicaciones del SNC, las complicaciones perivalvulares y la cirugía indicada y no realizada.
Situaciones especialesEndocarditis infecciosa con hemocultivo negativo74La bacteriemia constituye un criterio mayor para el diagnóstico de EI, pero hasta en un 8%-18% de las EI los hemocultivos son negativos75,76. Su causa principal es el tratamiento antibiótico previo, por lo que se recomienda, si el estado de los pacientes lo permite, obtener nuevos hemocultivos tras suspender la antibioterapia. Sin embargo, existen microorganismos de difícil crecimiento, que requieren medios especiales, o que solo crecen en medios de cultivo celulares (habitualmente no disponibles en los laboratorios asistenciales) entre los que se incluyen los del grupo HACEK, Abiotrophia spp, Coxiella burnetti, Tropheryma whipplei, Bartonella spp y, en menor proporción, Mycoplasma spp, Legionella spp, Brucella ssp, Aspergillus spp. En los casos no relacionados con el tratamiento antibiótico, la EIHCN suele presentarse de forma subaguda con eventos embólicos sintomáticos. Se recomienda alertar al microbiólogo, e incluir medios de cultivo especiales y serologías para estos microorganismos. El estudio molecular del tejido valvular o del material protésico obtenido durante la cirugía, mediante la reacción en cadena de la polimerasa (PCR) universal del gen 16S rRNA seguida de secuenciación, ha permitido alcanzar un diagnóstico definitivo en un importante número de casos de este subgrupo de pacientes76,77. En los casos donde el hemocultivo es negativo por un tratamiento antibiótico previo, y no disponemos de material valvular, la secuenciación metagenómica de sangre periférica (por la persistencia más prolongada del ADN bacteriano en la sangre) puede demostrar un agente etiológico, aunque esta prueba tiene falsos positivos y resulta de difícil interpretación. La duración del tratamiento de la EI por fiebre Q debe guiarse por la respuesta clínica y no por el descenso de los títulos de anticuerpos78. No está bien definida la pauta antibiótica, ni la duración para el tratamiento de la EI por Tropheryma whipplei, aunque se recomienda utilizar cotrimoxazol durante un mínimo de 12 meses79.
Endocarditis sobre TAVI y otros dispositvos valvulares80A pesar de su baja incidencia (0,5 casos por 100 pacientes-año; rango 0,2-2) el crecimiento exponencial de la utilización de esta prótesis nos enfrentará en los próximos años a un número creciente de EITAVI que presenta algunas características particulares. Las TAVI no presentan mayor riesgo de EI que las prótesis valvulares implantadas quirúrgicamente, pero en la mitad de los casos, la EITAVI está relacionada con la asistencia sanitaria (en la mayoría de los casos es causada por S. aureus y Enterococcus spp). Su presentación es atípica, lo que conlleva un retraso diagnóstico y una elevada proporción de complicaciones perivalvulares. La ETE tiene menos sensibilidad que en EIVP, por ello, en la mayoría de los casos es necesario realizar un PET-TC donde es importante diferenciar los patrones de captación focal y heterogénea del patrón homogéneo «inflamatorio» más frecuente. Hasta en un tercio de los casos, la ETAVI coexiste con la afectación simultánea de otra válvula o de un DEC. Para su tratamiento se utilizan las pautas recomendadas para otras EIVP, aunque no está definido si es necesario prolongar el tratamiento, e incluso un tratamiento supresor cónico cuando no se puede retirar la prótesis. La mortalidad es muy elevada: 27-75% en el primer año81. Más del 50% de los pacientes con EITAVI tendrían indicación de cirugía, pero solo se intervienen un 15% ya que estas prótesis se utilizan para pacientes ancianos, con comorbilidades que ya fueron malos candidatos para la sustitución valvular quirúrgica en su momento. Estudios recientes parecen demostrar una mejor supervivencia de la cirugía frente al tratamiento médico exclusivo, aunque estos resultados están condicionados por la experiencia del equipo quirúrgico82. Conforme se amplíen las indicaciones de la TAVI a pacientes más jóvenes, se podrá ampliar la recomendación de la sustitución valvular para los pacientes con EITAVI con riesgo quirúrgico bajo o intermedio. Las pautas recomendadas para la profilaxis preintervención no incluyen cobertura para enterococo, por lo que algunos autores sugieren combinar cefazolina con vancomicina. Por último, se recomienda limitar las exploraciones diagnóstico-terapéuticas invasivas en estos estos pacientes y se plantea si es necesario considerar la profilaxis antibiótica antes de realizar colonoscopia o exploraciones genitourinarias.
Los casos publicados de EI tras la implantación de MitraClip© son muy escasos; en el ensayo EVEREST su incidencia fue de 1,1%. En una revisión sistemática de 26 casos, la EI se presentó de forma temprana en 76,9%, con una mediana de tiempo entre la implantación de MitraClip y la aparición de los síntomas de cinco meses2-15,83. El microorganismo más frecuentemente identificado fue Staphylococcus aureus (46%), seguido de Enterococcus faecalis (11,5%), ScoN (11,5%) y Streptococcus spp. (11,5%). La mitad de los pacientes necesitó reemplazo valvular mitral quirúrgico. La mortalidad intrahospitalaria fue del 50% (38,4% en el grupo quirúrgico; 58,3% en el grupo médico; p = 0,433)84.
No se han publicado casos de EI asociada con los TAVI utilizados para el tratamiento de la insuficiencia tricuspídea (TriClip©, transcatheter tricuspid valve repair with EVOQUE©) aunque es esperable que su uso aumente en los próximos años, lo que nos enfrentará a nuevos retos relacionados con su infección.
Infecciones sobre dispositivos de estimulación cardiacas85,86Como DEC se incluyen: marcapasos permanentes, desfibriladores implantables y dispositivos de resincronización cardiaca. Su incidencia oscila entre 1 por 1.000 dispositivos-año para marcapasos y 8-9 por 1.000 dispositivos-año para dispositivos más complejos. El recambio del generador y el hematoma posoperatorio (OR: 8,46; IC 95%: 4,.01-17,86) se han relacionado con alto riesgo de infecciones sobre dispositivos de estimulación cardiacas (IDEC) por lo que, en aquellos pacientes anticoagulados, se recomienda suspender transitoriamente la anticoagulación, sin el uso de terapias «puente» con heparina, y realizar una hemostasia muy cuidadosa. Deben extremarse, también, las medidas universales de profilaxis quirúrgica (incluyendo la profilaxis antibiótica) y en casos de alto riesgo, el uso de bolsas impregnadas de antibióticos para recubrir el generador ha demostrado reducir la incidencia de IDEC87. El diagnóstico se basa, ante todo, en la demostración de una bacteriemia continua (mediante la realización de hemocultivos seriados) y en la presencia de signos inflamatorios en la bolsa del generador (en el caso ideal, con cultivos locales concordantes con los hemocultivos). La combinación secuencial de la ETE y del PET-TC puede demostrar vegetaciones en el cable, en la válvula o aumento de la actividad metabólica en la bolsa del generador que no hubiera sido percibida por el clínico88,89.
Diagnosticar una IDEC ante una bacteriemia sin signos de infección de la bolsa representa un reto que obliga a una valoración individualizada. El riesgo de la infección del dispositivo durante una bacteriemia depende del microorganismo: 14-55% para S. aureus, 7%-38% para Staphylococcus spp no aureus, 18%-20% para otros cocos grampositivos y 2%-17% para bacilos gramnegativos86. Por ello, se recomienda realizar estudios adicionales para descartar una IDEC ante una bacteriemia por S. aureus o por otros cocos grampositivos, en particular entero cocos, ScoN y estreptococos del grupo virilidad. Por el contrario, la bacteriemia por segregativos, a menudo, no justifica estudios adicionales. Algunos estudios han destacado una mayor propensión de Pseudomona aeruginosa y Serrato spp a causar IDEC en comparación con otros bacilos segregativos. Las imágenes móviles detectadas en los cables por la ETE no son patognomónicas de infección del dispositivo y pueden verse de manera habitual hasta en el 12-15% de los dispositivos implantados, por lo que ante una bacteriemia transitoria en un paciente portador de un DEC se podría optar por el tratamiento antibiótico de duración limitada y un seguimiento estrecho, con la repetición de los hemocultivos, una vez finalizado el tratamiento, para el diagnóstico precoz de la recaída.
Si se confirma el diagnóstico de infección local o sistémica, es obligada la extracción del dispositivo completo, siendo la tracción percutánea endovascular (TPE) la técnica de elección. La TPE es una técnica eficaz y segura, pero no exenta de riesgos y requiere considerable experiencia, por lo que diferentes escenarios obligan siempre a una valoración individualizada por infectólogos y cirujanos cardiacos experimentados con esta patología90,91. Ello reduce su principal complicación, la rotura de cava superior, a menos del 1%. Basada en una «recomendación de expertos», se recomienda el reimplante a las 72h de la retirada, siempre que los hemocultivos de control hayan resultado negativos y se haya realizado un correcto desbridamiento de la bolsa. Si se demuestra una EI valvular, se recomienda diferir el reimplante 14 días90. En cambio, se ha publicado la experiencia con el recambio en un solo tiempo sin que conlleve más riesgo de complicaciones ni una mayor tasa de recaídas91. Esta estrategia evita la necesidad de una segunda cirugía y previene el riesgo de complicaciones relacionadas con la utilización de un marcapasos transitorio en pacientes dependientes de marcapasos, durante las dos semanas recomendadas hasta el recambio.
ConclusionesLa incidencia de la EI está aumentando como consecuencia de un cambio en el perfil del paciente susceptible y de un aumento del intervencionismo diagnóstico y terapéutico. Los pacientes tienen mayor edad, más comorbilidad y más riesgo de infecciones relacionadas con la asistencia sanitaria, lo que determina que S. aureus, Staphylococcus coagulasa-negativo y Enterococcus spp hayan adquirido un mayor protagonismo. El mayor conocimiento sobre esta enfermedad y las nuevas pruebas de diagnóstico han elevado el nivel de sospecha de los clínicos que diagnostican la EI en escenarios diferentes a su presentación clásica. Los programas de TADE y la simplificación a antibioterapia oral permiten reducir la estancia hospitalaria con la misma eficacia que el tratamiento intrahospitalario. La ampliación de las indicaciones para las TAVI y los DEC nos enfrentan a nuevas formas de EI en las que el elevado riesgo operatorio no permite realizar una cirugía cardiaca reparadora, aunque estuviese indicada. Y a pesar de esta mayor complejidad se aprecia un descenso en la mortalidad hospitalaria. Las mejoras en las pruebas de imagen y en el diagnóstico microbiológico, la variedad de las pautas antimicrobianas actuales, los avances en la técnica quirúrgica y el manejo individualizado realizado por los equipos de endocarditis han contribuido, sin duda, a la mejora del pronóstico.
Muchos son los retos que nos presenta esta compleja enfermedad para los que será necesario que sigan existiendo equipos de endocarditis constituidos por grupos de profesionales de diferentes especialidades con un alto nivel de experiencia.
Consideraciones éticasEste trabajo no ha comportado experimentación en animales.
En este no intervienen pacientes o sujetos humanos.
Este trabajo no incluye un ensayo clínico.
Todos los datos mostrados en las figuras y tablas incluidas en el manuscrito se recogen en el apartado de resultados y las conclusiones.
FinanciaciónEl autor no ha recibido financiación para la realización de este artículo.
Conflicto de interesesEl autor no tiene conflictos de intereses.