La información disponible sobre pacientes con endocarditis infecciosa tras un trasplante cardiaco es relativamente escasa. Es crucial un diagnóstico precoz y un inicio muy rápido del tratamiento antimicrobiano. Es más frecuente la bacteriana que la fúngica, si bien esta es mucho más letal y más prevalente que entre los no trasplantados, y el patógeno bacteriano más frecuente es Staphylococcus aureus. La indicación quirúrgica se establece con mucha menor frecuencia que en corazones no trasplantados. Presenta mayor mortalidad que la endocarditis en la población general y la supervivencia postrasplante de los pacientes con endocarditis es significativamente más corta que la del resto de trasplantados cardíacos.
El resto de infecciones siguen siendo un riesgo importante para el trasplantado cardiaco pues causan aproximadamente el 20% de las muertes durante el primer año después del trasplante y el 50-75% de los pacientes tienen evidencia de infección microbiana en los primeros 3 años. Predominan las infecciones bacterianas, seguidas de las víricas y, en menor proporción, fúngicas y las causadas por protozoos.
Los mecanismos básicos de adquisición son la primoinfección, la reactivaón de una infección latente en pacientes seropositivos y la sobreinfección del receptor seropositivo de un órgano seropositivo.
Las manifestaciones clínicas en el trasplantado cardiaco son diferentes en frecuencia y tipo y dependen del pató del estado inmunitario previo del receptor, de la intensidad de la inmunosupresión y del tiempo transcurrido desde el trasplante, reconociéndose habitualmente tres períodos: primer mes, entre segundo y sexto mes y a partir de los 6 meses.
The information available on patients with infective endocarditis after heart transplantation is relatively scarce. Early diagnosis and rapid initiation of antimicrobial treatment is crucial. Bacterial disease is more common than fungal disease, although the latter is much more lethal and more prevalent than in non-transplant recipients. The most common bacterial pathogen is Staphylococcus aureus. The surgical indication is established much less frequently than in non-transplanted hearts. It has higher mortality than endocarditis in the general population, and post-transplant survival in patients with endocarditis is significantly shorter than in other heart transplant patients.
Other infections remain a significant risk for heart transplant recipients, causing approximately 20% of deaths during the first year after transplantation, and 50 -75% of patients have evidence of microbial infection in the first 3 years. Bacterial infections predominate, followed by viral infections and, to a lesser extent, fungal and protozoal infections.
The basic mechanisms of acquisition are primary infection, reactivation of a latent infection in seropositive patients, and superinfection of the seropositive receptor of a seropositive organ.
Clinical manifestations in heart transplant recipients vary in frequency and type and depend on the pathogen, the recipient's prior immune status, the intensity of immunosuppression, and the time elapsed since transplantation. Three periods are usually recognized: the first month, between the second and sixth months, and after 6 months.
El trasplante cardíaco se ha consolidado como el patrón oro del tratamiento en pacientes que padecen insuficiencia cardíaca avanzada refractaria al tratamiento médico óptimo1 y muestra unos resultados consistentes gracias, entre otros factores, a la mejora del seguimiento y los cuidados postrasplante y a la estandarización de los regímenes de inmunosupresión. Hasta en el 60% de las endocarditis infecciosas (EI) puede identificarse un origen nosocomial, por lo que esa terapia inmunosupresora obligada y el frecuente contacto con los distintos niveles de la atención sanitaria hacen que los pacientes trasplantados estén más expuestos a infecciones, con un incremento en morbimortalidad para esta población2.
La información disponible sobre pacientes con EI tras un trasplante cardíaco es relativamente escasa y se compone de casos aislados o pequeñas series de casos3,4, por lo que la utilidad clínica de sus conclusiones es reducida. Más recientemente se han publicado una revisión sistemática que identifica 57 pacientes en 32 artículos5 y un estudio retrospectivo de los registros de trasplante español y francés que abarca 12 años y encuentra tan solo 18 casos de EI6.
En todo caso, la EI en pacientes trasplantados presenta rasgos comunes y características diferenciales con la EI en corazones nativos, siendo por ello crucial un diagnóstico precoz y, sobre todo, un inicio muy rápido del tratamiento antimicrobiano; la mortalidad va del 67 al 80% cuando el tratamiento se retrasa, aunque sea de forma breve, e incluso puede acercarse al 100% dependiendo del germen y la carga infecciosa4.
No existe un periodo temporal típico para la aparición del episodio de EI tras el trasplante, y el tiempo medio varía entre series (desde 19 meses para Jordan et al.5 hasta 43 meses para Martínez-Sellés et al.6), aunque en todas ellas se encuentran casos desde pocas semanas hasta varios años tras el implante del órgano.
MicrobiologíaEl microorganismo bacteriano más frecuentemente implicado es el Staphylococcus aureus, con una incidencia variable del 26 al 45%4–6. Otros patógenos, con una preponderancia bastante menor, son Enterococcus faecalis y Pseudomonas aeruginosa.
La endocarditis fúngica tiene un papel sensiblemente mayor que en pacientes no trasplantados, ocupando el segundo lugar en frecuencia de patógenos (23-30%). Aspergillus fumigatus es el hongo identificado hasta en el 84% de los casos, asociándose en muchas ocasiones al antecedente de viremia por citomegalovirus (CMV), lo cual puede indicar que los pacientes con infección por A. fumigatus tenían una inmunosupresión elevada antes de la EI7. En varios casos comunicados, los pacientes tenían enfermedad por A. fumigatus comprobada por biopsia en el pulmón o la piel antes de la evidencia clínica de EI, lo que evidencia que la EI es una manifestación relativamente tardía de la infección por Aspergillus en los receptores de trasplantes de corazón.
Los pacientes trasplantados con EI presentan algunas diferencias respecto a los no trasplantados. De forma llamativa, la EI postrasplante parece presentar mayor mortalidad que la EI en la población en general4,8, quizá por la inmunosupresión crónica y la mayor presencia de comorbilidades en los trasplantados. La EI fúngica es claramente más prevalente entre receptores de trasplante cardíaco (hasta un 25% en la revisión de Jordan et al.4), cuando en los no trasplantados no suele alcanzar el 10%, mientras que Streptococcus viridans y varias floras anaerobias parecen estar subrepresentadas en los receptores de trasplantes en comparación con la población general.
Algunas otras características de la EI postrasplante son similares y coincidentes con la que aparece en la población general, como la mayor frecuencia de la infección causada por S. aureus.
No parece haber correlación entre el patógeno causal identificado y el momento (tiempo desde el trasplante) en el que aparece la endocarditis.
Manifestaciones clínicas. DiagnósticoExtracardíacasEn la mayor serie publicada, más de la mitad de los pacientes mostraron signos de infección sistémica en el momento de la presentación, con síntomas que varían considerablemente entre los pacientes, pero en general la fiebre y el deterioro cognitivo fueron los más comúnmente recogidos5.
El 39,6% de los pacientes experimentó embolias sépticas, siendo la gran mayoría cerebrales (27%). Otras complicaciones observadas incluyeron mediastinitis (14,3%), osteomielitis (6,3%) y meningitis (6,3%)5.
Cuando la infección es fúngica, los eventos embólicos alcanzan el 84% y es muy habitual la endoftalmitis como expresión sistémica aspergilósica; los fenómenos inmunológicos, en cambio, son muy raros en la exhaustiva revisión de endocarditis micóticas en trasplantes de órganos sólidos de Ioannou et al.9.
CardíacasEn la literatura no se encuentra una localización valvular predominante para el desarrollo de EI, y son bastante frecuentes las vegetaciones no adheridas a válvulas y asentadas en ventrículos y aurículas (posiblemente en relación con las suturas de la cirugía de trasplante)6. Además, la EI del lado izquierdo parece ser menos frecuente en comparación con los pacientes sin trasplante previo, mientras que se observa una mayor incidencia en la endocarditis derecha.
La válvula mitral es la más afectada en el lado izquierdo, incluso de forma recurrente10, y la localización aórtica es anecdótica. Los receptores de trasplante cardíaco se someten a biopsias frecuentes del ventrículo derecho, que pueden dañar la válvula tricúspide, lo cual puede explicar, al menos en parte, la mayor afectación derecha en pacientes trasplantados: aquellos con endocarditis de la válvula tricúspide tuvieron una mediana de 23 biopsias endomiocárdicas, mientras que los pacientes con infección de la válvula mitral tuvieron una mediana de 9 en la serie de Sherman-Weber et al.4. Aziz et al. describen una tasa de bacteriemia del 0% justo antes de la biopsia endomiocárdica, pero una tasa del 70% de bacteriemia por S. aureus coagulasa negativo en la sangre de aurícula derecha inmediatamente después de las biopsias11.
DiagnósticoEn todas las series publicadas la endocarditis se define utilizando los criterios de Duke12, alcanzando el diagnóstico de «definitiva» entre el 86 y el 100% de los casos4,5. Para maximizar la especificidad, en alguno de los estudios se requirió además la presencia de vegetación valvular demostrada por ecocardiograma, estudio anatomopatológico de una pieza quirúrgica o documentación en la autopsia4.
En todos los pacientes se realizó estudio ecocardiográfico, mayoritariamente transtorácico, pero complementado con una ecocardiografía transesofágica en el 70% para confirmar hallazgos o precisar detalles más específicos de cara a una eventual cirugía.
El diagnóstico microbiológico con identificación del germen causal se obtuvo en la práctica totalidad de los casos reportados, siendo el cultivo negativo la excepción.
Otros métodos de diagnóstico empleados son el cultivo valvular y la gammagrafía con radionúclidos (trazadores de leucocitos marcados, PET con 18F-fluorodesoxiglucosa, gammagrafía con galio-67 y angiografía con tecnecio-99m).
TratamientoTodos los pacientes con diagnóstico de EI recibieron terapia antimicrobiana guiada por hemocultivo y dirigida al patógeno identificado, y los casos con cultivo negativo se trataron con un ciclo antibiótico empírico. Los casos de endocarditis por A. fumigatus se trataron con mayor frecuencia con anfotericina B y voriconazol, aunque también se emplearon caspofungina, itraconazol e isavuconazol, con una duración total media del tratamiento antimicótico en este grupo de 76 días5.
El tratamiento quirúrgico también se recomienda según las indicaciones de las guías clínicas, pero, de acuerdo con la literatura, está claramente infrautilizado pese a que, si la cirugía está indicada, no operar entraña significativamente más mortalidad que operar al paciente (57,1 vs. 15,8%; p<0,01)5. Así, Sherman-Weber et al.4 no refieren ningún paciente operado en su experiencia y en las otras 2 series tan solo el 16,76 y el 35%5 de los pacientes fueron intervenidos.
Las razones para esta menor tasa de tratamiento quirúrgico en la endocarditis del paciente trasplantado en comparación con la tasa de cirugía de una población no seleccionada pueden ser variadas, pero indudablemente el mayor riesgo quirúrgico en la EI al haber una cirugía previa y la mayor frecuencia de afectación extravalvular en estos pacientes, con la dificultad técnica que puede comportar una solución quirúrgica radical, pueden influir en la decisión de seguir un tratamiento conservador.
Entre los pacientes intervenidos, la cirugía valvular es la intervención quirúrgica predominante, orientada a la válvula mitral en el 50% de los casos. Otros procedimientos realizados fueron reemplazo de injerto de arteria pulmonar, extracción del marcapasos e incluso retrasplante cardíaco (con nuevo retrasplante en uno de los 2 pacientes) en la serie de Jordan et al.5.
MortalidadLa tasa de mortalidad difiere ostensiblemente entre series, aunque hay diferentes razones que podrían explicarlo. Así, en el estudio de los registros de trasplante español y francés que reseña tan solo 18 endocarditis en 8.305 trasplantes entre enero de 2008 y diciembre de 2019, la mortalidad es del 17%, mucho menor que otras descritas anteriormente (683 y 80%4). Esta diferencia puede deberse a que las series citadas incluyen casos de autopsias, además de que reportan casos de los años 80 y 90, y desde entonces ha habido sustanciales avances en el tratamiento tanto de la EI como del trasplante cardíaco. Por último, la mediana de tiempo entre el trasplante y el desarrollo de EI en esta serie es de 43 meses (sustancialmente mayor a la de series previas) y abarca un periodo de seguimiento más largo6.
La serie de Jordan et al. exhibe una mortalidad del 44,6% y la mayoría de las muertes (76%) fueron atribuibles a la EI. La letalidad fue del 75% para la EI fúngica y del 36,1% para la EI bacteriana (p=0,02)5.
Sherman-Weber et al. comunican una mortalidad asociada con EI del 80%, y todos los pacientes con endocarditis por A. fumigatus fallecieron como consecuencia de múltiples émbolos y una infección diseminada por Aspergillus4. Es la serie con una mortalidad más alta y contrasta con la revisión de la literatura de todos los casos aislados publicados previamente, que también hacen los mismos autores, y que refleja una mortalidad global del 22%4. Esta tasa de mortalidad sustancialmente menor puede ser el resultado de un seguimiento incompleto, una mayor proporción de patógenos con una virulencia intrínsecamente menor (Staphylococcus epidermidis, Mycobacterium pneumoniae), una menor edad de los pacientes (mediana de 46 vs. 58 años en la serie de Sherman-Weber) o un sesgo de publicación, que prioriza la comunicación de casos de pacientes con buenos resultados.
El tiempo medio que transcurre entre el diagnóstico de la infección y la muerte oscila entre 3 semanas4 y 2,5 meses5, y la causa de muerte más comúnmente mencionada es el daño neurológico derivado del embolismo séptico, y en estos coinciden casi todas las publicaciones4–6. Otras causas con mucha menor incidencia son parada cardíaca súbita, progresión de la infección hacia insuficiencia cardíaca refractaria o fracaso multiorgánico.
La supervivencia postrasplante de los pacientes con endocarditis es significativamente más corta que la de otros receptores de trasplantes cardíacos:
- •
Supervivencia media después del trasplante de pacientes con endocarditis 1,4 años frente a 9,3 años en otros pacientes con trasplantes cardíacos (p<0,001)4.
- •
Probabilidad de supervivencia posterior al trasplante del 74, el 64 y el 48% a uno, 2 y 3 años, respectivamente, frente a la probabilidad de supervivencia posterior a la EI del 43, el 38 y el 38% a uno, 2 y 3 años, respectivamente5.
Con las debidas cautelas por la poca casuística disponible, generada en distintas épocas y con resultados diversos, podemos señalar algunos aspectos característicos y/o diferenciales de la EI en el corazón trasplantado:
- •
Presenta una incidencia acumulada variable, dependiente del número de casos de cada serie publicada, y que oscila entre el 0,2 y el 1,5%.
- •
La gran mayoría de los casos cumplen criterios de Duke modificados. Es interesante destacar que el trasplante cardíaco no se considera una condición cardíaca predisponente dentro de los criterios clínicos menores de Duke.
- •
Es más frecuente la bacteriana que la fúngica, si bien esta es mucho más letal.
- •
La EI fúngica es claramente más prevalente entre receptores de trasplante cardíaco que entre los no trasplantados y es indicación de cirugía per se.
- •
El patógeno bacteriano más frecuente, al igual que en los no trasplantados, es S. aureus, mientras que S. viridans y algunas floras anaerobias inciden con menor frecuencia en los receptores de trasplantes en comparación con la población general.
- •
Las endocarditis en corazón izquierdo son menos frecuentes que en pacientes sin trasplante previo, mientras que la endocarditis derecha es más frecuente, posiblemente en relación con las biopsias endomiocárdicas y la mayor frecuencia de procedimientos invasivos en los pacientes trasplantados.
- •
No se recomienda tratamiento antibiótico profiláctico en pacientes trasplantados que se someten a procedimientos dentales, excepto en el subgrupo de los que presentan insuficiencias valvulares previas.
- •
La indicación quirúrgica se establece con mucha menor frecuencia que en EI de corazones no trasplantados, a pesar de que los pacientes con endocarditis no operados presentan 4 veces más mortalidad que los operados.
- •
La EI postrasplante parece presentar mayor mortalidad que la EI en la población en general, quizá por la inmunosupresión crónica y la mayor presencia de comorbilidades en los trasplantados.
- •
La supervivencia postrasplante de los pacientes con endocarditis es significativamente más corta que la de otros receptores de trasplantes cardíacos.
La supervivencia del injerto y del paciente trasplantado se basa en un equilibrio entre la prevención del rechazo y el uso de inmunosupresores: la incidencia del rechazo ha disminuido, pero las infecciones oportunistas siguen siendo un riesgo importante debido a la inmunodepresión.
Las infecciones causan aproximadamente el 20% de las muertes durante el primer año después del trasplante y el 50-75% de los pacientes tienen evidencia de infección microbiana en los primeros 3 años, siendo por ello un factor de morbimortalidad con el consiguiente impacto en la supervivencia del injerto y del paciente. Predominan las infecciones bacterianas (43-60%), seguidas de las víricas (40-45%) y, en menor proporción, de las fúngicas y de las causadas por protozoos (8-14%)13.
Los mecanismos de adquisición son, básicamente, la primoinfección, la reactivación de una infección latente en pacientes seropositivos o la sobreinfección del receptor seropositivo de un órgano seropositivo. El estado de inmunosupresión del paciente, tanto por su enfermedad basal y comorbilidades como por el tiempo y tipo de terapia inmunosupresora, y la presencia o ausencia de virus inmunomoduladores influyen de manera decisiva en su desarrollo, dado que uno de los principales efectos adversos de la inmunosupresión es el aumento del riesgo de infecciones y de su gravedad14.
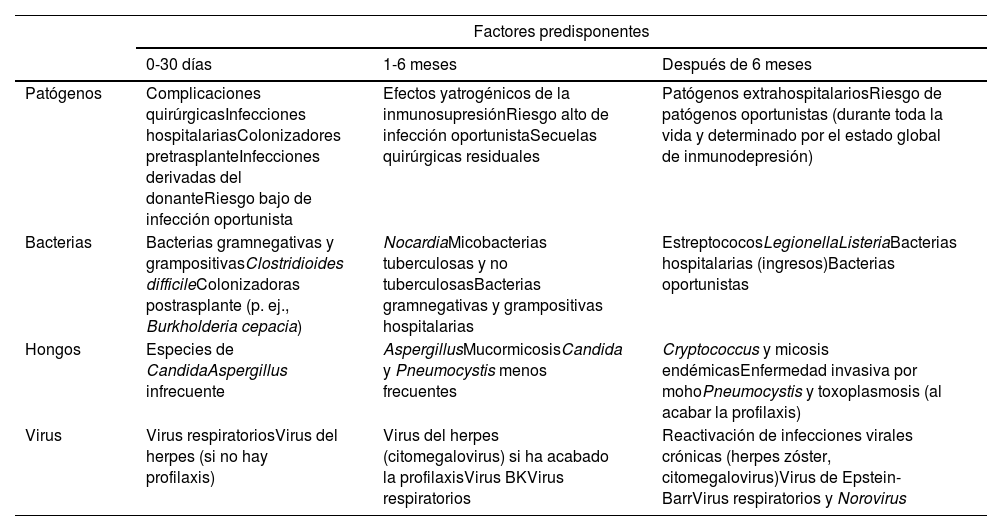
CronologíaLas infecciones tras el trasplante cardíaco son diferentes en frecuencia, tipo y patógenos causales y siguen un patrón de aparición relativamente predecible. Si bien los avances en medidas preventivas y asistenciales han modificado el riesgo y la cronología de algunas infecciones, estas deben evaluarse en el contexto del tiempo transcurrido desde la cirugía y habitualmente se clasifican en 3 periodos de tiempo desde el implante del órgano (tabla 1).
Cronología de la aparición de infecciones postrasplante
| Factores predisponentes | |||
|---|---|---|---|
| 0-30 días | 1-6 meses | Después de 6 meses | |
| Patógenos | Complicaciones quirúrgicasInfecciones hospitalariasColonizadores pretrasplanteInfecciones derivadas del donanteRiesgo bajo de infección oportunista | Efectos yatrogénicos de la inmunosupresiónRiesgo alto de infección oportunistaSecuelas quirúrgicas residuales | Patógenos extrahospitalariosRiesgo de patógenos oportunistas (durante toda la vida y determinado por el estado global de inmunodepresión) |
| Bacterias | Bacterias gramnegativas y grampositivasClostridioides difficileColonizadoras postrasplante (p. ej., Burkholderia cepacia) | NocardiaMicobacterias tuberculosas y no tuberculosasBacterias gramnegativas y grampositivas hospitalarias | EstreptococosLegionellaListeriaBacterias hospitalarias (ingresos)Bacterias oportunistas |
| Hongos | Especies de CandidaAspergillus infrecuente | AspergillusMucormicosisCandida y Pneumocystis menos frecuentes | Cryptococcus y micosis endémicasEnfermedad invasiva por mohoPneumocystis y toxoplasmosis (al acabar la profilaxis) |
| Virus | Virus respiratoriosVirus del herpes (si no hay profilaxis) | Virus del herpes (citomegalovirus) si ha acabado la profilaxisVirus BKVirus respiratorios | Reactivación de infecciones virales crónicas (herpes zóster, citomegalovirus)Virus de Epstein-BarrVirus respiratorios y Norovirus |
Modificada de Singh et al.16.
Las infecciones durante este periodo son fundamentalmente nosocomiales (bacterianas y fúngicas) y se relacionan con el procedimiento quirúrgico, la estancia en unidad de cuidados intensivos y la instrumentalización (uso de catéteres, ventilación mecánica), por lo que deben extremarse las medidas de aislamiento y asepsia. Además, se requiere un seguimiento estrecho y un alto grado de sospecha por la escasez de sintomatología que en ocasiones las acompañan, por lo que se debe prestar atención a la evolución de determinaciones analíticas (leucocitosis, elevación de PCR y procalcitonina) y utilizar técnicas de imagen de alta sensibilidad como la tomografía computarizada para realizar un diagnóstico precoz y específico14,15.
Debe iniciarse el tratamiento empírico de amplio espectro según el estado clínico del paciente, siempre antes de la extracción de cultivos y considerando infecciones oportunistas.
Las infecciones bacterianas, incluidas las debidas a patógenos resistentes a antimicrobianos, son con mucho las más frecuentes, y además de las infecciones asociadas a catéteres vasculares y la neumonía hospitalaria, no son infrecuentes la colitis por Clostridioides difficile y las infecciones de la herida quirúrgica16, y las infecciones asociadas a dispositivos de asistencia circulatoria que pueden utilizarse como puente al trasplante o en situación de disfunción ventricular grave. Es preciso considerar la posibilidad de mediastinitis en todos los enfermos trasplantados cardíacos que presentan bacteriemia de origen poco claro o supuración en la herida quirúrgica en el primer mes postrasplante13.
Las infecciones virales como el virus del herpes simple y el virus del herpes humano 6 pueden aparecer en el periodo inmediatamente posterior al trasplante, por lo que es fundamental la realización de cultivos y la determinación semanal de la carga viral de CMV. Las infecciones fúngicas son infrecuentes excepto la candidiasis invasiva, que por lo general produce candidemia o infecciones del foco quirúrgico y durante este periodo también pueden manifestarse ciertas infecciones transmitidas por el donante16.
De uno a 6 mesesTras el primer mes las tasas de infecciones quirúrgicas disminuyen habitualmente, mientras que aumenta la de las infecciones oportunistas de novo (listeriosis y nocardiosis) o la reactivación de infecciones por virus y micobacterias asociadas a inmunodepresión. Entre ellas están la neumonía por Pneumocystis jirovecii (actualmente menos frecuente por la eficacia de la profilaxis con trimetoprima-sulfametoxazol durante 6-12 meses14) e infecciones fúngicas por Candida o Aspergillus y por bacterias oportunistas (Toxoplasma gondii, Listeria, Nocardia)15,16.
Sin duda la más importante es la infección por CMV. Debido a la profilaxis antiviral sistemática (que normalmente se administra durante los 3-6 meses posteriores al trasplante), la mayoría de los casos aparece más tarde, una vez que se suspende dicho tratamiento. Para el diagnóstico del CMV se utilizan técnicas inmunológicas (reacción en cadena de la polimerasa, antigenemia) y técnicas de cultivo rápido (Shell-vial)14.
En caso de infecciones oportunistas o con riesgo vital, se ha de plantear la reducción transitoria de inmunosupresión hasta la mejoría del cuadro. La mortalidad es mayor en las infecciones fúngicas, seguidas de las infecciones protozoarias, bacterianas y víricas17.
A partir de 6 mesesA partir del sexto mes, y con la reducción de la inmunosupresión, las infecciones oportunistas disminuyen y predominan las infecciones adquiridas en la comunidad, como en la población general: infecciones respiratorias, gastrointestinales y genitourinarias.
Otras manifestaciones tardías pueden corresponder a infecciones virales reactivadas o crónicas. Algunos tumores secundarios a la infección viral pueden producirse también de forma tardía; destacan por su frecuencia las neoplasias malignas cutáneas. Además, algunos linfomas y síndromes linfoproliferativos por virus de Epstein-Barr se producen cuando ha pasado más de un año16.
Las infecciones por micosis, como la criptococosis o la histoplasmosis, se manifiestan a menudo tarde y sin un desencadenante aparente ni un cambio de la inmunodepresión. El riesgo de infecciones oportunistas disminuye, aunque nunca desaparece por completo puesto que el tratamiento del rechazo (especialmente con fármacos que producen depleción de linfocitos T) predispone al paciente a los patógenos oportunistas16.
No existe una evidencia clara en cuanto al uso de profilaxis antibiótica estándar en procedimientos dentales y genitourinarios.
Condiciones específicasDiálisisLos receptores de trasplante cardíaco que precisan diálisis y reoperación torácica tienen más riesgo de aspergilosis pulmonar invasiva y deben recibir profilaxis con voriconazol18.
Infección de herida quirúrgicaLa mediastinitis y las infecciones de la incisión esternal son complicaciones postoperatorias propias de los receptores de trasplante cardíaco con una incidencia de alrededor del 2,5%. Las mediastinitis suelen estar causadas por S. aureus o por S. epidermidis, aunque no hay que excluir del tratamiento empírico los bacilos gramnegativos14 y se debe estar atento a la posible presencia de patógenos infrecuentes: se han descrito casos de mediastinitis e infección de herida esternal por Mycoplasma hominis, Legionella, Aspergillus, mucormicetos y Nocardia16. Entre los factores que predisponen a la mediastinitis en esta población se encuentran las reintervenciones por hemorragia, el uso de tratamiento inmunosupresor y la diabetes mellitus. Se debe proceder siempre al tratamiento quirúrgico con limpieza exhaustiva del mediastino y control de la infección en el momento del trasplante, y antibióticos postoperatorios prolongados.
Dispositivos de asistencia ventricularLas infecciones de estos dispositivos son frecuentes y su tratamiento plantea muchas dificultades; en muchos casos se puede controlar la infección lo bastante bien como para posibilitar el trasplante. La infección del dispositivo pretrasplante se asocia a una tasa mayor de complicaciones peritrasplante cardíaco. La experiencia disponible muestra que el uso de terapia antimicrobiana antes, durante y después del trasplante se asocia a menos recaídas que en el caso de ciclos antibióticos breves.
Enfermedad de ChagasUn 25% de los pacientes sometidos a un trasplante cardíaco por una miocardiopatía secundaria a una infección crónica por Trypanosoma cruzi presenta recidivas de la enfermedad de Chagas aguda, con clínica de fiebre, miocarditis y lesiones cutáneas. En general, la enfermedad se controla con quimioterapia. La detección de la parasitemia mediante microscopio o análisis de reacción en cadena de la polimerasa en muestras de sangre parece una forma útil de monitorizar la reactivación y como guía de la quimioterapia tras el trasplante16.
Donante positivo para VHCCon la disponibilidad actual de una terapia antiviral de acción directa altamente efectiva contra el virus de la hepatitis C (VHC), cada vez se utilizan más los órganos positivos para VHC. En general no se observan diferencias a corto plazo19 en las tasas de rechazo, hospitalizaciones o muerte entre los pacientes con donante sin VHC y con VHC, si bien los efectos de la seroconversión y los resultados a largo plazo siguen sin estar claros.
ProfilaxisPara minimizar las complicaciones infecciosas en el paciente trasplantado se aplican diversas medidas orientadas de forma específica a cada uno de los periodos de aparición de las diferentes infecciones:
PretrasplanteA todos los candidatos a trasplante se les administran todas las vacunas apropiadas para su edad. Esto incluye las vacunas contra el neumococo, el tétanos, la hepatitis B, la influenza, el SARS-CoV-2 y la varicela/herpes zóster15. De esta forma aseguramos una adecuada respuesta inmune, ya que tras el inicio de la inmunosupresión las vacunas son menos efectivas. Las vacunas con virus vivos atenuados están totalmente contraindicadas en el paciente trasplantado por el alto riesgo de enfermedad.
Deben detectarse y tratarse la sífilis y la tuberculosis latente.
Primer mesEs básico extremar las medidas de aislamiento y asepsia porque, como se ha señalado previamente, las infecciones durante este periodo son nosocomiales y se relacionan con el procedimiento quirúrgico y la estancia en unidad de cuidados intensivos.
Además, debe prestarse atención a la evolución de determinaciones analíticas (leucocitosis, elevación de PCR y procalcitonina) y utilizar técnicas de imagen de alta sensibilidad para poder hacer un diagnóstico precoz de cualquier episodio infeccioso y poder instaurar un tratamiento empírico hasta la confirmación o no de la infección y del germen.
Entre 1 y 6 mesesAunque existen unas pautas comunes generalmente aceptadas, cada centro puede establecer sus propios protocolos de profilaxis antibiótica en función de la epidemiología.
Los hongos filamentosos en los enfermos de riesgo se previenen con algún azol, una equinocandina o anfotericina B por vía intravenosa o nebulizada.
La profilaxis primaria frente a P. jirovecii con trimetoprima-sulfametoxazol en dosis bajas durante los primeros 6-12 meses postrasplante, y cuando la inmunosupresión es más elevada, consigue que la incidencia de esta infección sea prácticamente nula. Además, parece conferir protección adicional frente a T. gondii.
El máximo riesgo de toxoplasmosis se observa en el receptor seronegativo de trasplante cardíaco de un donante seropositivo y en esta situación se recomienda la profilaxis con pirimetamina (25mg/24h) y ácido folínico (15mg/24h) durante las primeras 6 semanas13.
En general, los enfermos seronegativos a algún patógeno se consideran en riesgo de adquirir la infección si el donante es positivo. De esta forma, las pruebas serológicas negativas previas pueden identificar enfermos que podrían beneficiarse con profilaxis posterior al trasplante, y en este sentido son útiles para:
- •
Instaurar profilaxis postoperatoria para CMV y el virus del herpes simple.
- •
Evaluar vacunaciones y profilaxis postexposición para varicela/herpes zóster.
- •
Mantener un seguimiento estrecho en el receptor negativo para Epstein-Barr, ya que no tiene una profilaxis específica pero las complicaciones linfoproliferativas postrasplante son más frecuentes en los enfermos que presentan la infección primaria mientras están inmunodeprimidos13.
La profilaxis frente a CMV es especialmente beneficiosa en pacientes con riesgo aumentado de infección (rechazo agudo, uso de anticuerpos monoclonales antilinfocitarios, combinación de receptor negativo y donante positivo), y el tratamiento más utilizado como profilaxis durante los primeros 3-6 meses postrasplante es el valganciclovir oral, que consigue reducir la carga viral. El espectro de la enfermedad por CMV puede variar desde una viremia asintomática hasta una infección grave e invasiva de los tejidos, como una neumonitis por el CMV. Puede considerarse el uso de un inhibidor del mTOR (everolimus) en pacientes de alto riesgo con una infección recurrente por el CMV al mismo tiempo que se suprime el micofenolato para mitigar el riesgo de una futura infección activa por el CMV17.
El aciclovir oral es efectivo para pacientes con reactivaciones frecuentes del virus del herpes simple, habitualmente en forma de herpes oral o genital.
En el caso del virus varicela-zóster, aparte de la vacunación pretrasplante que hemos señalado previamente para receptores seronegativos, se debe considerar la administración de inmunoglobulina específica antivaricela-zóster siempre que se produzca un contacto con el virus y si no está demostrada una adecuada respuesta serológica a la vacunación previa.
Conclusiones- •
Los enfermos trasplantados cardíacos tienen una incidencia global de infección que oscila entre el 30 y el 60%, con una mortalidad relacionada del 4 al 15%. Predominan las infecciones bacterianas (43-60%), seguidas de las víricas (40-45%) y, en menor proporción, las fúngicas y las causadas por protozoos (8-14%).
- •
En series y cohortes más modernas de pacientes trasplantados se detecta una mayor frecuencia de Enterobacteriaceae, Pseudomonas y Enterococcus con resistencias crecientes a los antimicrobianos20.
- •
La infección por germen no-CMV es la principal causa de muerte entre los 31 días y el primer año después del trasplante de corazón y es responsable del 30% de la mortalidad global21.
- •
La mortalidad es mayor en las infecciones fúngicas, seguidas de las infecciones protozoarias, bacterianas y víricas. La aspergilosis y la candidiasis son las infecciones fúngicas más frecuentes después del trasplante cardíaco.
- •
Durante el curso postrasplante es posible identificar un patrón de probabilidad de patógenos causantes de infección que es diferente según el tiempo trascurrido desde el implante del órgano.
- •
En la fase inicial (primer mes), las infecciones de herida y fúngicas son las complicaciones más frecuentes: en particular, la aspergilosis y las bacterias resistentes a múltiples fármacos durante la estancia en la unidad de cuidados intensivos.
- •
A medio plazo (hasta el sexto mes) pueden aparecer con mayor frecuencia neumonía (bacteriana, P. jirovecii), infecciones del tracto urinario (a menudo bacterianas), infecciones por CMV, virus del herpes o infecciones por varicela-zóster y micosis.
- •
Después del primer año postrasplante las infecciones oportunistas son menos comunes, mientras que los patógenos de la comunidad se convierten en la etiología infecciosa más frecuente en estos pacientes.
- •
Cuando ha pasado el postoperatorio inmediato, además de las conductas higiénicas, se inicia profilaxis con medicamentos antimicrobianos, como trimetoprima-sulfametoxazol para P. jirovecii y toxoplasmosis, enjuagues antimicóticos para candidiasis oral y valganciclovir oral para CMV, que se mantienen entre 3 y 6 meses.
En la elaboración del artículo se han tenido en cuenta las guías SAGER con respecto a los posibles sesgos de sexo y género.
FinanciaciónNinguna.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.