El uso de dispositivos de soporte mecánico circulatorio de corta duración está asociado con riesgos y complicaciones específicas, y las infecciones nosocomiales son una de ellas. Se relacionan con factores predisponentes como la comorbilidad previa del paciente o la gravedad de la enfermedad actual, además de factores relacionados con la inmovilidad, el encamamiento prolongado y la estancia en unidades de cuidados intensivos. Las principales fuentes de infección son el torrente circulatorio, el tracto urinario, la infección del sitio quirúrgico y la neumonía asociada a la ventilación mecánica, pero también hay infecciones específicas relacionadas con el dispositivo, como las infecciones en los puntos de inserción de las cánulas o la mediastinitis.
Los pacientes infectados se mantienen más tiempo en ventilación mecánica y en ECMO, tienen estancias hospitalarias más prolongadas y la presencia de sepsis o shock séptico se asocia de forma independiente a una mayor mortalidad.
En los dispositivos de larga duración las infecciones pueden derivar en una disminución significativa de la calidad de vida y en un aumento de la morbilidad y la mortalidad. El riesgo de infecciones presenta una disminución inicial en los primeros seis meses posimplante, pero muestra un incremento progresivo durante el soporte a largo plazo, aumentando en función del tiempo. Uno de cada 6 pacientes desarrollará una infección relacionada con el dispositivo en el primer año tras el implante y la infección es responsable del 7% de todas las muertes relacionadas con el dispositivo durante el primer año y del 15% de las muertes posteriores.
The use of short-term mechanical circulatory support devices is associated with specific risks and complications, and nosocomial infections are one of them. They are related to predisposing factors such as the patient's previous comorbidity or the severity of the current disease, as well as factors related to immobility, prolonged bedridden and stay in intensive care units. The main sources of infection are the bloodstream, urinary tract, surgical site infection, and ventilator-associated pneumonia. There are also specific device-related infections, such as infections at insertion sites or mediastinitis.
Infected patients remain on mechanical ventilation and ECMO for longer periods of time, have longer hospital stays, and the presence of sepsis or septic shock is independently associated with higher mortality.
In long-term devices, infections can lead to a decrease in quality of life and an increase in morbidity and mortality. The risk of infections initially decreases in the first six months post-implantation, but progressively increases during long-term support, increasing over time. One in six patients will develop a device-related infection in the first year after implantation, and the infection is responsible for 7% of all device-related deaths during the first year and 15% of subsequent deaths.
ENDOCARDITIS E INFECCIONES EN PACIENTES CON SISTEMAS DE ASISTENCIA MECÁNICA CIRCULATORIA DE CORTA DURACIÓN
IntroducciónA pesar de las mejoras tanto en la tecnología como en el manejo de los dispositivos de soporte mecánico circulatorio de corta duración, su uso está asociado con riesgos y complicaciones específicos, por lo que en muchos pacientes tratados con ellos aparecen complicaciones graves como trombosis, accidentes cerebrovasculares, coagulopatía y sangrado o infección1.
Las infecciones nosocomiales son una complicación común en los pacientes bajo soporte mecánico independientemente del tipo de dispositivo y, en general, se relacionan con algunos factores predisponentes como la comorbilidad previa del paciente, la gravedad de la enfermedad actual o la inmunodepresión, además de los factores relacionados con la inmovilidad, el encamamiento prolongado y la estancia en unidades de cuidados intensivos (UCI). Las principales fuentes de infección en estos pacientes son infecciones del torrente circulatorio, infecciones del tracto urinario (ITU), infecciones del sitio quirúrgico y la neumonía asociada a la ventilación mecánica (NAVM)2, pero también hay infecciones específicas relacionadas con el dispositivo, como las infecciones en los puntos de inserción de las cánulas (en el caso de canulación periférica) o mediastinitis en el contexto de una canulación central.
Los pacientes infectados se mantienen más tiempo en ventilación mecánica y en ECMO, tienen estancias hospitalarias más prolongadas y la presencia de sepsis o shock séptico se asocia de forma independiente a una mayor mortalidad3.
La mayor parte de la experiencia publicada se refiere a la terapia con ECMO, dado el generalizado uso que se ha hecho en las últimas 2 décadas tanto como soporte respiratorio (pandemias de gripe aviar o COVID-19) como soporte cardiorrespiratorio en diversos contextos (parada extrahospitalaria, shock postinfarto, insuficiencia cardiaca avanzada, etc.). Mucho menor es la literatura centrada en dispositivos implantables, como bombas centrífugas paracorpóreas tipo CentriMag® (Abbott Medical, Zaventem, Bélgica), y resultan casi anecdóticos los artículos sobre otros dispositivos de soporte parcial o implante menos agresivo como Impella® (Abiomed Europe GmbH, Aachen, Alemania) o TandemHeart (LivaNova, Pittsburgh, PA, EE. UU.). Por ello nos centraremos fundamentalmente en las infecciones relacionadas con la ECMO como paradigma de las infecciones en soporte de corta duración y señalaremos las diferencias o particularidades en aspectos concretos que tienen los otros tipos de dispositivos.
En todos los estudios existentes concurre una significativa heterogeneidad en los datos debida a su naturaleza retrospectiva con definiciones no comparables, el diseño monocéntrico de muchos de los estudios realizados y la inclusión de poblaciones heterogéneas y/o varias modalidades de ECMO. Diversas revisiones sistemáticas y metaanálisis han tratado de arrojar luz sobre la incidencia de las infecciones y los factores de riesgo relacionadas con la ECMO, la supervivencia en ECMO y la supervivencia general1,4,5.
DefiniciónAdemás de las infecciones nosocomiales clásicas, los pacientes en ECMO también pueden presentar infecciones específicas relacionadas con la ECMO, que deben ser consideradas por separado, aunque su definición es variable entre unos estudios y otros. Algunos autores se refieren a las infecciones asociadas a la ECMO como «cualquier infección que se produzca durante el período de la ECMO»6, aunque las infecciones que mencionan son las típicas del entorno de la UCI.
Además, la ventana de definición de infección es muy variable para cada estudio, y va desde las 12, 24 o las 48h después de la canulación hasta las 24, 48, 72h e incluso 5, 7 o 30 días después de la retirada de la ECMO5. Otros autores contabilizan justo desde el inicio de la ECMO hasta su retirada.
En el anexo 1 del material suplementario se presenta una sistematización de las definiciones y criterios de infección en los pacientes con dispositivo de soporte mecánico circulatorio tanto de corta como de larga duración, propuesto por la ISHLT en un reciente consenso7.
Infección del torrente circulatorioLa mayoría de los estudios aplican los criterios de los Centros para el Control de Enfermedades (CDC, por sus siglas en inglés) para el diagnóstico de la infección del torrente sanguíneo basándose en los resultados del cultivo. Cuando la muestra se extrae de arteria y vena centrales es posible clasificar erróneamente como «infecciones del torrente sanguíneo asociadas a la vía central» lo que son infecciones relacionadas/originadas en el dispositivo de ECMO, por lo que el ECDC recomienda la toma de muestras de una vena periférica.
En todo caso, la identificación de una infección del torrente circulatorio (ITC) en los pacientes con ECMO es inconsistente en los estudios. En algunos solo se presenta el primer evento de cada paciente, otros autores hablan de ITC sin más información adicional. La fuente más frecuentemente citada en la literatura para la ITC secundaria es la NAVM, mientras que menos de la mitad de ITC primarias se asocian con infección del catéter venoso central, por lo que algunos sugieren que la infección primaria del torrente circulatorio sin un origen conocido o identificable podría ser atribuible a la cánula de ECMO, especialmente en soportes prolongados en el tiempo5.
Infección de la cánula/infección del punto de canulaciónSu definición o caracterización también es muy variable entre estudios, y en la literatura podemos encontrarlas descritas como «infección relacionada con la cánula de ECMO» o como «mediastinitis después de ECMO VA central» e «infecciones del punto de canulación de ECMO», en casos de canulación central y periférica quirúrgica, respectivamente5.
La colonización de las cánulas de ECMO debe considerarse en los pacientes en ECMO con ITC persistente de origen desconocido que no mejora con la extracción de catéteres y vías intravasculares y el cambio del circuito. Como el cambio de la propia cánula de ECMO entraña un alto riesgo y no suele ser factible por las condiciones del paciente, se recomienda tratamiento antibiótico o antifúngico prolongado hasta poder decanular al paciente.
En casos de infección demostrada del sitio quirúrgico o punto de canulación es muy frecuente el tratamiento quirúrgico, llegando al 41% en alguna serie; aunque la infección no siempre se asocia con mayor mortalidad hospitalaria, sí lo hace de forma significativa con una estancia más prolongada tanto en la UCI como en el hospital6.
Colonización del dispositivo (cánula-circuito-oxigenador-bomba)La sepsis es un factor de riesgo para la colonización secundaria de la cánula de ECMO y del circuito de ECMO (tubos-oxigenador), haciendo que el propio dispositivo de soporte circulatorio actúe como fuente y reservorio de infecciones nosocomiales.
La retirada rápida de vías arteriales y centrales ante la sospecha de una ITC asociada al catéter puede evitar la colonización secundaria del dispositivo de ECMO como demuestran Kuehn et al. en un trabajo en el que realizaron PCR de 20 membranas de oxigenador con una positividad general del 45%. En 4 casos PCR-positivos, los patógenos detectados en las superficies del oxigenador también se encontraron en el cultivo de sangre o el cultivo de muestras obtenidas del foco de infección8.
En 222 oxigenadores cultivados prospectivamente, Kim et al. encontraron que la colonización del oxigenador (11,6%) se correlacionaba con la colonización de vías centrales y también tendía estar asociada con ITC por el mismo microorganismo. Además, la colonización del oxigenador se asoció de forma independiente con la mortalidad (OR: 15,49)9.
IncidenciaEn un completo análisis de 30 estudios que incluían a 4.733 pacientes adultos en ECMO, Ait Hssain et al. reportan 1.249 infecciones nosocomiales relacionadas con ECMO por cada 1.000 días de ECMO. El rango de incidencia total de infección fue del 4,1 al 85,4%, con 2.059 patógenos identificados a partir de 1.498 episodios de infección en los 1.249 pacientes infectados. Las incidencias de infección relacionada con ECMO fue muy variable entre estudios para cada tipo de infección (del 1,99 al 31% para ITU o del 23,9 al 55,4% para NAVM, por ejemplo)1.
En el metaanálisis de Li et al.4, la prevalencia de infección nosocomial varió entre el 8,8 y el 64% y la incidencia general oscilaba entre 1,7 y 85,4 por 1.000 días de ECMO. Al igual que en otros pacientes gravemente enfermos, la NAVM y las infecciones del torrente circulatorio son también las infecciones notificadas por estos autores, con una prevalencia de 12,7-59% (NAVM) y 5,7-35% (ITC), y unas incidencias también muy variables. Es de destacar que el desarrollo de infección aumentó el riesgo relativo de muerte en un 32%4.
MicrobiologíaLa mayoría de los trabajos coinciden en señalar los gramnegativos como el grupo de patógenos más prevalente, seguidos de bacterias grampositivas y hongos. Ait Hssain et al. identifican hasta el 48,6% de bacterias gramnegativas, siendo Acinetobacter baumannii, Pseudomonas aeruginosa y Klebsiella pneumoniae las más comunes, mientras que Enterococcus spp., Staphylococcus coagulasa-negativo y Staphylococcus aureus fueron las bacterias grampositivas predominantes1.
Similares resultados se observan en la revisión de Peña-López et al.5 especialmente en los casos de ITC secundaria (debida principalmente a NAVM) pues, para las ITC primarias por infección de catéter o dispositivo ECMO, los causantes son predominantemente especies de grampositivos y Candida.
De los 25 estudios revisados por Li et al.4, un total de 19 informaron resultados microbiológicos del agente causal y 15 de ellos (79%) señalaban bacterias gramnegativas (las mismas que en las revisiones precedentes) como los principales patógenos aislados. Tan solo 2 estudios comunicaron etiología por grampositivos y los otros 2 una infección fúngica.
En los últimos años se observa una incidencia aumentada de ITC por gramnegativos y una mayor presencia de bacterias multirresistentes y hongos (principalmente Candida spp.) sobre todo en soporte ECMO VV para neumonías virales5.
Factores de riesgoSe han identificado múltiples factores de riesgo asociados al desarrollo de infecciones en los pacientes asistidos con ECMO, y algunos estudios se han centrado en el modo de soporte (VA, VV)2 o en alguna indicación concreta, como la ECMO poscardiotomía10,11 que presenta alguna característica específica como el índice de masa corporal como predictor de infección; el tiempo quirúrgico prolongado y la circulación extracorpórea aumentan el riesgo de IN relacionada con ECMO (tórax abierto más tiempo, daño pulmonar y respuesta inflamatoria sistémica), pero en el análisis de regresión multivariable no fueron factores de riesgo independientes para la infección11.
La duración del soporte es, sin duda, el factor más señalado en todos los estudios individuales y en los metaanálisis. La razón de probabilidades acumulada de la duración de la ECMO para predecir la infección nosocomial fue de 1,05 (IC del 95%: 1,02-1,08; p<0,001) en la revisión de Ait Hssain et al.1, aunque con una heterogeneidad significativa entre los estudios.
Otros factores que aumentan significativamente el riesgo de infección y que se repiten en los metaanálisis1,4,5 son la duración de la ventilación mecánica, la estancia hospitalaria, el modo ECMO (VV frente a VA), enfermedades subyacentes, la puntuación SOFA, la puntuación SAPS, la edad, la duración de la vía arterial, la insuficiencia renal aguda, la insuficiencia hepática aguda, el índice de masa corporal, la reanimación cardiopulmonar <5min, la hemodiálisis y un diagnóstico de enfermedad autoinmune.
DiagnósticoRepresenta un desafío dado que el propio dispositivo promueve cambios inflamatorios y los parámetros habituales, como los signos clínicos o los marcadores de infección, pueden ser difíciles de interpretar.
- •
Un cambio en la temperatura por sí solo no debe considerarse un signo de infección ya que la temperatura del paciente depende de la pérdida de calor del circuito y de los ajustes del intercambiador de calor; ante una alta sospecha de infección deben vigilarse las tendencias con respecto a los ajustes del intercambiador.
- •
Los valores de punto de corte habituales para biomarcadores como la proteína C reactiva (PCR), la procalcitonina o el recuento de leucocitos son inespecíficos y tienen una baja precisión diagnóstica para detectar infección en los pacientes adultos con ECMO. De nuevo, el seguimiento y análisis de tendencias a lo largo del tiempo de las variaciones (diarias) de la procalcitonina u otros biomarcadores inflamatorios (PCR, IL-6, IL-10) pueden ayudar en el manejo de los pacientes con ECMO en quienes se sospecha una infección5.
- •
El diagnóstico de NAVM en pacientes con distrés respiratorio es igualmente complicado:
- ∘
La radiografía de tórax tiene los beneficios de una baja exposición a la radiación, una invasividad mínima y una disponibilidad inmediata, pero su especificidad es inferior al 20%. Además, las estrategias ventilatorias ultraprotectoras pueden opacar el espacio aéreo, aunque no haya una nueva infección, lo que también es probable en casos de edema pulmonar cardiogénico grave.
- ∘
Las secreciones hemorrágicas pueden interferir con la interpretación precisa de los cultivos del lavado broncoalveolar y pueden retrasar la sospecha clínica de una aspergilosis pulmonar invasiva5.
- ∘
- •
Las escalas tradicionales para evaluación de sepsis (SOFA, SIRS, LODS) no pueden predecir la ITC en los pacientes con ECMO, así que habrá que guiarse por nuevas inestabilidades hemodinámicas, cambios inexplicables en los perfiles de coagulación o altas puntuaciones de coagulación intravascular diseminada, por ejemplo, para sospechar de forma fundada una infección.
La ITC durante el soporte con ECMO es un determinante importante de mortalidad, con un riesgo relativo de mortalidad general de hasta 3,210, y eso es más significativo en la población de pacientes infantiles.
El impacto de las infecciones nosocomiales en la supervivencia de la ECMO se evaluó sobre 1.613 pacientes por Ait Hssain et al., encontrando tasas de supervivencia más bajas en los pacientes con infección en ECMO, con un riesgo relativo agrupado del 84%.
En cuanto a la mortalidad intrahospitalaria, su riesgo aumenta hasta en un 32% en el metaanálisis de Li et al.4 y otros estudios confirman la infección relacionada con ECMO y las infecciones del torrente circulatorio como factores de riesgo significativos para muerte intrahospitalaria11.
Dispositivo de asistencia ventricular CentriMag®De manera similar a como ocurre con la ECMO, la utilización de dispositivos implantables de corta duración se asocia con mayor riesgo de complicaciones infecciosas. Estas, además, presentan características comunes con la ECMO en cuanto a definición, localización y origen de la infección, por lo que todo lo anteriormente expuesto es, en líneas generales, trasladable a la CentriMag®.
La versatilidad de uso de esta bomba centrífuga (soporte uni-o biventricular, implante central o periférico, asistencia derecha temporal con un dispositivo de larga duración izquierdo, etc.) hace que la literatura reporte series cortas en indicaciones diversas en las que solo se comunica la incidencia y/o prevalencia de infección, pero hay muy pocos estudios específicos de complicaciones de CentriMag®12.
John et al.13 comunican un 5% de infecciones en una serie de 37 pacientes de 7 centros utilizando la bomba en shock cardiogénico poscardiotomía, posinfarto y como soporte derecho tras implante de un dispositivo izquierdo de larga duración. Como soporte exclusivamente derecho en diversas indicaciones, el grupo de Pittsburgh publica una serie de 29 pacientes, de los que 13 (45%) presentaron algún evento infeccioso, definido este como neumonía, sepsis o infección del bolsillo del dispositivo izquierdo de larga duración14. Chen et al.15 informan de sus resultados en ECMO de rescate en 59 pacientes con shock cardiogénico y reanimación cardiopulmonar de más de una hora, a los que tras 24h se les implantaba un soporte biventricular con CentriMag®; tan solo 4 pacientes presentaron infección (2 sepsis, una mediastinitis y una infección esternal), pero el shock séptico resultó ser factor predictor de mortalidad.
En un análisis retrospectivo de 161 pacientes de la Universidad de Columbia a los que se implantó una asistencia CentriMag® (89% biventricular), Cevasco et al. analizan los eventos adversos relacionados con el dispositivo: el más común fue el sangrado mayor (75,1%) y 95 pacientes (59%) desarrollaron alguna infección importante, como NAVM e ITU. El análisis acumulativo de datos mostró que la infección se relacionaba directamente con el tiempo de soporte12.
Medidas preventivasLas prácticas higiénicas y los distintos grupos de medidas para infecciones nosocomiales en las UCI son diferentes para cada centro y no suelen verse reflejadas en la literatura disponible. En los pacientes bajo terapia ECMO debemos considerar medidas profilácticas o de vigilancia en diferentes niveles de actuación5:
Ventilación y manejo de la vía aéreaECMO VALa extubación precoz se ha asociado con una caída en la tasa de NAVM de casi el 50%. También pueden contribuir la retirada de vías y accesos invasivos y acortar el tiempo de decisión de implantar de un dispositivo más duradero en el caso de que la ECMO sea un puente a otra asistencia.
ECMO VVNuestro grupo utiliza de forma sistemática la «ECMO despierto» en los pacientes que esperan un trasplante de pulmón. La traqueotomía percutánea precoz (<7 días) es segura en los pacientes con ECMO, y combinada con cambio postural a decúbito prono y broncoscopias frecuentes durante el soporte de ECMO pueden facilitar la recuperación pulmonar5.
CánulasLa canulación percutánea y periférica se han asociado con tasas más bajas de sangrado y riesgo de infección. La fijación de las cánulas para evitar micromovimientos puede reducir el riesgo de colonización exógena, y algunos autores propugnan el uso de adhesivos tisulares de cianoacrilato junto con apósitos transparentes, ya que también ofrecen algunas propiedades antibacterianas contra Staphylococcus epidermidis16. La desinfección diaria de los circuitos, las conexiones y el dispositivo con gluconato de clorhexidina al 2% ha demostrado una reducción significativa de infecciones del torrente sanguíneo relacionadas con ECMO y de muerte relacionada con sepsis17.
CircuitoEl uso de circuitos más cortos con menos llaves y puntos de acceso puede minimizar los riesgos de contaminación. De hecho, la Extracorporeal Life Support Organization (ELSO) recomienda evitar el acceso innecesario al circuito y la administración de bolos intermitentes de medicamentos o electrolitos a través del circuito, para no romper la esterilidad5.
Manejo del pacienteMantener una vía central durante más de 8 días se asocia con tasas más altas de ITC y de colonización secundaria del oxigenador18; si bien la evidencia no respalda políticas de reemplazo programado de catéteres, es necesario implementar prácticas estrictas de control de infecciones.
La ELSO tampoco recomienda el uso rutinario de cultivos de vigilancia, aunque en algunas encuestas realizadas entre sus miembros la mitad de los encuestados informaron que realizaban cultivos de vigilancia de manera rutinaria (a diario la mayoría) durante el funcionamiento de la ECMO. Los cultivos de vigilancia no distinguen colonización de infección, incluso en presencia de altas cargas bacterianas, lo que puede conducir a un uso inadecuado de antibióticos y a un aumento de los costes5.
El tratamiento antibiótico profiláctico se ha estudiado en algún metaanálisis19. De 11 estudios incluidos, solo 2 compararon directamente los resultados de los enfermos con y sin profilaxis antibiótica, sin que se pudieran demostrar beneficios asociados a la profilaxis. Los datos aportados por los restantes estudios solo permitían mostrar que quizás pudieran ser eficaces en ciertas subpoblaciones de pacientes, como los casos con apertura de la cavidad torácica3.
Conclusiones- •
Las infecciones nosocomiales en los pacientes bajo soporte mecánico circulatorio de corta duración se relacionan con factores predisponentes como la comorbilidad previa del paciente, la gravedad de la enfermedad actual o la inmunodepresión, además de los factores relacionados con la inmovilidad, el encamamiento prolongado y la estancia en las UCI.
- •
Las principales fuentes de infección en estos pacientes son infecciones del torrente circulatorio, ITU, infecciones del sitio quirúrgico y la NAVM.
- •
Otras infecciones específicas se relacionan el dispositivo: infecciones en los puntos de inserción de las cánulas o mediastinitis.
- •
El diagnóstico de infección en estos pacientes es complejo: la temperatura corporal se encuentra controlada artificialmente, la ECMO produce una situación de respuesta inflamatoria mantenida y los enfermos críticos pueden estar multicolonizados sin presentar necesariamente una infección activa.
- •
Los pacientes infectados se mantienen más tiempo en ventilación mecánica y en ECMO, tienen estancias hospitalarias más prolongadas y la presencia de sepsis o shock séptico se asocia de forma independiente a una mayor mortalidad.
- •
Es fundamental seguir las prácticas de control de infecciones como la higiene de manos, acortar el tiempo de permanencia de vías centrales, reducir la exposición a antibióticos o evitar romper la esterilidad del circuito de oxigenación en la ECMO.
ENDOCARDITIS E INFECCIONES EN LOS PACIENTES CON SISTEMAS DE ASISTENCIA MECÁNICA CIRCULATORIA DE LARGA DURACIÓN
IntroducciónEn las últimas 2 décadas, los dispositivos de asistencia ventricular izquierda (DAVI) de larga duración se han establecido como una opción terapéutica eficaz para aumentar la supervivencia y mejorar la calidad de vida en los pacientes con insuficiencia cardíaca sistólica avanzada. Los avances de la tecnología de soporte circulatorio mecánico (SCM) en la última década han contribuido a la mejora constante en la supervivencia tras un DAVI de flujo continuo, situándose actualmente en el 81% al año20. Sin embargo, las infecciones siguen siendo el talón de Aquiles de estos dispositivos, lo que puede derivar en una disminución significativa de la calidad de vida, así como en un aumento de la morbilidad y la mortalidad.
Mientras que el riesgo inmediato de otras complicaciones asociadas al DAVI tiende a disminuir de forma mantenida tras el periodo postoperatorio, el riesgo de infecciones presenta una disminución inicial en los primeros 6 meses, pero muestra un incremento progresivo durante el soporte a largo plazo, aumentando en función del tiempo. Aunque en las publicaciones más recientes20, la infección no específica del DAVI sigue siendo el evento adverso más común (libertad de infección mayor del 47,8% a un año y del 36,3% a 2 años), uno de cada 6 pacientes desarrollará una infección relacionada con el DAVI en el primer año tras el implante, una tasa que aumenta con la duración del soporte. Actualmente, la infección es responsable del 7% de todas las muertes relacionadas con el DAVI durante el primer año y del 15% de las muertes posteriores.
Definición y clasificaciónEl primer consenso sobre la definición de las infecciones relacionadas con dispositivos de asistencia ventricular se publicó en 2011 por la ISHLT21. El documento clasificó las infecciones en 3 categorías: infecciones específicas de DAVI, infecciones relacionadas con DAVI e infecciones no relacionadas con DAVI. Las infecciones específicas del DAVI pueden afectar a cualquier componente del dispositivo, incluyendo la bomba, la cánula, el bolsillo (pocket) o el cable de impulsión (driveline), y potencialmente desencadenar sepsis. Por otro lado, las infecciones relacionadas con el DAVI son aquellas que pueden presentarse en los pacientes sin dispositivos, pero cuya incidencia es mayor en presencia del DAVI, como la endocarditis infecciosa y la mediastinitis, que pueden causar una elevada morbimortalidad22. Finalmente, las infecciones no relacionadas con el DAVI son independientes del dispositivo, como ITU, neumonías o bacteriemias.
Estas definiciones se basaron en criterios que abarcaban datos clínicos, microbiológicos, quirúrgicos e histopatológicos, y se clasificaron además como probadas, probables y posibles. El diagnóstico probado requiere muestras microbiológicas, mientras que los diagnósticos probables o posibles se establecen mediante evaluación clínica adecuada.
Aunque en la última década, varias sociedades científicas como la SCM Academic Research Consortium o la Extracorporeal Life Support Organization, han intentado definir y clasificar estas infecciones en los pacientes con SCM, recientemente la ISHLT ha publicado un consenso que abarca tanto el soporte circulatorio de corta duración como el de larga duración, cuyas definiciones aparecen en el anexo 1 del material suplementario7.
En estas nuevas definiciones, las infecciones específicas del SCM representan infecciones que son propias del hardware y no ocurren en los pacientes no soportados por SCM, y van desde infecciones cutáneas, superficies de contacto sanguíneo con el dispositivo, la superficie externa de los dispositivos implantables, así como la interfaz entre el dispositivo y el tejido vascular. A diferencia de los documentos previos, se ha dividido las infecciones cutáneas (tanto del driveline como de las cánulas) en «complicadas» o «no complicadas» en lugar de «superficial» o «profunda», basándose tanto en criterios clínicos como en la presencia de bacteriemia, la presencia de organismos multirresistentes o hongos, la formación de abscesos, infecciones internas o externas del dispositivo o complicaciones tromboembólicas.
Las infecciones no específicas del SCM no surgen específicamente del hardware del dispositivo interno implantado o del dispositivo externo temporal transcutáneo, pero pueden estar relacionadas o afectar al dispositivo, como la endocarditis infecciosa, las infecciones del torrente sanguíneo asociadas al catéter, la mediastinitis, la sepsis, etc.
EpidemiologíaIncidencia y clínicaAunque las infecciones específicas del DAVI han disminuido en los últimos 15 años, los problemas infecciosos siguen siendo el evento adverso más frecuente en los pacientes con soporte de DAVI, tal y como muestra el informe INTERMACS 202023, donde aproximadamente el 41% de los pacientes experimentan una infección grave dentro del primer año tras el implante. Datos recientes muestran que el evento adverso más frecuente tanto en el periodo temprano (≤90 días después del implante) como en el tardío (>90 días después del implante) tras la colocación de un DAVI de flujo continuo es la infección mayor, que ocurre en el 22,4 y el 31,5% de los pacientes, respectivamente7.
Históricamente, las tasas de infección de los DAVI de primera generación se encontraban entre el 25 y el 80%, con una gran variabilidad teniendo en cuenta el escaso número de pacientes reportados y a la amplia variedad de tipos de infección incluidos. Con la mejora de los dispositivos, los DAVI de flujo continuo de segunda generación presentaron tasas de infección más bajas en comparación con los dispositivos de primera generación, que oscilaban oscilan entre el 30 y el 50%. Asimismo, al comparar DAVI de flujo continuo con bombas de flujo pulsátil, la tasa de infección fue claramente menor en los DAVI de flujo continuo (0,48 episodios de infección por paciente/año en flujo continuo vs. 0,90 episodios por paciente/año en flujo pulsátil; p=0,01)24.
Desde la implantación de los DAVI de flujo continuo, las infecciones afectan al 19-39% de los receptores y provocan más del 10% de las muertes relacionadas con el DAVI25. La mayor frecuencia de infecciones en la terapia de destino en comparación con los DAVI de puente sugiere que la incidencia aumenta con una mayor duración del soporte del DAVI. Asimismo, en una cohorte contemporánea de pacientes registrados en la base de datos de la STS - INTERMACS, la infección sigue siendo la principal causa de reingreso hospitalario durante los primeros 180 días tras la implantación de un dispositivo de asistencia ventricular (DAVI)26.
Según una revisión reciente del registro de la ISHLT27, la mayor incidencia es de las infecciones no relacionadas con el DAVI (66% de todas las infecciones en los pacientes con SCM), siendo la neumonía (34%) la más frecuente, seguida de infecciones del torrente sanguíneo, ITU e infecciones gastrointestinales. En el postoperatorio inmediato, los receptores de DAVI son especialmente propensos a contraer infecciones hospitalarias no relacionadas con el DAVI, independientemente del tipo o localización, lo que sugiere que muchas de estas infecciones son de origen nosocomial y se desarrollan mientras los pacientes permanecen en la UCI o durante la hospitalización posterior a la implantación.
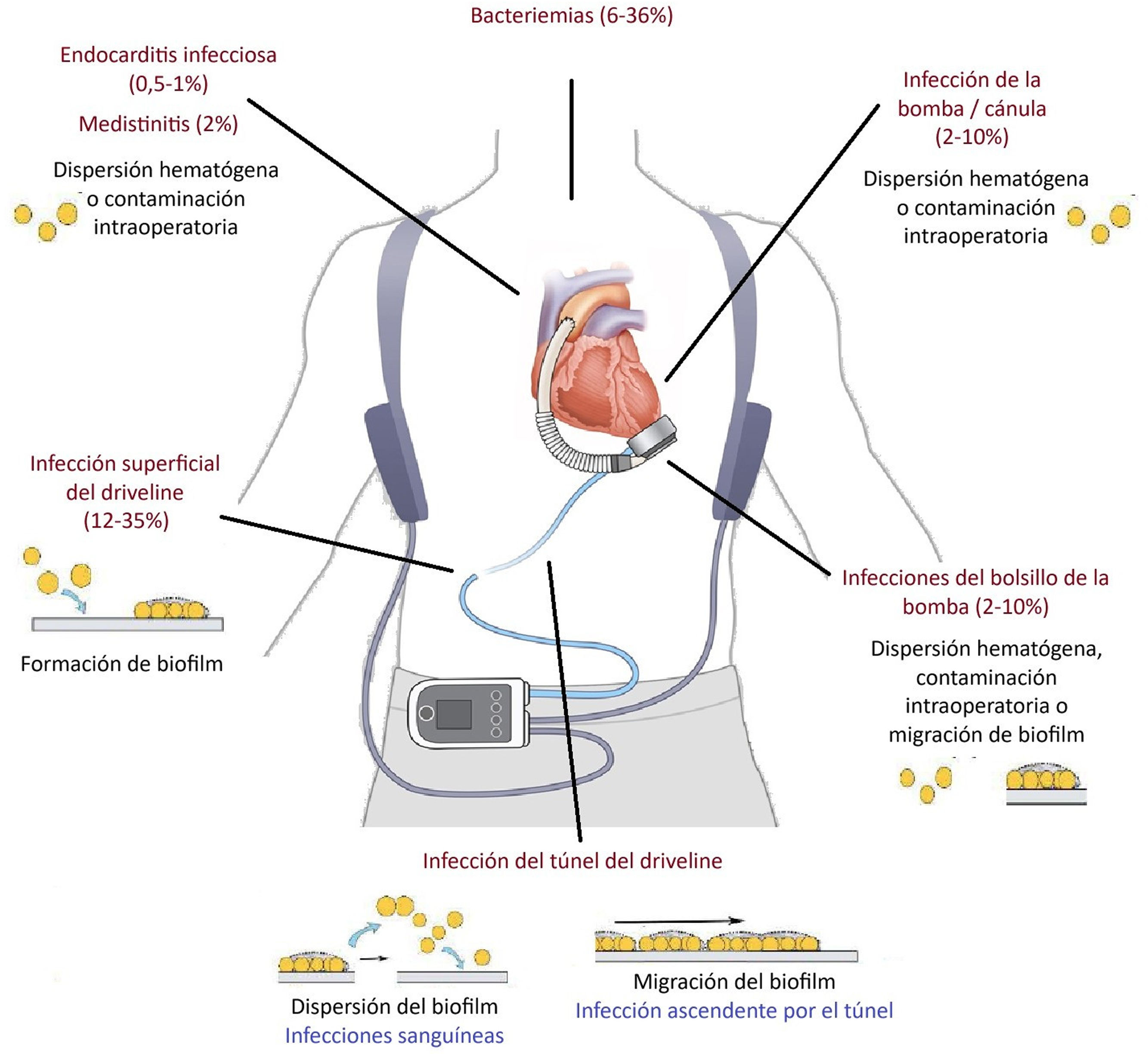
Dentro de las infecciones relacionadas con el DAVI podemos encontrar:
- •
La infección del driveline puede presentarse como eritema, sensibilidad y secreción purulenta en el punto de entrada del dispositivo, pudiendo ser superficial o afectar profundamente el tejido subcutáneo. Esta infección sigue siendo el tipo más común de infección específica (12-35% de los pacientes). En los últimos años, las tasas de infecciones del driveline han disminuido debido a la reducción de su diámetro en los dispositivos de última generación, con la utilización de una tunelización más larga hacia el lado contralateral y una mejora en el cuidado del sitio de salida. La infección del driveline es típicamente una infección de inicio tardío, con un 85% de estas infecciones reportadas que ocurren más de 30 días después de la implantación del dispositivo. El tiempo promedio desde la implantación hasta el inicio de la infección del driveline es de 6 meses.
- •
La presencia del driveline en la piel y el túnel subcutáneo permite la formación de biopelículas (biofilms) y la migración de patógenos bacterianos y fúngicos. La formación de biopelículas es una estrategia microbiana que proporciona un escudo contra el tratamiento antimicrobiano y la respuesta inmunitaria, favoreciendo la persistencia de la infección y la migración a tejidos más profundos, como el bolsillo de la bomba y el torrente sanguíneo28 (fig. 1).
- •
La infección del bolsillo es la segunda infección específica del DAVI más frecuente, ocurriendo aproximadamente entre el 19,6 y el 28%22. Las que ocurren en los primeros 30 días son probablemente causadas por inoculación directa durante la cirugía, mientras que las más tardías suelen ser una extensión de la infección del driveline (fig. 1). El bolsillo de la bomba es un espacio poco vascularizado, por lo que estas infecciones son más resistentes al tratamiento conservador. Con los dispositivos más antiguos, este bolsillo se creaba en el espacio preperitoneal para alojar la bomba. Sin embargo, los DAVI modernos requieren un bolsillo de bomba intrapericárdico mucho más pequeño, disminuyendo la infección de estos dispositivos. Las manifestaciones clínicas de las infecciones en el bolsillo del DAVI varían desde un absceso debajo de la piel intacta hasta un drenaje purulento localizado con cambios celulíticos sobre la piel y signos sistémicos de infección como fiebre e incluso infecciones del torrente sanguíneo y sepsis. Este amplio espectro de presentación clínica depende en parte del patógeno causante.
- •
Las infecciones de la bomba/cánula y la endocarditis infecciosa son muy poco frecuentes (<1%), pero suelen ser mortales25. Estas pueden producirse cuando un organismo asciende por el driveline, se propaga por vía hematógena o se inocula directamente en el momento de la implantación, especialmente si los receptores se someten también a una cirugía valvular (fig. 1). Esta categoría de infección incluye una vegetación o trombo infectado que involucra las válvulas cardíacas en los pacientes con DAVI o cualquier superficie en contacto con la sangre del DAVI, como la parte interna de la bomba o la cánula. Algunos factores que contribuyen al desarrollo de una vegetación o trombo infectado incluyen las características de la superficie del dispositivo, la dinámica del flujo sanguíneo, el área de superficie interna del dispositivo, la agregación plaquetaria o trombogénesis y los factores de virulencia del patógeno causante. Los dispositivos más antiguos estaban asociados con tasas más altas de trombosis intravascular y, por lo tanto, tasas más altas de endocarditis infecciosa, probablemente debido a su mayor tamaño y superficies internas más trombogénicas. Los síntomas de la endocarditis infecciosa en receptores de DAVI suelen ser inespecíficos, incluyendo shock séptico, pérdida de peso, fiebre y malestar, y son difíciles de distinguir de una sepsis no relacionada con el dispositivo. Rara vez se han reportado émbolos y fallos del dispositivo resultantes de la formación de grandes trombos intraluminales, especialmente en dispositivos más antiguos que eran más trombogénicos.
- •
Las infecciones relacionadas con el DAVI (especialmente las infecciones en el torrente sanguíneo) se asocian independientemente con un aumento de la estancia hospitalaria, la mortalidad y se vinculan más comúnmente con accidentes cerebrovasculares, especialmente los hemorrágicos.
- •
La mediastinitis afecta al 2% de los pacientes con DAVI, normalmente en el postoperatorio inmediato, con una mortalidad de hasta el 53%.
Numerosos estudios han identificado factores predisponentes tanto del paciente como del dispositivo para la infección del DAVI. Dentro de estos factores podemos encontrar la edad temprana (<50 años, posiblemente debido al mayor riesgo de traumatismo en el driveline), la obesidad (es el factor predictivo independiente de infección más comúnmente encontrado) y la diabetes mellitus25,29. Existen datos contradictorios sobre la relación entre las infecciones del DAVI y la enfermedad renal, el déficit de vitamina D y el bajo nivel de albúmina (como sustituto de la desnutrición). El sexo y la raza no parecen influir en la tasa de infecciones del DAVI. Si analizamos los factores psicosociales, la falta de apoyo social, la falta de adherencia al tratamiento, trastornos cognitivos, abuso de sustancias y enfermedades psiquiátricas graves se asocian con mayor riesgo de infección).
Algunos estudios también han encontrado relación con otros factores como la mayor gravedad de la insuficiencia cardíaca, la insuficiencia cardiaca derecha, la desnutrición, la disfunción de células T asociada con el dispositivo, hipogammaglobulinemia, líneas intravasculares y organismos capaces de formar biopelículas, cierre esternal diferido, estancia prolongada en la UCI y duración prolongada del soporte SCM24.
Asimismo, también se ha relacionado con un aumento de la tasa de infección el traumatismo repetitivo en el sitio de salida causado por tracción por cizallamiento o lesión por torsión en el driveline, la protrusión del velour en el sitio de salida, y la duración del soporte28. Varios estudios han hallado que el año de implantación es un factor determinante de la infección y la supervivencia, lo que de nuevo sugiere que la experiencia y los avances han mejorado los resultados con el tiempo.
MicrobiologíaEn un análisis reciente de los pacientes del ISHLT Mechanically Assisted Circulatory Support Registry, la mayoría de las infecciones en los pacientes con DAVI fueron de origen bacteriano, mientras que las infecciones fúngicas (fundamentalmente por Candida spp) causaron ≤1% de las infecciones en las infecciones específicas o relacionadas con el DAVI y ≤7% de las infecciones no relacionadas con el DAVI (las infecciones virales y protozoarias fueron extremadamente raras)27.
Los patógenos bacterianos más comunes fueron bacterias grampositivas, típicamente especies de Staphylococcus (>50%), organismos que colonizan la piel y están asociados con la formación de biopelículas. El patógeno más frecuente en las infecciones del DAVI es Staphylococcus aureus (14-56%), ya sea sensible a la meticilina (8-43%), resistente a la meticilina (4-30%) o sin especificar. Le siguen el Staphylococcus coagulasa negativo (7-56%). Las bacterias gramnegativas más frecuentes fueron Pseudomonas aeruginosa (3-28%), seguida de miembros de la familia Enterobacteriaceae (5-29%), incluyendo especies de Enterobacter y Klebsiella. Asimismo, en más de la mitad de los casos se identifican infecciones polimicrobianas. Las infecciones por Pseudomonas y/o especies de Serratia se asociaron de manera importante al contacto del driveline con agua.
Las infecciones fúngicas del DAVI son menos frecuentes, pero su pronóstico es significativamente peor (especialmente la infección por Aspergillus spp). Afortunadamente son cada vez menos frecuentes en los DAVI de nueva generación, probablemente debido a una combinación de mejora de la técnica quirúrgica, avances en el diseño de las bombas y aplicación de profilaxis antifúngica perioperatoria.
DiagnósticoCuando se sospecha una infección en los pacientes con dispositivos de SCM, es fundamental llevar a cabo una evaluación completa para identificar tanto la fuente como la etiología microbiológica de la infección.
El proceso diagnóstico debe incluir cultivos bacterianos y fúngicos de muestras tomadas de los sitios de drenaje de los accesos cutáneos y cualquier herida o tracto, así como cultivos sanguíneos y muestras intraoperatorias de tejidos y líquidos en caso de que se realice una intervención quirúrgica. En cuanto a los biomarcadores, la proteína C reactiva y la procalcitonina sérica, aunque útiles, tienen una especificidad limitada, especialmente en los pacientes en estado crítico. Asimismo, los biomarcadores fúngicos como el beta-D-glucano pueden ser empleados, pero su especificidad también se ve reducida en este contexto.
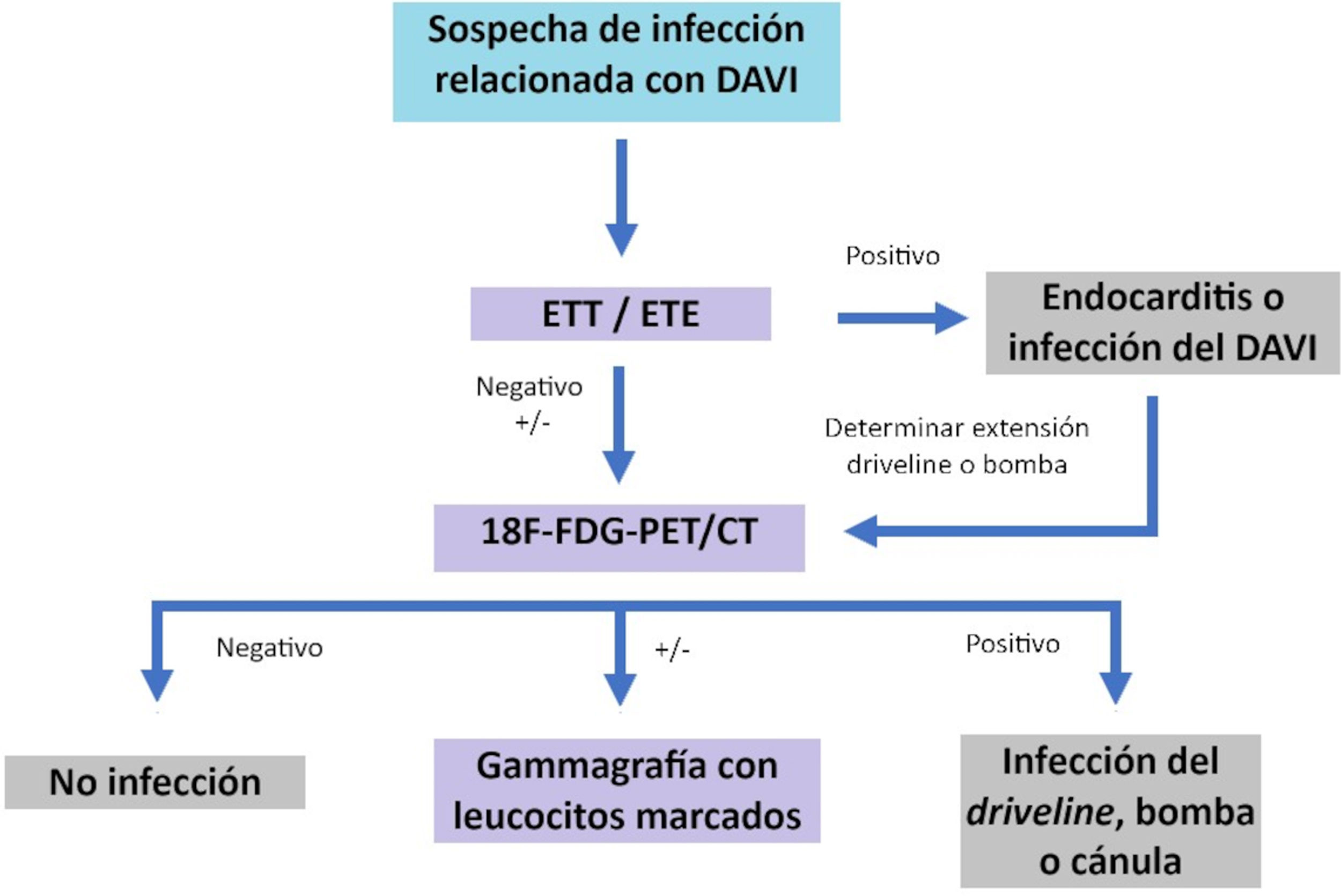
En relación con las técnicas de imagen, debido a las particularidades de estos dispositivos, se requiere un enfoque multimodal, como se sugiere en el artículo de Dilsizian et al.30, ilustrado en la figura 2.
Aunque no existen grandes estudios específicamente enfocados al estudio ecocardiográfico en las infecciones de dispositivos DAVI, se recomienda la evaluación basada en guías de las estructuras de DAVI y los patrones de flujo cuando se sospecha una infección del dispositivo. Las infecciones relacionadas con los DAVI pueden involucrar componentes del dispositivo, como el driveline, la bomba, el bolsillo de la bomba, la cánula de entrada o salida, o las válvulas nativas que se infectan secundariamente. Aunque la ecocardiografía es ampliamente considerada la prueba de primera línea en casos sospechosos de endocarditis, tiene ciertas limitaciones en los casos de DAVI, por lo que es recomendable realizar estudios de imagen del dispositivo y sus componentes, utilizando tomografía computarizada (TC) del tórax, abdomen y pelvis o el ultrasonido, que puede ser útil para la evaluación de colecciones líquidas superficiales. Un ecocardiograma transesofágico (ETE) negativo no siempre descarta la endocarditis asociada al DAVI, y la bacteriemia persistente debe levantar sospechas de endocarditis en estos pacientes. Las complicaciones incluyen embolización micótica sistémica y vegetaciones que causan obstrucción del tracto de entrada o salida, lo que lleva a la disfunción del DAVI.
Asimismo, la tomografía por emisión de positrones combinada con tomografía computarizada (18F-FDG-PET/TC) ha mostrado ser una herramienta diagnóstica valiosa en la localización precisa y la extensión de la infección a lo largo del dispositivo (desde el sitio de salida del driveline y el bolsillo de la bomba) y, más importante aún, puede predecir el resultado clínico de los pacientes con infección mejor que la TC.
Un estudio reciente evidenció que la captación de 18F-FDG era significativamente mayor en los pacientes con infecciones confirmadas, especialmente en el bolsillo de la bomba, lo que subraya la utilidad de este método para la detección precoz31. Además de su capacidad diagnóstica, el 18F-FDG-PET/CT tiene un impacto directo en la toma de decisiones clínicas, influyendo en la gestión terapéutica de hasta el 83% de los pacientes con infección. Esta influencia se traduce en intervenciones como desbridamientos quirúrgicos, recambio del dispositivo y modificaciones en la priorización para trasplante cardíaco, lo que refleja su relevancia no solo para confirmar la presencia de infección, sino también para orientar estrategias terapéuticas cruciales.
Otra prueba útil en estos pacientes es la gammagrafía con leucocitos marcados, que es particularmente útil para identificar infecciones en áreas donde hay dispositivos implantados, siendo más específico que el 18F-FDG-PET/TC, implicando además menor exposición a radiación.
Finalmente, también es necesario realizar una evaluación de infecciones no específicas de SCM, lo cual implica cultivos respiratorios, urinarios y pruebas para Clostridium difficile, según corresponda, para completar el diagnóstico y tratamiento adecuado del paciente.
PrevenciónLa prevención es una de las estrategias más importantes para evitar las infecciones. Además de las estrategias básicas antes de cualquier intervención (descartar infección, retirar catéteres…), se han propuesto múltiples estrategias para reducir la incidencia de las infecciones específicas, incluidas las comercializadas por los fabricantes, las introducidas perioperatoria, intraoperatoria y posoperatoriamente por los profesionales médicos (cuidados a la salida del hospital, educación de los pacientes, profilaxis antimicrobiana y técnicas quirúrgicas optimizadas)28. Algunas de las más relevantes son:
- •
Avances en el diseño y fabricación del DAVI: Las mejoras en los DAVI han reducido significativamente las complicaciones, incluidas las infecciones. La transición de DAVI paracorpóreos a implantables ha disminuido las infecciones en el driveline. Aunque algunos estudios comparan diferentes dispositivos, no hay consenso claro sobre cuál es más propenso a infecciones, lo que podría deberse a diferencias en la flexibilidad del cable, su diámetro y los biomateriales utilizados.
- •
Cuidado del driveline y educación del paciente: Evitar microtraumatismos en el sitio de salida del driveline es clave para prevenir infecciones. Las estrategias incluyen una higiene rigurosa, el uso de apósitos estériles y dispositivos de anclaje para inmovilizar el cable. La educación del paciente y del cuidador sobre el manejo del driveline en el hogar, así como la adherencia a protocolos estandarizados, son fundamentales para reducir el riesgo de infecciones postoperatorias.
- •
Profilaxis antimicrobiana: La profilaxis antimicrobiana, tanto sistémica como tópica, es una práctica común. Se recomienda la profilaxis antimicrobiana antes de la cirugía, administrando antibióticos dentro de los 60min previos a la incisión quirúrgica, dirigidos a Staphylococcus (incluido S. aureus resistente a meticilina en los pacientes colonizados) y adicionalmente de acuerdo con la epidemiología local. No se recomienda el uso rutinario de antifúngicos ni cobertura para gramnegativos. En la actualidad, se recomiendan regímenes simplificados con cefalosporinas de primera o segunda generación, adaptados según la prevalencia local de patógenos. Aunque se usan agentes tópicos como mupirocina o geles antibacterianos, se requieren estudios a gran escala para evaluar su eficacia en la prevención de infecciones específicas del DAVI. Respecto a la profilaxis para procedimientos en los pacientes con DAVI, se siguen las recomendaciones de las guías específicas32.
- •
Estrategias quirúrgicas de prevención: Durante el implante del DAVI, algunas técnicas quirúrgicas específicas ayudan a reducir infecciones como el uso de suturas para fijar el driveline, técnicas de tunelización subcutánea y la colocación estratégica del cable para minimizar el riesgo de lesiones por tracción e infecciones ascendentes. Aunque se utilizan en algunos centros, los datos sobre el uso de dispositivos recubiertos con antibióticos o el recubrimiento del driveline y/o el dispositivo con una membrana extracelular impregnada de antibiótico son todavía limitados.
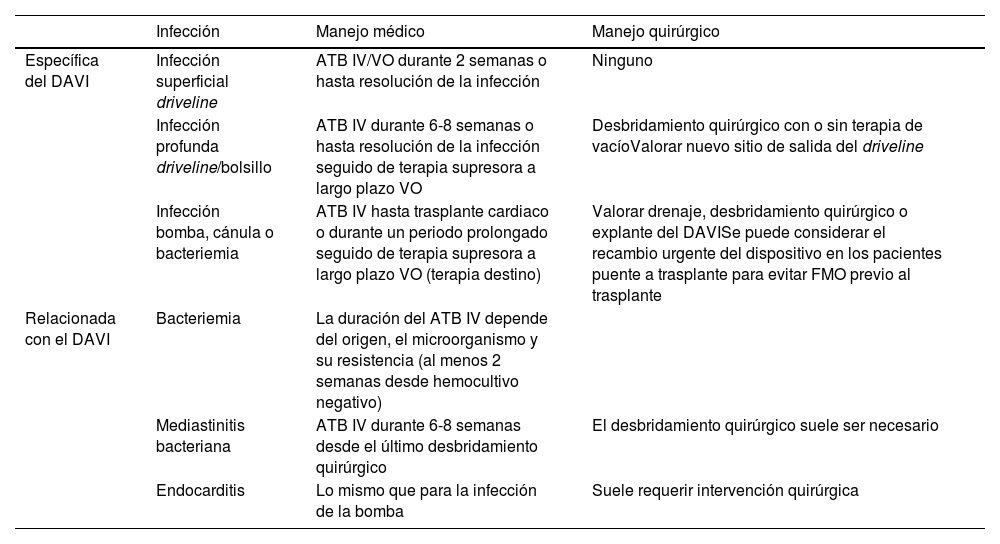
El tratamiento de las infecciones en los pacientes con DAVI es complejo, sin una clara evidencia para guiar el manejo dada la gran variabilidad existente entre dispositivos, patógenos y centros. Las indicaciones se basan principalmente en recomendaciones de expertos, que tienen como objetivo mejorar los resultados de las infecciones del DAVI y lograr una mayor estandarización en la práctica clínica39. Tal y como se describe en la tabla 1, los antibióticos intravenosos deben usarse para los pacientes con infección superficial del driveline con evidencia de enfermedad sistémica o como terapia inicial para cualquier infección no superficial. En los pacientes con infecciones en el torrente sanguíneo, infecciones profundas del driveline, sospecha de absceso o signos de enfermedad sistémica, se debe iniciar antibióticos intravenosos. La elección del antimicrobiano empírico sigue dependiendo de la institución y suele abarcar la flora cutánea y las bacterias entéricas en función de los patrones de susceptibilidad locales.
Recomendaciones ISHLT 2017 sobre el manejo médico y quirúrgico de las infecciones del DAVI
| Infección | Manejo médico | Manejo quirúrgico | |
|---|---|---|---|
| Específica del DAVI | Infección superficial driveline | ATB IV/VO durante 2 semanas o hasta resolución de la infección | Ninguno |
| Infección profunda driveline/bolsillo | ATB IV durante 6-8 semanas o hasta resolución de la infección seguido de terapia supresora a largo plazo VO | Desbridamiento quirúrgico con o sin terapia de vacíoValorar nuevo sitio de salida del driveline | |
| Infección bomba, cánula o bacteriemia | ATB IV hasta trasplante cardiaco o durante un periodo prolongado seguido de terapia supresora a largo plazo VO (terapia destino) | Valorar drenaje, desbridamiento quirúrgico o explante del DAVISe puede considerar el recambio urgente del dispositivo en los pacientes puente a trasplante para evitar FMO previo al trasplante | |
| Relacionada con el DAVI | Bacteriemia | La duración del ATB IV depende del origen, el microorganismo y su resistencia (al menos 2 semanas desde hemocultivo negativo) | |
| Mediastinitis bacteriana | ATB IV durante 6-8 semanas desde el último desbridamiento quirúrgico | El desbridamiento quirúrgico suele ser necesario | |
| Endocarditis | Lo mismo que para la infección de la bomba | Suele requerir intervención quirúrgica |
ATB: antibiótico; DAVI: dispositivo de asistencia ventricular izquierda; FMO: fallo multiorgánico.IV: intravenoso; VO: vía oral.
Aunque existen numerosas estrategias terapéuticas conservadoras y quirúrgicas para el tratamiento de la infección del driveline, la única solución permanente para su resolución definitiva es la retirada del dispositivo o el trasplante de corazón. En todos los casos, el tratamiento de estas infecciones debe iniciarse de forma empírica tras la recogida de muestras microbiológicas, cubriendo patógenos frecuentes (incluido el MRSA), considerando la resistencia microbiana local, antecedentes de cultivos previos, el uso previo de antimicrobianos, la extensión de la infección, la presencia o ausencia de bacteriemia asociada y las pruebas de imagen33. Una vez disponibles los resultados microbiológicos, se ajustará la terapia según el cultivo (más de la mitad de los patógenos son multirresistentes). Además, dado que muchos patógenos producen biofilms que proporcionan protección física frente a la respuesta inmunitaria y facilitan la resistencia a los antibióticos, en ocasiones es recomendable realizar alguna prueba (de imagen o microbiológica) tras el tratamiento antibiótico para garantizar su erradicación y guiar la duración del tratamiento.
El tratamiento de las infecciones del driveline sigue los principios recomendados por la ISHLT de acuerdo a un esquema de escalada según su gravedad: para las infecciones superficiales del driveline sin extensión ni absceso, la terapia antimicrobiana oral debe continuarse al menos hasta que se objetiva una mejoría clínica del sitio de salida con cicatrización de este y cultivos microbiológicos negativos; si la terapia oral no es eficaz, el paciente debe ser hospitalizado y se le administrarán antibióticos intravenosos.
Las infecciones más profundas o recurrentes a menudo requieren un tratamiento quirúrgico más agresivo, como la apertura y el drenaje del túnel, el desbridamiento, la retunelización del driveline infectado y el cierre asistido por vacío para facilitar la cicatrización. El abordaje quirúrgico no está estandarizado, por lo que en la literatura encontramos distintas técnicas para su tratamiento. Pieri et al.34, describen su experiencia con la translocación y el recubrimiento del driveline con omento para tratar infección crónica severa. Para este abordaje es necesaria una laparotomía superior para movilizar el omento. Posteriormente, se realiza la disección del recorrido del driveline hasta tejido sano con excisión del tejido circundante afectado, creando a continuación un nuevo túnel de tejido contralateral y reubicando el driveline mediante un tubo insertado desde el nuevo sitio de salida hacia la cavidad abdominal y el antiguo sitio de salida. Después de limpiar y reconectar el driveline al controlador, se envuelve con el omento para aumentar la capacidad inmunológica del tejido. El sitio de salida anterior generalmente se reseca y se cierra directamente o de manera secundaria con terapia de vacío (VAC).
Haddad et al. 35 publicaron otra alternativa exitosa a la recolocación del driveline en casos de infección profunda recurrente. En este caso, se administraron perlas antibióticas reabsorbibles compuestas de sulfato de calcio, vancomicina y tobramicina en el lecho de la herida tras un desbridamiento quirúrgico extenso, con lo que consiguieron libertad de infección a los 9 meses tras la intervención, aunque se han planteado dudas sobre la toxicidad y la hipersensibilidad del uso local de microesferas con antibióticos.
Además de estos abordajes quirúrgicos, encontramos en la literatura distintas estrategias terapéuticas que combinan diferentes tratamientos36. Aunque la terapia VAC es un método bien conocido en el tratamiento de heridas crónicas, se ha descrito también su combinación con instilación de polihexanida (PHMB, un agente desinfectante) en el tratamiento de una infección profunda del driveline. Otro tratamiento que ha sido utilizado es el uso oxígeno hiperbárico para el tratamiento de infecciones crónicas del driveline pues, aunque los DAVI de flujo continuo no han sido testados en cámaras hiperbáricas, existen algunos informes que describen métodos para proteger las baterías y controladores de dispositivos antiguos como HeartWare HVAD® (HeartWare, Inc., Framingham, MA, EE. UU.) y HeartMate II® (Thoratec Corporation, Pleasanton, CA, EE. UU.) durante la exposición en estas cámaras.
Del mismo modo, se ha visto que son efectivos en el tratamiento de estas infecciones el gel plaquetario alogénico (PLT-gel) y el plasma rico en plaquetas (PRP). Ambos contienen una alta concentración de factores de crecimiento derivados de plaquetas, factor de crecimiento TGF-β1 y factor de crecimiento endotelial vascular, que potencian la actividad de fibroblastos, células mesenquimatosas y células estromales en el proceso de cicatrización de heridas. Además, se ha observado que el PRP inhibe in vitro el crecimiento de S. aureus y E. coli. El plasma frío también ha sido descrito como un tratamiento novedoso para este tipo de infecciones ya que provoca la formación de especies reactivas de oxígeno y nitrógeno que afectan el equilibrio redox celular y pueden inactivar microorganismos de manera efectiva. Más recientemente se han descrito otros métodos poco comunes como el uso de una cámara fluorescente portátil capaz de detectar la colonización bacteriana para guiar el desbridamiento basándose en el principio de autofluorescencia o la utilización de cloruro de metilrosanilinio (violeta cristal) mezclado con macrogol en forma de ungüento que muestra actividad contra bacterias grampositivas (especialmente MRSA) y P. aeruginosa.
El tratamiento de las infecciones de la bomba o de la endocarditis del dispositivo es más complejo y en ocasiones requiere recambio o retirada del dispositivo, con un riesgo quirúrgico muy alto. El cambio del dispositivo también se puede considerar como última opción en casos de infección del driveline profunda resistente en la que se han agotado el resto de las terapias. Aunque existen experiencias en la literatura en las que, a pesar de una mortalidad no despreciable, se observa libertad de infección a medio plazo37, encontramos un metaanálisis reciente que observó que en los pacientes con infecciones específicas de VAD, el intercambio de la bomba no pareció ofrecer ventajas en términos de mortalidad general y recurrencia de infecciones en comparación con estrategias que no implicaban el cambio a los 12 meses de seguimiento, con una tasa de recurrencia de la infección tras el intercambio del DAVI en torno al 27%, con un seguimiento medio de 290 días38. La mayoría de las infecciones específicas de VAD fueron infecciones del driveline (82,0%), seguidas de infecciones del dispositivo o infecciones relacionadas (25,3%), sin diferencias significativas entre los grupos de recambio y no recambio. Sin embargo, en otra revisión reciente que incluyó 26 pacientes (7 con DAVI de flujo continuo y 19 DAVI de flujo pulsátil), se objetivó una mayor supervivencia entre los pacientes que se sometieron a una intervención quirúrgica adicional en comparación con aquellos tratados solo con antibióticos (71,4 vs. 27,3%; p=0,07), sin diferencia entre el intercambio quirúrgico del dispositivo y el trasplante de corazón (80,0 vs. 66,7%; p=0,23)39.
Mueller et al. exploraron el uso de un dispositivo periférico de asistencia ventricular izquierda temporal como puente a la terapia definitiva con un DAVI tras la explantación completa del dispositivo en un paciente con infección grave del bolsillo y la bomba, con mediastinitis asociada40. El paciente sobrevivió con la asistencia temporal durante 3 meses antes de la reimplantación de un HeartWare HVAD® y un año después permanecía libre de infección. No existe hasta el momento evidencia adicional que respalde este enfoque más allá de este caso clínico.
Los pacientes candidatos a trasplante cardíaco pueden obtener una mayor prioridad en la lista de espera en función de la presencia y gravedad de la infección del DAVI (siempre y cuando no presenten septicemia, aunque se puede considerar el trasplante en casos de bacteriemia activa tratada con antimicrobianos específicos). Es crucial realizar una completa eliminación del todo el DAVI y del material del driveline durante el explante de la bomba en el trasplante en caso de infecciones específicas del DAVI. Cabe destacar que, aunque las infecciones graves postrasplante son más frecuentes en los pacientes con infección preoperatoria del DAVI, la supervivencia postrasplante a largo plazo no parece verse afectada41.
La evaluación del riesgo de recidiva debe incluir si se ha producido una reinfección anteriormente, la capacidad del microorganismo para la formación de biofilm, la extensión observada en las técnicas de imagen y la ubicación del hardware afectado por la infección. Esto es fundamental especialmente en los pacientes con DAVI como terapia de destino pues hasta el 50% de los pacientes con infección del driveline sin bacteriemia recaen si no se utiliza la supresión antimicrobiana a largo plazo, y las infecciones intratables pueden duplicar con creces la mortalidad en comparación con los pacientes cuyas infecciones desaparecen25. En los pacientes puente a trasplante en muchos casos, se justifica el uso de terapia antimicrobiana supresora a largo plazo hasta el momento del trasplante, dado el riesgo de que la infección se extienda de superficial a profunda. Sin embargo, hay que tener en cuenta que esta terapia supresora, aunque necesaria, se asocia asimismo con infecciones asociadas a antibióticos como Clostridium difficile y aumenta el riesgo de resistencia antibiótica. Se debe tener especial precaución cuando se trata Pseudomonas, dado el riesgo de resistencia y las limitadas opciones de antibióticos orales.
Complicaciones (morbimortalidad)La infección es una complicación importante en los pacientes con DAVI y está asociada a peores resultados, incluyendo el desarrollo de insuficiencia renal, disfunción multiorgánica y aumento de la mortalidad. Esto va a depender de la gravedad y la extensión de la infección, y es especialmente cierto para aquellos que desarrollan infecciones sistémicas más graves, como sepsis o infecciones del torrente sanguíneo (18 vs. 61,9% a 2 años)24.
Si analizamos la supervivencia a medio y largo plazo, la infección en los pacientes con DAVI tiene un impacto relevante, como se observó en una revisión de los pacientes del registro de la ISHLT donde la supervivencia de los pacientes a los 24 meses después de desarrollar cualquier infección fue un 15% menor (59 vs. 74,8%) que en los pacientes que no desarrollaron infección27. Otro análisis reciente de casi 13.000 pacientes del registro INTERMACS reveló varios hallazgos clave sobre la relación entre infecciones y mortalidad en los pacientes con dispositivos de asistencia ventricular. En primer lugar, cualquier infección se asoció con un mayor riesgo de muerte en comparación con los pacientes sin infecciones (HR: 2,63). En segundo lugar, el riesgo fue mayor cuando la infección ocurrió entre los 90 y 180 días postimplante (HR: 3,26), seguido de infecciones tardías (>180 días, HR: 3,13) y tempranas (≤90 días, HR: 2,37). Estos resultados sugieren que el riesgo no disminuye con el tiempo, sino que persiste y puede incrementarse en fases más avanzadas del seguimiento. Y, por último, las infecciones relacionadas con el DAVI presentaron el mayor riesgo de mortalidad (HR: 3,02), en comparación con infecciones específicas del DAVI (HR: 2,92) y no relacionadas con el dispositivo (HR: 2,42)42. Estos hallazgos resaltan la necesidad de estrategias integrales de prevención, detección precoz y manejo agresivo de las infecciones en los pacientes con DAVI, independientemente del momento de aparición o del tipo de infección.
Además de afectar a la supervivencia, las infecciones específicas del DAVI, es decir, aquellas relacionadas con la bomba, el driveline u otros componentes del dispositivo que se presentan hasta en el 40% de los pacientes a los 5 años de soporte, representan el 13,5% de todas las rehospitalizaciones con un aumento de la utilización de los servicios y costes sanitarios43. Del mismo modo, diversos estudios han correlacionado la presencia de infecciones durante el soporte con DAVI con un mayor riesgo de trombosis del dispositivo y de accidente cerebrovascular (hasta 20 veces más riesgo de ictus hemorrágico que los pacientes sin bacteriemia, en parte debido al DAVI y en parte por la trasformación hemorrágica del ictus embólico en el contexto de la anticoagulación)28.
Conclusiones- •
El aumento de la prevalencia de la insuficiencia cardiaca y la capacidad limitada del trasplante ha dado lugar a un mayor uso de la asistencia circulatoria mecánica. La infección relacionada con el DAVI es la complicación más frecuente a largo plazo de este soporte de larga duración, con un driveline que permanece expuesto al entorno externo convirtiéndose en el lugar más frecuente de infección.
- •
Las infecciones relacionadas con el DAVI siguen teniendo una incidencia no despreciable, con una repercusión importante en los costes, la utilización de los servicios sanitarios y la morbimortalidad de estos pacientes.
- •
Los hallazgos de ensayos clínicos y análisis de registros destacan la variabilidad en las tasas de infección y la necesidad de prevenir no solo las infecciones específicas del SCM, sino también aquellas no relacionadas con el dispositivo, como las bacteriemias asociadas a catéter, la neumonía y las ITU, entre otras.
- •
El tratamiento de estos pacientes requiere un esfuerzo multidisciplinar coordinado entre cardiólogos, cirujanos cardiacos, enfermeras coordinadoras de DAVI y especialistas en enfermedades infecciosas, con la participación de los pacientes y sus cuidadores. Se necesitan esfuerzos clínicos y de investigación continuos para dilucidar los métodos más eficaces de prevención y tratamiento de la infección en esta población de alto riesgo en rápida expansión.
Los autores declaran no haber recibido financiación.
Consideraciones éticasEn la elaboración del artículo se han tenido en cuenta las guías SAGER con respecto a los posibles sesgos de sexo y género.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.