Evaluación de resultados en cirugía univentricular.
Pacientes y métodosAnálisis retrospectivo de 42 pacientes intervenidos entre 2013-2015.
ResultadosPaliación neonatal (16 pacientes): fístula Blalok-Taussing: 7 casos; Norwood: 5; Banding 4 casos. BTM: edad 23 días (2-40); Aristóteles 7,5; estancia en UCIP 12 días (5-32), hospitalaria 32 días (10-97). Una reintervención por trombosis. Sin mortalidad.
Norwood: 5 pacientes. Edad 29 (6-90) días. Aristóteles: 20,8; estancia UCI: 35 (19-57) días, hospitalaria 48 días. Morbilidad: una trombosis de vena cava inferior. Mortalidad: un shock séptico refractario. Todos han alcanzado el Glenn.
Glenn: 11 pacientes (uno con Damus-Kaye-Stansel asociado). Mediana de edad: 8 (4-135) meses. Aristóteles 9. Estancia en UCI 17 (3-90) días, hopitalaria 27 (7-119) días. Complicación: una parálisis frénica.
Fontan: 15 pacientes. Edad: 56 meses (40-113). Aristóteles 11. Estancia en UCIP y hospital: 7 (4-81) y 24 (14-90) días. Complicaciones: un taponamiento por quilopericardio, un quilotórax recidivante (pleurodesis y embolización de conducto torácico) y trombosis de VCI (fibrinólisis). Sin mortalidad.
Mortalidad 2,3% (un Norwood).
ConclusionesLa cirugía univentricular implica procedimientos complejos de alto riesgo. Actualmente puede realizarse con éxito y permite a la mayoría llegar a la paliación definitiva de Fontan.
To evaluate the results in surgical procedures of univentricular hearts.
Patients and methodsRetrospective analysis of the 42 patients operated from 2013 to 2015.
ResultsNeonatal palliation (16 patients): Blalock-Taussig shunt: 7 cases; Norwood procedure: 5 patients; Banding 4 cases. BT shunt: age 23 days (2-40); Aristóteles 7.5. Medium stay at PICU 12 days (5-32) and hospital 32 days (10-97). 1 reintervention due tu acute thrombosis. No mortality. Norwood procedure: 5 patients. Age 29 (6-90) days. Aristóteles 20.8. Stay at PICU 35 (19-57) days and hospital 48 days. Morbidity: 1 case of inferior vena cava thrombosis. Mortality: 1 case due to refratory septic shock. All cases have reached the Glenn procedure.
Glenn procedure: 11 patients (1 case associated to Damus-Kaye-Stansel procedure). Age: 8(4-135) months. Aristóteles 9. Stay at PICU 17 (3-90) days and hospital 27 (7-119 days). Morbidity: 1 case of phrenic nerve paralysis.
Fontan procedure: 15 patients. Age 56 (40-113) months. Aristóteles 11. Stay at PICU and hospital: 7 (4-81) and 24 (14-90). Morbidity: 1 case of cardiac tamponade due to chylopericardium, 1 case of persistent pleural effusion (reintervention and embolization of thoracic duct and 1 case of thrombosis of inferior vena cava. No mortality.
Overall mortality 2.3%
ConclusionsSurgery of univentricular hearts means complex high risk procedures. Currently, they can be performed successfully and patients are able to reach the definitive palliation with the Fontan procedure.
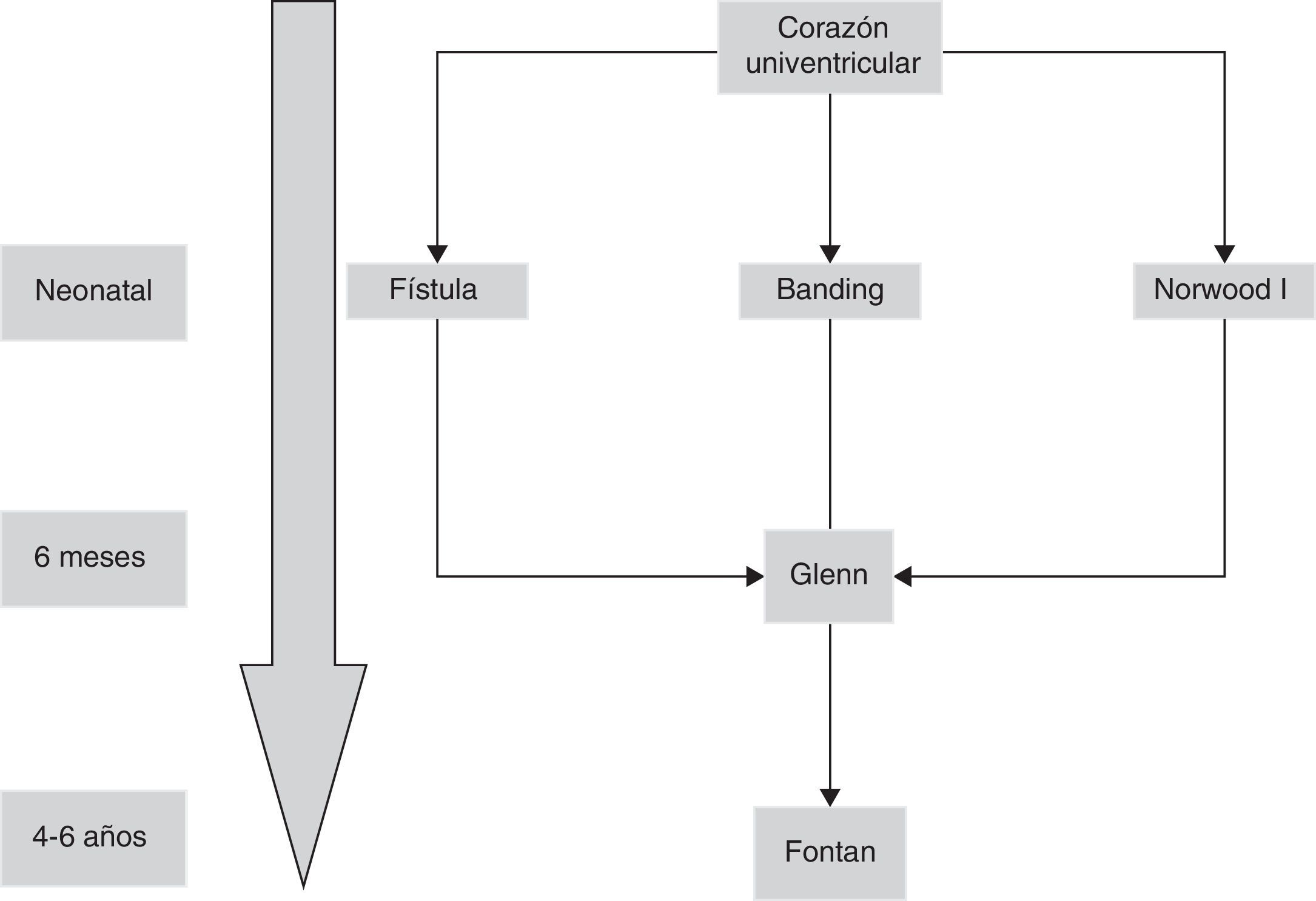
La situación de ventrículo único está presente cuando hay una imposibilidad o se desaconseja la reconstrucción biventricular con circulación pulmonar y sistémica por separado. El espectro del manejo quirúrgico de los pacientes con ventrículo único es similar a una serie de patologías como la atresia tricúspide, otras formas de conexión AV univentricular, y otras anomalías con un solo ventrículo adecuadamente desarrollado, y están basados en la fisiología e intervención de Fontan y sus modificaciones, y todo el espectro de intervenciones paliativas pre-Fontan.
El objetivo de la cirugía paliativa en el periodo neonatal de los pacientes con corazones univentriculares es conseguir un balance entre el flujo sistémico y pulmonar (Qp/Qs), conseguir una mezcla de sangre no obstructiva a nivel intraauricular y asegurar un flujo sistémico no obstructivo. En caso de no presentar un adecuado flujo pulmonar (generalmente debido a una obstrucción valvular pulmonar o previa a esta), se requiere una paliación neonatal mediante una fístula sistémico-pulmonar para aumentar la relación a favor del Qp. En otras ocasiones, el flujo a nivel pulmonar no es obtructivo o, incluso excesivo, siendo necesario un banding del tronco de la pulmonar. Las fístulas sistémico-pulmonares fueron descritas en 1945 por Blalock y Taussig, y más tarde por Potts y Waterston.
En 1958, Glenn introduce una alternativa para oxigenar la sangre procedente del territorio de la vena cava superior, al anastomosar la misma a la arteria pulmonar derecha, desinsertando esta última del tronco pulmonar común1. Ya en 1971 Fontan publica la anastomosis de la orejuela derecha al tronco pulmonar, derivando la sangre del territorio de la vena cava inferior al pulmón izquierdo, completándose así la separación de la circulación sistémica y pulmonar2.
Aunque la operación de Fontan fue inicialmente descrita como tratamiento de la atresia tricúspide3, pronto se comprobó que era aplicable a una variedad de entidades clínicas con un ventrículo severamente hipoplásico. Además, su uso se ha extendido a tratamiento de pacientes con dos ventrículos adecuadamente desarrollados pero con anomalías intracardiacas demasiado complicadas para una reparación univentriucular o directamente no septables4.
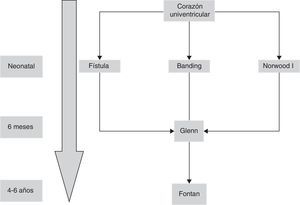
El caso particular de un ventrículo izquierdo no desarrollado, se define como síndrome de corazón izquierdo hipoplásico y es la situación en la que el corazón izquierdo es incapaz de mantener el adecuado gasto cardiaco tras el nacimiento por la falta de desarrollo de una o más estructuras cardiacas a pesar de intervención médica o quirúrgica. En 1983, Norwood describe por vez primera la paliación exitosa neonatal que condujo a una posterior intervención de Fontan5 (fig. 1).
ObjetivoEl objetivo de este estudio es exponer y evaluar los resultados de nuestro servicio en las distintas intervenciones y técnicas quirúrgicas realizadas a los pacientes con fisiología ventrículo único intervenidos durante el periodo 2013-2015, analizándolos en términos de mortalidad, morbilidad y complejidad.
MétodoSe trata de un estudio observacional restrospectivo que incluye a todos los pacientes intervenidos con fisiología de ventrículo único durante el periodo 2013-2015 por la sección de cirugía cardiovascular infantil de nuestro servicio.
Analizamos las distintas paliaciones realizadas a nuestros pacientes.
Se ha considerado mortalidad quirúrgica como aquella que tiene lugar durante el ingreso hospitalario antes del alta del paciente. Asimismo, consideramos morbilidad a cualquier complicación o alteración del curso clínico del paciente tras la intervención que requiere actuación para su corrección.
ResultadosSe analizan un total de 42 procedimientos realizados durante dicho periodo, en las diferentes etapas paliativas:
- -
Periodo neonatal: 16 pacientes.
- -
Periodo de Glenn: 11 pacientes.
- -
Periodo de Fontan: 15 pacientes.
Cirugía realizada en periodo neonatal:
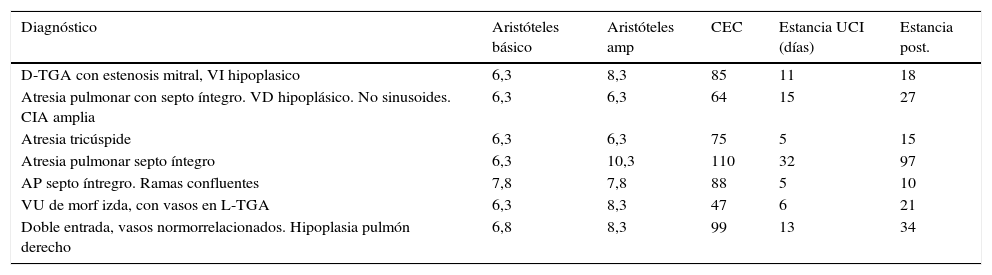
De los pacientes intervenidos en este periodo, se realizó fístula sistémico-pulmonar de Blalock Taussing modificada (BTM) a un total de 7 pacientes con situación de ventrículo único. Excluimos de aquí a los pacientes en situación biventricular. En nuestra institución, realizamos todos los casos por esternotomía media, con soporte de circulación extracorpórea. En un solo caso se realizó sin CEC, y requirió reintervención por trombosis precoz. Las características de los pacientes intervenidos se muestran en la tabla 1.
Características de los pacientes con fístula BTM
| Diagnóstico | Aristóteles básico | Aristóteles amp | CEC | Estancia UCI (días) | Estancia post. |
|---|---|---|---|---|---|
| D-TGA con estenosis mitral, VI hipoplasico | 6,3 | 8,3 | 85 | 11 | 18 |
| Atresia pulmonar con septo íntegro. VD hipoplásico. No sinusoides. CIA amplia | 6,3 | 6,3 | 64 | 15 | 27 |
| Atresia tricúspide | 6,3 | 6,3 | 75 | 5 | 15 |
| Atresia pulmonar septo íntegro | 6,3 | 10,3 | 110 | 32 | 97 |
| AP septo íntregro. Ramas confluentes | 7,8 | 7,8 | 88 | 5 | 10 |
| VU de morf izda, con vasos en L-TGA | 6,3 | 8,3 | 47 | 6 | 21 |
| Doble entrada, vasos normorrelacionados. Hipoplasia pulmón derecho | 6,8 | 8,3 | 99 | 13 | 34 |
La mediana de la escala de complejidad Aristóteles ampliado fue de 7,5 puntos. El tiempo de CEC medio fue de 63 min (47-110), la media de estancia en UCI fue de 12 días (5-32) y de hospitalización de 32 días (10-97). En un caso se produjo una trombosis precoz de la fístula que requirió intervención emergente con buen resultado y funcionalidad posterior. Otro paciente presentó una neumonía complicada con shock séptico que implicó reintubación, tratamiento antibiótico y ventilación mecánica prolongada y se resolvió satisfactoriamente. No hubo mortalidad en estos pacientes y todos han completado el estadio de Glenn.
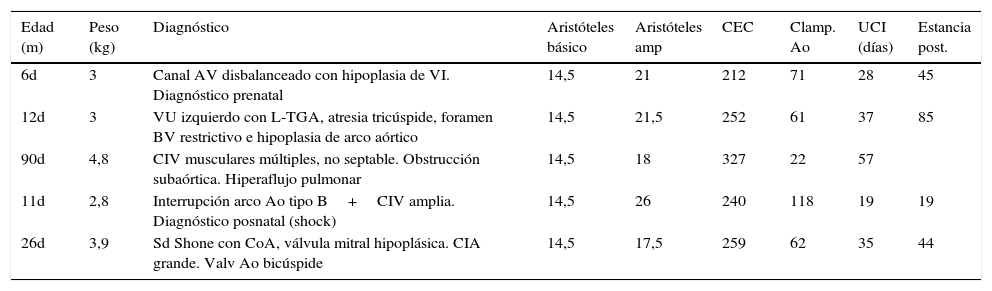
La cirugía neonatal del síndrome de corazón izquierdo hipoplásico (HLHS) se realizó sobre 5 pacientes (Norwood I) (tabla 2). La edad media de los pacientes fue de 29 días (6-90). La mediana de Aristóteles ampliado fue de 20,8. La estancia en UCIP fue de 35 días (19-57) y la hospitalaria de 48 días (19-85). La media de los tiempos de CEC y pinzamiento aórtico fue de 258 min (212-327) y 67 min (61-118) respectivamente. Como morbilidad cabe destacar que un paciente de la serie requirió soporte de ECMO, siendo desconectado sin complicaciones. Otro paciente presentó una trombosis de vena cava inferior (posiblemente asociada a vía central femoral) que se resolvió con tratamiento fibrinolítico y hubo un único caso de éxitus debido a un shock séptico refractario. El resto de los pacientes han alcanzado el estadio de Glenn.
Características de los pacientes en estadio Norwood I
| Edad (m) | Peso (kg) | Diagnóstico | Aristóteles básico | Aristóteles amp | CEC | Clamp. Ao | UCI (días) | Estancia post. |
|---|---|---|---|---|---|---|---|---|
| 6d | 3 | Canal AV disbalanceado con hipoplasia de VI. Diagnóstico prenatal | 14,5 | 21 | 212 | 71 | 28 | 45 |
| 12d | 3 | VU izquierdo con L-TGA, atresia tricúspide, foramen BV restrictivo e hipoplasia de arco aórtico | 14,5 | 21,5 | 252 | 61 | 37 | 85 |
| 90d | 4,8 | CIV musculares múltiples, no septable. Obstrucción subaórtica. Hiperaflujo pulmonar | 14,5 | 18 | 327 | 22 | 57 | |
| 11d | 2,8 | Interrupción arco Ao tipo B+CIV amplia. Diagnóstico posnatal (shock) | 14,5 | 26 | 240 | 118 | 19 | 19 |
| 26d | 3,9 | Sd Shone con CoA, válvula mitral hipoplásica. CIA grande. Valv Ao bicúspide | 14,5 | 17,5 | 259 | 62 | 35 | 44 |
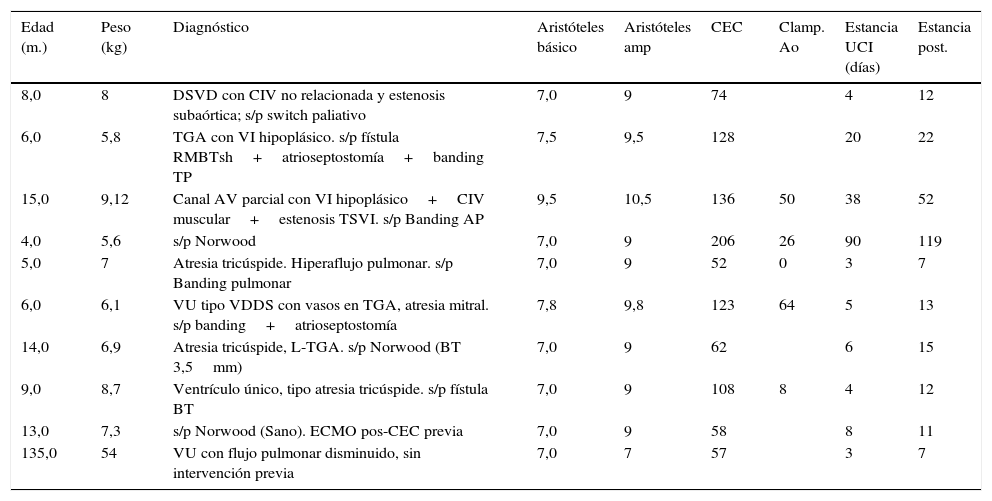
En nuestra serie, realizamos el procedimiento de Glenn a 11 pacientes (un caso con anastomosis de Damus-Kaye-Stansel asociado) (tabla 3). Estos pacientes provienen de los casos que ya habían sido intervenidos de la misma serie y periodo y otros procedentes de un periodo anterior y de otro centro. La mediana de edad de los pacientes fue de 8 meses (4-135). La puntuación de Aristóteles ampliado fue de 9. La media de tiempo de circulación extracorpórea fue de 121 min (52-206) y se realizó pinzamiento aórtico en 4 pacientes que requerían procedimientos en cavidades izquierdas: atrioseptostomía (2 pacientes), Damus-Kaye-Stansel y ampliación de neoaorta. La media de estancia en UCIP fue de 17 días (3-90) y de hospitalización de 27 días (7-119). No hubo ningún caso de mortalidad y la única complicación fue un caso de parálisis frénica derecha que prolongó el tiempo de ventilación mecánica del paciente y finalmente fue intervenido para realización de plicatura diafragmática.
Características de los pacientes en estadio Glenn
| Edad (m.) | Peso (kg) | Diagnóstico | Aristóteles básico | Aristóteles amp | CEC | Clamp. Ao | Estancia UCI (días) | Estancia post. |
|---|---|---|---|---|---|---|---|---|
| 8,0 | 8 | DSVD con CIV no relacionada y estenosis subaórtica; s/p switch paliativo | 7,0 | 9 | 74 | 4 | 12 | |
| 6,0 | 5,8 | TGA con VI hipoplásico. s/p fístula RMBTsh+atrioseptostomía+banding TP | 7,5 | 9,5 | 128 | 20 | 22 | |
| 15,0 | 9,12 | Canal AV parcial con VI hipoplásico+CIV muscular+estenosis TSVI. s/p Banding AP | 9,5 | 10,5 | 136 | 50 | 38 | 52 |
| 4,0 | 5,6 | s/p Norwood | 7,0 | 9 | 206 | 26 | 90 | 119 |
| 5,0 | 7 | Atresia tricúspide. Hiperaflujo pulmonar. s/p Banding pulmonar | 7,0 | 9 | 52 | 0 | 3 | 7 |
| 6,0 | 6,1 | VU tipo VDDS con vasos en TGA, atresia mitral. s/p banding+atrioseptostomía | 7,8 | 9,8 | 123 | 64 | 5 | 13 |
| 14,0 | 6,9 | Atresia tricúspide, L-TGA. s/p Norwood (BT 3,5mm) | 7,0 | 9 | 62 | 6 | 15 | |
| 9,0 | 8,7 | Ventrículo único, tipo atresia tricúspide. s/p fístula BT | 7,0 | 9 | 108 | 8 | 4 | 12 |
| 13,0 | 7,3 | s/p Norwood (Sano). ECMO pos-CEC previa | 7,0 | 9 | 58 | 8 | 11 | |
| 135,0 | 54 | VU con flujo pulmonar disminuido, sin intervención previa | 7,0 | 7 | 57 | 3 | 7 |
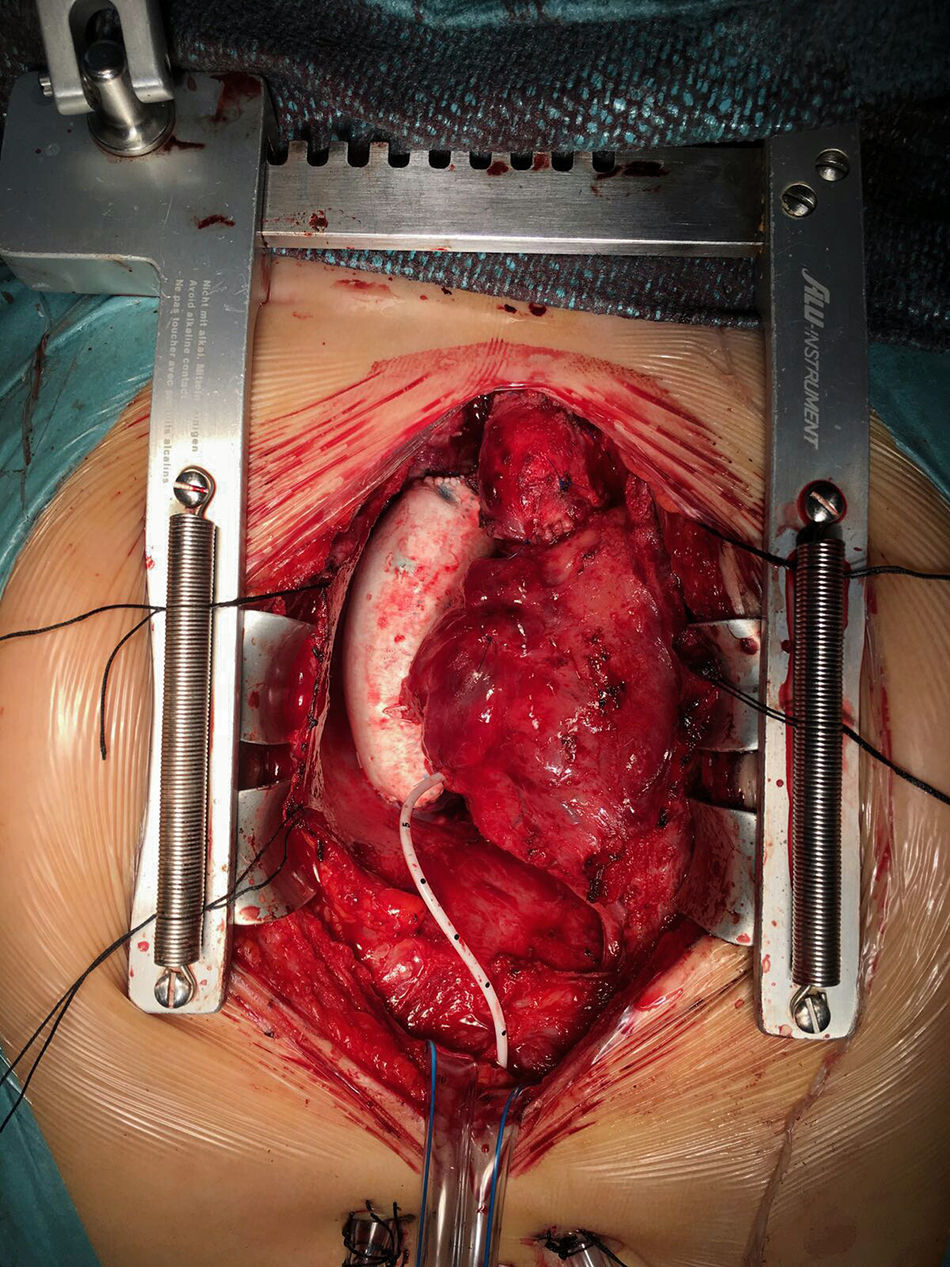
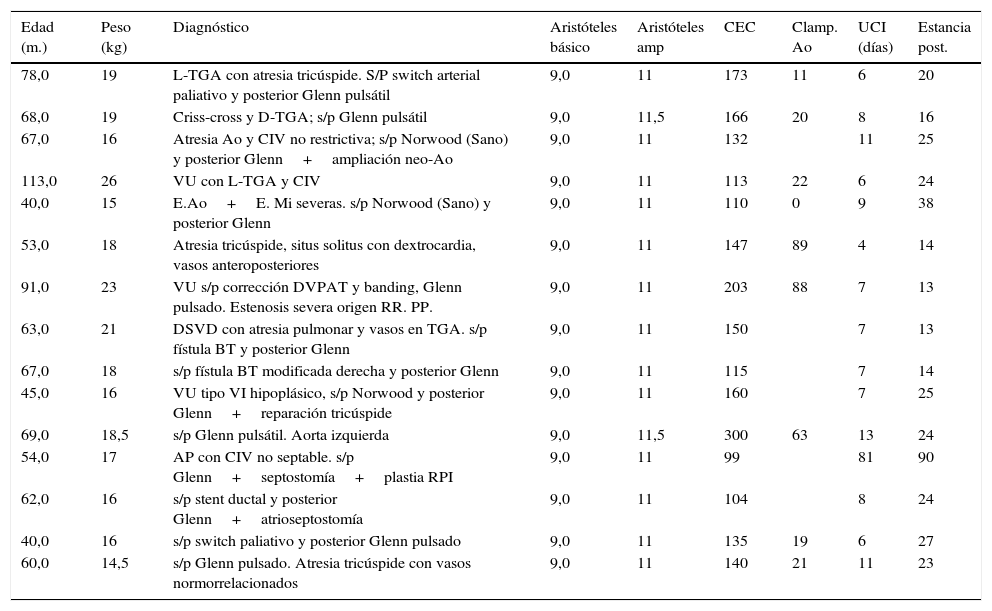
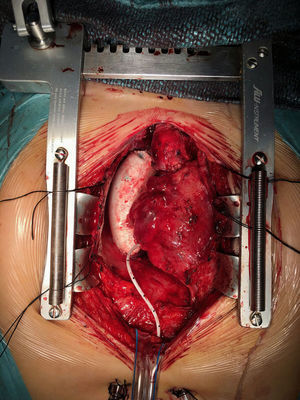
Durante este periodo, hemos intervenido a 15 pacientes (tabla 4) realizándose cirugía de Fontan. La técnica que realizamos es el túnel lateral con injerto de PTFE de 18-20mm de diámetro entre la VCI y la arteria pulmonar derecha (fig. 2). En la mayoría de los casos realizamos una fenestración de 3-4mm entre la cara lateral del injerto y la pared libre de la aurícula derecha. Únicamente no se realizó en 4 casos en los que los datos hemodinámicos preoperatorios eran muy favorables. Solo en 2 casos realizamos el Fontan intra-extracardiaco. En un paciente se trataba de un caso de atresia tricúspide, situs solitus con dextrocardia y vasos anteroposteriores. En otro paciente la anatomía era de vasos en L-TGA, dextrocardia y estenosis pulmonar severa.
Pacientes en estadio de Fontan
| Edad (m.) | Peso (kg) | Diagnóstico | Aristóteles básico | Aristóteles amp | CEC | Clamp. Ao | UCI (días) | Estancia post. |
|---|---|---|---|---|---|---|---|---|
| 78,0 | 19 | L-TGA con atresia tricúspide. S/P switch arterial paliativo y posterior Glenn pulsátil | 9,0 | 11 | 173 | 11 | 6 | 20 |
| 68,0 | 19 | Criss-cross y D-TGA; s/p Glenn pulsátil | 9,0 | 11,5 | 166 | 20 | 8 | 16 |
| 67,0 | 16 | Atresia Ao y CIV no restrictiva; s/p Norwood (Sano) y posterior Glenn+ampliación neo-Ao | 9,0 | 11 | 132 | 11 | 25 | |
| 113,0 | 26 | VU con L-TGA y CIV | 9,0 | 11 | 113 | 22 | 6 | 24 |
| 40,0 | 15 | E.Ao+E. Mi severas. s/p Norwood (Sano) y posterior Glenn | 9,0 | 11 | 110 | 0 | 9 | 38 |
| 53,0 | 18 | Atresia tricúspide, situs solitus con dextrocardia, vasos anteroposteriores | 9,0 | 11 | 147 | 89 | 4 | 14 |
| 91,0 | 23 | VU s/p corrección DVPAT y banding, Glenn pulsado. Estenosis severa origen RR. PP. | 9,0 | 11 | 203 | 88 | 7 | 13 |
| 63,0 | 21 | DSVD con atresia pulmonar y vasos en TGA. s/p fístula BT y posterior Glenn | 9,0 | 11 | 150 | 7 | 13 | |
| 67,0 | 18 | s/p fístula BT modificada derecha y posterior Glenn | 9,0 | 11 | 115 | 7 | 14 | |
| 45,0 | 16 | VU tipo VI hipoplásico, s/p Norwood y posterior Glenn+reparación tricúspide | 9,0 | 11 | 160 | 7 | 25 | |
| 69,0 | 18,5 | s/p Glenn pulsátil. Aorta izquierda | 9,0 | 11,5 | 300 | 63 | 13 | 24 |
| 54,0 | 17 | AP con CIV no septable. s/p Glenn+septostomía+plastia RPI | 9,0 | 11 | 99 | 81 | 90 | |
| 62,0 | 16 | s/p stent ductal y posterior Glenn+atrioseptostomía | 9,0 | 11 | 104 | 8 | 24 | |
| 40,0 | 16 | s/p switch paliativo y posterior Glenn pulsado | 9,0 | 11 | 135 | 19 | 6 | 27 |
| 60,0 | 14,5 | s/p Glenn pulsado. Atresia tricúspide con vasos normorrelacionados | 9,0 | 11 | 140 | 21 | 11 | 23 |
La edad media de los pacientes fue de 56 meses (40-113) meses. La mediana de puntuación de Aristóteles ampliado fue de 11 puntos. Los tiempos de CEC medios fueron de 128 min (99-300) y se realizó pinzamiento aórtico en 8 pacientes en los que hubo que asociar algún procediendo al Fontan (Fontan intra-extracardiaco, cierre de flujo anterógrado de un Glenn pulsado o plastia de ramas pulmonares). La mediana de estancia en UCIP fue de 7 (4-81) días y de hospitalización de 24 (14-90) días.
No hay ningún caso de mortalidad en este subgrupo del estudio. Las complicaciones en cuanto a morbilidad han venido derivadas tanto de la presencia de derrames quilosos como por los eventos trombóticos. Hubo dos casos de quilotórax recidivante. En uno de ellos, se produjo además un taponamiento cardiaco por un quilopericardio tabicado que necesitó reesternotomía para drenaje y liberación de adherencias. En el otro caso, se produjo un quilotórax derecho recidivante y resistente a tratamiento conservador. En este caso, se optó por realizar una reintervención para fenestrar el Fontan (fue un caso no fenestrado inicialmente) y en el mismo acto quirúrgico se realizó una pleurodesis con sellante tisular. A pesar de ello, el drenaje persistió, llegándose a realizar una linfografía para localizar el punto de efusión y embolización del conducto linfático torácico.
Un paciente presentó una trombosis aguda de vena cava inferior y parte del conducto extracardiaco, resuelta satisfactoriamente con tratamiento fibrinolítico y sin complicaciones posteriores.
DiscusiónLa morbimortalidad general a 30 días postoperatorios ha disminuido significativamente en la última década, incluso para procedimientos cada vez más complejos. Sin embargo, solo las fístulas sistémico-pulmonares siguen un patrón distinto, posiblemente debido a cambios en el tipo de pacientes que son sometidos a estos procedimientos, de la paliación de formas neonatales de tetralogía de Fallot hacia procedimientos con morfología de ventrículo único. En una reciente publicación, Dorobantu et al. han identificado aquellas formas de atresia pulmonar con septo íntegro y morfología de ventrículo único con estenosis pulmonar como factor independiente de mortalidad postoperatoria precoz. La mortalidad global se sitúa en el 6,5%6.
En nuestra serie, no encontramos ningún caso de mortalidad ni postoperatoria precoz ni en la espera hasta el segundo estado de la paliación.
En nuestro grupo, el acceso de elección para la realización de las fístulas es la esternotomía media, ya que nos permite, de un lado, mantener la ventilación de los dos pulmones (frente a la toracotomía) durante el procedimiento, y de otro lado, realizar la fistula de forma más central evitando estenosis de arterias lobares pulmonares. Además, este acceso también permite realizar la ligadura del ductus persistente. Todos los procedimientos excepto un paciente han sido realizados con circulación extracorpórea sin clamplaje aórtico. Precisamente este caso fue el que presentó una trombosis aguda de la fístula que requirió RCP y reapertura emergente del tórax en la unidad de cuidados intensivos pediátricos y posterior reintervención sobre la fístula. No obstante, la relación entre el uso de circulación extracorpórea y la morbimortalidad postoperatoria no resulta del todo aclarada7.
El manejo del síndrome de corazón izquierdo hipoplásico continúa siendo hoy día uno de los desafíos de la cirugía de las cardiopatías congénitas. Los resultados quirúrgicos de esta cardiopatía han mejorado de forma importante en los últimos años, lo cual puede atribuirse tanto a modificaciones en la técnica quirúrgica como a una mejor comprensión de los desafíos en el cuidado postoperatorio de los pacientes. Uno de los más importantes avances quirúrgicos ha sido la incorporación a la operación de Norwood de un conducto entre ventrículo derecho y arteria pulmonar o fístula de Sano. Esta modificación se asocia a una mayor estabilidad hemodinámica inmediata, mejor función ventricular y mayor sobrevida inmediata8. En nuestra serie, se ha realizado el procedimiento de Norwood-Sano en dos de los 5 pacientes. En uno de esos casos además, no se realizó de entrada. Fue una paciente con el diagnóstico de múltiples comunicaciones interventriculares (considerada no septable) con estenosis subaórtica en situación de hiperaflujo pulmonar y sin diagnóstico prenatal. Inicialmente se optó por realizar un procedimiento de Damus-Kaye-Stansel con fístula de Blalock-Taussing de 3,5mm. Tras esta cirugía la paciente necesitó soporte con ECMO y se procedió a realizar cateterismo cardiaco (bajando el soporte durante el estudio hemodinámico) y se demostró la presencia de un gradiente significativo (no presente en los estudios preoperatorios) a nivel del arco aórtico, por lo que se reinterviene completando la cirugía de Norwood y cambiando la fuente de flujo a una fístula de Sano para optimizar la oxigenación. En un estudio comparativo entre las dos fuentes de flujo pulmonar, se observó una supervivencia libre de trasplante a los 12 meses significativamente mayor en el grupo de Norwood-Sano respecto a la fístula BTM. Sin embargo, la sobrevida a más largo plazo no mostró diferencias significativas. Es muy probable que el flujo continuo hacia el pulmón generado por el BTM determine una menor presión diastólica aórtica, menor perfusión coronaria y aumento del QP/QS. Sin embargo, es necesario contar con estudios a más largo plazo para determinar posibles efectos deletéreos sobre la función del ventrículo derecho y remodelado del mismo de la ventriculotomía del conducto de Sano9.
En la actualidad, la mortalidad de la intervención de Norwood oscila según las publicaciones en torno al 20%10. El único caso de mortalidad en nuestra serie se localiza en este grupo y se trató de un paciente con shock séptico refractario a todas las medidas (incluso ECMO) en el postoperatorio precoz.
El siguiente periodo de alto riesgo tras el alta hospitalaria es el periodo comprendido entre la cirugía neonatal y la segunda paliación. La mortalidad en este periodo se sitúa entre el 10 y el 15% según las publicaciones. Cabe destacar que no hemos perdido ningún paciente en este periodo y todos los pacientes han alcanzado el estadio de Glenn tras el alta hospitalaria.
Tras la paliación inicial, la cirugía de Glenn es un paso intermedio antes de la paliación definitiva del Fontan, y aporta ventajas a la fistula sistémico-pulmonar del periodo neonatal, tales como el incremento de la saturación arterial de oxígeno y disminución de la sobrecarga del corazón que ocasiona una fístula sistémico-pulmonar. Supone una situación más estable antes del Fontan.
Desde la introducción de la cirugía de Fontan, sucesivos cambios han aportado ganancias importantes en términos de resultados de los pacientes con ventrículo único. Hasta tal punto, que se han publicado cifras de mortalidad tan destacables como del 1,2% sin ocurrir posteriormente mortalidad más allá de los primeros 30 días de postoperatorio. Las causas de mortalidad asociadas a la cirugía de Fontan son principalmente los eventos tromboembólicos, el síndrome de bajo gasto cardiaco y la presencia de derrames prolongados con fracaso de Fontan y necesidad de reintervención. Las estancias hopitalarias prolongadas pueden ocurrir frecuentemente en los pacientes sometidos a cirugía de Fontan y están relacionadas directamente con la persistencia de derrames. Estas efusiones prolongadas están presentes, según la bibliografía hasta en un 9% de los pacientes. Esta situación conlleva que hasta el 40% de los pacientes con derrames puede precisar reoperación, aumentando la estancia media en torno a 40 días sobre una estancia hospitalaria habitual de 12 días según las series11.
En nuestro caso, la estancia hospitalaria está influida por dos casos en los que la presencia de derrame pleural y pericárdico ha sido llamativa. Uno de los casos cursó con derrame pleural asociado a derrame pericárdico que no pudo ser drenado mediante pericardiocentesis percutánea ecoguiada. A pesar de optimizar tratamiento conservador, el paciente derivó a situación de taponamiento cardiaco y se intervino de urgencias. En la reintervención se comprobó la situación de quilopericardio con múltiples tractos de fibrina en pericardio que impidieron su drenaje percutáneo. La liberación de adherencias y desbridamiento de la cavidad pericárdica, así como de ambas cavidades pleurales resolvió el cuadro y permitió la buena evolución del paciente.
El otro caso que tuvo una estancia aún más prolongada (90 días de postoperatorio) fue igualmente un derrame pleural derecho prolongado.
Este caso, presentó en postoperatorio una trombosis de la desembocadura del conducto con oclusión de la rama pulmonar derecha y parcialmente izquierda con buena situación clínica. Se realizó fibrinólisis satisfactoria con rTPA, pero se mantuvo la situación de drenaje muy abundante y prolongado. Un nuevo cateterismo demostró presiones elevadas en territorio de Fontan (no tenía preoperatoria). Como era un Fontan no fenestrado, antes de considerar un fallo de Fontan, se procedió a los 30 días de postoperatorio inicial en las que las medidas conservadoras no fueron efectivas, a una reintervención del paciente para realizar una fenestración de 4mm del conducto a la pared de aurícula derecha así como a intentar una pleurodesis con sellante tisular de la cavidad pleural derecha. A pesar de ello, la situación de derrame pleural derecho persistó, y sospechando una lesión del conducto linfático torácico, se realizó una linfografía con vistas a embolizar el conducto torácico que fue finalmente efectiva para la buena evolución del paciente12.
Además de la trombosis presentada por este paciente, otro paciente intervenido de Fontan en la serie presentó trombosis de la vena cava inferior y parcialmente del conducto, igualmente resuelta con fibrinólisis sin complicaciones. La presencia de los fenómenos trombóticos se explica por la presencia de un material protésico extraño como fuente de eventos. Además, se ha encontrado cierta situación de hipercoagulabilidad con déficit de proteína C, S y antitrombina III, así como un aumento de la agregación plaquetaria13.
En nuestro grupo de pacientes, ningún paciente ha presentado cuadro de arritmia que haya requerido implantación de marcapasos epicárdico definitivo tras la cirugía de Fontan ni en el seguimiento hasta el momento, y no es política de nuestro grupo dejar electrodos epicárdicos permanentes de forma profiláctica.
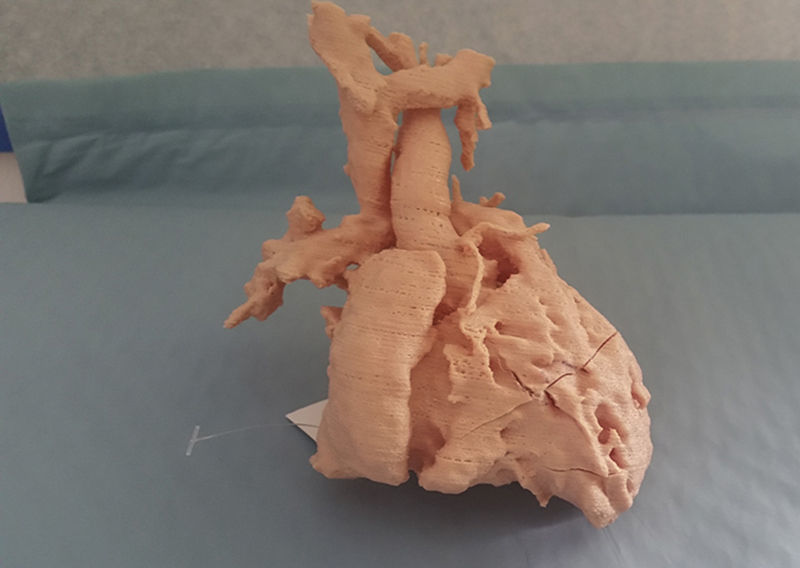
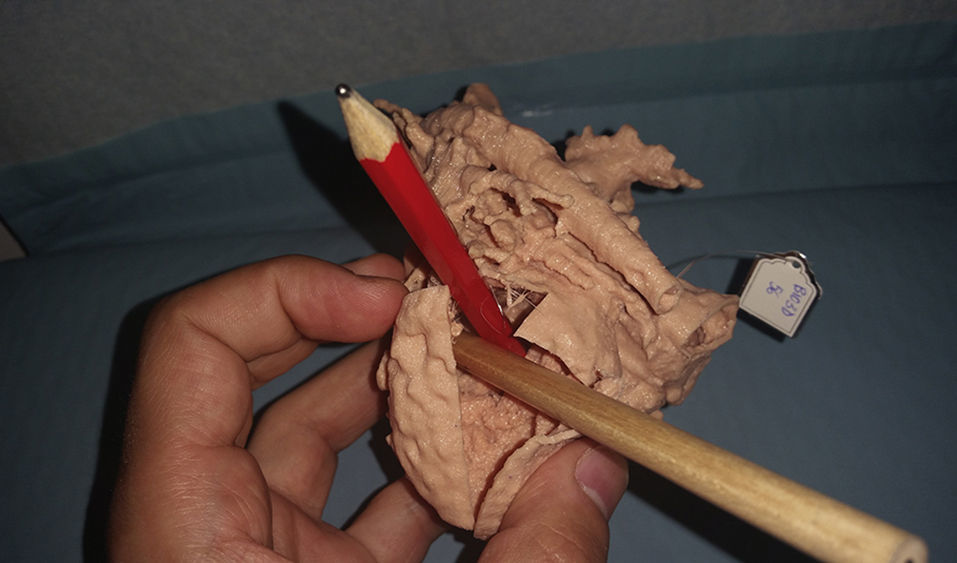
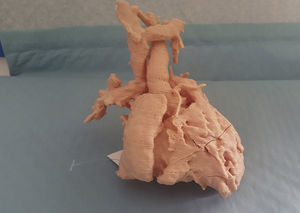
Como se ha expuesto al principio de este artículo, la vía univentricular no solo es aplicada a pacientes con una única cámara ventricular desarrollada adecuadamente, sino que es de aplicación a un grupo heterogéneo de casos en los que la separación anatómica de los dos ventrículos no es susceptible de ser realizada con garantías. La incorporación de nuevas tecnologías de imagen, como es la simulación 3D de modelos a escala real a partir de la información obtenida por resonancia magnética cardiaca, nos ha permitido recientemente reconducir un caso que, inicialmente fue considerado para vía univentricular. Se trata de un paciente con el diagnóstico de ventrículo izquierdo de doble salida con estenosis infundibular al tracto de salida derecho. En este caso, se realizó un Glenn junto con banding de arteria pulmonar. La inspección del modelo 3D nos ha permitido identificar correctamente la doble salida izquierda (hacia aorta e infundíbulo derecho) y planificar la cirugía que, en lugar de a un Fontan se ha reconducido a un rescate biventricular (figs. 3 y 4).
ConclusionesLa vía univentricular supone para el paciente una serie de intervenciones de alta complejidad y riesgo tanto de mortalidad como importante morbilidad asociada. Esta morbilidad, conlleva además una serie de procedimientos (cateterismos, pruebas de imagen, etc.) e, inexorablemente, reintervenciones que suponen un peaje elevado para estos pacientes. Sin embargo, el desarrollo de las técnicas actuales y la actuación de un equipo multidisciplinar coordinado e integrado permite alcanzar unos buenos resultados en cuanto a morbimortalidad.
En el mejor de los casos, se trata de paciente con un pronóstico de ser sometidos a 3 intervenciones de riesgo, todas ellas con carácter paliativo.
Por tanto, la mejora en métodos diagnósticos puede suponer la reconducción a una fisiología biventricular cuando las condiciones técnicas y anatómicas lo permitan, mejorando así el pronóstico a largo plazo de estos pacientes.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni animales.
Confidencialidad de los datosLos autores declaran que en este artículo no aparecen datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Este artículo se corresponde con una comunicación que optó a premio en el Congreso de la SECTCV en junio de 2016.