El tumor retroperitoneal con extensión a la vena cava inferior (VCI) más frecuente es el carcinoma de células renales. Tiene una supervivencia a 5 años de hasta un 32% cuando se realiza nefrectomía radical y trombectomía. El tratamiento quirúrgico es complejo y puede necesitar el soporte de circulación extracorpórea y parada circulatoria e hipotermia.
MétodosEstudio descriptivo, retrospectivo, mediante análisis de datos de pacientes intervenidos de tumores con invasión de la VCI entre 1992 y 2015. Se recogieron datos demográficos, tumorales, de técnica quirúrgica, intraoperatorios, posquirúrgicos y de mortalidad. Las variables cuantitativas se presentan como media±desviación estándar y las cualitativas como número de casos. La supervivencia se registró por curvas de Kaplan-Meier.
ResultadosSe presentan 18 pacientes con tumores retroperitoneales (carcinoma de células renales 66%) con extensión a VCI. Se utilizó circulación extracorpórea en 13casos y paro circulatorio en 5. Doce pacientes tuvieron un aumento de creatinina >0,3mg/dl sin precisar terapias de sustitución renal. La estancia en la Unidad de Cuidados Críticos fue de 2,8±2 días. La supervivencia media fue de 791±633 días, con una mortalidad a los 30 días del 11% y a los 5 años del 72%.
ConclusionesEl tumor con extensión a VCI presenta un desafío quirúrgico. La supervivencia a corto plazo es elevada; a largo plazo es limitada por el proceso neoplásico.
The most frequent tumor located at the inferior vena cava (IVC) is renal cell carcinoma. When radical nephrectomy and thrombectomy is performed, survival is 32%. It is a complex surgery that may require extracorporeal circulation support and hypothermic circulatory arrest.
MethodsRetrospective descriptive study via data analysis of patients operated on tumors with IVC invasion within 1992 and 2015. The data collected included demographic, tumor, surgical technique, intraoperative, post-surgical and mortality date. The quantitative variables are presented as mean±standard desviation, and the qualitative variables as number of cases. Survival has been registred by means of the Kaplan-Meier curves.
ResultsWe present 18 patients with IVC tumor extension (renal cell carcinoma 66%). The extracorporeal circulation was used in 13 of the cases and circulatory arrest in 5. Twelve patients showed an increase in creatinine>0.3mg/dl without requiring renal replacement therapy. The stay in Intensive Care Unit was 2.8±2 days. The mean survival rate was 791±633 days, with a 30-day mortality rate of 11% and a 5-year mortality rate of 72%.
ConclusionsTumors with IVC extension are a rare pathology that poses a surgical challenge and requires a multidisciplinary team for its management. Short-term survival is high, being limited by the neoplastic process in the long term.
Existen diferentes tumores abdominales con posibilidad de extensión a la vena cava inferior (VCI), como el carcinoma suprarrenal, carcinoma de pelvis renal, leiomiosarcoma de partes blandas, hepatocarcinoma, tumor de ovario y testículo, feocromocitoma, tumor de Wilms, el angiomiolipoma1 y, sobre todo, el carcinoma de células renales2 (CCR).
Los tumores cardíacos malignos son poco frecuentes y la mayoría son metastásicos, con una incidencia unas 20-40 veces mayor que la de los tumores primarios3. Una de las vías de presentación de tumores cardíacos es la progresión del trombo tumoral a través de la VCI4.
El CCR corresponde al 3-4% de todas las neoplasias y es más frecuente en varones entre 60 y 80 años. Los factores de riesgo más frecuentes son el tabaco, la obesidad y la hipertensión arterial. Presenta 5tipos histológicos: células claras (75%), tumores cromofílicos o papilares (15%), células poligonales largas, oncocitoma renal y carcinoma de células colectoras. Las metástasis más frecuentes son las pulmonares (75%). La mediana de supervivencia para la enfermedad metastásica es de 13 meses5. El CCR se extiende hacia la vena renal en un 20-35% de los casos1 y hacia la VCI en un 5-10% de los casos6, con una supervivencia a los 5años de hasta un 32% cuando se realiza nefrectomía radical y trombectomía de la VCI7. La tendencia natural de los trombos tumorales es a crecer en sentido centrípeto, a favor de los factores físicos que suponen la corriente sanguínea y el efecto de succión de la aurícula derecha. La supervivencia empeora a medida que el tumor infiltra mayor territorio venoso8.
En 1913 se describió por primera vez la realización de una nefrectomía con cavotomía en un tumor renal9. Desde entonces se han desarrollado múltiples técnicas con resultados desalentadores. En 1972 se consiguió la curación de los pacientes mediante la extirpación completa del tumor y del trombo10, con un aumento de las tasas de supervivencia en los últimos años.
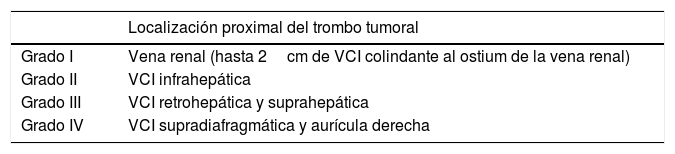
El tratamiento quirúrgico de los tumores con invasión de VCI no metastásicos se considera actualmente como la primera medida terapéutica11. La técnica quirúrgica en estos casos es compleja y depende del nivel al que se sitúe el extremo cefálico del trombo1. Actualmente, la clasificación más aceptada aplicada a CCR es la de Neves-Zincke1 (tabla 1). En los grados I y II, la trombectomía y exéresis tumoral se puede lograr de forma sencilla. En los grados III y IV la técnica es más compleja, especialmente si se necesita extirpar pared de la VCI retrohepática o suprahepática; incluso algunas veces, se requiere un abordaje combinado desde la aurícula derecha. En estas ocasiones, se puede utilizar la circulación extracorpórea (CEC) con o sin parada circulatoria e hipotermia8,12 (HCA). La HCA permite obtener una óptima visualización del trombo tumoral con una mejor resección13 y reconstrucción vascular. No obstante, la necesidad de CEC no es unánime en la literatura14,15.
Clasificación de Neves y Zincke1
| Localización proximal del trombo tumoral | |
|---|---|
| Grado I | Vena renal (hasta 2cm de VCI colindante al ostium de la vena renal) |
| Grado II | VCI infrahepática |
| Grado III | VCI retrohepática y suprahepática |
| Grado IV | VCI supradiafragmática y aurícula derecha |
VCI: vena cava inferior.
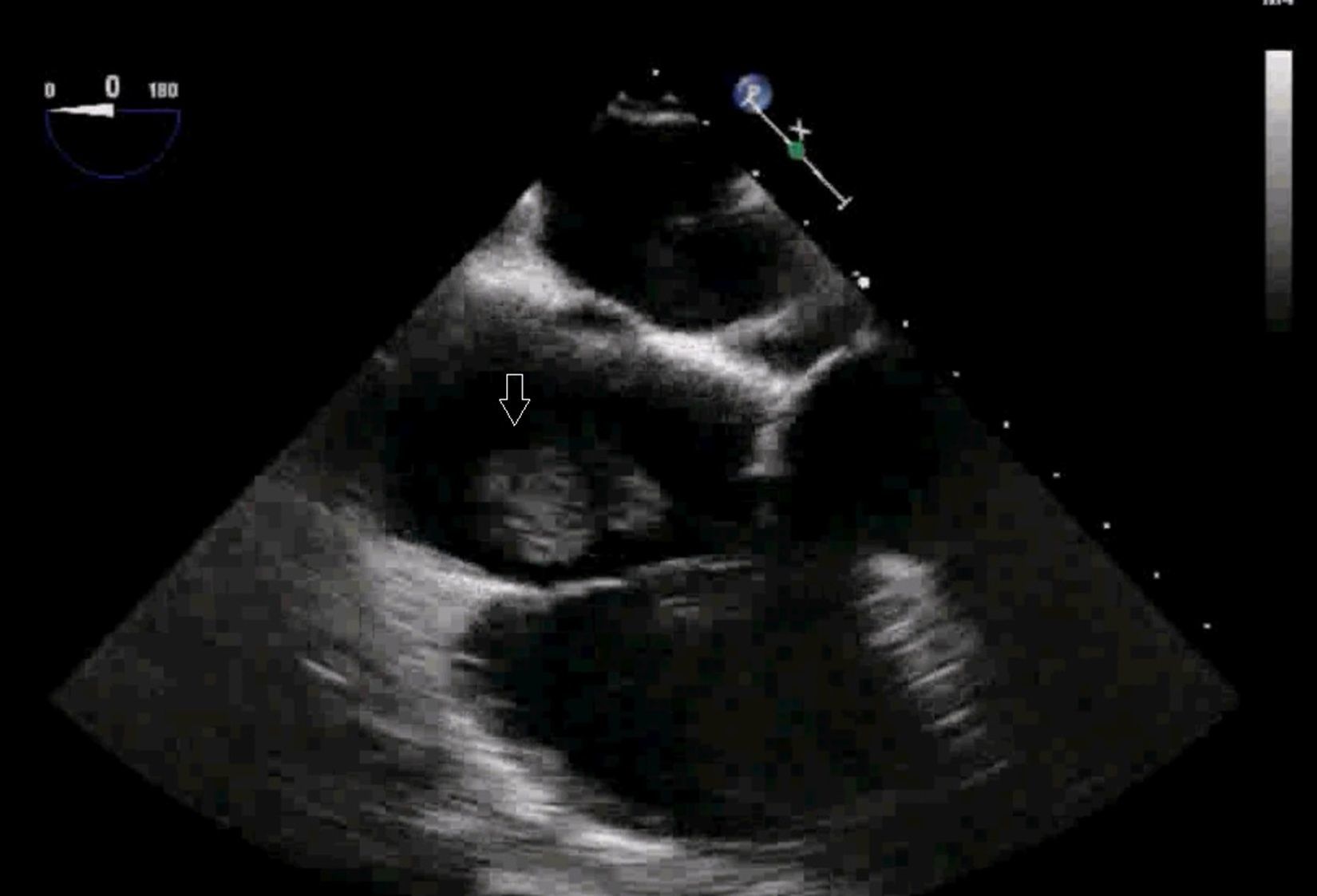
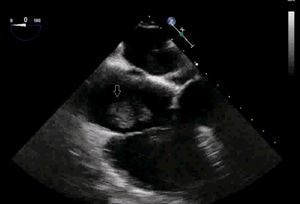
El uso de la ecocardiografía transesofágica (ETE) intraoperatoria permite detectar la migración de trombos a VCI y cavidades cardíacas (fig. 1, vídeos 1, 2 y 3) y apoya la decisión sobre la técnica quirúrgica y el modo de perfusión16.
El objetivo de este trabajo es analizar los tumores retroperitoneales con extensión endoluminal (trombo tumoral) en la VCI a la altura de las venas renales o por encima de ellas tratados por el Servicio de Cirugía Cardiovascular. Se analizan las características de los pacientes, la técnica quirúrgica y los resultados precoces y evolutivos.
MétodosSe realiza un estudio descriptivo y retrospectivo mediante análisis de datos obtenidos de las historias clínicas de los pacientes intervenidos de tumores retroperitoneales con extensión a VCI yuxtarrenal o superior, entre los años 1992 y 2015 por el Servicio de Cirugía Cardíaca del Hospital General Universitario de Valencia y el Servicio de Cirugía Cardiovascular del Hospital Clínico Universitario de Valencia. El estudio ha sido autorizado por el Comité de Ética del Hospital General Universitario de Valencia.
Se recogieron las características de los pacientes (sexo, edad, peso, talla), antecedentes personales, datos del tumor (extensión del trombo por clasificación de Neves-Zincke, afectación de vena renal y de VCI, histología), técnica quirúrgica empleada, necesidad y duración de CEC y de parada circulatoria, transfusión intraoperatoria, daño renal postoperatorio (incremento de cifras de creatinina superior a 0,3mg/dl17), tiempo de ventilación mecánica postoperatoria (se consideró extubación precoz si era antes de las 6h del postoperatorio), días de estancia en la Unidad de Cuidados Críticos (UCC), reintervención por sangrado, mortalidad (en los 30 primeros días y a los 5años) y tiempo de supervivencia.
Análisis estadísticoLas variables cuantitativas se presentan como media±desviación estándar o mediana con intervalos de confianza, según corresponda. Las variables cualitativas se presentan como número de casos. La supervivencia global se ha calculado utilizando el método de Kaplan-Meier y se expresa como porcentaje.
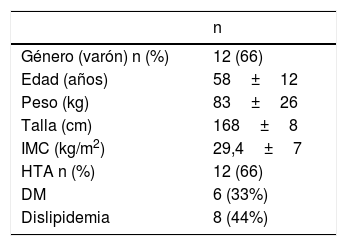
ResultadosSe analizan 18 pacientes. Las características demográficas y los antecedentes se muestran en la tabla 2. La mayoría fueron varones (66%) y la edad media fue de 58±12 años. Las comorbilidades más frecuentes fueron el sobrepeso (IMC 29,4±7kg/m2) y la hipertensión arterial. La exploración con tomografía computarizada con reconstrucción 3D o la resonancia magnética fue empleada para definir el estadio tumoral y el nivel del trombo en VCI.
El abordaje quirúrgico (tabla 3) dependió del grado de Neves-Zincke. En todos los casos el abordaje abdominal se realizó a través de una laparotomía media xifopúbica, que se amplió a una esternotomía media en caso de necesidad de CEC.
Características quirúrgicas y mortalidad
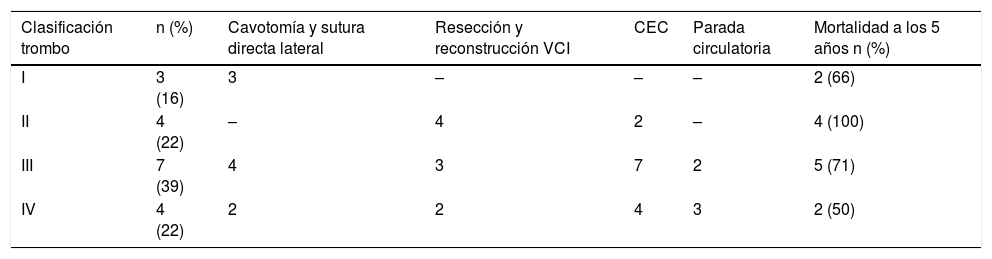
| Clasificación trombo | n (%) | Cavotomía y sutura directa lateral | Resección y reconstrucción VCI | CEC | Parada circulatoria | Mortalidad a los 5 años n (%) |
|---|---|---|---|---|---|---|
| I | 3 (16) | 3 | – | – | – | 2 (66) |
| II | 4 (22) | – | 4 | 2 | – | 4 (100) |
| III | 7 (39) | 4 | 3 | 7 | 2 | 5 (71) |
| IV | 4 (22) | 2 | 2 | 4 | 3 | 2 (50) |
CEC: circulación extracorpórea; VCI: vena cava inferior.
En 3pacientes que presentaban un nivel I se procedió al control de la VCI proximal y distal al trombo y la vena renal contralateral y se realizó nefrectomía radical con cavotomía y extracción del trombo tumoral. En caso de infiltración o fijación del trombo en la desembocadura de la vena renal en la VCI, se procedió a la resección limitada de la cara lateral de la cava y a la sutura directa lateral.
Cuatro pacientes presentaban un nivel II. Se realizó control previo del pedículo hepático, VCI infradiafragmática por encima del hilio hepático e infrarrenal, nefrectomía y cavotomía. En todos ellos se realizó resección parcial de VCI infiltrada y sustitución por parche de pericardio bovino. En 2de los casos fue necesario el empleo de CEC.
En el resto de los pacientes, 7 con un nivel III y 4con un nivel IV, debido a la extensión del tumor se planificó desde el inicio la necesidad de utilizar CEC. En primer lugar, se procedió al acceso abdominal con disección tumoral sin manipulación de la VCI y del resto de las estructuras vasculares con el fin de evitar un posible desprendimiento del trombo. En una segunda fase se procedió a la ampliación de la herida a una esternotomía media y al establecimiento de la CEC, con especial cuidado en la canulación venosa para evitar el desprendimiento del trombo. La HCA se empleó en 5pacientes, 3con grado IV y 2con grado III. La duración de la CEC fue muy variable (tiempo medio de CEC 95±42 min). Los tiempos de HCA fueron 24±11 min. La reparación de la VCI consistió en la sutura directa de la VCI en 6pacientes y en otros 5se realizó resección con sustitución por un parche de pericardio (bovino). En un caso se asoció trombectomía pulmonar por embolia pulmonar derecha. Se monitorizaron con ETE sin observarse en ningún caso la migración trombótica intraoperatoria.
Presentaron infiltración de la vena cava 5pacientes, 4de ellos del grado II y uno del grado IV. La resección con sustitución por un parche de pericardio se realizó para evitar la estenosis de la VCI tras la resección del ostium de la vena renal.
La anatomía patológica del tumor fue la siguiente: tumor renal de células claras en 12 casos (66%), carcinoma renal papilar en 2 (11,5%), leiomiosarcoma en 2 (11,5%), feocromocitoma en uno (5,5%) y metástasis en otro (5,5%).
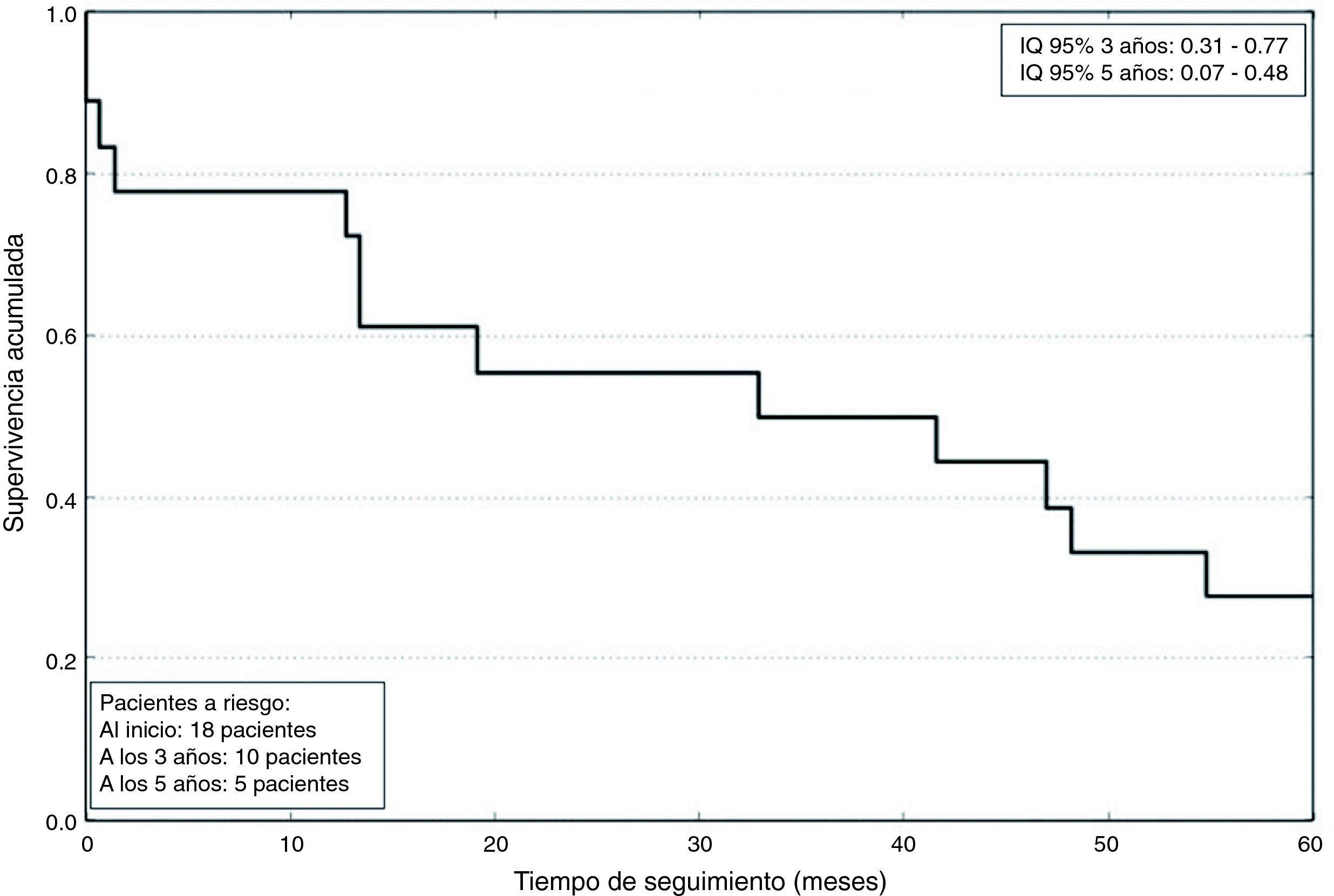
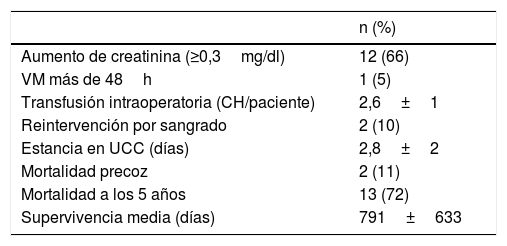
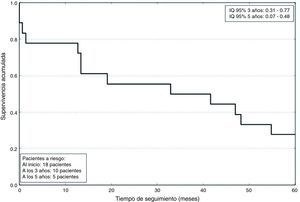
Los datos postoperatorios se resumen en la tabla 4. La estancia en UCC fue de 2,8±2 días. La mortalidad a los 5años fue de un 72%, con una supervivencia media de 791±633 días, como se refleja en la figura 2. La mortalidad asociada a cada grado de Neves-Zincke se resume en la tabla 3. Dos de los pacientes fallecieron en el postoperatorio precoz (30 días de la cirugía), uno de ellos por un shock hemorrágico en el postoperatorio inmediato y el otro a los 21 días por insuficiencia respiratoria aguda. La extubación fue precoz en 17 pacientes y un paciente desarrolló un síndrome de distrés respiratorio que retrasó su extubación hasta el sexto día. Dos pacientes fueron reintervenidos de urgencia por sangrado. Doce de los pacientes presentaron aumento de las cifras basales de creatinina superior a 0,3mg/dl, aunque ninguno de ellos precisó terapias de depuración extrarrenal durante su estancia en la UCC.
Complicaciones perioperatorias y seguimiento
| n (%) | |
|---|---|
| Aumento de creatinina (≥0,3mg/dl) | 12 (66) |
| VM más de 48h | 1 (5) |
| Transfusión intraoperatoria (CH/paciente) | 2,6±1 |
| Reintervención por sangrado | 2 (10) |
| Estancia en UCC (días) | 2,8±2 |
| Mortalidad precoz | 2 (11) |
| Mortalidad a los 5 años | 13 (72) |
| Supervivencia media (días) | 791±633 |
CH: concentrados de hematíes; UCC: Unidad de Cuidados Críticos; VM: ventilación mecánica.
Los tumores retroperitoneales con extensión a VCI son una entidad poco frecuente pero que representa un desafío quirúrgico y que precisa un equipo multidisciplinar para el manejo perioperatorio18–20. La supervivencia a corto plazo de estos pacientes es elevada y la supervivencia a largo plazo está limitada por la evolución del proceso neoplásico.
La presencia de trombo tumoral en la VCI se asocia a una menor supervivencia en el CCR. El nivel del trombo tumoral está en clara controversia como factor pronóstico independiente de supervivencia, con estudios tanto a favor18,20 como en contra21,22. No obstante, la evaluación preoperatoria de la extensión proximal del trombo es importante para la planificación de la estrategia quirúrgica1,21,23. La resonancia magnética tradicionalmente se ha considerado como el patrón oro de esta evaluación, pero en la actualidad se considera que la tomografía computarizada puede tener una precisión comparable24.
La clasificación de Neves-Zincke1 divide la extensión craneal del trombo en 4niveles. En los niveles I y II, la técnica quirúrgica implica el control proximal y distal de la VCI y de la vena renal contralateral25. Históricamente, en los niveles III y IV se han empleado las técnicas de derivación cardiopulmonar y parada circulatoria con hipotermia profunda26; no obstante, hay grupos que defienden la realización de la cirugía sin el empleo de CEC14,15, con una disminución del riesgo de coagulopatías y de alteraciones neurológicas. El uso de CEC depende de la experiencia del equipo quirúrgico. En nuestra serie se ha empleado la CEC en 13 casos, 2con un nivel II de Neves-Zincke, 7 con un nivel III y 4con un nivel IV. Se realizó HCA en 2pacientes con nivel III y en 3pacientes con nivel IV. El paciente con tiempo de CEC más prolongado (130 min) presentó una coagulopatía de consumo y politransfusión.
Uno de los parámetros que clásicamente afecta al pronóstico es la infiltración tumoral de la vena cava27. Es por ello por lo que el diagnóstico de afectación vascular es primordial. Aunque en ocasiones las pruebas preoperatorias habituales no sean capaces de diagnosticarla, la invasión se confirma durante la intervención quirúrgica y el estudio anatomopatológico de la pared venosa. Tanto la TAC multicorte como la resonancia magnética contribuyen a un diagnóstico preciso de la localización del trombo tumoral y pueden ayudar en el estudio de la infiltración de la pared de la vena cava28. La infiltración de la pared de la vena cava requiere la resección total o parcial de algún segmento de la pared29 con posterior reconstrucción, de forma que se obtengan unos márgenes libres de enfermedad y una vena permeable sin estenosis residual significativa.
La mortalidad a los 5 años de nuestros pacientes se sitúa en un 72%. En otras series que solo incluyen CCR, la mortalidad es del 70%8. Ninguno de los 5pacientes (4 de ellos con grado II en la escala de Neves-Zincke) que presentaban infiltración de la pared de la VCI sobrevivieron a los 5 años. Por otro lado, al menos en los CCR, la supervivencia cercana al 30% a los 5 años de esta enfermedad neoplásica avanzada supone una gran mejoría respecto a la alternativa de no intervenir, en cuyo caso la mortalidad sería del 100%6.
La mortalidad perioperatoria precoz, hasta los 30 días postoperatorios, de nuestra serie ha sido de 2casos, uno a las 12 h de la cirugía por un shock hemorrágico y el otro a los 21 días de la intervención a causa de un deterioro respiratorio en la sala de hospitalización, dato este algo superior a otras series, con una mortalidad perioperatoria del 2-5%8,30. Un tercer paciente falleció a los 42 días en su domicilio. El resto de los fallecimientos han sido por la progresión de la enfermedad neoplásica.
La migración del trombo hacia el corazón durante la intervención puede tener consecuencias fatales si no se reconoce y se trata de forma precoz. Para evitar la embolización pulmonar, se han empleado en ocasiones filtros venosos, aunque su uso es controvertido. La ETE se utiliza para el diagnóstico precoz de esta complicación durante el procedimiento31 como método de monitorización continua que permite la visualización del trombo y evita las complicaciones hemodinámicas y la alteración en la relación ventilación-perfusión que puede ocasionar su migración32. En nuestra serie se monitorizaron con ETE los 11 pacientes con grado III y IV para evaluar de forma dinámica el compromiso intraauricular del tumor. No se observó en ningún caso la migración trombótica intraoperatoria.
Administramos enoxaparina profiláctica (40mg subcutánea cada 24 h) a las 24 h de la intervención si se había empleado CEC o a las 6 h en caso de no emplearla, junto con 100mg de ácido acetilsalicílico a partir del día siguiente de la intervención para evitar las complicaciones trombóticas y embólicas19. En nuestra serie no se observaron eventos trombóticos en la UCC, aunque no se dispone de datos tras el alta del paciente de esta unidad.
La morbimortalidad quirúrgica en los pacientes transfundidos, en general, se ha demostrado que es más elevada que en los no transfundidos33. Este aumento se debe al daño pulmonar ocasionado por la transfusión, reacciones hemolíticas, edema pulmonar, riesgo de contraer el virus de la hepatitis C y de la inmunodeficiencia humana, riesgo de nuevos patógenos emergentes e incluso recurrencia de cáncer34. El uso de dispositivos de recuperación de sangre en pacientes neoplásicos es controvertido porque, aunque disminuyen la transfusión y en algunas publicaciones no observan un mayor riesgo de diseminación tumoral35, en otras series se incide en la importancia del hallazgo de células tumorales en el lecho quirúrgico36. Tampoco se ha conseguido demostrar el incremento de la mortalidad a largo plazo37 ocasionado por la embolia cancerígena secundaria al empleo de la CEC38. En nuestra serie, un 50% de los pacientes precisaron concentrados de hematíes (media 2,6±1). La administración de eritropoyetina preoperatoria para reducir la necesidad de transfusiones sanguíneas no aumenta los efectos adversos en una revisión sistemática39, aunque no hay datos concluyentes que demuestren que su uso mejore la supervivencia global.
Este estudio supone una revisión retrospectiva, por lo que puede presentar ciertos sesgos y limitaciones. Por una parte, los datos de ciertas complicaciones pueden estar limitados por los datos disponibles en las historias clínicas y bases de datos. Además, el hecho de que la serie sea pequeña puede sesgar tanto la supervivencia como las complicaciones derivadas de la intervención. No se ha incluido información de tratamientos oncológicos adicionales (quimioterapia, radioterapia) que puedan haber influido en la evolución. Se han analizado todos los casos estadísticamente de manera conjunta40 debido a la pequeña muestra, si bien es posible que los comportamientos biológicos de los diferentes tumores sean diferentes y sea más adecuado un análisis por subgrupos.
Concluimos que el tratamiento quirúrgico de los tumores retroperitoneales con extensión a VCI se beneficia de un abordaje multidisciplinar. El uso de CEC es muy útil en los grados III y IV de Neves-Zincke, asociado incluso a la HCA para facilitar la resección del tumor. La ETE intraoperatoria confirma el nivel del trombo tumoral en la VCI y permite la detección de fenómenos embolígenos durante el acto quirúrgico. Esta cirugía consigue una supervivencia elevada a corto plazo, aunque la supervivencia a largo plazo está limitada por la evolución propia del tumor: es la infiltración de la pared de la VCI la que marca un peor pronóstico.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores declaran que en este artículo no aparecen datos de pacientes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.