El carcinoma de células renales con trombo tumoral en la vena cava inferior supone un desafío quirúrgico debido a su complejidad y potenciales riesgos. Describimos nuestro método para el manejo quirúrgico con derivación cardiopulmonar y analizamos los resultados quirúrgicos y oncológicos.
MétodosEstudio retrospectivo de una serie de pacientes tratados mediante nefrectomía con trombectomía por trombo en la vena cava inferior de nivel III y IV, desde 2010 hasta 2024. Se recogieron características demográficas, prequirúrgicas, tumorales, intraoperatorias y postoperatorias.
ResultadosFueron analizados 31 pacientes. En 16 pacientes (51%) el nivel del trombo estaba por encima de las suprahepáticas o a nivel de la aurícula derecha. La mediana de seguimiento fue de 9,36 meses (5,27-40,2). El nivel del trombo o el estadio patológico no influyeron significativamente en el tiempo quirúrgico. Un paciente falleció intraoperatoriamente por complicación y 3 pacientes en el postoperatorio inmediato. En la mortalidad al mes influyó de forma significativa el tiempo en parada (p=0,041) y las comorbilidades de Charlson (p=0,043) y en la mortalidad a los 3 meses solo influyó significativamente el tiempo en parada (p=0,00904). Un nivel del trombo por encima de suprahepáticas o a nivel de aurícula derecha (p=0,03) y un estadio patológico T3cG3-4 (p=0,003) y los T4G3 (p=0,018) influyeron de forma significativa en una peor supervivencia específica del cáncer. La mediana de supervivencia estimada fue de 1,8 años.
ConclusionesNuestra técnica de parada circulatoria con perfusión cerebral anterógrada nos permite trabajar con más calidad y seguridad, con nulas complicaciones cerebrales en nuestra serie y buenos resultados oncológicos.
Renal cell carcinoma (RCC) with tumor thrombus in inferior vena cava is a surgical challenge due to its complexity and potential risks. We describe our approach to surgical management with cardio-pulmonary bypass, analyzing surgical and oncological outcomes.
MethodsRetrospective study of a series of patients undergoing nephrectomy with thrombectomy for inferior vena cava thrombus level III and IV, from 2010 to 2024. Demographic, preoperative, tumor, intra- and postoperative characteristics were collected.
ResultsThirty-one patients were analyzed. In 16 patients (51%) the thrombus level was above the suprahepatic or right atrium level. The median follow-up was 9.36 months (5.27-40.2). Thrombus level or pathologic stage did not significantly influence operative time. One patient died intraoperatively due to complications and 3 patients in the immediate postoperative period. Mortality at one month was significantly influenced by downtime (P=0.041) and Charlson comorbidities (P=0.043), and mortality at 3 months was significantly influenced only by downtime (P=0.00904). Thrombus level above the suprahepatic or right auricular level (P=0.03), and pathological stage T3cG3-4 (P=0.003) and T4G3 (P=0.018) significantly influenced worse cancer-specific survival. The median estimated survival was 1.8 years.
ConclusionsOur technique of circulatory arrest with antegrade cerebral perfusion allows us to work with more quality and safety with no brain complications in our series and good oncological results.
Según estimaciones del año 2024, el carcinoma de células renales (CCR) representa el 4,1% de todos los cánceres nuevos diagnosticados y el 2,4% de todas las muertes por cáncer, según la base de datos del National Cancer Institute SEER1.
El CCR es uno de los cánceres urológicos más letales, con una supervivencia relativa a 5 años del 75,2%1. Tiene tendencia a invadir el sistema venoso renal y formar un trombo tumoral que puede extenderse a la vena cava inferior (VCI) (4-10%); en el 1% de los casos llega a extenderse hasta la aurícula derecha2,3.
El CCR con trombo en la VCI no se asocia necesariamente con un peor pronóstico. En algunos estudios se han demostrado tasas de supervivencia a 5 años del 32% al 68% para pacientes con trombo tumoral en ausencia de metástasis, después de un tratamiento quirúrgico intensivo, en los que el nivel del trombo era independiente del pronóstico2,4. Sin tratamiento, la supervivencia específica del cáncer a un año es inferior al 29%5.
A pesar de los resultados alentadores de la nefrectomía con trombectomía en pacientes seleccionados, este procedimiento a menudo resulta en una morbimortalidad significativa, con tasas de mortalidad de hasta el 40% en pacientes con trombo que se extiende por encima del diafragma6,7. En pacientes de mayor riesgo no considerados inicialmente para cirugía radical, la disponibilidad de la nueva terapia dirigida (como los inhibidores de puntos de control inmunitario y las terapias dirigidas contra el factor de crecimiento endotelial vascular) han proporcionado una posible alternativa estratégica8.
El objetivo del estudio fue evaluar a los pacientes intervenidos mediante cirugía con trombo en la vena cava de nuestra Unidad de Gestión Clínica de Urología en un hospital de tercer nivel, describir la técnica que empleamos y los resultados conseguidos, tanto quirúrgicos como oncológicos.
MétodosDiseño del estudioSe realizó un estudio retrospectivo de pacientes con CCR y trombo en VCI de nivel III o IV intervenidos de nefrectomía radical con trombectomía desde junio de 2010 hasta mayo de 2024. El nivel del trombo fue definido según la clasificación de la Clínica Mayo9. Todos los pacientes fueron operados con la colaboración de cirugía cardiovascular.
Recogida de datosLos datos de seguimiento se obtuvieron de los registros clínicos digitalizados (Millennium) de nuestro hospital. Se excluyó a los pacientes que habían recibido neoadyuvancia.
VariablesSe recogieron variables demográficas, prequirúrgicas, tumorales, intraoperatorias y postoperatorias.
Análisis estadísticoPara el análisis de datos, las variables categóricas se expresan como frecuencias y las continuas como media (desviación estándar) o mediana (cuartiles). Se utilizó una regresión de Cox para evaluar la influencia de la presencia de márgenes en la metástasis y recidiva regional. Para estimar la magnitud de la relación entre el tiempo quirúrgico y la embolización previa, se utilizó una regresión lineal, al igual que para ver la relación entre los concentrados transfundidos intraoperatorio y la embolización previa. Para ver las diferencias entre los grupos de mortalidad se utilizó la prueba de Fisher para las variables categóricas y la U de Mann Whitney para las continuas. El programa empleado fue R Core Team 2024, versión 4.4.1.
Técnica quirúrgicaNuestro objetivo es entrar en circulación extracorpórea (CEC) y realizar parada circulatoria total con protección cerebral anterógrada (PAC) a través del tronco arterial braquiocefálico derecho (TABD), perfundiendo por la arteria axilar derecha (AAD) o por el TABD directamente y, durante el tiempo de PAC, crear la apertura de la VCI y extraer el trombo tumoral sin pérdida de sangre.
Monitorización añadida además de la habitual en cualquier CEC:
- •
Dos líneas de presión arterial contralaterales.
- •
BIS® para monitorizar la actividad eléctrica cerebral y de la profundidad de la anestesia.
- •
INVOS de Somanetics®, para monitorización de la perfusión cerebral.
- •
Monitorizamos la temperatura corporal en la línea de retorno venoso de la CEC.
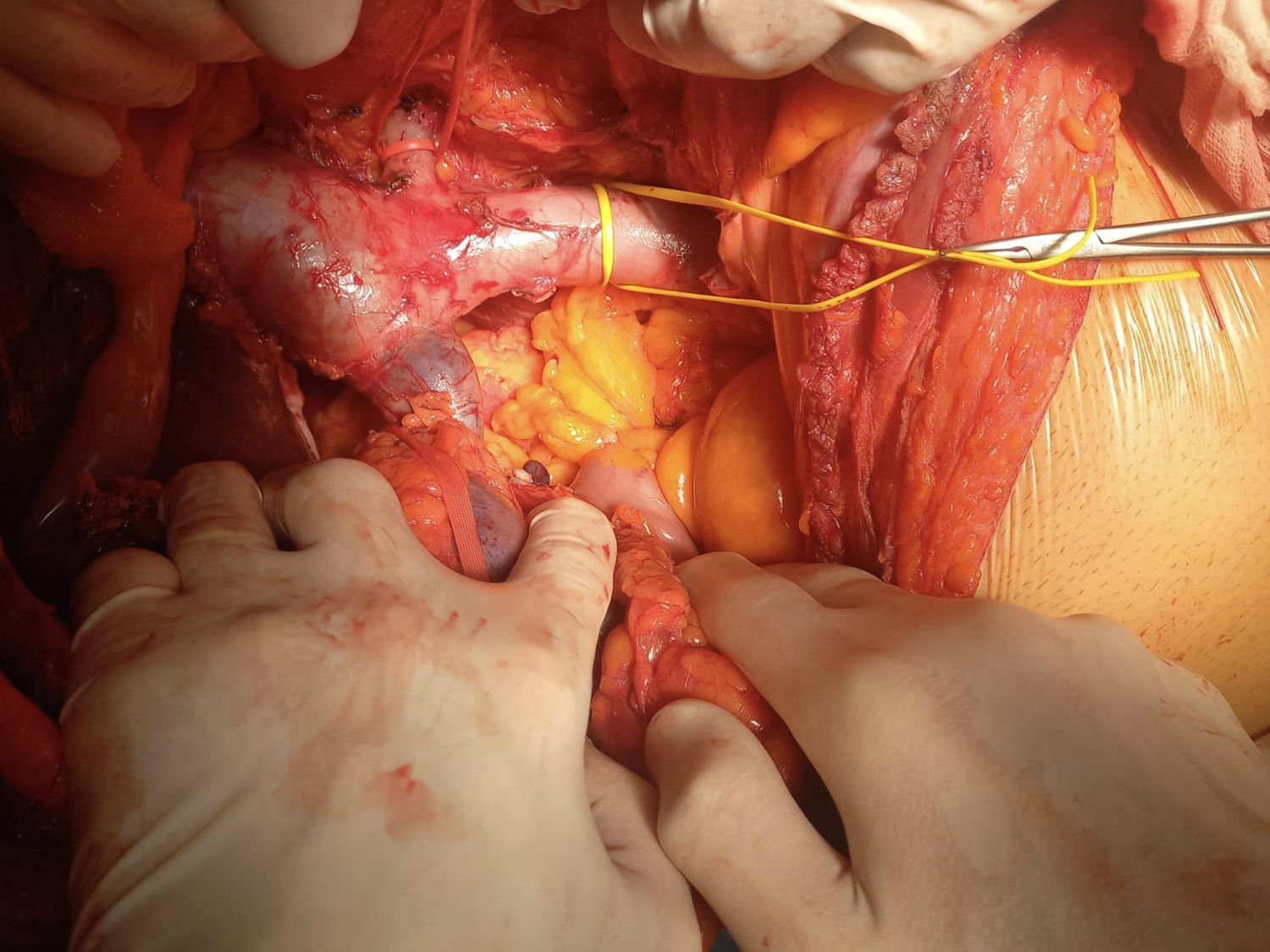
El procedimiento quirúrgico lo inicia el equipo de urología mediante incisión subcostal ampliada para valorar la resecabilidad del tumor renal. Si es resecable, el equipo de cirugía cardíaca espera a la disección y exposición completa del campo quirúrgico renal, con ligadura precoz de la arteria renal en aquellos casos sin embolización previa y un control de la cava infrarrenal y de la vena renal contralateral (fig. 1) antes de heparinizar para evitar sangrados y futuras transfusiones. Una vez completado este primer paso, se aborda la parte cardíaca.
Se realiza primero una incisión longitudinal infraclavicular de 5cm si se canula la AAD o una esternotomía directamente si la opción es en el TABD.
La canulación axilar se hace suturando un tubo de dacrón de 8mm (término-lateral a la AAD) y conectando directamente a la línea arterial del circuito de CEC mediante una conexión recta 3/8-3/8. En el TABD la canulación se hace directamente con una cánula arterial Optic de 18 french.
Si la opción es la AAD, heparinizamos con heparina sódica a la dosis de 1mg/kg y anastomosamos el tubo de dacrón según técnica habitual antes de practicar la esternotomía para minimizar la pérdida de sangre.
Tras la esternotomía, completamos la heparinización habitual en CEC a 3mg/kg; se canulan ambas venas cavas con cánulas de 30 french (Medtronic DLP®). Insertamos además una cánula de perfusión en aorta ascendente de 7 french (Andocor Arco4R ®) y otra en el seno coronario de 14 french (Edwards®) para perfundir cardioplejía anterógrada y retrógrada (Celsior®) así como para reperfundir al final de la PAC. Rodeamos con cintas de goma el tronco braquiocefálico derecho para pinzarlo en el momento de iniciar la PAC.
Una vez canulado el paciente, iniciamos la CEC y comenzamos a bajar la temperatura corporal hasta los 28°C. Cuando el corazón comienza a bradicardizarse, pinzamos la aorta e iniciamos la perfusión de cardioplejía anterógrada (Celsior®, 10ml/kg) protegiendo con esta solución el miocardio durante el tiempo en CEC que dure la parada cardíaca. Además, mientras baja la temperatura colocamos al paciente en Trendelenburg para evitar posibles embolias cerebrales y conseguimos ambiente de frío local con bolsas de hielo alrededor de la cabeza. Es muy importante administrar el anestésico hipnótico propofol momentos antes de alcanzar los 28°C, a dosis suficiente para alcanzar un BIS de 0 con una tasa de supresión de 100 inmediatamente antes de iniciar la PAC con un flujo de 8-10ml/kg por min y con una presión de perfusión de 50-60mmHg.
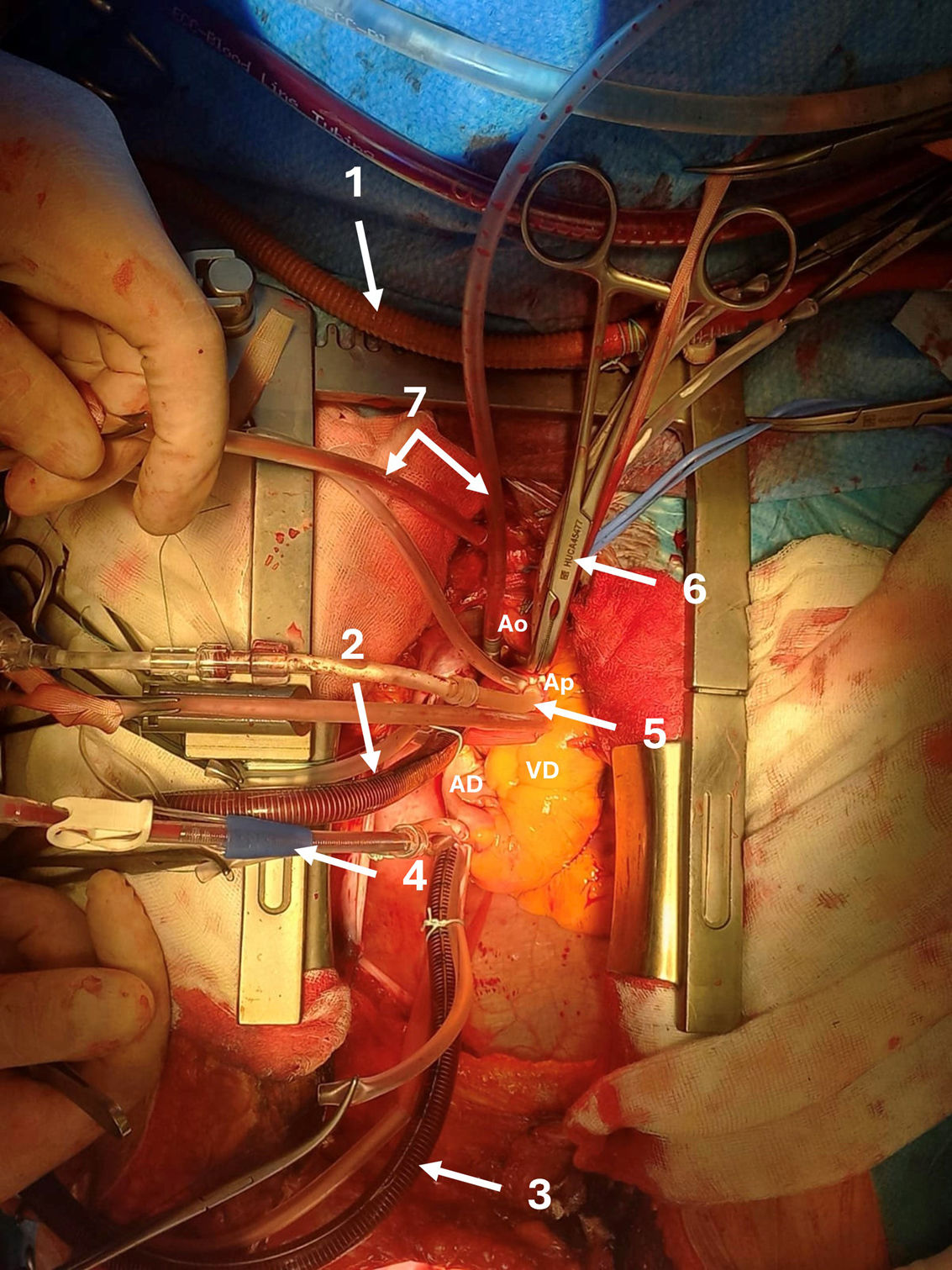
En este momento se realiza la apertura de la VCI y la extracción del trombo tumoral (fig. 2). Antes, se ha pinzado la cánula en la VCI para evitar su vaciado y la entrada de aire. La doble canulación es una técnica segura que mejora el drenaje del corazón y nos permite abrir la aurícula derecha cerca de la salida de la VCI y colaborar en la extracción del trombo en aquellos casos en los que alcanza la aurícula derecha. Otra ventaja en los casos en los que puede fracasar la PAC es poder hacer perfusión retrógrada cerebral a través de la vena cava superior; de hecho, el circuito de CEC siempre se deja preparado para afrontar cualquier imprevisto.
Canulación cardíaca. 1) canulación axilar con tubo de dacron 8mm; 2) canulación de vena cava superior; 3) canulación de vena cava inferior; 4) canulación de cardioplejía retrógrada en seno coronario; 5) canulación de cardioplejía anterógrada en aorta ascendente; 6) pinzamiento aórtico; 7) cánulas de aspiración de campo.
AD: aurícula derecha; Ao: aorta ascendente; Ap: arteria pulmonar; VD: ventrículo derecho.
Esta técnica permite, en el caso de que se complique la parte abdominal, consumir más tiempo quirúrgico con la seguridad de mantener una adecuada perfusión cerebral y minimizar el sangrado, haciendo una hipotermia moderada a 28°C.
Tras la extracción y sutura de la VCI abdominal, finaliza la PAC y normalizamos la temperatura del paciente respetando los tiempos de calentamiento. Se reperfunde sangre caliente a través de la cánula retrógrada ubicada en el seno coronario y se sale de CEC habitualmente con latido espontáneo. La cirugía finaliza en ambos campos, abdominal y torácico, según el procedimiento habitual.
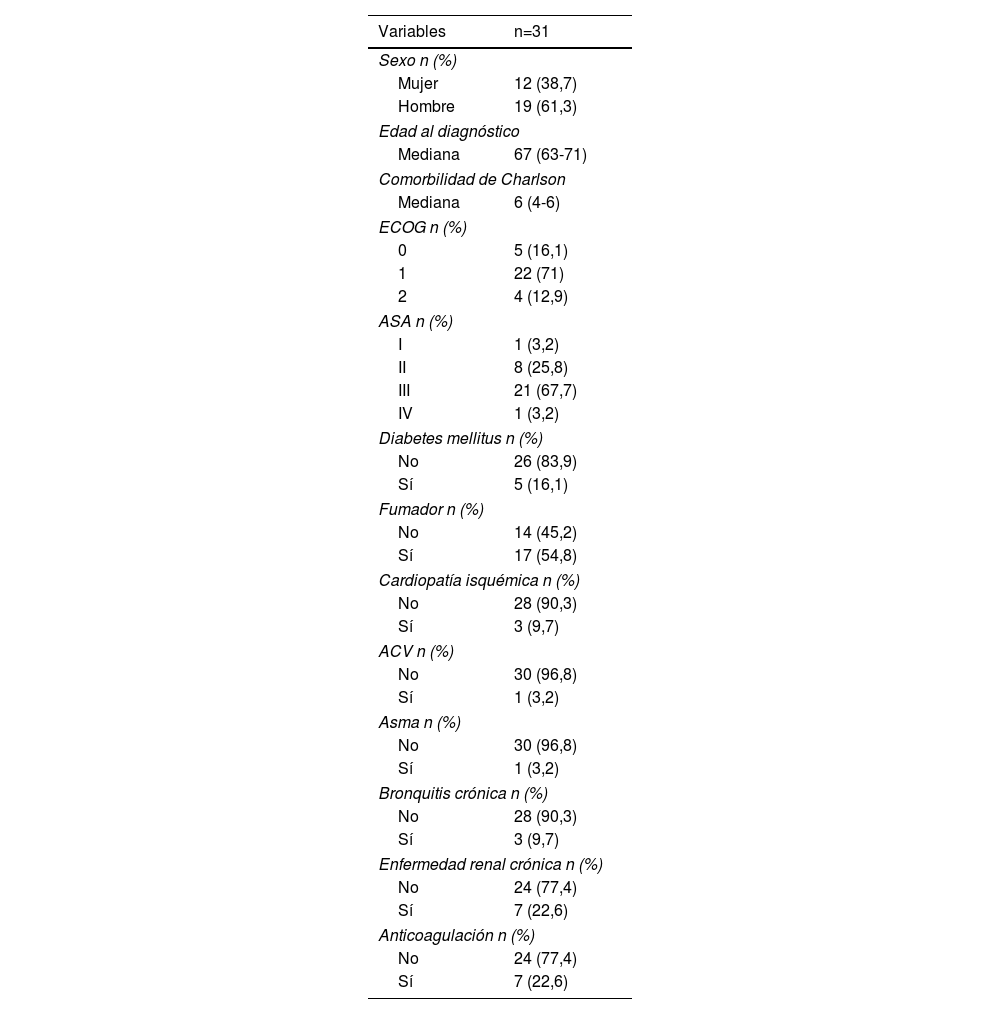
ResultadosCaracterística de los pacientesSe seleccióno a 31 pacientes, 19 hombres y 12 mujeres. La mediana de edad fue de 67 años (63-71), con una mediana de comorbilidad de Charlson de 6 (4-6) y ASA III (67,7%). El resto de las características demográficas y comorbilidades se describen en la tabla 1.
Característica demográficas y comorbilidades
| Variables | n=31 |
|---|---|
| Sexo n (%) | |
| Mujer | 12 (38,7) |
| Hombre | 19 (61,3) |
| Edad al diagnóstico | |
| Mediana | 67 (63-71) |
| Comorbilidad de Charlson | |
| Mediana | 6 (4-6) |
| ECOG n (%) | |
| 0 | 5 (16,1) |
| 1 | 22 (71) |
| 2 | 4 (12,9) |
| ASA n (%) | |
| I | 1 (3,2) |
| II | 8 (25,8) |
| III | 21 (67,7) |
| IV | 1 (3,2) |
| Diabetes mellitus n (%) | |
| No | 26 (83,9) |
| Sí | 5 (16,1) |
| Fumador n (%) | |
| No | 14 (45,2) |
| Sí | 17 (54,8) |
| Cardiopatía isquémica n (%) | |
| No | 28 (90,3) |
| Sí | 3 (9,7) |
| ACV n (%) | |
| No | 30 (96,8) |
| Sí | 1 (3,2) |
| Asma n (%) | |
| No | 30 (96,8) |
| Sí | 1 (3,2) |
| Bronquitis crónica n (%) | |
| No | 28 (90,3) |
| Sí | 3 (9,7) |
| Enfermedad renal crónica n (%) | |
| No | 24 (77,4) |
| Sí | 7 (22,6) |
| Anticoagulación n (%) | |
| No | 24 (77,4) |
| Sí | 7 (22,6) |
ASA: American Society of Anesthesiologists; ECOG: Eastern Cooperative Oncology Group Performance Status Scale.
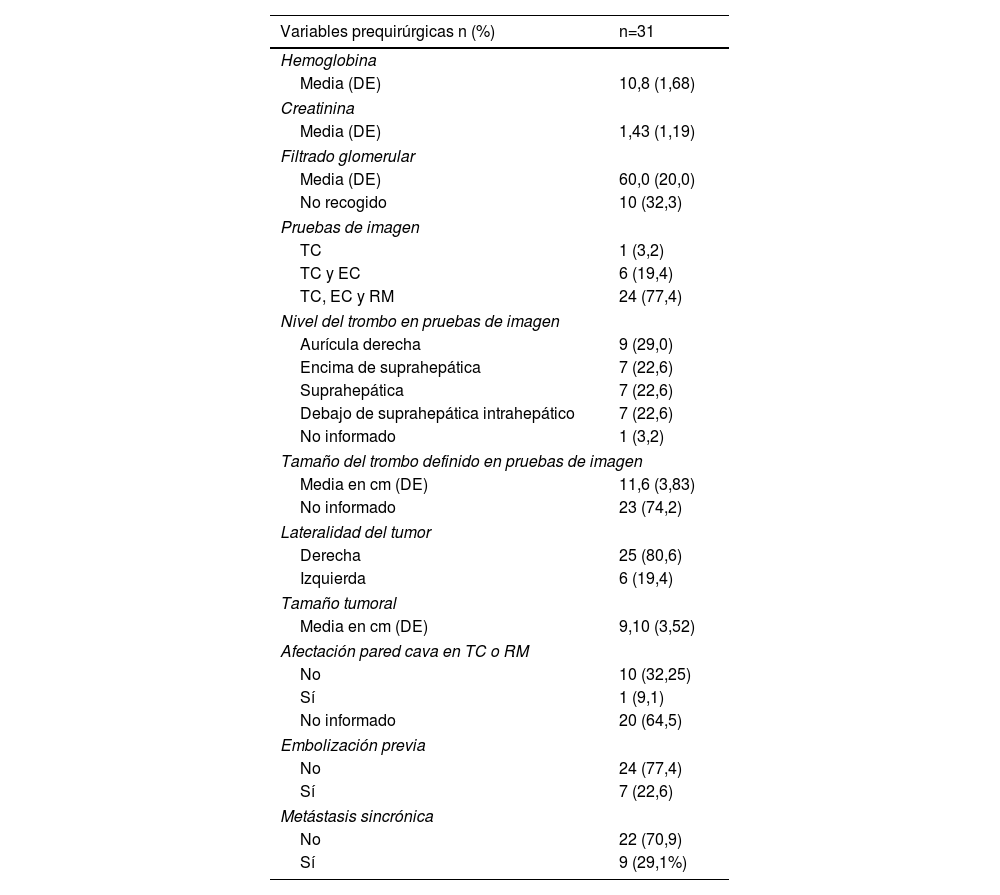
En 16 pacientes (51%) el nivel del trombo estaba por encima de las suprahepáticas o a nivel de aurícula derecha. En 20 pacientes (64%) no se informó de la infiltración de la pared de la cava en la TC o RM. Los pacientes a los que se les realizó embolización de arteria renal previa a la cirugía (n=7) no presentaron menor tiempo quirúrgico (p=0,78), precisaron 2,71 (IC95%: 0-14 a 5,28; p=0,048) concentrados de hematíes más y no se asociaron con mayor mortalidad perioperatoria (shock hemorrágico, shock cardiogénico o taponamiento cardíaco) (p=0,605). De los 4 pacientes que fallecieron en el primer mes, 3 presentaron nivel del trombo en aurícula derecha y uno en las suprahepáticas. El resto de las variables prequirúrgicas se describen en la tabla 2.
Variables prequirúrgicas
| Variables prequirúrgicas n (%) | n=31 |
|---|---|
| Hemoglobina | |
| Media (DE) | 10,8 (1,68) |
| Creatinina | |
| Media (DE) | 1,43 (1,19) |
| Filtrado glomerular | |
| Media (DE) | 60,0 (20,0) |
| No recogido | 10 (32,3) |
| Pruebas de imagen | |
| TC | 1 (3,2) |
| TC y EC | 6 (19,4) |
| TC, EC y RM | 24 (77,4) |
| Nivel del trombo en pruebas de imagen | |
| Aurícula derecha | 9 (29,0) |
| Encima de suprahepática | 7 (22,6) |
| Suprahepática | 7 (22,6) |
| Debajo de suprahepática intrahepático | 7 (22,6) |
| No informado | 1 (3,2) |
| Tamaño del trombo definido en pruebas de imagen | |
| Media en cm (DE) | 11,6 (3,83) |
| No informado | 23 (74,2) |
| Lateralidad del tumor | |
| Derecha | 25 (80,6) |
| Izquierda | 6 (19,4) |
| Tamaño tumoral | |
| Media en cm (DE) | 9,10 (3,52) |
| Afectación pared cava en TC o RM | |
| No | 10 (32,25) |
| Sí | 1 (9,1) |
| No informado | 20 (64,5) |
| Embolización previa | |
| No | 24 (77,4) |
| Sí | 7 (22,6) |
| Metástasis sincrónica | |
| No | 22 (70,9) |
| Sí | 9 (29,1%) |
DE: desviación estándar; EC: ecocardiograma; RM: resonancia magnética abdominal; TC: tomografía computarizada toracoabdominal.
En la tabla 3 se presentan las características tumorales. Hubo 3 pacientes (9,9%) cuya histología no fue CCR. Los márgenes quirúrgicos microscópicos fueron positivos en 23 pacientes (76%), sobre todo en la vena renal (21 pacientes). No encontramos relación estadísticamente significativa entre el nivel del trombo y la invasión de la pared de la cava (nivel suprahepática p=0,6; encima de suprahepáticaso aurícula derecha p=0,1). Sí encontramos relación significativa entre el nivel del trombo y el estadio clínico N1 o M1 (p=0,03).
Características tumorales
| Variables | n = 31 n (%) |
|---|---|
| Estadio clínico | |
| T3bN0 | 6 (19,4) |
| T3bN0M1 | 4 (12,9) |
| T3bN1M1 | 1 (3,2) |
| T3cN0 | 14 (45,2&) |
| T3cN0M1 | 2 (6,5) |
| T3cN1 | 2 (6,5) |
| T3cN1M1 | 1 (3,2 |
| T4NxM1 | 1 (3,2) |
| Estadio patológico | |
| T3aG2-4 | 14 (67,74) |
| T3bG2-4 | 9 (29) |
| T3cG3-4 | 4 (13) |
| T4G3 | 1 (3,2) |
| No CCR | 3(9,6) |
| Histología | |
| CCR célula clara | 27 (72,9) |
| CCR papilar | 1 (3,3) |
| Carcinoma urotelial | 1 (3,3) |
| Carcinoma suprarrenal | 1 (3,3) |
| Sarcoma intimal | 1 (3,3) |
| Afectación linfática | |
| N0 | 9 (29) |
| N1 | 4 (12,9) |
| Nx | 18 (58,1) |
| Márgenes quirúrgicos | |
| Negativos | 7 (20,3) |
| Positivos | 23 (76,5) |
| No informado | 1 (3,2) |
| Afectación de la pared de la cava en cirugía | |
| No | 12 (38,7) |
| Sí | 9 (29,0) |
| No informado | 10 (32,25) |
| Metástasis sincrónica | |
| No | 20 (64,5) |
| Sí | 11 (35,5) |
| Localización de la metástasis sincrónica | |
| Pulmón | 4 (12,9) |
| Hígado | 2 (6,4) |
| Ovario | 2 (6,4) |
| Mediastino | 1 (3,2) |
| Ganglionar | 1 (3,2) |
| Pulmón e hígado | 1 (3,2) |
| Sin metástasis | 20 (64,5) |
| Metastasectomía sincrónica | |
| No | 28 (90,3) |
| Sí | 3 (9,7) |
CCR: carcinoma de células renales.
En la tabla 4 se describen las características intra- y postoperatorias. La media del tiempo quirúrgico fue de 5,13 horas (0,946), con una media de tiempo en parada de 22,3 min (12,2) y una temperatura media en parada de 26,8°C (1,86). Ni la embolización previa, ni el nivel del trombo, ni el estadio patológico influyeron significativamente en el tiempo quirúrgico. La estancia media en UCI fue de 4,90 días (2,72). Un paciente falleció intraoperatoriamente por complicación (shock cardiogénico) y 3 pacientes en el postoperatorio inmediato (2 por shock hemorrágico y uno por taponamiento cardíaco). De los 27 pacientes que fueron alta tras la cirugía, hubo 3 ingresos (11,1%) por complicación de Clavien-Dindo II en el primer mes (2 con tromboembolia pulmonar y uno con fiebre), ninguno con consecuencias mortales. En nuestra serie no hemos tenido que hacer reanimación cardiopulmonar en ningún caso.
Características intraoperatorias y postoperatorias
| Variables | |
|---|---|
| Tiempo quirúrgico | |
| Media (horas) | 5,13 (0,946) |
| Concentrado de hematíes transfundidos | |
| Mediana | 4 (3-7) |
| Plaquetas transfundidas | |
| Mediana | 2 (1-3) |
| Tiempo en parada | |
| Media (minutos) | 22,3 (12,2) |
| Temperatura en parada | |
| Media (°C) | 26,8 (1,86) |
| Complicaciones intraoperatorias n (%) | |
| TEP | 1 (3,2) |
| Shock cardiogénico | 1 (3,2) |
| Disección de aorta | 1 (3,2) |
| Complicaciones en postoperatorio inmediato n (%) | |
| Shock hemorrágico | 2 (6,5) |
| Taponamiento cardíaco | 1 (3,2) |
| Clavien-Dindo perioperatorio n (%) | |
| I | 1 (7,6) |
| ii | 3 (23) |
| IIIa | 3 (23) |
| IIIb | 1 (7,6) |
| IV | 1 (7,6) |
| V | 4 (30,7) |
| Días en UCI | |
| Media | 4,90 (2,72) |
| Días de ingreso poscirugía | |
| Mediana | 11 (8-15) |
| Reingreso primer mes n (%) | |
| No | 28 (90,3) |
| Sí | 3 (9,7) |
| Motivo de reingreso al mes n (%) | |
| TEP | 2 (7,45) |
| Fiebre, colección | 1 (3,7) |
| Tiempo a la recidiva local | |
| Mediana (meses) | 3,12 (2,56-3,45) |
| Tiempo a la recidiva ganglionar | |
| Mediana (meses) | 3,12 (2,87-10,6) |
| Tiempo a la recidiva a distancia | |
| Mediana (meses) | 4 (2-13) |
| Tratamiento de la recidiva n (%) | |
| No | 14 (45,16) |
| Sí | 17 (54,83) |
| Tiempo a la primera recidiva | |
| Mediana | 3,9 (2,79-9,13) |
| Seguimiento | |
| Mediana | 9,36 (5,27-40,2) |
| Estado al final del seguimiento n (%) | |
| Fallecidos | 21 (67,7) |
| Vivos | 10 (32,3) |
| Fallecidos primer mes | 4 (19) |
| Fallecidos a los 6 meses | 9 (43) |
°C: grados centígrados; TEP: tromboembolia pulmonar; UCI: unidad de cuidados intensivos.
Con una mediana de seguimiento de 9,36 meses (5,27-40,2), hubo 5 pacientes (16,1%) que presentaron recidiva local en el seguimiento, 7 pacientes (22,58%) recidiva ganglionar y 18 pacientes (58,1%) recidiva a distancia. La mediana de tiempo a la recidiva de cualquier tipo fue de 3,9 meses (2,79-9,13). Ningún paciente presentó daño cerebral en el postoperatorio inmediato ni durante el seguimiento. No fue necesaria valoración neurológica en ningún caso.
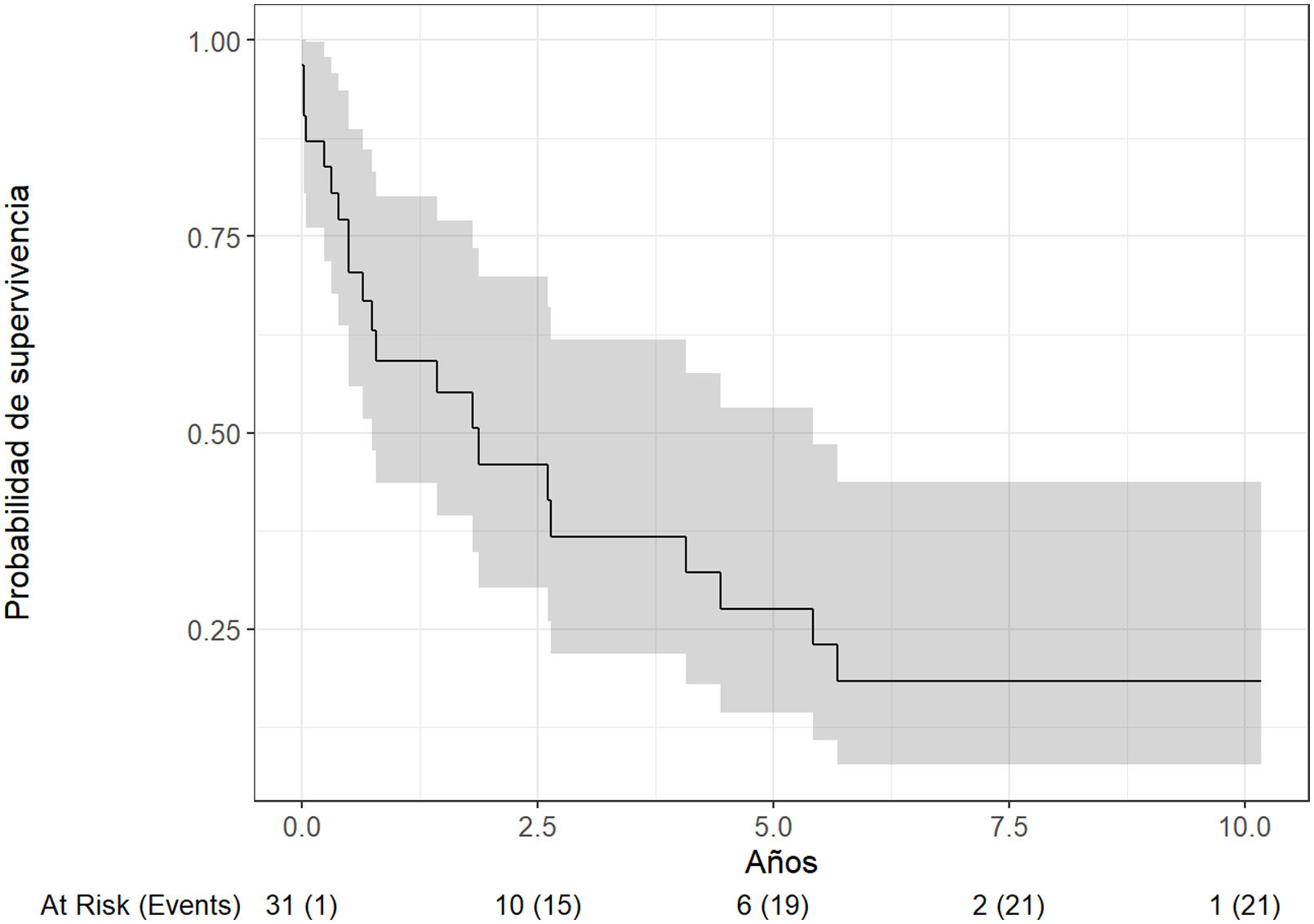
SupervivenciaLa mediana de supervivencia fue de 1,8 años (fig. 3). El 60% sobrevivió al primer año y el 27% al quinto. Los pacientes con nivel de trombo por encima de suprahepáticas o en aurícula derecha (n=16) presentaron menor supervivencia específica de cáncer (p=0,03) frente a aquellos con trombo tumoral en las suprahepáticas o por debajo de ellas. En cuanto al estadio patológico, los T3cG3-4 (p=0,003) y los T4G3 (p=0,018) tuvieron significativamente peor supervivencia específica de cáncer que los T3aG2-4. No hubo diferencias en supervivencia específica entre los pacientes con márgenes positivos (HR: 0,48; IC95%: 0,19-1,23; p=0,1), ni con estadio clínico N1 (HR: 3,20; IC95%: 0,67-15,37; p=0,1) o M1 (HR: 1,98; IC95%: 0,80-4,91; p=0,1).
Desde la recidiva de cualquier tipo, el 100% sobrevivió al mes, el 54% a los 6 meses y el 40% al año, con una mediana de supervivencia de 8,6 meses. Aquellos con trombo por debajo de suprahepáticas presentaron un tiempo libre de enfermedad estadísticamente más largo que aquellos con trombo por encima de suprahepáticas (HR: 5,25; IC95%: 1,15-23,93; p=0,03). Del mismo modo, los pacientes N0 presentaron mayor tiempo libre de enfermedad que los N1 (HR: 9,36; IC95%: 1,74-50,39; p=0,009). Los márgenes quirúrgicos microscópicos no mostraron significación estadística en el tiempo libre de enfermedad (p=0,2).
MortalidadEn la mortalidad al mes influyó significativamente el tiempo en parada (p=0,041) y las comorbilidades de Charlson (p=0,043) y en la mortalidad a los 3 meses solo influyó significativamente el tiempo en parada (p=0,00904).
Al final del seguimiento hubo 21 fallecidos, 4 pacientes (19%) durante el primer mes debido a complicaciones perioperatorias y 9 pacientes (42,9%) durante los 6 primeros meses por progresión de su enfermedad.
DiscusiónLa mejora en la evaluación perioperatoria de pacientes con CCR y trombo en la VCI ha disminuido la morbilidad al mejorar el proceso de toma de decisiones. La extensión proximal del trombo, su volumen y la posible invasión de la pared de la cava es fundamental en la determinación del procedimiento quirúrgico, incluyendo la movilización hepática, la derivación venovenosa o la derivación cardiopulmonar con paro cardíaco10-12.
La derivación cardiopulmonar conlleva un alto riesgo de mortalidad perioperatoria y accidente cerebrovascular13. La hipotermia profunda implica enfriar al paciente a 18-20°C, lo que se asocia a una disminución de la mortalidad perioperatoria. Aunque la hipotermia sistémica disminuye la isquemia hepática y renal, se necesitará diálisis en un 2% de estas cirugías cardíacas14. La mortalidad de la derivación cardiopulmonar en pacientes tratados mediante trombectomía con nivel IV puede llegar al 22%15. Para niveles III y menores, la derivación venovenosa tiene tasas de mortalidad más baja, con tiempos quirúrgicos y estancias hospitalarias más cortas13.
Una potencial complicación de la derivación cardiopulmonar con hipotermia es el deterioro de la función cognitiva. Un estudio reciente16 no encuentra diferencias significativas en la función cognitiva postoperatoria en pacientes tratados con o sin derivación cardiopulmonar,en los que la pérdida estimada de sangre es el único factor asociado con el deterioro cognitivo a la semana de la cirugía, pero sin ningún factor asociado a los 6 meses. En nuestra serie, una vez canulado al paciente, se inicia la CEC comenzando a bajar la temperatura hasta alcanzar una hipotermia moderada, con inicio de la perfusión de cardioplejía anterógrada para la protección miocárdica. Se coloca al paciente en Trendelenburg para evitar posibles embolias cerebrales y se consigue ambiente frío local con bolsas de hielo alrededor de la cabeza. La doble canulación que realizamos (vena cava superior y VCI) es una técnica segura que mejora el drenaje del corazón y nos permite abrir la aurícula derecha cerca de la salida de la VCI y colaborar en la extracción del trombo en aquellos casos en los que alcanza la aurícula derecha. Otra ventaja es en los casos en los que puede fracasar la perfusión anterógrada cerebral, para realizar perfusión retrógrada cerebral a través de la vena cava superior.
La anticoagulación terapéutica no está indicada en todos los CCR con trombo en cava. Las indicaciones incluyen la embolia pulmonar, la trombosis venosa profunda iliofemoral, la sospecha de trombo blando asociado al trombo tumoral o un trombo tumoral en el que la progresión podría incrementar la complejidad quirúrgica10. Un estudio retrospectivo mostró que no existen diferencias significativas en la supervivencia entre pacientes con trombo tumoral tratados con anticoagulación o sin ella15.
El nivel del trombo y su posible invasión de la pared proporcionan información relevante relacionada con la magnitud de la cirugía prevista. Abaza et al.17 demuestran que la extensión de la afectación venosa (vena renal frente a vena cava) impactaba en la supervivencia, con mejoras en supervivencia específica de cáncer en aquellos con afectación únicamente en la vena renal. Zhao et al.18, en una revisión retrospectiva, concluyen que el trombo venoso tumoral que invade la pared se asociaba a mayor complejidad quirúrgica expresada en tiempo operatorio, transfusión, estancia hospitalaria y complicaciones19. Sin embargo, como variable pronóstica, la afectación del trombo en la vena cava no se ha demostrado de manera sólida y constante en todos los estudios20. Que el nivel del trombo pueda tener implicaciones pronósticas se vio reflejado en la clasificación TNM de 2010, en la que el estadio T3 se subdividió según la afectación del trombo en la vena renal, vena cava infradiafragmática o supradiafragmática. Otros estudios solo encuentran relación entre el nivel del trombo y la tasa de recidiva, pero no con la supervivencia21. En nuestro estudio hemos encontrado que el nivel del trombo por encima de suprahepáticas o en la aurícula derecha presentaban menor supervivencia específica de cáncer y menor tiempo libre de enfermedad. Del mismo modo, aquellos con trombo en la aurícula derecha tenían un tercio de probabilidad de presentar complicación intraoperatoria con consecuencia mortal.
Aunque en nuestra revisión sí encontramos relación entre el nivel del trombo y el estadio clínico N1 o M1 y hemos hallado diferencias significativas entre el nivel del trombo y la supervivencia específica de cáncer, no hemos encontrado diferencias en supervivencia específica entre los pacientes con N1 o M1, probablemente debido al escaso tamaño muestral. Otros estudios no han encontrado relación entre el nivel del trombo y la afectación ganglionar22.
La invasión venosa microscópica de la vena cava y la vena renal se informan en el 4,7-40,5% de las series23. Aunque esta invasión venosa microscópica tiene un valor predictivo controvertido, Rodríguez Faba et al.24, en una muestra con 1.023 pacientes, concluyen que la invasión venosa microscópica de la vena renal era un factor predictivo independiente de supervivencia específica de cáncer en el análisis multivariable, no así la invasión de la vena cava. Abel et al.25 informan que pacientes con invasión venosa microscópica experimentaban mayor recidiva local. En nuestro estudio, en el análisis multivariable no hemos encontrado relación estadísticamente significativa entre la invasión venosa microscópica de la vena renal y la supervivencia específica de cáncer ni el tiempo libre de enfermedad.
En nuestra serie los pacientes con estadio patológico T3cG3-4 y T4 G3, de manera independiente a la invasión vascular, presentaron de manera significativa peor supervivencia específica de cáncer, sin encontrar diferencias en el tiempo libre de enfermedad, probablemente debido al tamaño muestral. En otras series se describe que, en pacientes con estadio T3N0-XM0, los márgenes vasculares positivos se asocian con mayor riesgo de progresión26.
Sobre otras cuestiones, la embolización preoperatoria no la realizamos de rutina pues no ha mostrado ventajas significativas27,28. El principal beneficio potencial es que puede permitir la división de la vena que contiene trombo en casos de no realizar una trombectomía en bloque, como puede ocurrir con trombo muy voluminoso del lado izquierdo. Solo destacamos que en nuestra serie los pacientes embolizados requirieron de media más concentrados de hematíes, sin encontrar ninguna asociación con el tamaño tumoral ni los estadios clínicos ni patológicos.
En nuestra opinión y con base en nuestros resultados, creemos que la clasificación TNM debería considerar ciertos cambios en próximas revisiones. Si nos basamos solo en el estadio patológico de nuestra serie, solo el 50% de los afectados por trombo en la aurícula derecha fueron clasificados correctamente. De manera global, en el 46,6% (n=14) de los pacientes no hubo relación entre el estadio clínico y el estadio patológico.
Entre los avances recientes propuestos destacamos las estrategias de inmunoterapia neoadyuvante29,30 y radioterapia31, que persiguen la reducción del tumor primario y del trombo tumoral, pues, como hemos confirmado, un nivel alto del trombo conlleva menor supervivencia específica de cáncer y alto riesgo de recidiva, incluso después de haber extirpado con éxito el trombo tumoral. Estas estrategias podrían en un futuro contribuir a disminuir los márgenes microscópicos en la vena renal, ya que en estudios amplios se confirmó la relación con peor supervivencia específica de cáncer24.
Este estudio presenta una serie de limitaciones. La más importante es la inherente a la recogida de datos restrospectiva, con cierto sesgo de selección y pérdida de datos en su recogida. La población de estudio fue intervenida por varios cirujanos. El tamaño muestral y el seguimiento corto pueden limitar el encontrar diferencias significativas en la supervivencia específica de cáncer o en el tiempo libre de enfermedad.
ConclusionesEl nivel del trombo por encima de las venas suprahepáticas y un estadio patológico pT3c o mayor son factores independientes de supervivencia específica de cáncer en pacientes con tumores renales que invaden la cava. Nuestra técnica de parada circulatoria con perfusión cerebral anterógrada nos permite trabajar con más calidad y seguridad, con nulas complicaciones cerebrales cognitivas en nuestra serie.
FinanciaciónLa presente investigación no ha recibido ayudas específicas provenientes de agencias del sector público, sector comercial ni entidades sin ánimo de lucro.
Consideraciones éticasDada la naturaleza retrospectiva y de no intervención, no se requirió la aprobación del Comité de Ensayos Clínicos de nuestro centro, aunque se siguieron las recomendaciones en consonancia con el código ético de la OMS. Debido a la naturaleza observacional y retrospectiva del estudio, se desestimó la necesidad de consentimiento informado individual de cada paciente.
Los autores agradecemos su apoyo en el análisis estadístico a la Plataforma de Bioestadística y Epidemiología del ISPA.