Existe una alta incidencia y prevalencia de insuficiencia cardíaca. Su causa más frecuente es la cardiopatía isquémica. Su pronóstico es pobre y está directamente relacionado con la fracción de eyección (FE) e inversamente relacionado con los diámetros y volúmenes del ventrículo izquierdo (VI). La técnica de restauración ventricular está indicada en pacientes con cardiopatía isquémica, baja FE (< 35%), aumento de los volúmenes de ventrículo izquierdo (índice de volumen telediastólico [IVTD] > 100ml/m2) y contorno ventricular mayor del 35% con ausencia de viabilidad. La restauración ventricular trata de disminuir el volumen de VI intentando normalizarlo; devolver al ventrículo una forma lo más parecida a la normal posible. Suele asociarse a revascularización miocárdica completa y reparación mitral, en el caso de que esté indicado. Los resultados descritos por el grupo RESTORE confirman que la restauración ventricular izquierda consigue disminuir el volumen telediastólico (VTD) de 161±59 a 121±35ml; el volumen telesistólico (VTS) de 108±45 a 79±34ml, y la FE mejoró de 34±9 a 41±9%, con una supervivencia a los 5 años del 75%.
There is a high incidence and prevalence of heart failure. Coronary artery disease is the most common cause. The prognosis is poor and is directly related to the ejection fraction and inversely related to the left ventricular diameters and volumes. The technique is indicated in patients with ischemic heart disease, low ejection fraction (< 35%), increased left ventricular volumes (LVEDVI > 100ml/m2), ventricular contours greater than 35% with no viability. The aim is to reduce the left ventricular volume trying to normalize it; bring back the left ventricle to a shape as normal as possible. It is usually associated with complete myocardial revascularization and mitral repair if indicated. The results described by the RESTORE group confirms that ventricular restoration surgery is able to reduce end-diastolic volume 161±59 to 121±35ml, the systolic 108±45 to 79±34ml, and the ejection fraction improved from 34±9 to 41±9%, with a 5-year survival of 75%.
La insuficiencia cardíaca (IC) es la única enfermedad cardiovascular cuya prevalencia e incidencia continúa aumentando a pesar de los enormes avances en el tratamiento médico y quirúrgico que se han producido en los últimos años. Ello es debido a que en la actualidad la población llega a edades más avanzadas y la IC es mucho más prevalente en ancianos que en jóvenes. Además, la supervivencia tras el infarto agudo de miocardio (IAM) también ha mejorado mucho, y es ésta la principal causa de IC en el mundo llamado desarrollado. Sin embargo, el pronóstico de la IC sigue siendo infausto, de manera que el 50% de los pacientes que están en clase III o IV de la New York Heart Association (NYHA) morirán en los próximos 3 años1–5. Como se ha dicho antes, la etiología más frecuente en los países desarrollados es la cardiopatía isquémica, siendo su principal causa en el 70% de los casos6.
Los pacientes con miocardiopatía isquémica pueden presentar angina, IAM, IC y muerte súbita. El riesgo de desarrollar IC está aumentado de cuatro a seis veces en pacientes que sufrieron previamente IAM y dos a tres veces en pacientes con angina, sugiriendo la enorme importancia que tiene la isquemia miocárdica en la disfunción ventricular isquémica progresiva. Esto también ha sido demostrado en el estudio Framingham7, donde la prevalencia de IC seguido de IAM se elevaba a 14% a los 5 años y 22% a los 10 años.
La causa del mal pronóstico de la IC de origen isquémico es el remodelado ventricular. Éste es un fenómeno complejo que ocurre tras el IAM. Afecta a la totalidad del VI y no sólo al área infartada. En él están involucrados aspectos moleculares, neurohormonales y genéticos. Se produce una pérdida de miofibrillas con posterior desorganización de las proteínas del miocito que finalmente desencadena una fibrosis. Macroscópicamente, se observa que el VI aumenta sus diámetros y volúmenes de forma que se afecta su forma y función. Al aumentar la tensión de pared se incrementa el consumo de oxígeno, desciende el flujo sanguíneo subendocárdico, y por último se reduce el acortamiento de las fibras musculares cardíacas; de ahí la caída de la FE8,9.
En la actualidad el tratamiento del IAM va encaminado a, en primer lugar, una reperfusión rápida del área infartada mediante angioplastia primaria o trombólisis, y en segundo lugar a administrar lo más precozmente tratamiento farmacológico para prevenir el remodelado ventricular. A pesar de todo, la dilatación ventricular ocurre en hasta el 20% de los pacientes tras 3 años postinfarto y está directamente relacionado con el riesgo de muerte. Tanto la caída de la FE como el aumento de volúmenes de VI son predictores de mal pronóstico, sin embargo el aumento de los volúmenes es más predictivo de mortalidad que la propia caída de la FE. Concretamente, sabemos que los pacientes que tienen un índice de volumen telesistólico (IVTS) por encima de 40ml/m2 tras un infarto tendrán una alta incidencia de IC y un pro-nóstico de vida pobre10,11.
La reperfusión precoz después de un infarto de miocar-dio, bien sea por trombólisis o angioplastia primaria, altera los cambios patológicos que siguen al infarto agudo, de manera que se produce un rescate de la zona de miocardio más epicárdica, y en ocasiones del miocardio medio, dejando la necrosis localizada en la porción más endocárdica del miocardio. Esto consigue modificar una potencial zona discinética en otra acinética. Cuando un tercio o más del perímetro ventricular está involucrado, el volumen ventricular aumenta rápidamente, obteniendo un ventrículo con tendencia a la esfericidad, disminuyendo gravemente la función cardíaca2. Di Donato12 ha demostrado que la supervivencia en grandes series de pacientes intervenidos con técnica de Dor estaba más relacionada con la extensión de la disinergia que con el tipo de ésta (acinesia vs discinesia); de hecho, existe una continuidad entre la acinesia y la discinesia en la pared ventricular postinfarto a pesar de que, según Dor13, existen muchos cirujanos y cardiólo-gos que todavía creen que existe una diferencia fundamental entre ambos tipos de cicatrices ventriculares y que las acinesias no son susceptibles de cirugía.
Este conjunto de ideas ha ayudado a avanzar sobre la hipótesis de que la cirugía de restauración ventricular (RV) puede ser aplicada con éxito en la miocardiopatía dila-tada de origen isquémico.
Indicaciones de la Técnica de Restauración ventricularCuando tenemos un paciente que padece de cardiopatía isquémica y además objetivamos que tiene disfunción ventricular, existen una serie de cuestiones que debemos plantearnos con vistas a enfocar el mejor tratamiento posible para dichos enfermos. Estas cuestiones son las siguientes:
- –
¿Tiene el paciente vasos resvascularizables? Si la respuesta es no, el paciente se descarta para cirugía de revascularización y de RV. Pero si la respuesta es afirmativa, una nueva cuestión debe-mos realizarnos.
- –
¿Existe viabilidad en el VI? La viabilidad puede ser determinada por diversas pruebas complementarias, aunque la que ha ganado más popularidad en los últimos tiempos es la resonancia magnética (RM), ya que ofrece múltiples ventajas, entre las que destaca la gran calidad de sus imágenes, lo que conlleva una altísima reproducibilidad y una muy baja variabilidad; su seguridad, pues no se utiliza radiación ionizante; y su versatilidad, dado que se puede hacer un estudio morfológico y un estudio funcional que incluya una cuantificación no sólo de la función ventricular, sino también de la perfusión miocárdica, de la viabilidad y del tamaño de la necrosis en una misma exploración; también se puede determinar por ecografía con do-butamina o con medicina nuclear. Cuando el VI es viable, en su gran mayoría la actitud a seguir con el paciente es la indicación de revascularización aislada. Sin embargo, cuando detectamos una gran cicatriz, debemos plantearnos nuevas preguntas:
- –
¿Está más del 35% del contorno ventricular afecta-do? Cuando la cicatriz ventricular está afectando a menos del 35% del contorno ventricular izquierdo no existe indicación formal de RV, por lo que, en principio, bastaría con indicar revascularización miocárdica aislada. En caso afirmativo, una nueva cuestión florece.
- –
¿Están los volúmenes ventriculares aumentados? Si los volúmenes ventriculares aún no están di-latados, sigue existiendo indicación de revascula-rización miocárdica aislada. Si, por el contrario, el IVTD es superior a 100ml/m2, sólo queda plantearnos una última pregunta.
- –
¿Existe un patrón de llenado ventricular restrictivo? Si el paciente no tiene un patrón de llenado gravemente restrictivo, la cirugía de revascularización miocárdica completa y de RV está indicada con el objetivo de conseguir un IVTD de 60ml/m2. Si el patrón de llenado ventricular es gravemente restrictivo o existe hipertensión pulmonar grave, la cirugía de RV está contraindicada. Si, por el contrario, el patrón de llenado es intermedio, se puede realizar la RV con objetivo de IVTD algo mayor que el habitual: 70ml/m2.
Así pues, según el grupo de Menicanti2, las indicaciones para la restauración ventricular son las siguientes:
- –
Infarto anteroseptal y VI dilatado.
- –
Fracción de eyección disminuida.
- –
Asinergia del VI superior al 35% del perímetro ventricular.
- –
Sintomatología de angina, IC, arritmias o una combinación de las tres.
- –
Isquemia inducible con prueba de provocación en pacientes asintomáticos.
Y las contraindicaciones relativas son:
- –
Hipertensión pulmonar superior a 60mmHg en ausencia de insuficiencia mitral.
- –
Disfunción grave de ventrículo derecho.
- –
Existencia de asinergia regional sin dilatación ventricular.
La RV consiste en una técnica que realiza una exclu-sión de porciones de VI que no son funcionales (cicatriz) y que conducen a una contracción defectuosa del miocardio colindante, e intenta devolver al VI una forma lo más parecida posible a la normalidad.
Los objetivos de la RV son: disminuir el volumen de VI intentando normalizarlo. Devolver al VI una forma lo más parecida posible a la normal. Evitar la isquemia mediante la revascularización miocárdica, que debe estar siempre asociada y realizarse de forma completa, y por último disminuir la sobrecarga de volumen reparando la válvula mitral cuando esté indicado.
Existen muchas modificaciones de la técnica original descrita por Dor. El procedimiento se puede realizar con el corazón latiendo, fibrilando o en asistolia; antes o después de la revascularización; empleando parche o no, etc. A continuación describimos la técnica que utilizamos en nuestro servicio y que también se utiliza en muchos otros centros.
Mediante circulación extracorpórea (CEC) y con el corazón latiendo, se explora el área de VI cicatricial me-diante descompresión ventricular a través de una cánula introducida por la vena pulmonar superior izquierda. Habitualmente, el área cicatricial se deprime, y suele apreciarse la falta de contractilidad de dicha área. Se procede a incisión con bisturí sobre el área cicatricial hasta conseguir una apertura suficiente como para introducir un dedo dentro del VI. Mediante palpación digital entre el primer y segundo dedo del cirujano, se procede a exploración del grosor y contractilidad del VI, para precisar el área no contráctil. En los casos en que existe trombo ventricular, se extrae. Se realiza escarectomía, si existe cicatriz fibrosa endocárdica (se identifica como una zona blanca nacarada de elevada resistencia). Identificando la zona de transición entre el ventrículo sano y la cicatriz, y teniendo en cuenta los volúmenes residuales del ventrículo que quedarán tras la realización de la técnica, se procede a realizar sutura en «bolsa de tabaco» en lo que se suele denominar «cuello del aneurisma» con el fin de excluir de la cavidad ventricular el área infartada, seguido de una segunda bolsa de tabaco distal a la anterior o un parche. Finalmente, se cierra el VI mediante una doble sutura apoyada en teflón o pericardio autólogo14. A continuación, se realiza revascularización completa según técnica convencional y anuloplastia, si procede.
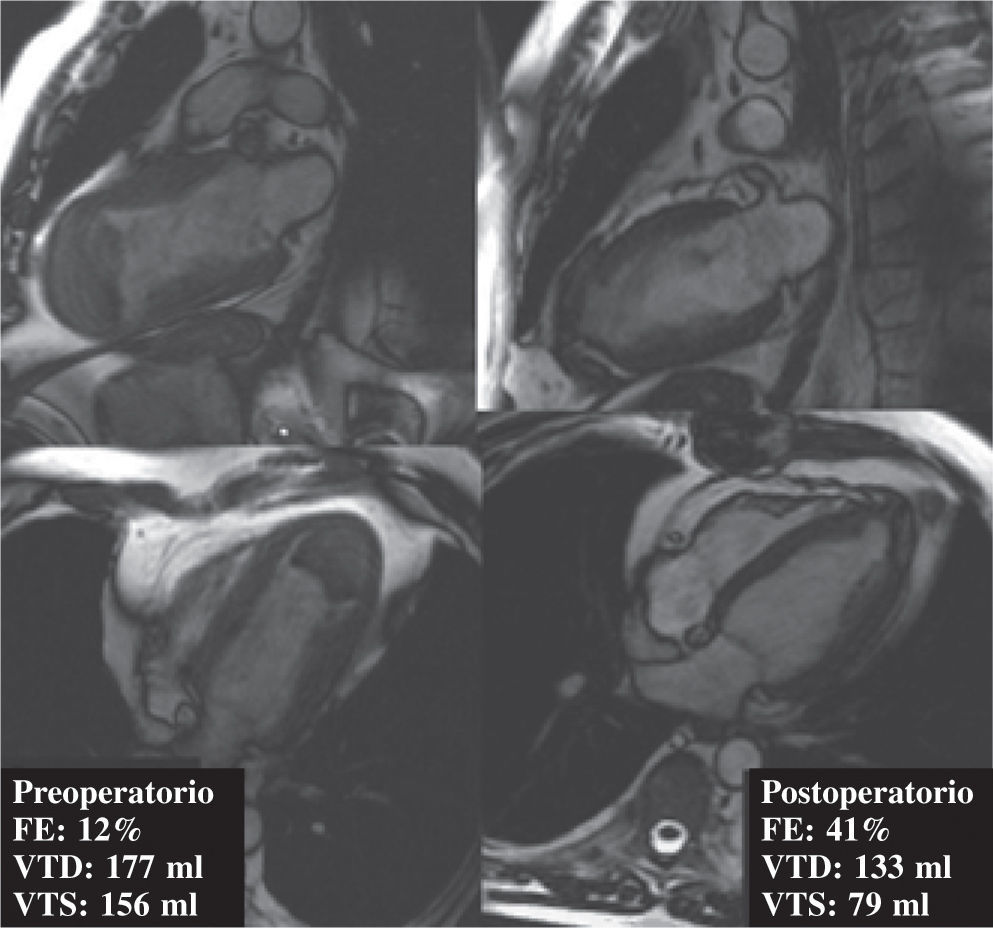
Resultados de la Técnica. El Estudio Surgical Treatment for Ischemic Heart FailureLos resultados descritos desde los inicios de la téc-nica en la década de 1980 han sido esperanzadores, con una mejoría de la función ventricular, de los volúme-nes, de la clase funcional y de la supervivencia muy significativa15,16. En la actualidad, el grupo con mayor peso dentro de la literatura internacional en cuanto a la restauración ventricular es el grupo RESTORE (international Reconstructive Endoventricular Surgery returning Torsion Original Radius Elliptical shape to the left ventricle). El grupo consta de 10 centros internacionales, fue creado en 1998 y representa la mayor experiencia mundial en cuanto a la RV. Si analizamos los datos publicados por el grupo RESTORE en cuanto a resultados, describieron una mortalidad hospitalaria incluyendo casos urgentes inferior al 6%. Globalmente, el VTD medio se redujo de 161±59 a 121±35ml; el VTS de 108±45 a 79±34ml, y la FE mejoró de 34±9 a 41±9%. Como ejemplo de dichos cambios, véase la figura 1, en la que se aprecia RM antes y después de la RV. La su-pervivencia a los 5 años estaba en torno al 75%15,17.
Imagen de RM cardíaca. A la izquierda se aprecia VI en dos y cuatro cámaras correspondientes a paciente varón de 52 años con 12% de FE y volúmenes gravemente dilatados. Véase imagen de trombo apical. A la derecha, el mismo paciente tras cirugía de revascularización coronaria y restauración ventricular. La FE ha pasado a ser del 45%, y los volúmenes se han reducido significativamente. La clase funcional según la NYHA del paciente ha bajado de III a I.
Sin embargo aún no existía ningún estudio prospec-tivo aleatorizado que demostrara las bondades de la RV. De manera que se diseñó el estudio STICH (Surgical Treatment for Ischemic Heart Failure), enfocado para estu-diar pacientes con cardiopatía isquémica e IC o disfunción ventricular izquierda. Un estudio ambicioso, prospectivo, aleatorizado y multicéntrico, cuyos resultados se han publicado recientemente en la prestigiosa revista New England Journal of Medicine18. En ella se dice que la asociación de la RV con revascularización miocárdica no mejora la mortalidad, ni la capacidad funcional, ni reduce los reingresos. Fuertes críticas al estudio STICH se han publicado cuestionando la validez de las conclusiones extraídas del estudio por diferentes motivos19,20. En este estudio quizás se «pecó» de exceso de confian-za en la técnica de RV, de manera que sólo un 20% de los pacientes candidatos a RV fueron aleatorizados. El 80% de los candidatos fueron tratados directamente con cirugía de RV por evidencia clínica de la superioridad del procedimiento. Se cuestiona también la falta de experiencia en RV de los centros participantes (127 cen-tros) para el estudio de relativamente pocos pacientes (501 pacientes), con lo que de media se intervenía con RV a menos de cuatro pacientes por centro. Conociendo que existen centros como el que lidera Menicanti, que tiene la mayor experiencia mundial en RV, y que un solo país como Polonia concentraba a 288 pacientes de los 1.000 estudiados, cabe adivinar que hubo centros con una escasa participación y, sin duda alguna, una corta experiencia para obtener resultados adecuados. Por otra parte, la reducción del índice de VTS, aun siendo significativa, es inferior a la media de reducción por los grupos que tienen experiencia. El grupo de Menicanti redujo el VTS medio en 57ml (39%), mientras que en el estudio STICH redujo tan sólo 16ml/m2 (19%) en los tan sólo 161 pacientes intervenidos con RV a los que se pudo medir (recordemos que se intervinieron 501 pacientes). Y, por último, el método de medida; como hemos dicho, la RM se ha constituido como el «patrón oro» de medida de función ventricular y volúmenes ventriculares. En ocasiones se producen cambios muy sutiles en el volumen y función ventricular que la ecocardiografía no es capaz de detectar, especialmente en pacientes recién intervenidos, que suelen tener una mala ventana ultrasónica donde es difícil visualizar con exactitud el contorno del VI, sobre todo en la zona más apical, que es donde se ha realizado la RV. Por tanto, en ocasiones la ecocardiografía (prueba de imagen utilizada en el STICH) puede ser un método insuficiente para apreciar con exactitud los cambios producidos en volumen y función ventricular.
Todas estas cuestiones hacen que la comunidad científica que más ha investigado sobre el tratamiento quirúrgico de la IC dude sobre si los resultados del estudio STICH son suficientes para que la RV pueda convertirse en un tratamiento histórico, aunque esté avalada por la evidencia científica de excelentes estudios previos con millares de pacientes. Asimismo, se cuestiona si se hubiesen obtenido los mismos resultados si se hubiese limitado el número de hospitales participantes en el estudio al grupo RESTORE, teniendo en cuenta su experiencia en la realización de la técnica.
A modo de conclusión, dados los excelentes resultados publicados por numerosas series de RV y a pesar de la no evidencia de superioridad de la técnica frente a la revascularización miocárdica aislada en el estudio STICH, se podría afirmar que con la RV se puede tratar con buenos resultados a un porcentaje amplio de población que padece miocardiopatía dilatada de origen isquémico.
Conceptos ClarosA modo de resumen, debemos recordar que:
- –
Existe una alta incidencia y prevalencia de la IC. Su causa más frecuente es la cardiopatía isquémica. Su pronóstico es pobre, y está directamente relacionado con la FE e inversamente relacionado con los diámetros y volúmenes del VI (especial-mente cuando el IVTS > 40ml/m2).
- –
El paciente con cardiopatía isquémica ideal para revascularización miocárdica aislada es aquel paciente con enfermedad de tres vasos proximal, vasos distales buenos y presencia de viabilidad miocárdica en todo el territorio del VI.
- –
Debemos ponernos «en guardia» cuando tenemos un paciente con cardiopatía isquémica, baja FE y aumento de los volúmenes de VI, y en una ecocardiografía, ventriculografía o cualquier otra prueba de imagen observamos un área acinética, discinética o aneurismática. En ese caso debemos realizar una prueba de detección de viabilidad.
- –
Indicaremos la RV si: ausencia de viabilidad en el territorio anteroseptal y apical en más del 35% de la circunferencia total del ventrículo, volúmenes aumentados (IVTD ≥ 100ml/m2) y FE menor del 35% en ausencia de hipertensión pulmonar grave sin insuficiencia mitral o presencia de patrón de llenado de VI gravemente restrictivo.
- –
Debemos asociarle revascularización miocárdica completa y anuloplastia mitral si: insuficiencia mitral moderada o grave (orificio regurgitante efectivo [ORE] > 0,20cm2) o en ausencia de ésta, pero si existe dilatación del anillo mitral (> 38mm).